1.本发明涉及一种用于将sirna等核酸分子递送至细胞内的核酸递送促进剂。本发明还涉及一种能够利用rna干扰(rnai)来治疗疾病的药剂。特别是,本发明涉及一种对胰腺癌具有抗肿瘤效果,能够有效抑制胰腺癌的肿瘤增大、浸润、转移的核酸制剂及含有其的药物组合物。
背景技术:
2.一般认为,癌症中胰腺癌的预后最差。因为胰腺是腹膜后器官,难以做到早期发现,并且胰腺癌细胞的运动性非常强,导致腹膜浸润及向血管、消化道、神经等转移的可能性更大。
3.目前,本发明人等通过对胰腺癌的浸润及转移机理进行探讨发现,胰腺癌细胞的细胞膜突起中存在胰岛素样生长因子2mrna结合蛋白质3(insulin-like growth factor 2mrna-binding protein 3,igf2bp3),该igf2bp3上结合有多种mrna,导致这些mrna在细胞膜突起中积累,胰岛素样生长因子2mrna结合蛋白质3通常在核小体发现,已知其会与胰岛素样生长因子ii的mrna的5’非翻译区结合来阻碍胰岛素样生长因子ii的翻译。并且有报道指出,通过利用rna干扰(rnai)阻碍这些mrna,能够有效抑制胰腺癌细胞的浸润及转移(专利文献1)。
4.近年来,利用rna干扰(rnai)的核酸药物作为新的治疗药物备受瞩目,而sirna(small interfering rna,小干扰rna)则是其中的代表,通常是由21~23碱基对构成的低分子双链rna。然而,sirna因其结构导致阴离子性高,细胞膜渗透性低,因此,在向细胞内递送方面存在技术问题。针对该技术问题,本发明人等制作了sirna-叶酸-聚乙二醇(peg)-壳聚糖寡糖乳酸(col)纳米粒子复合物,并确认该纳米粒子具有促进细胞摄入sirna的效果。并且也有报道指出,摄入至胰腺癌细胞的针对具有igf2bp3结合能力的mrna的sirna会抑制胰腺癌的浸润及转移(非专利文献1)。
5.另一方面,本发明人等还发现,侧链具有氨基或胍基的阳离子型寡肽可以用于将双链rna向细胞内递送(专利文献2、非专利文献2)。另外,为了递送rnai分子,还就包含维生素e和阳离子型糖的复合物的应用进行了探讨(非专利文献3及4)。
6.现有技术文献
7.专利文献
8.专利文献1:国际公开wo2016/002844号
9.专利文献2:国际公开wo2014/148620号
10.非专利文献
11.非专利文献1:oncotarget,2019,vol.10,no.30,pp.2869-2886
12.非专利文献2:bioorganic&medicinal chemistry 21(2013)1717-1723
13.非专利文献3:bioorganic&medicinal chemistry 22(2014)1394-1403
14.非专利文献4:bioorganic&medicinal chemistry letters 25(2015)815-819
技术实现要素:
15.如上所述,在提高核酸药物的实用性方面,作为核酸药物的sirna等rnai分子向细胞的递送是一个非常重要的技术问题。仍存在很多待解决的技术问题,例如,不仅仅是递送而是特异性递送至靶细胞;及不会阻碍摄入细胞内之后的核酸药物的效果。
16.本发明人等鉴于上述技术问题进行了反复探讨,结果发现,通过使用叶酸和阳离子型寡肽的复合物,能够向具有叶酸受体的细胞内特异性递送sirna及shrna。另外还发现了新的治疗策略,即,通过使用该方法,靶向胰腺癌细胞,将sirna或shrna有效地摄入所靶向的胰腺癌细胞,敲低特定的rna的表达,能够抑制胰腺癌的肿瘤增大、浸润及转移,从而完成了本发明。
17.即,本发明提供以下方案。
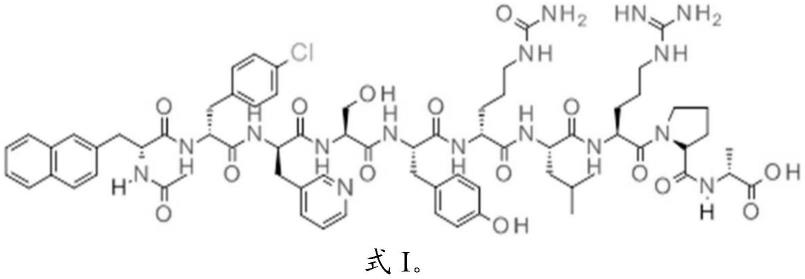
18.1.一种sirna或shrna的递送促进剂,由叶酸-阳离子型寡肽复合物构成,阳离子型寡肽包含由8~40个氨基酸构成的阳离子型寡肽部位,所述阳离子型寡肽部位包含至少两个下述式(i)的氨基酸残基连续的部分,且除下述式(i)的氨基酸残基的连续部分以外为不连续的一个其它氨基酸残基,
19.[化学式1]
[0020][0021]
式(i)中,r1为基团h3n
-ch
2-或式(ii)所表示的基团,在r1为基团h3n
-ch
2-的情况下,r2不存在或者为碳原子数1~3的亚烷基,在r1为式(ii)所表示的基的情况下,r2为碳原子数1~4的亚烷基;在一个阳离子型寡肽中,r1及r2全部相同;
[0022]
[化学式2]
[0023][0024]
式(ii)中,r3、r4及r5为氢原子或者甲基,可以相同或不同。
[0025]
2.根据上述1所述的递送促进剂,其中,阳离子型寡肽部位由8~12个氨基酸构成。
[0026]
3.根据上述1或2所述的递送促进剂,其中,阳离子型寡肽部位为l-2,3-二氨基丙酸(dap)、l-2,4-二氨基丁酸(dab)、l-鸟氨酸(orn)、l-赖氨酸(lys)、l-2-氨基-3-胍基丙酸(agp)、l-2-氨基-4-胍基丁酸(agb)、或l-精氨酸(arg)的同型多聚体。
[0027]
4.根据上述1~3中任一项所述的递送促进剂,其中,阳离子型寡肽具有具备下述结构的二氨基丁酸的八聚物作为部分结构。
[0028]
[化学式3]
[0029][0030]
5.根据上述1~4中任一项所述的递送促进剂,其中,叶酸经由或不经由接头连接于阳离子型寡肽的n端、c端或者侧链。
[0031]
6.根据上述5所述的递送促进剂,其中,叶酸-阳离子型寡肽复合物经由接头连接,接头为肽接头。
[0032]
7.根据上述6所述的递送促进剂,其中,肽接头为由1~4个甘氨酸残基构成的肽。
[0033]
8.根据上述4所述的递送促进剂,其中,叶酸-阳离子型寡肽复合物为具有下述结构的fol-dab8a及/或fol-dab8b。
[0034]
[化学式4]
[0035][0036]
[化学式5]
[0037][0038]
9.一种抗肿瘤剂,包含能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna、及上述1~8中任一项所述的递送促进剂。
[0039]
10.根据上述9所述的抗肿瘤剂,其中,胰腺癌细胞中表达的mrna或snorna与胰岛素样生长因子2mrna结合蛋白质3(igf2bp3)结合。
[0040]
11.根据上述9或10所述的抗肿瘤剂,其中,胰腺癌细胞中表达的mrna或snorna选自由snora18 snorna、nup85 mrna、wasf2mrna、及snora22 snorna构成的组。
[0041]
12.根据上述9~11中任一项所述的抗肿瘤剂,相对于sirna或shrna包含0.5~10
当量的叶酸-阳离子型寡肽复合物。
[0042]
13.根据上述9~12中任一项所述的抗肿瘤剂,其中,sirna为rna/rna双链。
[0043]
14.根据上述9~13中任一项所述的抗肿瘤剂,其中,sirna或shrna包含经修饰的碱基、经修饰的糖、及/或经改造的核苷键。
[0044]
15.根据上述14所述的抗肿瘤剂,其中,上述经修饰的糖的修饰为2
’‑
ome修饰。
[0045]
16.根据上述14或15所述的抗肿瘤剂,其中,上述经改造的核苷键为硫代磷酸酯键。
[0046]
17.一种药物组合物,含有上述9~16中任一项所述的抗肿瘤剂。
[0047]
18.一种组合制剂,包含:
[0048]
(a)制剂,包含能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna;及
[0049]
(b)制剂,包含叶酸-阳离子型寡肽复合物,该叶酸-阳离子型寡肽复合物包含由8~40个氨基酸构成的阳离子型寡肽部位,所述阳离子型寡肽部位包含至少两个下述式(i)的氨基酸残基连续的部分,且除下述式(i)的氨基酸残基连续的部分以外为不连续的一个其它氨基酸残基,
[0050]
[化学式6]
[0051][0052]
式(i)中,r1为基团h3n
-ch
2-或式(ii)所表示的基团,在r1为基团h3n
-ch
2-的情况下,r2不存在或者为碳原子数1~3的亚烷基,在r1为式(ii)所表示的基的情况下,r2为碳原子数1~4的亚烷基;在一个阳离子型寡肽中,r1及r2全部相同;
[0053]
[化学式7]
[0054][0055]
式(ii)中,r3、r4及r5为氢原子或者甲基,可以相同或不同。
[0056]
19.一种用于治疗胰腺癌的药物试剂盒,包含:
[0057]
(a)能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna;及
[0058]
(b)叶酸-阳离子型寡肽复合物,包含由8~40个氨基酸构成的阳离子型寡肽部位,所述阳离子型寡肽部位包含至少两个下述式(i)的氨基酸残基连续的部分,且除下述式(i)的氨基酸残基连续的部分以外为不连续的一个其它氨基酸残基,
[0059]
[化学式8]
[0060][0061]
式(i)中,r1为基团h3n
-ch
2-或式(ii)所表示的基团,在r1为基团h3n
-ch
2-的情况下,r2不存在或者为碳原子数1~3的亚烷基,在r1为式(ii)所表示的基的情况下,r2为碳原子数1~4的亚烷基;在一个阳离子型寡肽中,r1及r2全部相同;
[0062]
[化学式9]
[0063][0064]
式(ii)中,r3、r4及r5为氢原子或者甲基,可以相同或不同。
[0065]
本说明书包括作为本技术的优先权基础的日本专利申请号2019-194646号的公开内容。
[0066]
根据本发明,提供一种核酸制剂,能够有效地胰腺癌细胞特异性递送sirna或shrna,从而抑制胰腺癌的肿瘤增大、浸润及转移。
附图说明
[0067]
图1示出包含fol-dab8a及fol-dab8b的粗产物的hplc分析结果。
[0068]
图2通过由荧光能量共振转移(fret)得到的荧光强度变化来示出1~3当量的dab8、fol-dab8a及fol-dab8b对sirna的rnase a抗性的影响。
[0069]
图3中,a:示出共聚焦显微镜图像,该图像显示被alexa488标记的sirna在叶酸-阳离子型寡肽复合物存在下摄入s2-013胰腺癌细胞。b:示出共聚焦显微镜图像,该图像显示被alexa488标记的sirna在叶酸-阳离子型寡肽复合物非存在下摄入s2-013胰腺癌细胞。c:示出阳离子型寡肽或叶酸-阳离子型寡肽复合物存在下sirna向s2-013胰腺癌细胞的摄入效率。结果显示平均及标准误差。dab8-1表示按照1当量添加阳离子型寡肽dab8,fol-dab8b-3表示按照3当量添加叶酸-阳离子型寡肽复合物dab8b。
[0070]
图4中,a:示出加扰对照sirna或snora18 sirna和阳离子型寡肽或叶酸-阳离子型寡肽复合物联用时对snora18的表达抑制效果。针对通过rt-pcr扩增后的条带,用将对照sirna和dab8组合时的条带强度设为1时的相对强度来显示数据。b:示出加扰对照sirna或snora18sirna和叶酸-阳离子型肽复合物(fol-dab8a及fol-dab8b)联用时基质胶测定中的浸润细胞数。
[0071]
图5中,a:示出加扰对照sirna或nup85 sirna和阳离子型寡肽或叶酸-阳离子型寡肽复合物联用时对nup85的表达抑制效果。通过针对通过rt-pcr扩增后的条带,用对照sirna和dab8组合时的条带强度设为1时的相对强度来显示数据。b:示出加扰对照sirna或nup85 sirna和叶酸-阳离子型肽复合物(fol-dab8a及fol-dab8b)联用时基质胶测定中的浸润细胞数。
[0072]
图6中,a:示出加扰对照sirna或wasf2 sirna和阳离子型寡肽或叶酸-阳离子型寡
dab8b的情况。
[0082]
图16示出通过in vivo imager对化学修饰wasf2 sirna向负载有来自s2-013胰腺癌细胞的人胰腺癌类器官的小鼠的胰腺癌组织的递送进行拍摄得到的结果。a-c:向wasf2 sirna追加1-3当量fol-dab8a的情况,d-f:向wasf2 sirna追加1-3当量fol-dab8b的情况。
具体实施方式
[0083]
下面,使用实施例对本发明进行更具体说明。其中,本发明的技术的范围并不限定于这些实施例。
[0084]
《核酸递送促进剂》
[0085]
本发明提供一种由叶酸-阳离子型寡肽复合物构成的核酸递送促进剂。
[0086]
《叶酸》
[0087]
叶酸是水溶性维生素b群的一种,具有下述结构。有报道称,叶酸受体在肿瘤细胞表面高浓度表达。由于叶酸受体在胰腺癌细胞株s2-013中表达,本发明人等首先报道了使用包含叶酸的复合物将sirna递送至细胞内(oncotarget,2019,vol.10,no.30,pp.2869-2886)。
[0088]
[化学式10]
[0089][0090]
在本发明中,用于与阳离子型寡肽制作复合物的叶酸可以使用具有上述结构的叶酸,也可以为保持了与阳离子型寡肽的结合性及与叶酸受体的结合性的叶酸盐或者叶酸衍生物。
[0091]
例如,根据上述结构可知,叶酸分子上存在两个羧基、氨基、亚胺基等,因此,还可以在这些不参与和阳离子型寡肽的结合的官能团上追加本领域熟知的取代基,另外,也可以在叶酸上结合标记化合物。
[0092]
《阳离子型寡肽》
[0093]
作为本发明中可以使用的阳离子型寡核苷酸,能够适当使用国际公开wo2014/148620号、以及bioorganic&medicinal chemistry 21(2013)1717-1723中公开的核苷酸。
[0094]
具体而言,本发明中使用的阳离子型寡核苷酸可以具有8个以上氨基酸残基,该氨基酸残基具有氨基或胍基。
[0095]
更具体而言,本发明中可以使用的阳离子型寡肽可以为由8~40个氨基酸构成的寡肽,其包含阳离子型寡肽部位,所述阳离子型寡肽部位包含至少两个下述式(i)的氨基酸残基连续的部分,且除下述式(i)的氨基酸残基连续的部分以外为不连续的一个其它氨基酸残基。
[0096]
[化学式11]
[0097][0098]
式(i)中,r1为基团h3n
-ch
2-或式(ii)所表示的基团,在r1为基团h3n
-ch
2-的情况下,r2不存在或者为碳原子数1~3的亚烷基,在r1为式(ii)所表示的基的情况下,r2为碳原子数1~4的亚烷基;在一个阳离子型寡肽中,r1及r2全部相同。
[0099]
[化学式12]
[0100][0101]
式(ii)中,r3、r4及r5为氢原子或者甲基,可以相同或不同。
[0102]
上述“式(i)的氨基酸残基”不受限定,具体而言,可列举例如:l-2,3-二氨基丙酸(dap)、l-2,4-二氨基丁酸(dab)、l-鸟氨酸(orn)、l-赖氨酸(lys)、l-2-氨基-3-胍基丙酸(agp)、l-2-氨基-4-胍基丁酸(agb)、或l-精氨酸(arg)。
[0103]
上述“其它氨基酸残基”不受特别限定,能够适当选择。可列举例如:甘氨酸、l-丙氨酸、l-脯氨酸;以及l-氨基脯氨酸、l-胍基脯氨酸等具有脯氨酸骨架的氨基酸,但不限定于此。
[0104]
在一个方案中,阳离子型寡肽部位可以为包含上述“其它氨基酸残基”的杂合多量体。在另一种方案中,阳离子型寡肽部位可以为不包含上述“其它氨基酸残基”的同型多聚体。考虑到阳离子型寡肽的合成的简便性、及本发明人等所确认的sirna及shrna的稳定化效果等,阳离子型寡肽部位优选采用由单一氨基酸构成的同型多聚体。
[0105]
在该情况下,作为单体的氨基酸可以为天然氨基酸,也可以为非天然氨基酸。另外,氨基酸可以为l型,也可以为d型,它们也可以混合存在寡肽分子中。
[0106]
因此,阳离子型寡肽可以具有例如l-2,3-二氨基丙酸(dap)、l-2,4-二氨基丁酸(dab)、l-鸟氨酸(orn)、l-赖氨酸(lys)、l-2-氨基-3-胍基丙酸(agp)、l-2-氨基-4-胍基丁酸(agb)、或l-精氨酸(arg)的同型多聚体作为部分结构。
[0107]
阳离子型寡肽还可以为盐的形式,作为能够适当使用的盐,可列举:盐酸盐、乙酸盐、三氟乙酸盐等,但不受特别限定。
[0108]
双链核酸具有螺旋结构不同的a型和b型,dna/dna双链中,具有主沟宽为的b型双螺旋结构,而在rna/rna双链及dna/rna链中,具有主沟宽分别为及的a型双螺旋结构。本发明旨在提高sirna的稳定性,因此,需要使用可以与a型双螺旋结构的rna/rna链结合的阳离子型寡肽。
[0109]
通常,为了提高由21~23碱基构成的sirna、及会产生这样的sirna的shrna的稳定性,构成阳离子型寡肽的氨基酸残基的数量采用8~12个即可。
[0110]
作为一个具体的方案,就下述实施例中实际探讨后发现带来了优选的结果的物质而言,阳离子型寡肽部位可以采用具有下述结构的二氨基丁酸的八聚物。
[0111]
[化学式13]
[0112][0113]
《叶酸-阳离子型寡肽复合物》
[0114]
叶酸和阳离子型寡肽的结合优选采用共价结合。作为共价结合,可以是直接或经由接头与阳离子型寡肽的n端、c端或者侧链结合。
[0115]
作为接头,能够适当使用本领域中通常用于制作缀合物的物质,不受特别限定,能够采用由例如甘氨酸、丝氨酸等氨基酸构成的肽接头。例如,肽接头可以为由1~4个甘氨酸残基构成的肽。例如,就在下述实施例中实际进行探讨后发现带来了优选的结果的物质而言,可列举由三个甘氨酸残基构成的接头。
[0116]
在叶酸-阳离子型寡肽复合物中,考虑到与叶酸受体的相互作用、以及与双链核酸的相互作用,叶酸和阳离子型寡肽的比率可以设为1:1,但不受特别限定。
[0117]
如上所述,由于叶酸分子中存在两个羧基,因此,在经由与叶酸的羧基的反应来结合上述结构的dab8的情况下,会产生下面两种异构体。在本说明书中,为了方便起见,将这些化合物记作fol-dab8a、及fol-dab8b。
[0118]
[化学式14]
[0119][0120]
[化学式15]
[0121][0122]
在上述fol-dab8a、及fol-dab8b中,作为接头,使用了三个甘氨酸,但接头的长度可以适当变更。
[0123]
根据用于形成复合物的阳离子型寡肽的种类,叶酸-阳离子型寡肽复合物还可以作为盐的形式来获得。作为能够适当使用的盐,可列举:盐酸盐、乙酸盐、三氟乙酸盐等,但不受特别限定。
[0124]
通过制成叶酸-阳离子型寡肽复合物,可以提高sirna及shrna的稳定性,同时向具有叶酸受体的细胞靶向递送。
[0125]
需要指出,虽然在实施例中,作为用于表明fol-dab8a及fol-dab8b的有效性的对照化合物,使用了不具有叶酸的阳离子型寡肽dab8,但制成n端具有允许进行uv检测和定量的酪氨酸(n端被乙酰基保护)和三个甘氨酸,在实施例中,为了方便起见,将其称为dab8。
[0126]
[化学式16]
[0127][0128]
式中,ac-yggg表示n-乙酰基-l-酪氨酸-甘氨酸-甘氨酸-甘氨酸。
[0129]
如实施例中证实,本发明的核酸递送促进剂能够在in vitro及in vivo促进sirna或shrna向细胞递送。本发明的核酸递送促进剂能够特异性促进向高表达叶酸受体的细胞、特别是癌细胞的递送。
[0130]
《抗肿瘤剂》
[0131]
本发明还提供一种核酸制剂,包含能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna、及上述本发明的递送促进剂。本发明的核酸制剂能够有效抑制胰腺癌的肿瘤增大、浸润、转移。因此,本发明的核酸制剂具有作为针对胰腺癌的肿瘤增大抑制剂、浸润-转移抑制剂、抗肿瘤剂的作用。
[0132]
在本发明中,sirna或shrna和叶酸-阳离子型寡肽复合物也可以经由另外的共价键结合,但也可以不经由共价键,而是通过sirna或shrna所具有的负电荷和阳离子型寡肽所具有的正电荷所带来的相互作用使叶酸-阳离子型寡肽复合物的一部分进入sirna或shrna的主沟内,从而具有稳定的结构,并不意在拘泥于该稳定化效果的机理。
[0133]
《rnai分子》
[0134]
已知sirna及shrna通过被称为rna干扰的机理靶向特定的mrna并抑制其的翻译(表达)。靶序列的碱基数不受特别限定,可以在15~500碱基的范围内选择。sirna是短链双链rna分子,shrna是发夹型rna,它能够在体内被dicer酶加工而生成sirna。在本说明书中,有时将sirna及shrna统一记作“rnai分子”。
[0135]
sirna是与靶rna的部分碱基序列同源的正义链、和可与该正义链杂交的反义链杂交而成的双链rna,通常,3’端保持为oh,而5’端被磷酸化,3’端侧可以突出1碱基以上且4碱基以下。
[0136]
与此相对,由单链rna构成的shrna是与靶mrna的部分碱基序列同源的正义链的区
域和可与该正义链杂交的反义链的区域通过接头区域结合而成的,整体具有发夹状的结构。shrna的3’端突出1碱基以上且4碱基以下,另外,该3’突出末端也可以由dna构成。shrna如上那样在细胞内被分解,与sirna相同地引发rna干扰。因此,也可以使用shrna来代替sirna。
[0137]
用于实现本发明的目的的sirna或shrna是能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna。
[0138]
本说明书所述的“胰腺癌细胞中表达的mrna或snorna”不受特别限定,可以为与胰岛素样生长因子2mrna结合蛋白质3(igf2bp3)结合的物质。
[0139]
如上所述,胰腺癌细胞的细胞膜突起中存在人igf2bp3,各种mrna与该igf2bp3结合,从而在细胞膜突起中积累。通过利用rna干扰阻碍这些与细胞膜突起中的igf2bp3结合的mrna,可以有效抑制胰腺癌中肿瘤的增大、浸润、转移。
[0140]
胰腺癌细胞中表达的mrna中,作为本发明人等利用rna干扰确认了针对胰腺癌的抗肿瘤效果的mrna,可列举例如:nup85、wasf2、arhgef4、ccdc88a、lamtor2、mtor的mrna。
[0141]
《nup85》
[0142]
nup85(核孔蛋白85)是属于核孔蛋白(nucleoporin)蛋白质家族的蛋白质,核孔蛋白是核膜孔复合物的成分,核膜孔复合物形成有用于调节高分子在细胞核和细胞质之间的移动的进出口。人nup85的氨基酸序列及编码其的mrna的碱基序列等信息以gene id:79902、ncbi参考序列:nm_024844等收录于ncbi等数据库。
[0143]
《wasf2》
[0144]
wiskott-aldrich综合征是一种原发性免疫缺陷,伴随尺寸减少的血小板减少症、湿疹、易感染性是这种疾病的特征。wiskott-aldrich综合征蛋白质家族成员2(wasf2)属于wiskott-aldrich综合征蛋白质家族,该蛋白质家族形成多蛋白质复合物,该多蛋白质复合物将受体激酶和肌动蛋白连接,人wasf2的氨基酸序列及编码其的mrna的碱基序列等信息以gene id:10163、ncbi参考序列:nm_006990等收录于ncbi等数据库。
[0145]
《arhgef4》
[0146]
arhgef4(rho guanine nucleotide exchange factor 4、rho鸟嘌呤核苷酸交换因子4)是一种参与胞内进程的蛋白质,该胞内进程通过刺激被启动,其中,该刺激经由g蛋白质共轭状态发挥作用。人arhgef4的氨基酸序列及编码其的mrna的碱基序列等信息以gene id:50649、ncbi参考序列:nm_015320等收录于ncbi等数据库。
[0147]
《ccdc88a》
[0148]
ccdc88a(含有卷曲螺旋结构域的88a)是编码作为肌动蛋白结合蛋白质的girdin蛋白质的基因。人ccdc88a的mrna的碱基序列等信息以gene id:55704、ncbi参考序列:nm_001135597等收录于ncbi等数据库。
[0149]
《lamtor2》
[0150]
lamtor2(late endosomal/lysosomal adaptor,mapk and mtor activator 2)是朗格汉斯细胞的稳态的调节剂,报道称其参与了信号转导及mtor级联。人lamtor2的氨基酸序列及编码其的mrna的碱基序列等信息以gene id:28956、ncbi参考序列:nm_014017等收录于ncbi等数据库。
[0151]
《mtor》
[0152]
mtor(mammalian target of rapamycin kinase,雷帕霉素激酶的哺乳动物标靶)是一种参与哺乳动物等的胞内信号转导的蛋白质激酶。人mtor的氨基酸序列及编码其的mrna的碱基序列等信息以gene id:2475、ncbi参考序列:nm_004958等收录于ncbi等数据库。
[0153]
在本领域中,众所周知,mrna是由基因(dna)转录而来且包含编码蛋白质的信息的rna。已知通常为双链的sirna在其双链解离后,一条链(反义链)与特定的蛋白质一同形成被称为risc(rna-induced-silencing-complex)的复合物。risc识别并结合与sirna的正义链的碱基序列具有同源序列的mrna,并通过rnaseiii样的酶活性切割mrna。另一方面,shrna在被递送至的细胞内经加工后产生sirna,然后可以起到相同的作用。
[0154]
而snorna是存在于核小体的非编码rna(small nuclear rna),报道称snorna是具有引导核糖体rna及除此之外的rna的甲基化及假尿苷化的化学修饰等功能的rna分子群(例如mol.biol.cell,2004,15:281-293;j.biol.chem,2015,290:11741-11748)。
[0155]
本发明人等最近发现,属于上述snorna的snora18和snora22具有对于igf2bp3的结合能力,会参与胰腺癌细胞的运动或浸润。另外还发现,snorna与kh型剪接调节蛋白质(khsrp)结合,并集中在细胞质的p体(p-body)中(oncotarget,2020,vol.11,no.2,pp:131-147)。
[0156]
本发明人等发现,针对以上snorna的sirna或shrna也可以通过识别结合并敲低snorna来抑制胰腺癌的肿瘤增大、浸润、转移。
[0157]
《snora18》
[0158]
小核小体rna snora18被报道作用于引导从尿苷向假尿苷的修饰部位的rna的成员。人snora18的碱基序列等信息以gene id:677805、ncbi参考序列:nr_002959等收录于ncbi等数据库。
[0159]
《snora22》
[0160]
小核小体rna snora22也被报道作用于引导从尿苷向假尿苷的修饰部位的rna的成员。人snora22的碱基序列等信息以gene id:677807、ncbi参考序列:nr_002961等收录于ncbi等数据库。
[0161]
因此,在本发明中,作为sirna或shrna可以靶向的胰腺癌细胞中表达的mrna或snorna,可列举例如:选自由snora18 snorna、nup85mrna、wasf2 mrna、及snora22 snorna构成的组的物质,但不受特别限定。
[0162]
在靶向mrna的情况下,sirna或shrna可与之杂交的靶mrna可以包含3’utr、5’utr、外显子、内含子、编码区、翻译开始区、翻译结束区或其它核酸区。
[0163]
本发明中使用的sirna及shrna可以敲低mrna或snorna以阻碍其功能。因此,更具体而言,本发明的sirna及shrna由与靶rna的特定的碱基序列基本互补的碱基序列构成。然而,sirna及shrna可以相对于靶碱基序列具有1~2个左右错配。在获得了作为靶标的mrna或snorna的碱基序列的情况下,本领域技术人员可以选择与靶序列以外的核酸的碱基序列不具有同源性、并且适合阻碍/敲低靶序列表达的区域,从而设计并合成合适的高特异性sirna及shrna。
[0164]
例如,已知sirna在满足以下条件时,rna干扰效果好:
[0165]
(1)反义链的5’端为a或u;
[0166]
(2)正义链的5’端为g或c;且
[0167]
(3)反义链的5’端部的7个碱基中的4个碱基以上为a或u。因此,本发明中使用的sirna可以是具有该碱基序列的sirna,但不限定于此。同理,本发明中使用的shrna可以是在细胞内经加工后产生如上sirna的shrna,但不限定于此。
[0168]
也可以使用能够通过网络利用的程序来确定对某一靶序列有效的sirna序列及shrna序列。
[0169]
在本说明书中,阻碍/抑制或敲低表达是指,阻碍/抑制靶mrna或snorna的分解、向所编码的蛋白质进行翻译。抑制包括与对照相比将细胞或细胞群(胰腺癌组织)中的靶mrna/snorna量降低20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上、或90%以上。表达的阻碍/抑制或敲低可以通过本技术领域中任意公知的方法来确定,例如可以通过基于rt-pcr的方法来确定。
[0170]
sirna及shrna可以仅由天然(非修饰)核苷酸构成,也可以部分或全部核苷酸经过修饰。通过使用本领域中熟知的任意修饰,可以增加sirna及shrna的化学稳定性。然而,不希望因修饰导致所需的sirna及shrna的活性降低。因此可以理解,不能使用诸如会妨碍shrna细胞内加工之类的修饰。作为非天然核苷酸的修饰可以为糖及/或碱基的修饰。
[0171]
作为糖的修饰,可列举例如:二环式糖、5'-乙烯基、5'-甲基、4'-s、2'-f、2'-och3(2'-ome)、及2'-o(ch2)2och3取代基等,但不限定于此。二环式糖通常被称为桥接核酸(bridged nucleic acid,bna),可列举例如:lna(锁核酸(locked nucleic acid(注册商标))、2,4-bna,ena(乙烯基氧基(4-(ch2)
2-o-2)bna)等,但不限定于此。另外,糖也可以部分包含脱氧核糖来代替核糖,在该情况下,sirna的一个或两个寡核苷酸链、或shrna的寡核苷酸链中可以混合存在dna和rna。sirna优选为rna/rna双链。另外,shrna优选为rna链。作为糖的修饰,可以适当使用例如2
’‑
ome修饰。
[0172]
作为碱基的修饰,可列举例如:
[0173]
胞嘧啶的5-甲基化、5-氟化、5-溴化、5-碘化、n4-甲基化、
[0174]
腺嘌呤的n6-甲基化、8-溴化、
[0175]
鸟嘌呤的n2-甲基化、8-溴化、
[0176]
尿嘧啶的5-氟化、5-溴化、5-碘化、5-羟基化等,但不限定于此。
[0177]
sirna及shrna中相同的核苷酸或不同核苷酸可以具有如上所述那样的糖及碱基的修饰。
[0178]
sirna及shrna还可以包含经改造的核苷间键。
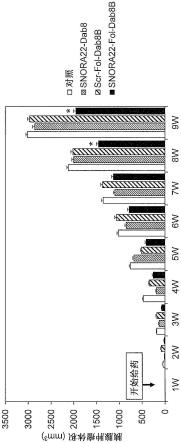
[0179]
经改造的核苷间键可以为例如硫代磷酸酯键、二硫代磷酸酯键、硼烷磷酸酯(boranophosphate)键、二氨基磷酸酰胺酯(phosphodiamidate)键及磷酰胺酯(phosphoamidate)键等,它们代替天然存在的磷酸二酯键而存在。
[0180]
sirna及shrna的核苷间键中的至少一个可以为经改造的核苷间键。或者,sirna及shrna的核苷间键中的至少两个、三个、或四个以上可以为经改造的核苷间键。经改造的核苷间键优选为硫代磷酸酯键。
[0181]
在sirna及shrna中,相同链中不同的核苷酸能够独立地进行不同的修饰。另外,相同的核苷酸可以具有修饰核苷间键(例如,硫代磷酸酯键),并进一步具有修饰糖(例如,二环式糖)。相同的核苷酸还可以具有修饰核酸碱基(例如,5-甲基胞嘧啶),并进一步具有修
饰糖(例如,2
’‑
ome修饰,二环式糖等)。
[0182]
本发明的sirna及shrna能够通过本技术领域公知的方法来制造。例如,sirna及shrna能够通过使用市售的自动核酸合成装置合成后,使用离子交换柱或反相柱等进行精制后制得。或者,sirna及shrna也可以指定核酸碱基序列以及修饰部位及种类后向制造商(例如,株式会社gene design)订购。
[0183]
另外,sirna及shrna上还可以结合有标记化合物(荧光蛋白质、萤光素酶等)、精制用化合物(生物素、亲和素、his标签肽、gst标签肽、flag标签肽等)等功能性分子。结合可以为直接结合,也可以为经由其它物质间接结合,优选通过共价键等直接结合。
[0184]
本发明的抗肿瘤剂中可以包含相对于sirna或shrna1分子为0.5~10当量的叶酸-阳离子型寡肽复合物,优选包含1~5当量的叶酸-阳离子型寡肽复合物,更优选包含1~3当量的叶酸-阳离子型寡肽复合物,但不限定于此。
[0185]
如实施例中证实,通过将sirna或shrna和叶酸-阳离子型寡肽复合物联用,能够显著抑制胰腺癌的肿瘤增大及浸润。本发明的叶酸-阳离子型寡肽复合物仅添加少量即能够发挥充分的效果,如相对于sirna或shrna添加1~3当量左右,因此,有望成为一种非常有用的胰腺癌的治疗方法。
[0186]
作为本发明的抗肿瘤剂,只要其有效成分被递送至作为靶部位的胰腺癌组织,则不受特别限制,可以制成例如注射剂、液剂、缓释剂。这些制剂的溶剂优选水,但优选通过使用生理盐水、pbs、血清白蛋白溶液等方法将制剂最终制成等渗液或类等渗液。
[0187]
《药物组合物》
[0188]
本发明还提供包含一种以上本发明的抗肿瘤剂的药物组合物。
[0189]
本发明的抗肿瘤剂的靶部位不仅可以为胰腺,还可以为胰腺癌细胞转移至的淋巴结及其它器官。另外,为了更可靠地向靶部位递送有效成分,剂型优选注射剂。
[0190]
药物组合物能够包含制剂领域通常使用的载体、赋形剂、稳定剂、崩解剂、表面活性剂、偶联剂、润滑剂、乳化剂、悬浮剂、抗氧化剂、调味剂、填充剂、助溶剂、包衣剂、着色剂、遮味剂、防腐剂、缓冲剂等。具体而言,可列举:水、生理盐水、其它水性溶剂、药学上可接受的有机溶剂、甘露醇、乳糖、淀粉、微晶纤维素、葡萄糖、钙、聚乙烯基醇、胶原蛋白、聚乙烯基吡咯烷酮、羧基乙烯基聚合物、海藻酸钠、水溶性葡聚糖、水溶性糊精、羧甲基淀粉钠、果胶、阿拉伯树胶、黄原胶、酪蛋白、明胶、琼脂、丙二醇、聚乙二醇、凡士林、石蜡、甘油、硬脂醇、硬脂酸、山梨糖醇等。
[0191]
药物组合物能够通过口服或肠胃外向供试体给药。作为肠胃外给药,可列举:向皮下、静脉、腹腔内、肿瘤内等注射或注入、及通过内窥镜或腹腔镜操作时给药,但不限定于此。
[0192]
本发明的药物组合物的给药量及给药频率根据不同的剂型、患者的年龄、性别、体重、疾病的严重程度等适当调节即可。例如,给药药物组合物时,可以采用保证sirna或shrna达到0.001mg/kg/天~1mg/kg/天、0.005mg/kg/天~0.5mg/kg/天、或0.01mg/体重kg/天~0.1mg/kg/天的量,并确定叶酸-阳离子型寡肽复合物的量,使其相对于sirna或shrna达到0.5~10当量。
[0193]
药物组合物可以单次给药或多次给药,例如可以按照1天、2天、3天、4天、5天、6天、1周、2周、3周、1月等的间隔给药。
[0194]
给药药物组合物的供试体可以为哺乳动物例如人、猴等灵长类动物、及非灵长类动物例如牛、猪、羊、马、猫、狗、豚鼠、大鼠及小鼠,更优选人。另外,供试体也可以为例如移植了人胰腺癌细胞的胰腺癌模型动物,该模型动物可以用于评价对于人的有效性。
[0195]
胰腺癌模型动物可以使用移植了例如日本特开2018-110575号中记载的癌类器官的非人动物,但不受特别限定。在此,“类器官”是指in vitro立体制作的器官,是对于特定的器官具有特异性的细胞的集合体。在本领域中,已经制成了各种器官的类器官。日本特开2018-110575号中记载的“癌类器官”是重现癌组织微环境的类器官。包括本技术的发明人在内的研究小组改良了日本特开2018-110575号的方法,制成了可以用于判断胰腺癌治疗药物的效果的人胰腺癌小鼠模型(日本特愿2020-078771),该小鼠模型也可以适当用于对本发明的抗肿瘤药及药物组合物对人的有效性进行评价。
[0196]
《组合制剂》
[0197]
本发明还提供一种组合制剂,包含上述能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna、及上述叶酸-阳离子型寡肽复合物,用于抑制胰腺癌的肿瘤增大、浸润、转移。
[0198]
根据本说明书的记载可知,sirna或shrna和叶酸-阳离子型寡肽复合物未共价结合,而是有意使叶酸-阳离子型寡肽复合物部分插入sirna或shrna的主沟,从而稳定sirna或shrna,但并不局限于机理。
[0199]
因此,sirna或shrna和叶酸-阳离子型寡肽复合物可以不预先包含在相同组合物中。即,可以分别制备含有sirna或shrna的制剂、和含有叶酸-阳离子型寡肽复合物的制剂,并在给药前将它们组合。
[0200]
此外,上述两种制剂也可以单独给药。然而,考虑到要通过叶酸-阳离子型寡肽复合物稳定sirna或shrna,这两种制剂优选同时(或者连续)并通过相同的给药途径给药,而不是在不同时刻给药、或者通过不同的向给药途径给药。
[0201]
《试剂盒》
[0202]
本发明还提供一种用于制造胰腺癌的药物试剂盒,包含上述能够与胰腺癌细胞中表达的mrna或snorna结合并阻碍其表达的sirna或shrna、及上述叶酸-阳离子型寡肽复合物。试剂盒中,除sirna或shrna及叶酸-阳离子型寡肽复合物之外,还包含关于可以同时给药、或适合给药的其它药剂、载体、给药方法等的使用说明书等。
[0203]
实施例
[0204]
通过下面的实施例对本发明进行具体说明,但本发明并不受这些实施例限定。
[0205]
[实施例1叶酸-阳离子型寡肽复合物的合成]
[0206]
如下合成叶酸-阳离子型寡肽复合物。需要指出,本实施例中使用的试剂及分析装置如下所示。
[0207]
《试剂》
[0208]
fmoc氨基酸衍生物及作为肽固相合成载体的树脂从渡边化学工业株式会社购买,另外,叶酸从东京化成株式会社购买,这些都直接使用。各肽链使用fmoc固相合成法,以fmoc-nh-sal-peg树脂为固相载体合成。fmoc-aa-oh试剂使用fmoc-dab(boc)-oh、fmoc-gly-oh、fmoc-tyr(t-bu)-oh。
[0209]
《esi ms》
[0210]
varian 910-ms(jasco)
[0211]
《紫外可见分光光度计》
[0212]
v-550(jasco)
[0213]
《变温紫外可见分光光度计》
[0214]
uv-1650pc(simadzu)
[0215]
《荧光分光光度计》
[0216]
fp-6500(jasco)
[0217]
《hplc》
[0218]
泵:pu-2080i plus(jasco)
[0219]
检测器:uv-2075i plus(jasco)
[0220]
低压梯度组件:lg-2080-02(jasco)
[0221]
脱气装置:dg-2080-53(jasco)
[0222]
反相柱:μ-bondasphere 150
×
3.9mm c18 5μm(waters),sunfire c18 obd 5μm 19
×
150mm(waters)
[0223]
《工序1:偶联操作》
[0224]
首先,通过fmoc固相合成合成l-2,4-二氨基丁酸的八聚物(dab8)。向petisyzer(hipep研究所)中加入固相载体,使所导入的氨基为13μmol,用1.3ml二甲基甲酰胺(dmf)清洗5次后,加入1.3ml dmf,并静置1小时以上,使载体溶胀。
[0225]
(i)溶胀后,用1.3ml dmf清洗5次,然后,加入1.3ml 25%哌啶/dmf溶液,使其反应5分钟,除去fmoc基。此时,用涡流混合器分数次搅拌。
[0226]
(ii)接着,用1.3ml dmf清洗5次后,加入相对于树脂上的氨基为5当量的fmoc-氨基酸(fmoc-aa-oh)、作为缩合试剂的n-[(1h-苯并三唑-1-基)(二甲基氨基)亚甲基]-n-甲基甲基甲铵六氟磷酸盐-n-氧化物(n-[(1h-benzotriazol-1-yl)(dimethylamino)methylene]-n-methylmethan aminiumhexafluorophosphate-n-oxide)(hatu
·
h2o,5当量)、二异丙基乙胺(dipea,10当量)、作为反应溶剂的dmf,合计1.3ml,缩合反应15分钟。此时,用涡流混合器分数次搅拌。
[0227]
反复进行(i)及(ii)的操作直至达到n端的氨基酸,然后,再进行(i)的操作,除去fmoc基,由此,在固相载体上合成nh
2-ggg-dab8。接着,用1.3ml dmf清洗5次后,将相对于树脂上的氨基为2当量的叶酸及2当量的n,n'-二环己基碳二亚胺(dcc)溶解在dmf-二甲基亚砜(dmso)混合溶剂(1:1,v/v)1.5ml中,静置6小时后,加入1.3ml,使其进行缩合反应14小时。
[0228]
《工序2:脱保护/脱树脂及精制》
[0229]
用dmf及chcl3将树脂分别清洗5次,在干燥器中减压干燥。将得到的树脂在室温下、三氟乙酸(tfa)-三异丙基硅烷-h2o混合溶剂(96.5/1.0/2.5,v/v/v)中搅拌1小时30分,进行脱保护/脱树脂。过滤去除树脂,使溶剂在氩气流下气化,然后,加入et2o使肽沉淀。加入离心分离机中除去上清液,并反复操作3次,然后,将et2o在氩气流下气化,得到粗产物(叶酸-阳离子型寡肽)。
[0230]
将得到的粗产物溶解于1ml大塚蒸馏水(大塚制药工场制),然后通过逆相hplc精制,逆相hplc使用以下条件。
[0231]
梯度循环:溶剂a(h2o-0.05%tfa)中的溶剂b(ch3cn-0.05%tfa)的比率以线性梯度计,5分钟时0%~5%;40分钟时5%~25%;5分钟时25%~100%
[0232]
测定温度:30℃
[0233]
流速:0.5ml/分钟
[0234]
图1示出fol-dab8粗产物的hplc分析结果。由于叶酸包含两个羧基,因此,导入叶酸后的dab8(记作fol-dab8)中将分开溶出两个峰。hplc分析时,将先溶出的作为fol-dab8a,后溶出的作为fol-dab8b。将各自的化学结构式示于下述。
[0235]
[化学式17]
[0236][0237]
[化学式18]
[0238][0239]
将hplc中制备的溶液冻干,得到黄色粉末。将精制后的fol-dab8a或者fol-dab8b溶解于大塚蒸馏水,预先计算叶酸的摩尔消光系数(波长368nm的摩尔消光系数:7967l/mol
·
cm),并根据叶酸的uv吸收计算收量。在固相载体上合成nh
2-ggg-dab8之后,与n端被乙酰基保护的酪氨酸进行偶联操作,进行《工序2》的操作之后,通过hplc精制,由此,得到白色粉末的dab8,并根据tyr的uv吸收计算收量。通过质谱(esi-ms)鉴定各个肽(dab8的[m h]
m/z计算值:1194.681,实测值:1194.682;fol-dab8a的[m h]
m/z计算值:1412.737,实测值:1412.738;fol-dab8b的[m h]
m/z计算值:1412.737,实测值:1412.739)。
[0240]
[实施例2熔融温度(tm)分析]
[0241]
测定实施例1中合成的阳离子型寡肽或叶酸-阳离子型寡肽复合物存在及不存在时核酸双链的熔融温度。
[0242]
本实施例中,向经退火的rna双链中添加阳离子型寡肽(dab8)或叶酸-阳离子型寡肽(fol-dab8a或者fol-dab8b),测定熔融温度(tm值)。作为rna双链,将由以下序列构成的寡核苷酸对用作sirna。
[0243]
5'-r(gucaucacacugaauacca)dtdt-3'(序列号1)
[0244]
5'-r(ugguauucagugugaugac)dtdt-3'(序列号2)
[0245]
准备50μm核酸水溶液144μl,在95℃下保持5分钟后,按照-0.5℃/分缓慢冷却至4℃。将其加入包含200mm nacl、20mm na2hpo
4-nah2po4的ph7.0缓冲液、大塚蒸馏水、及0.1mm肽水溶液的混合溶液中,使最终浓度为:10mm na2hpo
4-nah2po4、100mm nacl、4μm核酸双链、0、4、8、12、16、20μm肽(分别为0、1、2、3、4、5当量),由此制备样品。
[0246]
按照0.5℃/分从20℃升温至95℃,测定260nm的吸光度,求得熔融曲线。为了除去背景噪音,测定320nm的吸光度,通过从260nm的吸光度中减去320nm的吸光度后得到的值来制作熔融曲线,通过中线法求得tm值。
[0247]
结果,如表1所示,在未向rna双链添加阳离子型寡肽的情况下,tm值为72.3℃,而若添加1当量以上dab8、fol-dab8a、或fol-dab8b,则tm值均升高。即表明,fol-dab8a及b均和dab8一样与rna双链结合并提高其的热力学稳定性。
[0248]
[表1]
[0249][0250]
[实施例3rnasea抗性的评价]
[0251]
在阳离子型寡肽存在下进行核酸双链的rna分解酶抗性试验。
[0252]
本实施例中,向经退火的rna双链添加肽,形成复合物,测定rna的分解速度。
[0253]
向pcr管中加入大塚蒸馏水、100mm tris-hcl、1m nacl缓冲液(ph7.3)后,分别等量混合0.1mm 5’端为荧光基团的经6-fam修饰的单链rna(5'-fam-r(gucaucacacugaauacca)dtdt-3',序列号1)水溶液、0.1mm 3’端为淬灭基团的经dabcyl修饰的单链rna(5'-r(ugguauucagugugaugac)dtdt-dabcyl-3',序列号2)水溶液,使最终浓度为10mm tris-hcl、100mm nacl、10μm sirna。接着,在95℃下保持5分后,按照-0.5℃/分缓慢冷却至4℃。
[0254]
向石英皿中加入10mm tris-hcl、100mm nacl、10μm sirna水溶液、及0.1mm阳离子型寡肽水溶液,制成3ml,使最终浓度为:10mm tris-hcl、100mm nacl、10nm sirna、0、10、20、30nm肽(分别为0、1、2、3当量)。然后,在37℃下一边搅拌,一边加入100μg/ml来自牛胰腺的rnase a(roche公司制)15μl,开始测定荧光强度,并追踪经时变化(激发波长:490nm;测定波长:520nm;测定时间:60分)。
[0255]
将结果示于图2。rna双链解离后,荧光基团和淬灭基团的距离增大,荧光强度升高,因此,dab8、fol-dab8a、fol-dab8b若添加1当量以上,则荧光强度的增大速度均变慢,这表明,fol-dab8a及b与dab8一样也提高了rna双链的分解酶抗性。
[0256]
[实施例4确认sirna摄入胰腺癌细胞]
[0257]
流式细胞术难以识别标记摄入细胞内的sirna和标记未摄入细胞内的sirna,因此,使用共聚焦显微镜对sirna向胰腺癌细胞的摄入进行观察。
[0258]
将胰腺癌细胞株s2-013(东北大学加龄医学研究所医用细胞资源资源/细胞库,id:tkg0709)按照2
×
104个/孔的细胞密度接种于4孔室载玻片(thermo fisher scientific)中,向其中加入相对于alexa647(thermo fisher scientific)标记的加扰对照sirna(序列号3及4)为1~3当量的dab8、fol-dab8a、fol-dab8b,并培养48小时。使sirna的浓度为8.28μg/ml,并取25μl,作为dab8、fol-dab8a、fol-dab8b的浓度,将原液(dab8:119.3μg/ml;fol-dab8a、fol-dab8b:141.2μg/ml)稀释25倍后使用。相对于sirna为1、2、3当量的量为分别3.9μl、7.8μl、11.7μl。
[0259]
第二天,用4%多聚甲醛固定,并用加入dapi的封闭剂封闭后,通过一体式荧光显微镜(bz-x800,keyence)进行观察。结果,如图3a所示,通过alexa647的荧光确认sirna摄入细胞内。另一方面,在仅将sirna加入胰腺癌细胞株s2-013的培养液中进行培养的情况下,根据alexa647的荧光,确认sirna几乎未摄入细胞(图3b)。
[0260]
为了将摄入转换为数值,使用keyence分析软件bz-x800 analyzer的杂交细胞计数功能,对dab8、fol-dab8a、fol-dab8b存在下摄入了sirna的细胞进行计数。判断时,测定1/3以上的细胞核被染上深色的细胞、和细胞核的周围部具有深色团的细胞。
[0261]
结果,如图3c所示,在使用阳离子型寡肽(dab8)、以及叶酸-阳离子型寡肽复合物(fol-dab8a、fol-dab8b)的情况下,确认所添加的sirna的20~40%摄入细胞内。另外,3当量fol-dab8a、1当量fol-dab8b时,导入效率最高,导入效率优于追加了1~3当量的dab8。
[0262]
[实施例5叶酸-阳离子型肽追加sirna的敲低效果]
[0263]
分别探讨sirna在阳离子型寡肽或叶酸-阳离子型寡肽复合物的存在下对snora18、nup85、wasf2、snora22的敲低效果。
[0264]
表2中示出本实施例中使用的sirna的序列。如本领域通常进行那样,作为各sirna,使用表2所示的正义链和反义链形成了双链的sirna。
[0265]
[表2]
[0266][0267]
将追加了dab8和sirna的复合物为1当量、fol-dab8a和sirna的复合物为3当量、fol-dab8b和sirna的复合物为1当量的阳离子型寡肽或叶酸-阳离子型肽的加扰对照sirna(序列号3及4)、snora18 sirna(序列号5及6)、nup85 sirna(序列号7及8)、wasf2 sirna(序列号9及10)、snora22 sirna(序列号11及12)分别添加在6孔板(thermo fisher scientific)的s2-013细胞的培养液(1.0
×
105个/孔)中,48小时后回收细胞。
[0268]
使用回收的细胞的rna进行半定量rt-pcr法,确认细胞中的snora18、nup85、wasf2、snora22的敲低效果。
[0269]
具体而言,使用stratascript逆转录酶(agilent)及随机引物对从s2-013细胞得
到的总rna进行逆转录。制备各单链cdna的适当的稀释液,以用于随后的pcr扩增。将gapdh mrna用作内部定量对照。用于对snora18、nup85、wasf2及snora22扩增的引物序列记于以下的表3。
[0270]
[表3]
[0271][0272]
pcr反应中,在takara pcr thermal cycler dice gradient上,于94℃下进行2分钟初始变性,接着,按照94℃、30秒;58℃、30秒;72℃、1分钟进行21循环(gapdh)或25循环
(snora18、nup85、wasf2及snora22)。使用quantity one分析系统(bio-rad)进行扫描及光密度分析以测定条带强度。
[0273]
结果,如图4a、5a、6a、及7a中分别所示,在对照sirna和dab8、fol-dab8a或fol-dab8b的组合中,snora18、nup85、wasf2及snora22均未见敲低效果,而在将snora18 sirna、snora22 sirna、nup85 sirna、及wasf2 sirna与fol-dab8a或fol-dab8b组合后添加的情况下,均确认到显著的敲低效果。不包含叶酸的dab8中,未发现该敲低效果。
[0274]
[实施例6叶酸-阳离子型寡肽复合物 sirna对细胞浸润的阻碍效果]
[0275]
将追加了叶酸-阳离子型寡肽复合物后的加扰对照sirna、snora18sirna、nup85 sirna、wasf2 sirna、snora22 sirna(均为实施例5中使用的物质)分别添加在s2-013细胞的培养液中,48小时后,测定基质胶浸润。
[0276]
将悬浮于无血清培养基的4.0
×
104个细胞接种于matrigel invasion chamber(24孔板,孔径:8μm,becton dickinson制)的上腔。将包含5%胎牛血清的溶剂添加于下腔。将细胞在上腔内孵育20小时后,用显微镜对三个独立的区域进行观察,并对浸润至下腔的细胞进行计数。同样的实验反复进行3次,比较摄入了sirna的各s2-013细胞的细胞浸润能力。
[0277]
图4b、5b、6b、及7b中示出了将加扰对照sirna、或snora18sirna、nup85 sirna、wasf2 sirna、及snora22 sirna中的任意一者与叶酸-阳离子型寡肽复合物共同添加在细胞进行测定时,从上腔移动向下腔的细胞的数目。“*”表示t-检测中相对于对照具有显著差异,p《0.05。
[0278]
结果,与摄入对照sirna的s2-013细胞相比,摄入了snora18sirna、nup85 sirna、wasf2 sirna、或snora22 sirna的s2-013细胞显著抑制了细胞浸润。
[0279]
根据以上结果可以确认,与叶酸-阳离子型寡肽复合物组合后添加在培养细胞的培养基中的sirna被摄入s2-013细胞内,阻碍了参与细胞浸润的snorna及mrna的表达。
[0280]
[实施例7对于化学修饰sirna的效果]
[0281]
制作为了提高稳定性经化学修饰的sirna,并探讨叶酸-阳离子型寡肽复合物对于其的效果。
[0282]
表4中示出本实施例中使用的sirna的正义链及反义链的序列。分别包含经化学经修饰的碱基,并在3’端包含硫代磷酸酯键。
[0283]
[表4]
[0284][0285]
使用加扰对照sirna(序列号3及4)及上述sirna,与实施例4相同地探讨其向细胞的摄入。
[0286]
向正在培养的胰腺癌细胞株s2-013的培养液(2
×
104个/孔)中加入被alexa488(thermo fisher scientific)标记的sirna(2.5μg/ml)、及相对于sirna为1、2、3当量的
dab8、fol-dab8a、fol-dab8b。
[0287]
接着,与实施例5相同地,在叶酸-阳离子型寡肽复合物存在或不存在时探讨化学修饰sirna对胰腺癌细胞的浸润的效果。
[0288]
将加扰对照sirna(序列号3及4)、snora18 sirna(序列号21及22)、nup85 sirna(序列号23及24)、wasf2 sirna(序列号25及26)、snora22 sirna(序列号27及28)分别与2当量的dab8、fol-dab8a、fol-dab8b一同添加在正在培养的胰腺癌细胞株s2-013的培养液中。作为对照,分别单独向s2-013细胞的培养液中添加对照sirna、snora18sirna、nup85 sirna、wasf2 sirna、snora22 sirna。
[0289]
培养48小时后,进行基质胶浸润测定。在基质胶浸润测定中,示出从上腔移动向下腔的细胞的数目。“*”表示t-检测中相对于对照具有显著差异,p《0.05。
[0290]
其结果,如图8所示,与在fol-dab8a,fol-dab8b存在下添加了加扰对照sirna的s2-013细胞、及单独添加sirna的情况相比,在fol-dab8a、fol-dab8b存在下使用snora18 sirna、nup85 sirna、wasf2 sirna、或snora22 sirna的情况下,均显著抑制了s2-013细胞的浸润。在不包含叶酸的dab8存在下,也发现了snora18 sirna、nup85 sirna、wasf2 sirna、或snora22 sirna对于s2-013细胞的浸润的抑制效果,但与添加fol-dab8a、fol-dab8b是相比,抑制效果弱。
[0291]
[实施例8确认化学修饰sirna向胰腺癌细胞摄入1]
[0292]
将实施例7中制作的化学修饰snora22 sirna(序列号27及28)用alexa488(thermo fisher scientific)标记,并与叶酸-阳离子型寡肽复合物(fol-dab8b,2当量)一同添加在4孔腔(thermo fisher scientific)中的s2-013胰腺癌细胞或hpne正常胰管上皮细胞(atcc)的培养液(5
×
104个/孔)中,在37℃下孵育一晚后,观察dna(dapi)、叶酸受体(folr1)及sirna(alexa488)的染色。
[0293]
结果,如图9所示,与hpne正常胰管上皮细胞相比,s2-013胰腺癌细胞中,叶酸受体的染色强度高,同时,被摄入细胞内的snora22 sirna的染色强度也较强。这表示表达更多叶酸受体的胰腺癌细胞中摄入了更多snora22 sirna。
[0294]
图10示出了叶酸-阳离子型寡肽复合物(fol-dab8b,2当量)共存下snora22 sirna对s2-013胰腺癌细胞及hpne正常胰管上皮细胞的导入效率(%)。snora22 sirna向s2-013胰腺癌细胞的摄入显示出接近正常细胞3倍的数值。
[0295]
[实施例9确认化学修饰sirna向胰腺癌细胞的摄入2]
[0296]
已知被内吞作用摄入细胞内的sirna会与摄入核内体内的溶酶体融合。为了验证本发明的sirna和fol-dab8a或fol-dab8b的复合物是否经由内吞作用被摄入,获取了溶酶体的染色和sirna的染色的共聚焦显微镜图像。
[0297]
将被alexa488标记的化学修饰snora22 sirna(序列号27及28)、及叶酸-阳离子型寡肽复合物(fol-dab8a或fol-dab8b,2当量)添加在4孔腔(thermo fisher scientific)中的s2-013胰腺癌细胞的培养液(2
×
104个/孔)中,孵育一晚,观察溶酶体(lysotracker,使用thermo fisher scientific染色)及sirna(alexa488)的染色。
[0298]
结果,如图11所示,snora22 sirna被摄入s2-013胰腺癌细胞,并集中在溶酶体中,这表明,sirna和叶酸-阳离子型寡肽复合物通过内吞作用被摄入。
[0299]
[实施例10确认化学修饰提高了sirna的稳定性]
[0300]
本实施例中,探讨化学修饰是否提高了sirna在血清中的稳定性。
[0301]
将未经化学修饰的snora22 sirna(序列号11及12)、或化学修饰snora22 sirna(序列号27及28)和阳离子型寡肽(dab8)或叶酸-阳离子型寡肽复合物(fol-dab8a或者fol-dab8b)混合,室温下静置15分钟后,分别向pbs或者10%fcs/pbs中添加1μl,并进行混合(最终20μm)。作为对照,单独添加各snora22 sirna。
[0302]
刚刚混合后、混合3小时或混合6小时后进行采样,用液氮冷冻后,在-80℃下保存。得到全部样品后,使用非还原凝胶进行sds-page,用sybr gold(thermo fisher scientific)进行检测。
[0303]
结果,如图12所示,没有化学修饰的sirna,即使在阳离子型寡肽或叶酸-阳离子型寡肽复合物共存的情况下,也会快速分解,表明化学修饰提高了sirna在血清中的稳定性,基本能够抑制rnase对sirna的分解。
[0304]
[实施例11in vivo摄入sirna1]
[0305]
变更日本特开2018-110575中记载的方法,使用s2-013胰腺癌细胞制作人胰腺癌类器官。
[0306]
具体而言,将s2-013胰腺癌细胞(20
×
104个)、人间充质干细胞msc(lonza,40
×
104个),及人脐静脉内皮细胞huvec(lonza,14
×
104个)添加在48孔板(thermo fisher scientific)中的dmem/基质胶混合溶液中,在37℃的co2培养箱中孵育30分钟。
[0307]
然后,添加dmem/egm混合溶液300μl/孔,再在37℃下孵育24小时,由此在各孔内逐一制作胰腺癌类器官。
[0308]
接着,切开裸鼠(6周龄的balb/cslc-nu/nu(pathogen-free female athymic nude mice),日本slc株式会社)的侧腹的皮肤,将上述得到的胰腺癌类器官移植于皮下(每组2只)。
[0309]
移植后第6周,将被alexa-594标记的化学修饰snora22 sirna(序列号27及28,5μg)与1当量、2当量或3当量的阳离子型寡肽(dab8)或叶酸-阳离子型寡肽复合物(fol-dab8a或者fol-dab8b)一同尾静脉注射给药。24小时后,使用in vivo imager进行拍摄。
[0310]
测定设备:spectrum in vivo imaging system(perkinelmer,waltham,ma)
[0311]
测定条件:kexc 640nm,kemi 680nm
[0312]
结果,如图13所示,在使用dab8(a-c)、使用fol-dab8a(d-f)、及使用fol-dab8b(g-i)时,促进了snora22 sirna向胰腺癌组织递送,特别是在追加3当量fol-dab8a(f)、追加2当量追fol-dab8b(h)时,高浓度递送。
[0313]
需要指出,本实验中,几乎未观察到sirna向肝脏转移累积,并确认sirna被肾脏排出体外。
[0314]
[实施例12确认抗肿瘤效果]
[0315]
从将实施例11中制作的人胰腺癌类器官移植至裸鼠皮下1周后开始,以每周一次的频率,与阳离子型寡肽(dab8,2当量)或叶酸-阳离子型寡肽复合物(fol-dab8b,2当量)一同尾静脉注射给药化学修饰snora22sirna(序列号27及28、5μg),每周使用卡尺测量肿瘤体积(每组n=8)。作为对照,与叶酸-阳离子型寡肽复合物(fol-dab8b,2当量)一同给药加扰对照sirna(序列号3及4)。
[0316]
结果,如图14所示,根据从开始给药至9周后之间的测量结果,与非给药对照组
(control)、加扰对照sirna给药组(scr-fol-dab8b)、及阳离子型寡肽共同给药组(snora22-dab8)相比,snora22 sirna和叶酸-阳离子型寡肽复合物共同给药组(snora22-fol-dab8b)中,第8周以后可见显著的抑制肿瘤增大的效果。
[0317]
[实施例13sirna的in vivo摄入2]
[0318]
与实施例11相同地,通过in vivo imager对与叶酸-阳离子型寡肽复合物(fol-dab8a或者fol-dab8b)一同给药时化学修饰snora18 sirna(序列号21及22)向胰腺癌负载小鼠的递送进行拍摄。
[0319]
结果,如图15所示,确认fol-dab8a及fol-dab8b均会促进snora18sirna向胰腺癌组织的递送,特别是追加1当量(a)或3当量(c)fol-dab8a时,高浓度递送。
[0320]
[实施例14sirna的in vivo摄入3]
[0321]
与实施例11及13相同地,使用in vivo imager对与叶酸-阳离子型寡肽复合物(fol-dab8a或者fol-dab8b)一同给药时化学修饰wasf2 sirna(序列号25及26)向胰腺癌负载小鼠的递送进行拍摄。
[0322]
结果,如图16所示,确认fol-dab8a及fol-dab8b均会促进wasf2sirna向胰腺癌组织的递送,特别是追加1当量(d)或3当量(f)fol-dab8b时,高浓度递送。
[0323]
工业适用性
[0324]
根据本发明,提供一种治疗方法,能够有效抑制所有癌中被认为预后最差的胰腺癌的肿瘤增大、浸润及转移。本技术的抗肿瘤剂被有效地特异性递送至胰腺癌细胞,并且,通过与其它抗癌剂及/或抗癌治疗组合使用,可以大幅度提高胰腺癌的治疗效果。
[0325]
本说明书中引用的出版物、专利及专利申请均直接通过引用结合在本说明书中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。