1.本发明涉及用寡核苷酸、尤其是可比托莫德(cobitolimod)治疗炎性肠病例如活动性溃疡性结肠炎(ulcerative colitis,uc)的新疗法。
背景技术:
2.溃疡性结肠炎(uc)是一种以直肠粘膜和结肠粘膜的慢性炎症为特征的疾病,在第一阶段影响最内层。该病是复发性的,活动期和非活动期在病理、症状和治疗上都不同。uc的基本病因尚不清楚,也不知道是什么会触发该疾病在其非活动型和活动型之间复发(irvine,e.j.(2008)inflamm bowel dis 14(4):554-565)。活动性uc的症状包括进行性带血稀便和排便频率增加。活动性粘膜炎症通过内窥镜检查来诊断。
3.大便含有脓液、粘液和血液,并常伴有腹部绞痛和排泄急迫(里急后重(tenesmi))。腹泻可能起病隐匿,或更罕见的是非常突然地发作。在严重情况下,症状可能包括发烧和全身不适。在严重阶段,肠壁深层炎症可能发展,伴随有腹部压痛、心动过速、发烧和肠穿孔风险。此外,uc患者可能遭受肠道外表现,例如关节痛和关节炎、结节性红斑、坏疽性脓皮病和眼睛发炎。在缓解或非活动性uc的情况下,患者通常没有肠症状。
4.在uc患者之间,粘膜发炎和受损的程度不同。仅影响直肠的uc称为溃疡性直肠炎。当结肠左侧直至脾曲处出现炎症变化时,这种病症称为远端或左侧结肠炎。在广泛型uc中,横结肠也受到影响,而全结肠炎是指累及整个结肠的疾病。
5.活动性粘膜炎症可通过内窥镜检查来诊断,其特征是血管纹理消失(loss of vascular patterning)、水肿、瘀斑、自发性出血和纤维蛋白性渗出物。内窥镜检查图像是从直肠开始并以不同程度近端地延伸到结肠中的连续发炎的图像。在内窥镜检查下获得并经过组织学检查的活组织检查帮助诊断该病症。包括艰难梭菌(clostridium difficile)、弯杆菌(camphylobacter)、沙门氏菌(salmonella)和志贺氏菌(shigella)在内的传染性病因可以类似于uc,并可通过大便培养排除。
6.uc的医疗管理分为活动性疾病治疗和维持缓解。
7.对活动性uc患者的治疗旨在减少炎症并促进结肠愈合和粘膜恢复。对于中度病例,可以用常规药物控制该疾病,所述常规药物包括柳氮磺胺吡啶、5-氨基水杨酸(5-aminosalicylic acid,5-asa)(sutherland,l.,f.martin,s.greer,m.robinson,n.greenberger,f.saibil,t.martin,j.sparr,e.prokipchuk and l.borgn(1987)gastroenterology 92:1894-1898)和糖皮质激素(glucocorticosteroid,gcs)(domenech,e.,m.manosa and e.cabre(2014).dig dis 32(4):320-327)。
8.gcs通常用于治疗疾病突然发作,并且不建议用于维持缓解,因为长期使用会产生显著的副作用,并且可能会发展类固醇依赖性疾病。糖皮质激素药物的作用是非选择性的,因此从长远来看,它们可能会损害许多健康的合成代谢过程。因此,不建议使用全身性gcs进行维持治疗(prantera,c.and s.marconi(2013)therap adv gastroenterol 6(2):137-156)。
9.对于gcs难治且患有uc重度发作或中重度发作的患者,可以采用增加免疫调节剂,例如环孢霉素、6-巯基嘌呤和咪唑硫嘌呤。然而,免疫调节剂作用缓慢,并且对这些患者的缓解的诱导通常是暂时的(khan,k.j.,m.c.dubinsky,a.c.ford,t.a.ullman,n.j.talley and p.moayyedi(2011)am j gastroenterol 106(4):630-642)。
10.uc的其他治疗选择包括生物试剂(fausel,r.and a.afzali(2015)ther clin risk manag 11:63-73)。目前批准用于中度至重度uc治疗的三种tnf-α抑制剂是英夫利昔单抗(infliximab)、阿达木单抗(adalimumab)和戈利木单抗(golimumab)。所有这三种都带有与其使用相关的潜在风险,应避免用于某些患者,例如那些具有不受控制感染、晚期心力衰竭、神经系统病症的患者,以及有恶性肿瘤病史的患者,因为有加速肿瘤生长的潜在风险。tnf-α抑制剂治疗的其他潜在不良反应包括嗜中性粒细胞减少、肝中毒、血清病、白细胞碎裂性血管炎、皮疹(包括牛皮癣样皮疹)、诱导自体免疫,以及注射或输注部位反应(包括过敏反应、抽搐和低血压)。
11.所有这三种tnf-α抑制剂及其相关的生物类似物/衍生物对应物均可以用于诱导和维持uc患者的临床反应和缓解。使用咪唑硫嘌呤的联合疗法也可用于诱导缓解。
12.然而,超过50%的接受tnf-α抑制剂治疗的患者无法对诱导给药产生响应或随时间推移而失去对tnf-α抑制剂的响应(fausel,r.and a.afzali(2015)ther clin risk manag 11:63-73)。
13.维多珠单抗(一种α4β7整合素抑制剂)、托法替尼(一种jak抑制剂)和优特克单抗(一种抗il12/il23单克隆抗体),已被批准用于治疗uc。在gemini 1试验中,发现维多珠单抗在诱导和维持临床响应、临床缓解和粘膜愈合中比安慰剂更有效(feagan,b.g.,p.rutgeerts,b.e.sands,s.hanauer,j.f.colombel,w.j.sandborn,g.van assche,j.axler,h.j.kim,s.danese,i.fox,c.milch,s.sankoh,t.wyant,j.xu,a.parikh and g.s.group(2013).“vedolizumab as induction and maintenance therapy for ulcerative colitis.”n engl j med369(8):699-710.)。
14.慢性活动性且已知疗法难治的溃疡性结肠炎患者带来了严峻的医学挑战,通常仅剩下的行动方案就是结肠切除术。全结肠切除术可能是重度uc中的一种可能的治愈选择,但它是改变人生的手术,可能伴随着发生并发症的风险,例如结肠袋衰竭、结肠袋炎、盆腔脓毒症、女性不孕症和夜间大便失禁(nocturnal faecal soiling)等。因此,通常将外科手术留给患有严重难治性疾病、外科或其他紧急情况的患者,或患有结直肠发育不良或癌症的患者。
15.uc的紧急三线治疗是可比托莫德(cobitolimod;kappaproct/dims0150),一种基于修饰的单链脱氧核糖核酸(dna)的长度为19个碱基的合成寡核苷酸。可比托莫德具有序列5'-g*g*a*acagttcgtccat*g*g*c-3'(seq id no:1),其中cg二核苷酸是未甲基化的。
16.可比托莫德通过靶向免疫细胞中存在的toll样受体9(tlr9)来充当免疫调节剂。这些免疫细胞,即b细胞和浆细胞样树突状细胞(plasmacytoid dendritic cell,pdc)大量存在于诸如结肠粘膜和鼻粘膜的粘膜表面中。免疫系统是uc改变的关键介质。uc患者的结肠及直肠的粘膜是慢性发炎的,并含有活跃的免疫细胞。可以在炎症区域局部施用可比托莫德,这使药物与大量预期的靶细胞紧密接触,从而确保药物将到达富含tlr9表达细胞的区域。通过可比托莫德对这些细胞的激活诱导了多种细胞因子,例如i型干扰素和白介素10
(il-10),它们是经典的抗炎细胞因子,并被认为是可比托莫德的临床效果的重要因素。
17.可比托莫德的临床疗效已在“collect”临床试验中得到证实,该试验涉及以4周的间隔向患者施用30mg剂量的可比托莫德。该临床试验的详情发表在journal of crohns and colitis(atreya et al.j crohns colitis,2016may 20)中并总结在参考例1中。总体而言,有关可比托莫德的数据支持对慢性活动性uc患者的正效益风险评估。可比托莫德安全且耐受良好,已被证明有效地诱导慢性活动性uc患者的临床响应和缓解,以及对难治性中度至重度慢性活动性uc患者的症状性缓解和内窥镜检查缓解。
18.collect研究涉及在内窥镜检查期间通过喷雾导管装置局部施用可比托莫德。这是一种侵入性医疗程序,必须由医疗专业人员执行。此外,在对患者局部施用可比托莫德之前,对每个患者的结肠进行清洁以去除粪便物。这样做是为了使可比托莫德能够到达结肠内的肠上皮细胞,并使内窥镜医师能够观察结肠粘膜。因此,本领域公知寡核苷酸如可比托莫德与有机物如粪便结合。因此认为有必要从结肠中去除任何粪便覆盖层和其他粪便物质,以使可比托莫德能够到达结肠内的目标肠上皮细胞。
19.如上所述,慢性活动性且已知疗法难治的溃疡性结肠炎患者带来了严峻的医学挑战,通常仅剩下的行动方案就是结肠切除术。出于这个原因,尽管这种侵入性手术带来不便和不适,但患者将容忍既需要结肠清洁以去除粪便物又需要通过喷雾导管进行局部施用的医疗干预。然而,治疗上期望为溃疡性结肠炎患者提供不需要结肠清洁以去除粪便物并且优选地可以由患者自行施用的局部治疗。
技术实现要素:
20.现在令人惊讶地发现,尽管已知可比托莫德具有与粪便物结合的倾向,但当对没进行结肠清洁的患者施用时,可比托莫德对炎症性肠病如uc具有疗效。此外,令人惊讶地发现,可以通过适用于自我施用的灌肠装置施用可比托莫德。因此,不必在内窥镜检查期间使用喷雾导管装置来施用活性成分。
21.因此,本发明提供一种包含序列5'-ggaacagttcgtccatggc-3'(seq id no:2)的寡核苷酸,该寡核苷酸用于通过局部施用至结肠来治疗人对象炎性肠病,其中该对象在施用之前没有进行结肠清洁。
22.优选地,所述局部施用是通过适用于患者自我施用的灌肠剂来实现的。通常,灌肠剂具有细长尖端,该尖端配置为能够插入直肠。通常,所述尖端的长度为4cm至15cm,通常4cm至10cm,优选5cm至6cm。因此,典型地,可比托莫德通过涉及仅将长度为4cm至15cm、优选4cm至10cm的细长灌肠剂尖端插入直肠的方法施用。
23.优选地,炎性肠病的治疗包括在至少两个分开的时刻向对象施用单独剂量的150mg至350mg所述寡核苷酸,其中所述分开的时刻相隔3周。250mg药物的疗效的增加超过了先前以低得多的剂量进行的临床研究的预期。
24.本发明还提供了一种药物组合物,该药物组合物包含本文定义的寡核苷酸以及一种或多种药学上可接受的载体,该药物组合物用于治疗本文定义的人对象中的本文定义的炎性肠病,其中该对象在所述施用之前没有进行结肠清洁。通常,所述组合物的单独施用是在至少两个分开的时刻向对象施用,其中所述分开的时刻相隔3周,并且其中组合物的每次施用递送一定量的如本文定义的寡核苷酸。
25.本发明还提供了在本文定义的人对象中治疗本文定义的炎性肠病的方法,包括向所述对象施用本文定义的寡核苷酸或本文定义的组合物,其中该对象在所述施用之前没有进行结肠清洁。通常,所述寡核苷酸或组合物的单独施用是在至少两个分开的时刻向患者施用,其中所述分开的时刻相隔3周,并且其中寡核苷酸或组合物的每次施用递送一定量的如本文定义的寡核苷酸。
26.在优选的实施方式中,寡核苷酸具有序列5'-g*g*a*acagttcgtccat*g*g*c-3’(seq id no:1),其中cg二核苷酸是未甲基化的。因此,在优选的实施方式中,寡核苷酸是可比托莫德。
附图说明
27.图1示出了安慰剂对照的临床试验结果,该试验为在施用本发明的寡核苷酸或安慰剂(添加至标准治疗(standard of care,s.o.c.)中)后,治疗组和安慰剂组中按周报告便血=零(7天内患者报告的最大结果)的比例;
28.图2示出了安慰剂对照的临床试验结果,该试验为在施用本发明的寡核苷酸或安慰剂(添加至标准治疗(s.o.c.)中)后,治疗组和安慰剂组中按周报告每周排便频率<18(7天内患者报告的结果的汇总)的比例;
29.图3示出了安慰剂对照的临床试验结果,该试验为在施用本发明的寡核苷酸或安慰剂(添加至标准治疗(s.o.c.)中)后,治疗组和安慰剂组中按周报告每周排便频率<35(7天内患者报告的结果的汇总)的比例;
30.图4示出了安慰剂对照的临床试验结果,该试验为在施用本发明的寡核苷酸或安慰剂(添加至标准治疗(s.o.c.)中)后,治疗组和安慰剂组中按周报告每天排便频率<3(7天内患者报告的日平均结果)的比例;
31.图5示出了安慰剂对照的临床试验结果,该试验为在施用本发明的寡核苷酸或安慰剂(添加至标准治疗(s.o.c.)中)后,治疗组和安慰剂组中按周报告每天排便频率<4(7天内患者报告的日平均结果)的比例;
32.图6示出了安慰剂对照的临床试验结果,该试验为在施用本发明的寡核苷酸或安慰剂(添加至标准治疗(s.o.c.)中)后,治疗组和安慰剂组中按周报告每天排便频率<5(7天内患者报告的日平均结果)的比例;
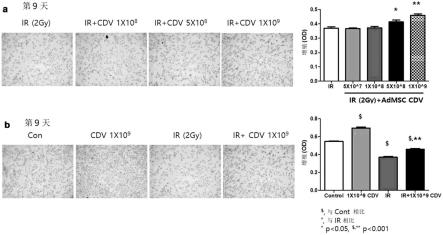
33.图7示出了10天中dss诱导的结肠炎小鼠模型中小鼠的体重减轻结果;
34.图8示出了10天中dss诱导的结肠炎小鼠模型中疾病活动指数(dai)的结果;
35.图9示出了10天中dss诱导的结肠炎小鼠模型中内窥镜检查结肠炎分级的结果;
36.图10示出了流式细胞术分析,其示出了第10天从dss诱导的结肠炎小鼠模型中的小鼠结肠标本分离的固有层单个核细胞(lpmc)的cd4
t细胞亚群中il17
、rorγt
、和il17
rorγt
细胞的百分比;
37.图11示出了第10天从dss诱导的结肠炎小鼠模型中的小鼠结肠标本中分离的髓源性抑制细胞(mdsccd11
gr1
)群的流式细胞术分析;
38.图12示出了在第0周和第3周接受可比托莫德31mg、125mg或250mg直肠灌肠、在第0、1、2和3周接受可比托莫德125mg直肠灌肠、或接受安慰剂直肠灌肠的患者在第6周时的临床缓解。临床缓解定义为mayo分项评分中直肠出血为0、排便频率≤1(与基线相比降低≥1
分)和内窥镜检查≤1(排除脆性)。*单侧p值<0.10表明结果具有统计学意义;
39.图13示出了第6周时的主要终点的具有80%置信区间的调整优势比,安慰剂作为比较器。临床缓解=mayo分项评分中直肠出血为0、排便频率≤1(与基线相比降低≥1分)、和内窥镜检查≤1(修改为排除脆性)。nri=无应答者插补(non-responder imputation)。od=观察数据(observed data)。or=优势比(odds ratio)。pga=医师总体评估(physician’s global assessment)。pmi=安慰剂多重插补(placebo multiple imputation)。pps=符合方案集(per protocol set)。
具体实施方式
40.本文引用的所有专利、专利申请和出版物均通过引用全文并入本文。
41.如本文所用,术语“对象”是指人类对象/患者。术语“对象”和“患者”在本文可互换使用。
42.如本文所用,术语炎性肠病(ibd)是指一组结肠和胃肠道的炎性病症。ibd的主要类型是溃疡性结肠炎(uc)和克罗恩病。uc和克罗恩病之间的主要区别在于炎症变化的位置和性质。克罗恩病可影响胃肠道的从口腔到肛门的任何部分,而uc仅限于结肠和直肠。在某些情况下,由于表现中的特质(idiosyncrasies),无法对克罗恩病或uc做出明确的诊断。在这些情况下,可以诊断为未定型结肠炎。ibd的其他形式包括但不限于:胶原性结肠炎、淋巴细胞性结肠炎、缺血性结肠炎、转移性结肠炎、白塞病(disease)和未定型结肠炎。
43.通常,炎性肠病是溃疡性结肠炎(uc)。
44.溃疡性结肠炎(uc)是本领域技术人员众所周知的。根据本发明治疗的溃疡性结肠炎可以涉及治疗溃疡性直肠炎、远端或左侧结肠炎、广泛性结肠炎、全结肠炎和结肠袋炎。
45.uc患者通常表现出从缓解到重度活动性的一系列疾病严重程度。可使用临床评估将uc患者分为如d’haens,gastroenterology 2007;132:763
–
786(其全部内容通过引用并入本文)中所定义的4种疾病活动亚组:(1)缓解(每天<2次或3次排便,大便中无血和/或脓液,无全身症状);(2)轻度活动性疾病(每天3次或4次排便,和/或不是每天大便中都有血和/或脓液,无发热或体重减轻的全身症状);(3)中度活动性疾病(每天>4次排便和/或每天有血和/或脓液),具有最小的全身症状;(4)重度活动性疾病(每天>6次血便,并且有毒性迹象,如发热、心动过速、贫血或红细胞沉降速率esr所证明的)。
46.通常,患者患有中度至重度uc。优选地,患者患有如上所定义的中度至重度uc。
47.如本文所用的,术语“治疗”和“进行治疗”应理解为包括对疾病或病症的症状的加重/恶化的治疗和/或改善和/或防止和/或减轻,以及对该疾病或病症的病因的治疗,并且可以包括以改善或稳定对象的病症的方式逆转、减轻或抑制病症的症状、临床征象和潜在病理。
48.特别是在溃疡性结肠炎的情况下,“治疗”通常是指在患有活动性溃疡性结肠炎的患者中诱导响应或缓解。因此,通常,寡核苷酸用于诱导患者活动性溃疡性结肠炎的响应或缓解。诱导响应意味着通过例如减轻和/或抑制活动性疾病的症状和临床征象来改善患者的病症。诱导缓解意味着将患者从被认为处于疾病活动期的状态转变为被认为处于缓解状态。
49.通常通过内窥镜检查、组织学、患者记录的结果和生活质量结果中的一项或多项
来评估在uc患者中对响应或缓解的诱导。因此,提及对响应或缓解的诱导包括对内窥镜缓解、内窥镜响应、组织学缓解、组织学响应、由医生或患者记录的结果确定的响应或缓解,以及由生活质量确定的响应或缓解中的一种或多种的诱导。这通常可参考一个或多个标准指数来评估。
50.通常,溃疡性结肠炎是慢性活动性溃疡性结肠炎。
51.如本文所用,术语“慢性活动性溃疡性结肠炎”是指患有活动性和慢性的溃疡性结肠炎的患者。活动性溃疡性结肠炎通常如本文所定义,即患者未处于缓解状态。慢性溃疡性结肠炎是指以直肠粘膜和结肠粘膜的慢性炎症为特征的疾病。
52.优选地,本文中提及的“治疗”是指在患有慢性活动性溃疡性结肠炎的患者中诱导响应或缓解。因此,通常,寡核苷酸用于在患者中诱导慢性活动性溃疡性结肠炎的响应或缓解。
53.可以根据一种或多种标准疾病指数来确定uc患者中对响应或缓解的诱导。典型的疾病指标包括但不限于以下提及的指标:(i)通过临床和生化疾病活动性确定的疾病活动性;(ii)通过内窥镜疾病活动性确定的疾病活动性;(iii)通过临床和内窥镜综合疾病活动指数确定的疾病活动性;(iv)生活质量;(v)组织学疾病活动性。这些指数在d’haens(如前所述)中进行了讨论。
54.基于通过临床和生化疾病活动性确定的疾病活动性的指数包括:truelove和witts严重性指数;powell-tuck(st.mark’s)指数;临床活动性(rachmilewitz)指数;活动性(seo)指数;医师总体评估;lichtiger(改进的truelove和witts严重性)指数;研究者总体评估;简单临床结肠炎活动性指数;基于个体症状评分的改善;溃疡性结肠炎临床评分;和患者定义的缓解。这些指数在d’haens(如前所述)中进行了讨论。
55.基于通过内窥镜疾病活动性确定的疾病活动性的指数包括:truelove和witts乙状结肠镜评估;baron评分;powell-tuck乙状结肠镜评估;内窥镜(rachmilewitz内窥镜)指数;乙状结肠镜指数;乙状结肠镜炎症等级评分;mayo评分柔性直肠乙状结肠镜检查评估;sutherland粘膜外观评估;和改进的baron评分。这些指数在d’haens(如前所述)中进行了讨论。
56.基于临床和内窥镜综合疾病活动指数确定的疾病活动性的指数包括:mayo评分(mayo临床评分/疾病活动指数);改进的mayo评分和sutherland指数(疾病活动指数/uc疾病活动指数)。mayo评分和sutherland指数在d’haens(如前所述)中进行了讨论。
57.基于生活质量的指数包括:ibd患者关注度分级表;和炎性肠病问卷(inflammatory bowel disease questionnaire,ibdq)。这些指数在d’haens(如前所述)中进行了讨论。
58.基于组织学疾病活动性的指数包括在d’haens(如前所述)中讨论的那些,例如geboes指数和riley指数,以及其他指数,例如nancy指数和robarts指数。
59.用于评估uc患者的优选指数包括临床活动性(rachmilewitz)指数、mayo评分和改进的mayo评分。
60.临床活动性(rachmilewitz)指数是考虑了以下7个变量的指数:排便次数、便血、研究人员对症状性状态的总体评估、腹部疼痛或痉挛、结肠炎引起的温度、肠道外表现和实验室结果。这在d’haens(如前所述)和rachmilewitz d.,bmj 1989;298:82
–
86(其全部内容
通过引用并入本文)中进一步进行了讨论。临床活动性(rachmilewitz)指数的确定产生0分至29分的患者评分(较高评分意味着较严重的疾病)。
61.临床缓解可被认为是临床活动性(rachmilewitz)指数评分≤4分。通过临床活动性(rachmilewitz)指数确定的响应意味着患者治疗后的评分比治疗前低。
62.mayo评分是考虑以下4项的指数:排便频率、直肠出血、下gi内窥镜检查结果,以及医师总体评估(physician’s global assessment,pga)。这在d’haens(如前所述)和schroeder kw et al,n engl j med1987;317:1625
–
1629(其全部内容通过引用并入本文)中进一步进行了讨论。mayo评分的确定产生0分至12分的评分(较高评分意味着较严重的疾病)。除了所述四个具体项目之外,还对患者的功能评估进行了测量,该功能评估无意包括在12分指数计算中,而应在确定pga评分时用作整体健康的量度。
63.根据下表所述,确定4项中每一项的mayo评分。
[0064][0065]b每个患者都可以作为其自己的对照来确定排便频率的异常程度。
[0066]c每日出血评分代表出血最严重的一天。
[0067]d医师总体评估认可三个其他准则:患者对腹部不适和总体健康感的每日记录,以及其他观察结果,例如身体检查结果和患者的表现状态。
[0068]
根据mayo评分的缓解可以定义为以下项的完全消除:(1)排便频率(正常的排便频率);(2)直肠出血(无直肠出血);(3)患者的功能评估评分(通常良好);(4)内窥镜检查结果(正常),并且pga评分为0。通过mayo评分确定的响应通常需要pga评分的改善(与基线相比降低最少1分),和至少一项其他临床评估(排便频率、直肠出血、患者的功能评估、内窥镜检查结果)的改善,并且在任何其他临床评估中无恶化。
[0069]
可替代地,临床缓解可以定义为mayo评分为0,并且临床改善(响应)定义为mayo评分与基线相比降低≥3分。
[0070]
可替代地,临床缓解可以定义为mayo评分为0,并且临床改善(响应)定义为mayo评分与基线相比降低≥3分(或者,如果基线mayo评分≤3分,则降低≥2分)。
[0071]
可替代地,通过mayo评分确定的缓解可以定义为要求乙状结肠镜检查和直肠出血的分项评分均为0,并且排便频率和pga分项评分的评分为0或1。响应可以定义为mayo评分与基线相比降低≥3分;临床响应可以定义为mayo评分(无内窥镜检查分项评分,也称为部分mayo评分)与基线相比降低≥2分,并且内窥镜响应可以定义为内窥镜检查分项评分与基线相比降低≥1分。
[0072]
可替代地,临床缓解可以定义为总mayo评分≤2分,而没有单个分项评分>1分,临床响应可以定义为总mayo评分与基线相比降低≥3分且≥30%,以及直肠出血分项评分降
低≥1分或绝对直肠出血分项评分为0或1,以及粘膜愈合可以定义为绝对内窥镜检查分项评分为0或1。
[0073]
在一个实施方式中,患有活动性溃疡性结肠炎的患者的mayo评分>2。处于溃疡性结肠炎缓解期的患者的mayo评分通常≤2。
[0074]
改进的mayo评分与上文定义的mayo评分有关。改进的mayo评分与mayo评分的不同之处在于,结肠镜检查/乙状结肠镜检查评分不太考虑脆性。因此,改进的mayo评分的评分表如下所示。
[0075][0076][0077]b每个患者都可以作为其自己的对照来确定排便频率的异常程度。
[0078]c每日出血评分代表出血最严重的一天。
[0079]d医师总体评估认可三个其他准则:患者对腹部不适和总体健康感的每日记录,以及其他观察结果,例如身体检查结果和患者的表现状态。
[0080]
改进的mayo评分的缓解和响应值与上文所述的mayo评分相同。改进的mayo评分通常根据fda的指导文件草案“溃疡性结肠炎:行业临床试验终点指南(ulcerative colitis:clinical trial endpoints guidance for industry)”(见于http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm515143.pdf)进行评估。
[0081]
可替代地,改进的mayo评分与mayo评分的不同之处可以在于,结肠镜检查/乙状结肠镜检查评分不太考虑脆性,并且还在于,医师总体评估不是决定性的。因此,改进的mayo评分的评分表也可以如下。
[0082][0083]b每个患者都可以作为其自己的对照来确定排便频率的异常程度。
[0084]c每日出血评分代表出血最严重的一天。
[0085]
该替代性改进的mayo评分的缓解值和响应值通常如上文针对mayo评分所述。可替
代地,可以根据该替代性改进的mayo评分,通过以下分项评分来定义缓解:i)直肠出血为0;ii)排便频率为0或1(与基线即第0周相比降低至少1分);以及iii)内窥镜检查评分为0或1(排除脆性)。
[0086]
uc缓解的诱导可以根据s.p.l.travis,aliment pharmacol ther 2011;34:113
–
124(其全部内容通过引用并入本文)中列出的准则来进行,即直肠出血、紧迫感和增加的排便次数的完全停止,优选通过内窥镜粘膜愈合来确认。
[0087]
可替代地,响应或缓解的诱导可以根据e.f.stange,journal of crohn’s and colitis(2008)2,1
–
23;s.p.l.travis,journal of crohn’s and colitis(2008)2,24
–
62;k geboes,gut 2000;47:404
–
409(其全部内容通过引用并入本文)中列出的准则来进行。
[0088]
可以根据一种或多种标准疾病指数来确定克罗恩病患者中响应或缓解的诱导。典型的指数包括克罗恩病活动性指数(crohn’s disease activity index,cdai)。cdai在love,“pharmacotherapy for moderate to severe inflammatory bowel disease:evolving strategies”,am j manag care.2016;22:s39-s50;peyrin-biroulet et al“defining disease severity in inflammatory bowel diseases:current and future directions”clin gastroenterol hepatol.2015;pii:s1542-3565(15)00787-00789.doi:10.1016/j.cgh.2015.06.001;以及ungar et al“advances in the development of new biologics in inflammatory bowel disease”,annals of gastroenterology(2016)29,243-248中进行了讨论。评估克罗恩病患者的可替代指数包括harvey-bradshaw指数和炎性肠病问卷。
[0089]
cdai是考虑了大量与克罗恩病相关的症状的综合评分,包括:液便或软便的次数;腹痛;整体健康;存在并发症(存在关节疼痛(关节痛)或症状明显的关节炎);虹膜炎或葡萄膜炎;存在结节性红斑、坏疽性脓皮病或口疮性溃疡;肛裂、肛瘘或肛周脓肿;其他瘘;在前一周发热;使用止泻宁(lomotil)或阿片类药物止泻;存在腹部肿块;血细胞比容;以及与标准重量的百分偏差。根据cdai的临床缓解通常用评分<150表示。
[0090]
根据本发明治疗的对象通常是抗炎疗法难治的或对抗炎疗法响应不足或不耐受,和/或证明或先前已证明对至少一种免疫调节剂、tnf-α抑制剂或抗整合素响应不足、响应丧失或不耐受。因此,通常,对象先前已经接受或目前正在接受抗炎疗法、优选用于uc的抗炎疗法,和/或免疫调节、tnf-α抑制剂或抗整合素疗法、优选用于uc的此类疗法。本文讨论了用于uc的抗炎疗法,并且通常包括gcs、柳氮磺胺吡啶和5-asa。
[0091]
免疫调节剂、tnf-α抑制剂和抗整合素在本文进行了讨论,通常包括咪唑硫嘌呤、6-巯基嘌呤和生物制剂,所述生物制剂包括tnf-α抑制剂英夫利昔单抗及其生物类似物和衍生物、戈利木单抗及其生物类似物和衍生物、阿达木单抗及其生物类似物和衍生物,非tnf生物制剂包括优特克单抗及其生物类似物和衍生物、托法替尼及其生物类似物和衍生物、以及抗整合素维多珠单抗及其生物类似物和衍生物。
[0092]
难治性疾病或对疗法响应不足的疾病通常是这样的疾病,即尽管有至少一个疗程的治疗史(在本发明背景下即抗炎治疗史),但活动性疾病的征象和症状仍持续存在的疾病。通常在uc治疗的背景下,尽管有两个或更多个疗程的抗炎治疗史,但活动性疾病的征象和症状仍持续存在。本领域技术人员将充分理解以抗炎疗法治疗uc的典型疗程,并且该典型疗程通常涉及以足够给药量给药足够次数来诱导典型患者的缓解。
[0093]
对疗法(在本发明背景下即抗炎疗法)不耐受是指该疗法已在对象中引起了不能耐受的副作用,例如通常导致疗法中断的副作用。
[0094]
通常,对象先前已经或目前正在接受氨基水杨酸(5-asa),优选用于uc的5-asa疗法。
[0095]
通常,对象先前已经或目前正在接受口服糖皮质激素(gcs),优选用于uc的口服gcs疗法。
[0096]
通常,抗炎疗法难治的或对抗炎疗法响应不足或不耐受的对象显示出或先前已经显示出对直肠、口服和/或肠胃外gcs治疗的响应不足或响应丧失(即难治)或不耐受(包括由于由于早期副作用而未进行gcs治疗)。
[0097]
通常,抗炎疗法难治的或对抗炎疗法响应不足或不耐受的对象具有对gcs治疗响应不充分(例如,类固醇难治)、或类固醇依赖性、或gcs治疗响应丧失、或gcs治疗不耐受的病史或当前状态。在治疗溃疡性结肠炎的过程中,对象通常已接受类固醇/gcs。
[0098]
类固醇难治性通常是指尽管有至少一个疗程的类固醇治疗史(例如包括剂量相当于强的松每日40mg-60mg口服施用30天或静脉内(intravenous,iv)施用7天至10天的诱导方案),但对象缺乏有意义的临床响应,即表现出持续活动性溃疡性结肠炎的征象和症状。
[0099]
类固醇依赖性通常是指在开始类固醇治疗后3个月内无法将类固醇降低到相当于泼尼松龙10mg/d以下而无复发性活动性溃疡性结肠炎的患者,或在停止类固醇治疗后3个月内复发的患者。
[0100]
gcs治疗不耐受通常意味着,对象在gcs治疗后经历了该对象无法耐受的副作用,例如但不限于库欣综合征(cushing
′
s syndrome)、骨量减少/骨质疏松症、高血糖症、失眠或感染。
[0101]
对免疫调节剂响应不足或响应丧失通常意味着,尽管先前使用至少一种免疫调节剂进行了治疗(例如一个口服咪唑硫嘌呤(≥1.5mg/kg)或6-巯基嘌呤(≥0.75mg/kg)的8周方案),但活动性溃疡性结肠炎的征象和症状仍持续存在。
[0102]
对免疫调节剂不耐受通常意味着,对象在接受免疫调节剂后经历恶心/呕吐、腹痛、胰腺炎、肝功能测试(liver function test,lft)异常、淋巴细胞减少、硫嘌呤甲基转移酶(thiopurine methyltransferase,tpmt)基因突变或感染或其他副作用。
[0103]
对tnf-α抑制剂响应不足或响应丧失意味着,尽管先前使用至少一种tnf-α抑制剂(例如英夫利昔单抗(5mg/kg(iv),2剂,相隔至少2周)或其生物类似物或衍生物、或戈利木单抗(200/100mg(sc),2剂,相隔至少2周)或其生物类似物或衍生物、或阿达木单抗(160/80mg(sc),2剂,相隔至少2周)或其生物类似物或衍生物的4周诱导方案(或根据当前标签推荐剂量))进行了治疗,活动性溃疡性结肠炎的征象和症状仍持续存在,或在先前临床获益后的维持给药期间症状的复发。
[0104]
对tnf-α抑制剂不耐受意味着在接受tnf-α抑制剂后的输注相关反应、脱髓鞘、充血性心力衰竭、感染或其他副作用。
[0105]
对抗整合素响应不足或响应丧失意味着,尽管先前使用抗整合素进行了治疗(例如至少10周的维多珠单抗300mg(iv)或其生物类似物或衍生物的方案或在当前标签中推荐的),但活动性溃疡性结肠炎的征象和症状仍持续存在,或在先前临床获益后的维持给药期间症状的复发。
[0106]
对生物免疫调节剂的响应不足或响应丧失也可能意味着,尽管之前用生物免疫调节剂(例如托法替尼(一种jak抑制剂)和优特克单抗(一种抗il12/il23单克隆抗体))进行治疗,活动性溃疡性结肠炎的征象和症状仍持续存在。
[0107]
通常,对象已被诊断为患有左侧溃疡性结肠炎,即远端结肠炎,包括直肠乙状结肠炎。
[0108]
通常,所述对象是可被选出进行结肠切除术的。
[0109]
如本文所用,术语“结肠切除术”是指大肠(结肠)的任何程度的外科手术切除。在本文中,结肠切除术包括但不限于:右半结肠切除术、左半结肠切除术、扩大半结肠切除术、横结肠切除术、乙状结肠切除术、直肠乙状结肠切除术、哈特曼氏手术(hartmann operation)、“双管”或米库利兹结肠造口术(mikuliczcolostomy)、全结肠切除术(也称为雷恩氏手术(lane's operation))、全结直肠切除术和结肠次全切除术。如本文所用,短语“可被选出进行结肠切除术”是指基于医师和外科医生的评估,可以选择进行非紧急结肠切除术的对象。可被选出进行结肠切除术的对象可以是但不限于(用于溃疡性结肠炎的)可用疗法难治的或对(用于溃疡性结肠炎的)可用疗法不耐受的对象。这不同于紧急结肠切除术,紧急结肠切除术是对患有急性疾病或受伤且需要立即就医的对象的一种急性干预。该短语还包括已被选出进行结肠切除术的对象。
[0110]
如本文所用,术语“寡核苷酸”是指由多个连接的单个核苷单元形成的多核苷。这样的寡核苷酸可从现有的核酸来源获得,包括基因组dna或cdna、质粒、载体或细菌dna,但优选通过合成方法产生。核苷残基可通过许多已知的核苷间键中的任何核苷间键来彼此偶联。这样的核苷间键包括但不限于天然核苷间磷酸二酯键或实际上经修饰的核苷间键,例如但不限于硫代磷酸酯、二硫代磷酸酯、烷基膦酸酯、烷基硫代膦酸酯、磷酸三酯、氨基磷酸酯、硅氧烷、碳酸酯、烷氧碳酰、乙酰氨基酸酯(acetamidate)、氨基甲酸酯、吗啉基(morpholino)、硼基(borano)、硫醚、桥连的氨基磷酸酯、桥连的亚甲基膦酸酯、桥连的硫代磷酸酯和砜核苷间键。术语“寡核苷酸”还涵盖具有一个或多个立体专一性核苷间键的多核苷(例如(rp)-或(sp)-硫代磷酸酯、烷基膦酸酯或磷酸三酯键)。如本文所用,术语“寡核苷酸”和“二核苷酸”明确旨在包括具有任何这样的核苷间键的多核苷和二核苷,而无论该键是否包含磷酸基团。在某些优选的实施方式中,这些核苷间键可以是磷酸二酯键、硫代磷酸酯键或二硫代磷酸酯键或其组合。
[0111]
术语“寡核苷酸”也涵盖具有额外取代基的多核苷,该额外取代基包括但不限于:蛋白质基团、亲脂基团、嵌入剂、二胺、叶酸、胆固醇和金刚烷。术语“寡核苷酸”还涵盖任何其他含核碱基的聚合物,包括但不限于:肽核酸(pna)、具有磷酸基团的肽核酸(phona)、锁核酸(lna)、吗啉代主链寡核苷酸和主链部分具有烷基接头或氨基接头的寡核苷酸。烷基接头可以是支链的或直链的、取代的或未取代的,以及手性纯的或外消旋混合物。
[0112]
本发明的寡核苷酸可包括天然存在的核苷、修饰的核苷或其混合物。如本文所用,术语“修饰的核苷”是包括修饰的杂环碱基、修饰的糖部分或其组合的核苷。在一些实施方式中,如本文所述,修饰的核苷是非天然嘧啶或嘌呤核苷。在一些实施方式中,修饰的核苷是2'-取代的核糖核苷、阿拉伯核苷(arabinonucleoside)或2'-脱氧-2'-取代的阿拉伯糖苷。
[0113]
如本文所用,术语“杂合寡核苷酸”是具有不止一类核苷的寡核苷酸。
[0114]
在本文中,术语“寡核苷酸”包括杂合寡核苷酸和嵌合寡核苷酸。“嵌合寡核苷酸”是在其序列结构内具有不止一种类型的核苷间键的寡核苷酸。这种嵌合寡核苷酸的一个优选实例是包含硫代磷酸酯、磷酸二酯或二硫代磷酸酯区域和非离子键(例如烷基膦酸酯键或烷基硫代磷酸酯键)的嵌合寡核苷酸(us5635377和us5366878)。
[0115]
在本文中,术语“寡核苷酸”也包括环化变体和环状寡核苷酸。
[0116]
优选地,寡核苷酸包含至少一种天然存在的磷酸二酯,或一种修饰的硫代磷酸酯,或二硫代磷酸酯核苷间键,然而也考虑了以下优选的键或实际上的主链修饰,包括但不限于:甲基膦酸酯、甲基硫代膦酸酯、磷酸三酯、硫代磷酸三酯、硫代磷酸酯、二硫代磷酸酯、三酯前药、砜、磺酰胺、氨基磺酸酯、甲缩醛、n-甲基羟胺、2’ome(氧甲基在2’位)、碳酸酯、氨基甲酸酯、吗啉代、硼代膦酸酯、氨基磷酸酯,尤其是伯氨基-氨基磷酸酯、n3氨基磷酸酯和n5氨基磷酸酯,以及立体专一性键(例如(rp)-或(sp)-硫代磷酸酯、烷基膦酸酯或磷酸三酯键)。
[0117]
核苷的糖部分可为非天然存在的糖部分。在本文中,“天然存在的糖部分”是作为核酸的一部分天然存在的糖部分,例如核糖和2'-脱氧核糖,“非天然存在的糖部分”是指作为核酸的一部分不是天然存在的,但可在寡核苷酸的主链中使用的任何糖,例如但不限于己糖。阿拉伯糖和阿拉伯糖衍生物是优选的糖部分的实例。
[0118]
修饰的或取代的寡核苷酸通常,由于期望的性质例如增强的细胞摄取、增强的对核酸靶标的亲和力和在核酸酶存在下增加的稳定性,而优于天然形式。寡核苷酸通常由多于10个直到100个或更多个脱氧核糖核苷酸或核糖核苷酸组成,尽管优选为约8个至约40个,最优选为约8个至约20个。确切的大小将取决于许多因素,而这些因素转而取决于寡核苷酸的最终功能或用途。寡核苷酸可以任何方式产生,包括化学合成、dna复制、反转录或其组合。
[0119]
用于本发明的寡核苷酸包含序列5'-ggaacagttcgtccatggc-3'(seq id no:2)。通常,至少一个cg二核苷酸是未甲基化的。
[0120]
通常,所述寡核苷酸中的至少一个核苷酸具有主链修饰。通常,所述寡核苷酸中的至少一个核苷酸具有磷酸主链修饰。主链修饰通常是硫代磷酸酯或二硫代磷酸酯修饰。
[0121]
在序列中,例如以下序列中,硫代磷酸酯键可以用星号(*)示出:
[0122]
5'-g*g*a*acagttcgtccat*g*g*c-3’(seq id no:1),其中cg二核苷酸是未甲基化的。
[0123]
优选地,所述寡核苷酸具有序列5'-g*g*a*acagttcgtccat*g*g*c-3’(seq id no:1),其中cg二核苷酸是未甲基化的。因此,优选地,所述寡核苷酸是可比托莫德。
[0124]
因此,本发明优选提供用于在本文定义的人对象中治疗本文定义的活动性溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠清洁。通常,将如本文所定义的量的单独剂量的可比托莫德在至少两个分开的时刻施用至对象,其中所述分开的时刻相隔3周。
[0125]
如本文所用,提及“没有进行结肠清洁”的对象旨在限定在施用寡核苷酸以减少在用寡核苷酸治疗的结肠中粪便物的量之前的一段时间内没有进行结肠清洁的对象。因此,通常对象在用寡核苷酸治疗前1小时,通常在用寡核苷酸治疗前4小时,优选在用寡核苷酸治疗前8小时,更优选在用寡核苷酸治疗前12小时,更优选在用寡核苷酸治疗前24小时,最
优选在用寡核苷酸治疗前48小时没有进行结肠清洁。
[0126]
通常,所述结肠清洁可以通过本领域已知的任何方法来实现,例如施用缓泻剂。
[0127]
通常,所述对象具有腔内粪便物质。通常,所述对象具有覆盖或靠近用寡核苷酸治疗的结肠上皮细胞的粪便物质。所述对象可能具有在腔内不直接与用寡核苷酸治疗的结肠上皮细胞接触的粪便物质。所述对象可能具有在腔内覆盖或靠近用寡核苷酸治疗的结肠上皮细胞的粪便物质和在管内不直接与用寡核苷酸治疗的结肠上皮细胞接触的粪便物质。更优选地,所述粪便物质的量是在从未进行过结肠清洁的患者中预期的正常量。
[0128]
在本发明的疗法中,通常施用150mg至350mg单独剂量的所述寡核苷酸,优选可比托莫德。通常,在每个单独剂量/施用中施用相同给药量的寡核苷酸,但也可以使用不同的给药量。
[0129]
通常,施用大于100mg到多至350mg单独剂量的所述寡核苷酸,优选可比托莫德。
[0130]
通常,在每个剂量/施用中施用175mg至325mg的所述寡核苷酸,优选可比托莫德,优选200mg至300mg,更优选210mg至290mg,还更优选220mg至280mg,还更优选230mg至270mg,甚至更优选240mg至260mg,甚至更优选245mg至255mg,甚至更优选249mg至251mg。
[0131]
优选地,施用约250mg的所述寡核苷酸,优选可比托莫德。由此,在至少两个时刻的每个中施用约250mg的所述寡核苷酸,优选可比托莫德。
[0132]
在活性剂给药量的背景下,如本文所用的“约”是指 /-10%,通常为 /-5%,优选为 /-1%。
[0133]
更优选地,施用250mg的所述寡核苷酸,优选可比托莫德。
[0134]
通常,优选将单独剂量(如本文所定义的量)的所述寡核苷酸在至少两个分开的时刻施用至对象,其中所述分开的时刻相隔3周。这意味着患者在相隔三周的指定剂量/施用之间不会接受任何额外的寡核苷酸。在相隔三周的指定剂量/施用之间的三周窗口期中,患者不接受本文定义的寡核苷酸,但可能接受一种或多种用于治疗溃疡性结肠炎的额外治疗剂。
[0135]
当将所述寡核苷酸的剂量在多于两个时刻施用至患者时,那么通常每个时刻是在前一个时刻之后三周。通常,在例如2、3、4、5、6、7、8、9或10个分开的时刻,每个时刻是在前一个时刻之后三周,将一定剂量(如本文规定的量)的所述寡核苷酸施用至患者。通常,向患者施用一定剂量的所述寡核苷酸直到该患者处于缓解状态,如上文所定义。在一些实施方式中,单独剂量仅在两个分开的时刻施用于对象,所述分开的时刻相隔3周。
[0136]
应该理解的是,提及在至少两个分开的时刻(其中所述分开的时刻相隔3周)施用是指用于诱导缓解的单个治疗方案。因此,在根据本发明的治疗过程之后,不排除将来使用寡核苷酸进行进一步治疗,例如在缓解后复发为活动性疾病状态之后进行治疗。
[0137]
在患者仅接受两剂量的情况下,第一剂量将在第0天递送,第二剂量将三周后递送。在患者接受三剂量的情况下,第一剂量将在第0天递送,第二剂量将在三周后递送,第三剂量将在第二剂量之后的三周后递送,即从第0天开始六周后。
[0138]
如本文所用,术语“相隔3周”是指在某些实施方式中,剂量的施用恰好相隔21天,即在第0天施用第一剂量并且在第21天施用另一剂量。然而,应当理解,对此进行微小变化仍在本发明的范围内。由于例如患者的疾病或药物的不可用性,这种微小的变化可能是不可避免的。因此,如本文所用,“相隔3周”是指相隔14天至28天,通常相隔18天至24天,或者
相隔19天至23天,或相隔20天至22天施用。
[0139]
因此,在某些实施方式中,本发明提供了本文定义的寡核苷酸,其用于在本文定义的人对象中治疗本文定义的溃疡性结肠炎,其中本文定义的量的单独剂量的所述寡核苷酸在至少两个、例如两个分开的时刻向患者施用,其中所述分开的时刻相隔18天至24天,相隔19天至23天,或相隔20天至22天。
[0140]
用于本发明的药物可以作为适应症的单一疗法进行施用,或与其他药物(一种或多种)作为适应症的辅助疗法一起施用,如下文更详细地描述的。在辅助(或“附加”(add-on))疗法的情况下,用于本发明的药物可以与其他药物(一种或多种),例如以固定剂量组合或以分开的剂量,同时地、分开地或依次地施用。
[0141]
如本文所用,术语“附加(add-on)”是指在不中断当前疗法或药物方案的情况下除了当前疗法或药物方案之外还施用所述寡核苷酸。
[0142]
因此,寡核苷酸可以作为单一疗法施用,或与用于治疗溃疡性结肠炎的一种或多种额外治疗剂联合施用。通常,寡核苷酸可以作为单一疗法施用,或与用于治疗溃疡性结肠炎的一种或多种额外治疗剂联合施用,该一种或多种额外治疗剂选自免疫调节药物、抗tnf治疗药物或用于治疗溃疡性结肠炎的其他合适的药物。
[0143]
适合与所述寡核苷酸联合使用的这样的药物的实例包括但不限于:gcs或衍生物;泼尼松龙、decortin、抗tnf或衍生物;英夫利昔单抗及其生物类似物和衍生物、阿达木单抗及其生物类似物和衍生物、戈利木单抗及其生物类似物和衍生物、抗整合素或衍生物;维多珠单抗及其生物类似物和衍生物、天然ifn-β、硫嘌呤或衍生物;咪唑硫嘌呤、6-巯基嘌呤、5-asa、柳氮磺胺吡啶、甲氨蝶呤、环孢菌素、及其等同物。
[0144]
通常,接受所述寡核苷酸的对象还接受一种或多种选自以下的其他药物:gcs、decortin、5-asa、咪唑硫嘌呤、6-巯基嘌呤、柳氮磺胺吡啶、甲氨蝶呤、泼尼松龙及其等同物或衍生物。
[0145]
优选地,接受所述寡核苷酸的对象还接受一种或多种选自以下的其他药物:gcs、5-asa、咪唑硫嘌呤、6-巯基嘌呤、柳氮磺胺吡啶和甲氨蝶呤。
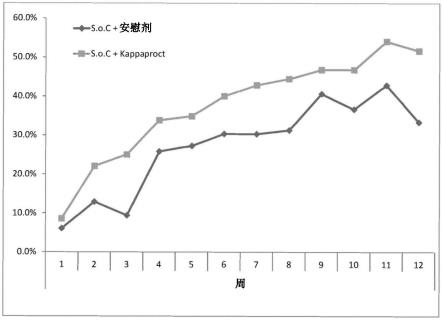
[0146]
更优选地,接受所述寡核苷酸的对象还接受一种或多种选自以下的其他药物:口服gcs、口服5-asa、咪唑硫嘌呤、6-巯基嘌呤和口服甲氨蝶呤。
[0147]
在一些实施方式中,接受所述寡核苷酸的对象还接受一种或多种类固醇药物,例如皮质类固醇和糖皮质激素。
[0148]
为了本发明的目的,术语“与......组合”和“附加”意指在治疗同一患者的相同疾病的过程中,包括以任何顺序(包括同时施用,以及长达几个月间隔的暂时间隔顺序)施用寡核苷酸和一种或多种额外治疗剂。
[0149]
通常,所述寡核苷酸被局部施用,例如局部施用至粘膜。
[0150]
通常,所述寡核苷酸通过结肠内施用。结肠内施用通常通过直肠进行。结肠内施用通常使用灌肠剂或导管进行。结肠内施用可能涉及通过直肠灌肠来施用。结肠内施用可以是局部的,例如在结肠镜检查期间借助于通过结肠镜的活检通道插入的喷射导管或其他合适的医疗设备进行。
[0151]
寡核苷酸可以药物组合物的形式施用,该药物组合物包含本文定义的寡核苷酸以及一种或多种药学上可接受的载体。如本文所用,术语“载体”涵盖任何赋形剂、稀释剂、填
充剂、盐、缓冲剂、水、稳定剂、增溶剂、脂质或本领域公知的用于药物制剂的其他材料。将理解,载体的特性将取决于具体应用的施用途径。
[0152]
如本文所用,术语“药学上可接受的”是指不干扰免疫调节寡核苷酸的有效性并且与诸如细胞、细胞培养物、组织、器官或有机体的生物系统相容的材料。优选地,生物系统是活的有机体,例如脊椎动物。
[0153]
通常,该组合物是寡核苷酸在液体载体中的溶液。
[0154]
通常,载体是水,优选无菌水。因此,该组合物通常包含水和本文定义的寡核苷酸。
[0155]
优选地,载体是水。
[0156]
已发现,有利地,寡核苷酸在水中稳定,因此寡核苷酸可以作为基本上由水和本文定义的寡核苷酸组成的组合物来施用。该组合物可以由水和本文定义的寡核苷酸组成。
[0157]
基本上由各组分组成的组合物是指包含基本上由其组成的组分以及其他组分的组合物,条件是其他组分不会实质性地影响组合物的基本特性。通常,基本上由某些组分组成的组合物将包含大于或等于95wt%(相对于组合物的总重量)的那些组分,或大于或等于99wt%(相对于组合物的总重量)的那些组分。
[0158]
因此,基本上由水和本文定义的寡核苷酸组成的组合物包含大于或等于95wt%(相对于组合物的总重量)的寡核苷酸和水,或大于或等于99wt%(相对于组合物的总重量)的寡核苷酸和水。
[0159]
药物组合物中寡核苷酸的浓度将根据若干因素而变化,包括要施用的寡核苷酸的给药量。作为溶液的组合物中寡核苷酸的典型浓度为1mg/ml至20mg/ml,优选4mg/ml至10mg/ml,在某些情况下为10mg/ml至20mg/ml,优选4.8mg/ml至5.2mg/ml,更优选约5.0mg/ml。
[0160]
优选地,本发明提供了用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠清洁,优选其中约250mg单独剂量的可比托莫德仅在两个分开的时刻施用至患者,所述分开的时刻相隔3周。
[0161]
可替代地,本发明提供了用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠清洁,优选其中约250mg单独剂量的可比托莫德在两个或更多个相隔3周的分开的时刻施用至患者,直到对象处于缓解状态,通常缓解如通过本文定义的指数所确定。
[0162]
更优选地,本发明提供了用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的活动性溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠清洁,其中约250mg单独剂量的可比托莫德仅在两个分开的时刻施用至患者,所述分开的时刻相隔3周,其中可比托莫德以包含可比托莫德和水的药物组合物的形式施用。
[0163]
更优选地,本发明提供了用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的活动性溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠清洁,其中约250mg单独剂量的可比托莫德仅在两个分开的时刻施用至患者,所述分开的时刻相隔3周,其中可比托莫德通过结肠内或直肠施用。
[0164]
更优选地,本发明提供了用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的活动性溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠
清洁,其中约250mg单独剂量的可比托莫德仅在两个分开的时刻施用至患者,所述分开的时刻相隔3周,其中可比托莫德以包含可比托莫德和水的药物组合物的形式通过结肠内或直肠施用。
[0165]
甚至更优选地,本发明提供了用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的慢性活动性溃疡性结肠炎的可比托莫德,其中该对象在所述施用之前没有进行结肠清洁,其中约250mg单独剂量的可比托莫德仅在两个分开的时刻施用至患者,所述分开的时刻相隔3周,其中可比托莫德以包含可比托莫德和水的药物组合物的形式通过结肠内或直肠施用。
[0166]
本发明还提供了一种药物组合物,该药物组合物包含本文定义的寡核苷酸以及一种或多种药学上可接受的载体,该药物组合物用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的炎性肠病,其中该对象在所述施用之前没有进行结肠清洁,其中所述组合物的单独施用在至少两个分开的时刻向对象施用,其中所述分开的时刻相隔3周,并且其中所述组合物的每次施用递送一定量的如本文定义的寡核苷酸。
[0167]
如上定义的用于用途的寡核苷酸的优选特征也是用于用途的组合物的优选特征。
[0168]
本发明还提供了本发明还提供了本文定义的寡核苷酸或本文定义的药物组合物在制备用于通过局部施用至结肠而在本文定义的人对象中治疗本文定义的炎性肠病的药物中的用途,其中该对象在所述施用之前没有进行结肠清洁,优选其中所述寡核苷酸或组合物的单独施用在至少两个分开的时刻向对象施用,其中所述分开的时刻相隔3周,并且其中所述寡核苷酸或组合物的每次施用递送一定量的如本文定义的寡核苷酸。
[0169]
如上定义的用于用途的寡核苷酸的优选特征也是寡核苷酸或组合物的用途的优选特征。
[0170]
本发明还提供了一种通过局部施用至结肠来治疗本文定义的人对象的本文定义的炎性肠病的方法,其中该对象在所述施用之前没有进行结肠清洁,该方法包括向所述对象施用本文定义的寡核苷酸或本文定义的组合物,优选其中所述寡核苷酸或组合物的单独施用在至少两个分开的时刻向患者施用,其中所述分开的时刻相隔3周,并且其中寡核苷酸或组合物的每次施用递送一定量的如本文定义的寡核苷酸。
[0171]
本发明还提供了一种通过局部施用至结肠来治疗本文定义的人对象的本文定义的炎性肠病的方法,其中该对象在所述施用之前没有进行结肠清洁,该方法包括:
[0172]
(a)选择本文定义的患者;和
[0173]
(b)向所述患者施用本文定义的寡核苷酸或本文定义的组合物,所述寡核苷酸或组合物的单独施用在至少两个分开的时刻向患者施用,其中所述分开的时刻相隔3周,并且其中寡核苷酸或组合物的每次施用递送一定量的本文定义的寡核苷酸。
[0174]
如上定义的用于用途的寡核苷酸的优选特征也是要求保护的方法的优选特征。
[0175]
以下非限制性实施例对本发明进行了说明。
[0176]
实施例
[0177]
实施例1—临床试验研究
[0178]
随机双盲、安慰剂对照的试验根据既定方法评估了局部可比托莫德在中度至重度活动性溃疡性结肠炎患者中的疗效和安全性。
[0179]
方法:根据领域内的标准纳入准则选择男性和女性进行试验,标准纳入准则包括
以下内容:
[0180]
1.男性或女性≥18岁
[0181]
2.确诊uc,距离确诊的最短时间≥3个月
[0182]
3.中度至重度活动性左侧uc(疾病应在肛缘上方延伸15cm或更多且不超出脾曲),由为6至12的改进的mayo评分(排除内窥镜分项评分的脆性1级)确定,其中通过在筛选访视1b(第7天至第10天筛选访视)进行的内窥镜检查的集中解读而评估的内窥镜分项评分≥2,并且没有其他单个分项评分<1
[0183]
4.目前口服使用5-asa/sp或具有5-asa/sp口服使用史
[0184]
5.目前使用gcs或具有gcs依赖、难治或不耐受史,包括由于早期副作用而未进行gcs治疗(只需满足一项gcs准则,请参见欧洲克罗恩病和结肠炎组织(european crohn
′
s and colitisorganisation,ecco)指南中的定义)
[0185]
6.表现出对以下至少一种药物响应不足、响应丧失或不耐受:
[0186]
●
免疫调节剂,例如环孢霉素、甲氨蝶呤、aza/6-mp、他克莫司
[0187]
○
例如,尽管先前使用至少一个口服aza(≥1.5mg/kg)或6-mp(≥0.75mg/kg)的8周方案或因不耐受或硫嘌呤甲基转移酶(tpmt)缺陷致使以较低剂量进行治疗,但活动性疾病的征象和症状仍存在持续,或者
[0188]
○
例如,先前对至少一种免疫调节剂不耐受(包括但不限于恶心/呕吐、腹痛、胰腺炎、肝功能测试(lft)异常、淋巴细胞减少、tpmt基因突变、感染)
[0189]
●
tnf-α抑制剂和/或抗整合素:
[0190]
○
尽管先前使用至少一种诱导方案以至少相隔2周使用两剂量(或根据当前标签推荐的剂量)进行了治疗,但仍存在持续活动性疾病的征象和症状,例如:
[0191]
■
英夫利昔单抗5mg/kg(静脉内(iv))或
[0192]
■
戈利木单抗200/100mg(皮下(sc))或
[0193]
■
阿达木单抗160/80mg(sc)或
[0194]
■
维多珠单抗300mg(iv)或
[0195]
○
不耐受史(包括但不限于输液相关反应、脱髓鞘、充血性心力衰竭、感染)
[0196]
在先前的临床获益后,使用上述任何药物维持施用期间症状复发,(继发性失效)[尽管临床获益不合格但停药]
[0197]
7.在研究期间允许接受治疗剂量的以下uc药物:
[0198]
a)口服gcs治疗(≤20mg强的松或等效物/每日),前提是在访视1a(第-14天)前剂量已稳定2周
[0199]
b)口服mmx布地奈德治疗(9mg/每日),在访视1a前至少8周开始
[0200]
c)口服5-asa/sp化合物,前提是在访视1a前剂量已稳定2周,并在访视1a前至少8周开始
[0201]
d)aza/6-mp,前提是在访视1b之前剂量已稳定8周,并且在访视1a之前至少3个月开始
[0202]
8.能够理解治疗、乐意遵守所有研究要求的意愿并能够提供知情同意
[0203]
根据领域内已知的排除准则,可以将患者排除在试验之外,排除准则包括以下内容:
[0204]
1.怀疑有诊断偏差,例如;克罗恩小肠结肠炎、缺血性结肠炎、放射性结肠炎、未定型结肠炎、感染性结肠炎、憩室病、相关结肠炎、显微镜下结肠炎、大块假性息肉病或无法通过型狭窄(non-passable stenosis)
[0205]
2.急性暴发性uc和/或全身毒性征象
[0206]
3.局限于直肠的uc(在肛缘上方延伸<15cm的疾病)
[0207]
4.恶性肿瘤史,除了:
[0208]
●
被治疗(治愈的)的基底细胞或鳞状细胞原位癌
[0209]
●
被治疗(治愈的)的宫颈上皮内瘤变或宫颈原位癌,在筛选访视1a前5年内无复发证据
[0210]
5.存在研究人员认为可能影响患者遵守方案和方案程序的可能性或会混淆研究结果或危及患者安全的任何临床显著疾病或这种疾病史
[0211]
6.在入组时使用环孢霉素、甲氨蝶呤、他克莫司、tnf-α抑制剂、抗整合素或类似免疫抑制剂和免疫调节剂进行同步治疗。任何先前使用此类药物的治疗必须在访视1a之前停止至少8周或血清浓度水平已无法测出
[0212]
7.访视1b前2周内使用直肠gcs、5-asa/sp或他克莫司治疗
[0213]
8.访视1a前两周内使用抗生素或非甾体抗炎药(nsaid)进行长期治疗(允许使用一种短期抗生素治疗方案和偶尔使用nsaid)
[0214]
9.严重的活动性感染
[0215]
10.胃肠道感染,包括艰难梭菌大便试验阳性
[0216]
11.目前正在接受肠胃外营养补充或输血
[0217]
12.在筛选期间处于哺乳期或血清妊娠试验阳性的女性
[0218]
13.在整个研究期间没有使用可靠的避孕方法(可靠的方法是屏障保护、激素避孕、宫内节育器或禁欲)的有生育潜能的女性
[0219]
14.入组前5个半衰期内且试验产品最后一次治疗后至少30天内同时参加另一项临床研究,其中包括研究性治疗或先前使用过研究性治疗
[0220]
15.先前接触过可比托莫德
[0221]
根据下文列出的研究组,所选择的进行试验的患者被随机分配到包含可比托莫德或安慰剂的治疗序列。可比托莫德或安慰剂通过适用于自我施用的直肠灌肠剂局部施用至结肠。与collect研究不同的是,在灌肠剂施用之前没有采取任何特殊步骤来确保结肠清洁。
[0222]
研究组:
[0223]-在第0周和第3周,两剂量的31mg可比托莫德(第1周和第2周,安慰剂);
[0224]-在第0周和第3周,两剂量的125mg可比托莫德(第1周和第2周,安慰剂);
[0225]-在第0周和第3周,两剂量的250mg可比托莫德(第1周和第2周,安慰剂);
[0226]-在第0、1、2和3周,四剂量的125mg可比托莫德。
[0227]
主要结果量度如下确立:
[0228]-第6周处于状态的患者的比例,临床缓解由改进的mayo分项评分定义,满足以下所有三个准则:i)直肠出血为0;ii)排便频率为0或1(与基线相比降低至少1分);iii)内窥镜评分为0或1(排除脆性)
[0229]
次要结果量度如下:
[0230]
●
第4周或第6周诱导症状性缓解的患者比例,症状性缓解由以下mayo分项评分定义:i)直肠出血为0;ii)排便频率为0或1(与基线相比降低至少1分)
[0231]
●
第4周或第6周没有直肠出血的患者比例,没有直肠出血由以下mayo分项评分定义:直肠出血为0
[0232]
●
第4周或第6周排便频率正常或增强的患者比例,排便频率正常或增强由以下mayo分项评分定义:排便频率为0或1(从基线降低至少1分)
[0233]
●
第6周内窥镜缓解,内窥镜缓解由改进的mayo定义:内窥镜评分为0或1
[0234]
●
第6周临床响应的患者比例,临床响应定义为临床缓解或与基线相比降低三分且降低≥30%
[0235]
●
第6周组织学缓解的患者比例,组织学缓解由nancy组织学指数定义
[0236]
●
第6周组织学响应的患者比例,组织学响应由nancy组织学指数评分定义
[0237]
●
排便紧迫性评分降低的患者比例
[0238]
●
第1、2、3和6周粪便钙卫蛋白与第0周相比的平均变化
[0239]
●
第6周每个炎性肠病问卷(ibdq)子域(sub domain)与第0周相比的平均变化
[0240]
结果
[0241]
主要疗效分析:第6周临床缓解分析
[0242][0243]
结论
[0244]
与安慰剂相比,在患有中度至重度溃疡性结肠炎的患者中,相隔三周用两剂量的250mg可比托莫德进行治疗导致在第6周时处于临床缓解状态的患者比例更高。接受两剂量的250mg可比托莫德的患者在第6周处于缓解状态的百分比也高于其他剂量方案(2x31mg、2x125mg和4x125mg)的处于缓解状态的患者的百分比。特别是,接受两剂量的250mg可比托莫德的处于缓解状态的患者的百分比高于接受四剂量的125mg可比托莫德的患者。这是个令人惊讶的结果,因为它表明通过减少次数的较高剂量施用相同总量的活性成分提供了改进的临床结果。
[0245]
结果还表明,令人惊讶地,无需从结肠和/或结肠上皮细胞中去除粪便物质即可获得临床疗效。此外,临床疗效可以通过由适用于自我施用的灌肠装置施用来实现。
[0246]
参考例1
–
显示最佳给药频率的临床试验结果
[0247]
在随机双盲、安慰剂对照的试验中,131名中度至重度活动性溃疡性结肠炎患者随机接受两次单剂量的可比托莫德/kappaproct(30mg)或安慰剂,在基线和第4周在下gi内窥镜检查期间局部施用。
[0248]
治疗组和安慰剂组患者使用电子日记每周监测他们大便中的最大血量(无、少量或大量),每周排便频率(如<18、18-35、36-60或61 )和每日排便频率(如<1、1-1.99、2-2.99、3-3.99、4-4.99、5-5.99、6-6.99、7-7.99或8 ),持续12周。
[0249]
整理结果并计算治疗组相对于安慰剂组的治疗差量(treatment delta)。从这些结果可以看出,在初次施用后3周有特别高的治疗差量。
[0250]
治疗组和安慰剂组的结果如下图所示:
[0251]
图1示出了治疗组和安慰剂组中按周报告便血=零(7天内患者报告的最大结果)的比例。
[0252]
图2示出了治疗组和安慰剂组中按周报告每周排便频率<18(7天内患者报告的结果的汇总)的比例。
[0253]
图3示出了治疗组和安慰剂组中按周报告每周排便频率<35(7天内患者报告的结果的汇总)的比例。
[0254]
图4示出了治疗组和安慰剂组中按周报告每日排便频率<3(7天内患者报告的日平均结果)的比例。
[0255]
图5示出了治疗组和安慰剂组中按周报告每日排便频率<4(7天内患者报告的日平均结果)的比例。
[0256]
图6示出了治疗组和安慰剂组中按周报告每日排便频率<5(7天内患者报告的日平均结果)的比例。
[0257]
下表给出了试验中评估的各临床结果的治疗差量。
[0258]
表1
–
通过电子日记数据每周报告的最大便血(相对于没有便血的患者显示有利于治疗的差量)
[0259][0260]
表2
–
每周排便频率(赞成治疗的差量)
[0261] 123456789101112
《182.8%5.6%10.2%5.3%4.0%13.0%13.0%11.4%11.8%6.2%6.4%2.4%18-353.0%10.0%7.4%21.8%9.8%4.1%7.4%6.8%-1.1%6.0%6.3%6.7%》355.8%15.6%17.6%27.1%13.8%17.1%20.4%18.2%10.7%12.2%12.7%9.1%
[0262]
表3
–
平均每日排便频率(赞成治疗的差量)
[0263] 123456789101112《20.0%4.4%7.2%4.1%3.0%6.3%6.9%9.7%2.1%7.6%9.3%6.9%《33.9%8.0%17.3%9.4%12.1%14.2%19.9%9.9%16.8%15.4%16.7%19.1%《44.7%22.4%21.0%17.7%13.6%25.1%29.9%29.0%22.0%11.6%22.9%17.6%《53.8%22.7%12.3%24.2%21.2%14.5%22.7%19.7%13.0%11.1%10.4%7.8%
[0264]
表4
–
症状缓解:便血=0并且每周排便频率<35
[0265][0266]
实施例2
–
葡聚糖硫酸钠(dss)诱导的结肠炎小鼠模型
[0267]
材料和方法
[0268]
小鼠:balb/c小鼠购自charles river laboratories,research models and services(sulzfeld,germany)。使用八周龄雌性balb/c小鼠用于实验,并依照动物福利法(animal welfare act)在独立通气笼中饲养。水和食物可随意获得。
[0269]
dss诱导的结肠炎:将3%(w/v)葡聚糖硫酸钠(dss)(mp biomedicals,illkirch,france)施用至8周龄雌性balb/c小鼠的饮用水中10天。完全未处理的三只小鼠的另外的对照组也是实验设置的一部分。在第0、2、4、6、7、8和10天监测食物摄取和体重。
[0270]
可比托莫德的直肠施用:每只小鼠40μg、84μg、1000μg或1560μg可比托莫德直肠施用两次(在第4天和第8天)。用无菌水稀释各浓度的可比托莫德,每只小鼠100μl用于直肠施用。小鼠中1000μg的剂量大约相当于人中250mg的剂量(参见“guidance for industry
–
estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult health volunteers”,us department of health and human services food and drug administration center for drug evaluation and research,july 2005)。在这个小鼠模型中观察到的结果可以被认为是对人在两个分开的时刻(相隔3周)施用单独剂量的150mg至350mg可比托莫德时观察到的效果的预测。小鼠中84μg的剂量大体上相当于人中30mg的剂量。
[0271]
将不含可比托莫德的无菌水直肠施用于7只小鼠的对照组(安慰剂)。在实验开始之前,将来自不同处理组的小鼠在每个笼子中随机混合,以确保可比较的实验条件。
[0272]
dss诱导的结肠炎的评估:在第0、2、4、6、7、8和10天监测到体重减轻。疾病活动指数(dai)是体重相比于初始体重的减轻、大便稠度和粪便中可见血液的综合评分。每只小鼠的最高评分为12。在第0、2、4、6、7、8和10天评估dai。此外,使用coloview内窥镜系统在体内研究结肠炎症,该系统由微型内窥镜(范围1.9mm外径)、氙气光源、三片式相机和气泵(均来自karl storz,tutzingen,germany)组成,以实现小鼠结肠的调节膨胀。对于内窥镜检查,用含有4%异氟烷的100%氧气以0.2l/min至0.5l/min的速率麻醉小鼠,使用2%异氟烷进行维持。内窥镜结肠炎分级由五个参数组成:结肠增厚、正常血管纹理的改变、纤维蛋白的存在、粘膜颗粒性和大便稠度。针对每个参数(评分为0-3)进行内窥镜分级,得到累积评分在0-15之间。在第0、2、4、6、7、8和10天分析内窥镜分级。
[0273]
结果
[0274]
图7示出了在实验过程中不同处理组中小鼠体重的变化。dss处理开始四天后,所有dss处理组的体重开始以类似的方式减轻。在第4天直肠施用可比托莫德,结果,与安慰剂处理的小鼠相比,用84μg可比托莫德(*p=0.0472)和1000μg可比托莫德(*p=0.0122)处理的小鼠在第6天的体重减轻明显更小。在第7天,与用84μg(*p=0.0122)可比托莫德处理的小鼠相比,用1000μg可比托莫德(**p=0.0012)处理的小鼠组的体重减轻更显著地降低,此后两组的体重减轻持续显著低于安慰剂处理组,直至第10天(实验结束)。从第7天开始,用40μg可比托莫德处理的小鼠组的体重减轻也略有降低,但这种减少并不显著。与安慰剂处理的小鼠相比,用1560μg可比托莫德处理的小鼠组显示出体重减轻的增加。在第10天的实验结束时,除了1560μg可比托莫德处理组的体重减轻与安慰剂处理组相似之外,所有可比托莫德处理组的体重减轻与安慰剂处理组相比都降低了。完全未处理的小鼠(无dss,无可比托莫德/安慰剂)的体重在整个实验过程中没有变化(图7)。
[0275]
图8示出了在实验过程中不同处理组的小鼠的疾病活动指数(dai)的变化。dai数
据揭示,可比托莫德的直肠施用改善了dss诱导的结肠炎。除了40μg的可比托莫德处理的小鼠外,所有可比托莫德处理的小鼠都显示出相似的dai变化。,用40μg可比托莫德处理的小鼠组没有表现出dai与安慰剂对照相比显著降低。从第6天起,用84μg和1000μg可比托莫德处理的小鼠表现出dai与安慰剂组相比降低。在最早时间点(第6天)显示出dai显著降低(*p=0.0216)的剂量是1000μg可比托莫德处理组。用84μg和1000μg可比托莫德处理的小鼠在第8天和第10天显示出dai显著降低(***p=0.0006)。用1560μg可比托莫德处理的组在第7天显示出dai降低,并且在第8天和第10天降低是显著的(分别为**p=0.0023和***p=0.0006)。在整个实验过程中,完全未处理(无dss,无直肠施用)的小鼠的dai没有变化(图8)。
[0276]
图9示出了在实验过程中不同治疗组的小鼠的内窥镜结肠炎分级的变化。内窥镜结肠炎分级与体重减轻和dai的结果一致。与安慰剂处理组相比,所有用可比托莫德处理的小鼠都出现了较少的dss诱导的结肠炎征象。与安慰剂组相比,内窥镜结肠炎分级在首次施用可比托莫德后降低,直到所有可比托莫德处理组的实验结束。从第7天开始,除了40μg可比托莫德处理组外,所有可比托莫德处理组的降低是显著的(**p≤0.01)。在最早时间点(第6天)内窥镜结肠炎分级显示显著降低(*p=0.0408)的给药量是1000μg可比托莫德处理组(图9)。
[0277]
结论
[0278]
总之,这些结果通过可比托莫德处理的小鼠的体重减轻、疾病活动指数和内窥镜结肠炎等级的显著降低,表明了可比托莫德处理来改善dss诱导的结肠炎。在第4天和第8天施用1000μg可比托莫德的小鼠中,体重减轻、dai和内窥镜结肠炎分级得到了显著改善。特别是,与其他可比托莫德剂量相比,1000μg剂量在更早的时间点观察到dai和内窥镜结肠炎分级的改善。
[0279]
实施例3-葡聚糖硫酸钠(dss)诱导的结肠炎小鼠模型的流式细胞术结果
[0280]
材料和方法
[0281]
小鼠:balb/c小鼠购自charles river laboratories,research models and services(sulzfeld,germany)。使用八周龄雌性balb/c小鼠用于实验,并依照动物福利法(animal welfare act)在独立通气笼中饲养。水和食物可随意获得。
[0282]
dss诱导的结肠炎:将3%(w/v)葡聚糖硫酸钠(dss)(mp biomedicals,illkirch,france)施用至8周龄雌性balb/c小鼠的饮用水中10天。完全未处理的三只小鼠的另外的对照组也是实验设置的一部分。
[0283]
可比托莫德的直肠施用:每只小鼠40μg、84μg、500μg或1560μg可比托莫德直肠施用两次(在第4天和第8天)。用无菌水稀释各浓度的可比托莫德,每只小鼠100μl用于直肠施用。小鼠中500μg的剂量大约为人中125mg的剂量(hed-参见“guidance for industry
–
estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult health volunteers”,us department of health and human services food and drug administration center for drug evaluation and research,july 2005)。小鼠中84μg的剂量大致相当于人中30mg的剂量。
[0284]
将不含可比托莫德的无菌水另外直肠施用于7只小鼠的对照组(安慰剂)。在实验开始之前,将来自不同处理组的小鼠在每个笼子中随机混合,以确保可比较的实验条件。
cells in inflammatory bowel disease.intest.res.2015:13(2):105
–
111中进行了综述)。因此,减少mdsc可有助于ibd患者的肠炎的治疗。
[0292]
进一步的分析揭示,与可比托莫德处理的小鼠相比,安慰剂处理的小鼠中gr1
cd11b
mdsc的水平升高。用500μg可比托莫德处理的小鼠显著(*p≤.05)下调了gr1
cd11b
mdsc的水平(图11)。施用500μg可比托莫德的小鼠中gr1
cd11b
mdsc群的减少最为明显。
[0293]
结论
[0294]
这些结果表明,在dss诱导的结肠炎模型中,可比托莫德处理显著减少了小鼠结肠中的促炎性il17 粘膜t细胞和gr1
cd11b
mdsc群。施用500μg可比托莫德的小鼠在取自结肠的样本中显示出最满意的结果(il17 cd4 细胞和gr1
cd11b
mdsc群减少)。令人惊讶的是,500μg剂量的il17 cd4 细胞减少大于84μg剂量和1560μg剂量,这表明这些值之间的给药量在调节ibd中的免疫反应方面是最有效的。这一发现还表明,在人中,相隔3周的至少两次分开的时刻使用150mg至350mg的可比托莫德的剂量方案比其他更高和更低的剂量更能调节免疫反应,因此会更有效用于治疗ibd。
[0295]
实施例4-随机双盲、五组、安慰剂对照的、平行组、剂量范围2b期研究
[0296]
研究设计
[0297]
该研究是随机双盲、五组、安慰剂对照的、平行组、剂量范围2b期研究,在12个国家(捷克共和国、法国、德国、匈牙利、意大利、波兰、罗马尼亚、俄罗斯联邦、塞尔维亚、西班牙、瑞典和乌克兰)的91个中心进行。机构审查委员会或伦理委员会根据每个国家的国家指南批准了该方案。所有患者在入组前都提供了书面知情同意书,并且该研究是根据良好临床实践指南(good clinical practice guidelines)和赫尔辛基宣言原则(declaration of helsinki principles)进行的。在datalabs数据库系统中以电子方式获取病例报告表数据。使用电子验证方法进行数据质量检查。稽查轨迹(audit trail)追踪所有数据库改变。
[0298]
患者
[0299]
符合条件的患者年龄≥18岁,患有uc(诊断≥3个月),uc在肛缘上方延伸≥15cm且未超出脾曲,mayo完整评分为6至12,包括内窥镜分项评分(经修改从1级排除脆性)≥2,并且没有单个分项评分<1。单一解读者集中解读出内窥镜分项评分和疾病范围。
[0300]
患者:目前或以前使用过口服5-氨基水杨酸(5-asa)/柳氮磺胺吡啶(sp);目前使用糖皮质激素(gcs)或具有gcs依赖、难治或不耐受史;并且以前对免疫调节剂、tnf抑制剂或抗整合素疗法响应不足、响应丧失或不耐受。入组前8周内用环孢霉素、甲氨蝶呤、他克莫司、tnf抑制剂或维多珠单抗治疗的患者(允许具有无法测量的tnf抑制剂或维多珠单抗血清水平的患者)、或在入组前两周内用直肠gcs、5-asa/sp或他克莫司疗法治疗的患者被排除在外,在入组前两周内接受抗生素或非甾体抗炎药作为长期治疗方案的一部分的患者也被排除在外。在研究期间,不变剂量的口服gcs(筛选前2周稳定的每日剂量≤20mg强的松或等效物)、口服布地奈德多基质(筛选前,每日9mg,进行≥8周)、口服5-asa/sp(筛选前≥8周开始,剂量稳定两周)和硫唑嘌呤/6-mp(在筛选前≥3个月开始,剂量稳定八周)的同步治疗是允许的。
[0301]
随机分组和设盲
[0302]
根据计算机生成的随机分组清单和中心程序,患者被随机分到五个治疗组(1:1:1:1:1):可比托莫德2x31mg、2x125mg、2x250mg、4x125mg、或安慰剂。一旦患者被认为有资格
参与,研究人员就会通过交互式语音响应系统获得唯一的患者识别号。患者、研究人员和主办方(包括实施干预、评估结果和分析数据的人员)对治疗分配不知情。使用区组大小10对同步的gcs使用和先前的tnf抑制剂暴露进行分层随机分组。
[0303]
在基线(第0周)和第3周施用活性研究药物(可比托莫德2x31mg、2x125mg和2x250mg组),或在第0、1、2和3周施用活性研究药物(4x125mg组)。为了保持盲法,在可比托莫德2x31mg、2x125mg和2x250mg组中的第1周和第2周以及安慰剂组中的第0、1、2和3周时施用安慰剂。活性治疗产品和安慰剂具有相同的外观、粘度、气味和包装/标签。
[0304]
程序
[0305]
研究治疗由每个中心的研究人员通过直肠灌肠剂(50ml活性研究药物的无菌水溶液,或50ml无菌水作为安慰剂)施用,患者左侧卧位;之后,患者保持躺卧30分钟。患者在第0、1、2和3周接受可比托莫德31mg(0.62mg/ml)、125mg(2.5mg/ml)、250mg(5mg/ml)或安慰剂。在灌肠剂施用之前没有进行结肠清洁。
[0306]
患者参加了两次筛选访视(第一次筛选后一周内进行第二次,包括全结肠镜检查)、随机分组(第0周,在内窥镜检查后10天内)以及第1、2、3、6和10周的随访进行研究药物施用和/或疗效/安全性评估。在筛选结肠镜检查时,从每个被研究的肠段(升结肠、横结肠、降结肠和乙状结肠以及直肠)中发炎最严重的区域进行两次活检。从第一次筛选访视到第10周,患者根据每日电子日记中的mayo分项评分记录排便频率和便血。针对资格的完整mayo评分的计算使用筛选期间的电子日记数据。对用于主要终点评估的mayo直肠出血和排便频率分项评分,使用第0周和第6周访视前一周内最近连续三天的数据,不包括第6周乙状结肠镜检查前两天的评估;排便频率分项评分以平均每日排便频率计算,直肠出血以这些日子内最差的结果计算。
[0307]
患者在第0周和每次随访时完成了排便紧迫性评估(简单临床结肠炎活动指数[sccai]的组成部分,参见d
′
haens g,sandborn w,feagan b,et al.a review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis,gastroenterology 2007;132:763
–
86,和walmsley rs,ayres rc,pounder re,allan rn,a simple clinical colitis activity index,gut 1998;43:29
–
32),并在第0、3和6周完成了炎症性肠病问卷(ibdq)。在筛选和第6周和第10周评估了医师总体评估(pga)。在筛选、第0周和每次随访时收集用于粪便钙卫蛋白分析的大便。在第6周进行柔性乙状结肠镜检查,从降结肠、乙状结肠和直肠采集活检样本。内窥镜检查视频(来自筛选和第6周)由单一的对部位和治疗不知情的解读者集中评估。一位对部位、治疗和临床数据不知情的病理医生集中解读出组织学。
[0308]
结果
[0309]
主要终点是第6周时的临床缓解,由以下mayo分项评分定义:直肠出血为0、排便频率≤1(与基线相比降低≥1分)和内窥镜检查≤1(经修改排除脆性)。
[0310]
通过不良事件分析、体格检查、生命体征监测、心电图和临床实验室评估来评估安全性。在每次研究访视时收集不良事件信息,直至随访结束(第10周)。
[0311]
统计分析
[0312]
统计分析集旨在检测与安慰剂相比最有效的剂量组。样本量计算是基于假设来检测一个治疗组与安慰剂之间的差异,其使用零假设的单侧检验,零假设即每个活性治疗组
和安慰剂之间的主要终点没有差异,i类错误水平为0.1。假设安慰剂有10%的缓解率,并为了检测第6周处于临床缓解状态的患者比例在任何活性治疗组与安慰剂之间有25%(差量)的目标差异,则预计每个治疗组35名患者的组规模可提供90%的把握度(power)。每组纳入43名患者将允许20%的脱落(drop-out)率。小于目标差异的差异(低至10%差量)仍被认为具有临床意义。
[0313]
对于诸如此类的探索性、剂量范围研究,重点不是确认疗效,而是寻找最有效的剂量(与安慰剂相比),以用于进一步的开发。因此,使用i类错误率为0.1(即p<0.10被认为具有统计显著性)的单侧检验适用于提供高统计把握度以检测目标效应大小,同时保持可接受的样本量。对于探索性(与验证性相反)试验,也不需要对多重性进行调整。这种方法符合2期剂量探索试验的监管要求和惯例。
[0314]
主要终点分析是在基于意向性治疗原则在全分析集(fas)上对活性治疗组与安慰剂进行四个成对比较进行的;fas定义为接受至少一剂研究药物的所有随机分组患者。缺失值使用无应答者插补(nri)法进行替换,这表示患者的主要终点结果中没有临床缓解。对fas进行了另外两项分析,其中对缺失数据的患者使用了安慰剂多重插补(pmi)法,并且使用了观察数据方法。使用pmi方法进行主要终点的敏感性分析被认为是一种较少偏差的用于估算缺失数据的方法(参见21ema.guideline on missing data in confirmatory clinical trials.2010.https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-missing-data-confirmatory-clinical-trials_en.pdf(accessed may 5,2020))。与研究方案相比,使用末次观察值结转(last observation carried forward,locf)的主要终点分析被排除在外,因为它与使用nri方法相同(所有对象在基线都将处于“无缓解”状态)。主要终点分析也在方案集(pps)上进行,方案集被定义为没有可能影响主要终点的重大方案偏差或方案偏差的所有fas患者;该分析仅使用观察数据。
[0315]
cochran-mantel-haenszel(cmh)检验用于分析每个活性治疗组和安慰剂在主要终点和其他分类疗效终点的优势比(odds ratio,or)方面的差异,并根据随机分组时使用的分类因素(目前使用gcs[是/否],以及先前使用tnf抑制剂[是/否])进行了调整。所检验的零假设是or=1,即活性治疗组和安慰剂之间没有差异。结果以对象的数量和比例以及or进行描述性呈现。
[0316]
主要终点由具有相应的双侧80%置信区间(ci)的or和单侧p值表示。单侧p值<0.1被认为已满足用于治疗比较的主要或次要疗效目标。没有对多重性进行调整。or>1.0表明活性治疗组优于安慰剂的疗效。对于主要终点,还进行了双侧检验以获得双侧p值及其相应的95%ci,其中单侧检验显示p值<0.1。
[0317]
安全性分析基于安全性分析集(所有接受至少一剂活性研究药物或安慰剂的患者)。安全数据(对治疗组不知情)在研究期间由独立的数据安全监测委员会审查了六次。使用9.3版本或更高版本的sas进行分析。
[0318]
结果
[0319]
在筛选的383名患者中,213名被纳入并随机分组以接受可比托莫德2x31mg(n=41)、2x125mg(n=43)、4x125mg(n=43)、2x250mg(n=42)或4x安慰剂(n=44)。总共有211名(99.1%)随机分组的患者接受了至少一剂量的研究治疗,193名(90.6%)完成了第6周的研究访视,190名(89.2%)完成了第10周的研究访视。所有211名接受治疗的患者都包括在全
分析集和安全集中,并评估了主要终点。共有37名患者不符合pps的要求。
[0320]
基线时的治疗组在年龄、种族、体重指数和疾病特征方面相似。79名(37.4%)患者在研究期间同步使用类固醇(随机化下的平均剂量:泼尼松龙或等效剂量14.6mg/天,布地奈德多基质8.2mg/天),41名(19.4%)使用硫嘌呤。总体而言,48名(22.7%)患者之前使用过tnf抑制剂,15名(7.1%)患者使用过维多珠单抗。
[0321]
在第6周时,可比托莫德2x250mg组的临床缓解率最高,使用nri方法与安慰剂相比的差异是统计学显著的(即p<0.1)(21.4%对比6.8%;or为3.8[80%ci为1.53,9.47],单侧p=0.0247[双侧p=0.0495])(表1;图12和图13)。使用对fas中缺失数据的替代方法对主要终点的敏感性分析与主要分析一致(图13);这些证实了使用pmi方法(or为3.6[80%ci为1.44,8.95],单侧p=0.0368)和观察数据(or为4.2[80%ci为1.65,10.51],p=0.0197),可比托莫德2x250mg组与安慰剂相比具有统计学显著差异。使用pps中的观察数据,可比托莫德2
×
250mg组的临床缓解率与安慰剂相比也是统计学显著的(23.5%对比8.6%;or为3.4[80%ci为1.34,8.73],p=0.0400)。
[0322][0323]
总体而言,39.8%的患者经历了一种或多种不良事件。使用可比托莫德的不良事件发生率与使用安慰剂观察到的相似,并且在可比托莫德剂量组之间也相似。
[0324]
讨论
[0325]
在这些治疗难治性中度至重度活动性左侧结肠炎患者中,接受两次250mg可比托莫德局部施用的患者在第6周的临床缓解率高于安慰剂组,具有统计学显著的(基于单侧p<0.10)治疗差异,约为15%。这一发现在整个全分析群体和每个方案群体中是一致的,在另外两个使用不同方法处理缺失数据的敏感性分析中也是一致的。这些数据表明可比托莫德2x250mg方案是一种有效的治疗方法。尽管观察到的差异低于25%的样本量目标差量,但高于10%的差异,这被认为对uc的临床缓解具有临床意义。基于观察到的or(3.8)和80%ci(1.5-9.5),我们可以以80%的置信度排除缺少差异(or=1),但不能排除比观察到的更大的真实差异,包括25%差量的可能性。
[0326]
因此,在通过全结肠镜检查的集中解读确认符合活动性左侧结肠疾病的资格要求的这一非常特定的中度至重度左侧结肠炎患者群体中,两次施用250mg剂量,达到了第6周临床缓解的主要终点。据我们所知,这是首次使用集中解读内窥镜检查对左侧结肠炎中专门进行的研究(用于资格和结果)。根据目前的监管指南,临床缓解是根据mayo分项评分定义的,该mayo分项评分经修改从内窥镜分项评分1级中排除脆性并去除pga组成(参见fda.溃疡性结肠炎:行业临床试验终点指南(ulcerative colitis:clinical trial endpoints guidance for industry).2016.https://www.fda.gov/regulatory-information/search-fda-guidance-documents/ulcerative-colitis-clinical-trial-endpoints-guidance-industry(2020年5月5日获得)和ema.治疗溃疡性结肠炎新药开发指南(guideline on the development of new medicinal products for the treatment of ulcerative colitis).2018.https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-development-new-medicinal-products-treatment-ulcerative-colitis-revision-1_en.pdf(2020年5月5日获得))。与使用8至12周的较晚时间点来评估缓解的大多数其他uc试验相比,在第6周评估缓解(参见sands be,sandborn wj,panaccione r,et al.ustekinumab as induction and maintenance therapy for ulcerative colitis.new eng j med 2019;381:1201
–
14;sandborn wj,su c,sands be,et al.tofacitinib as induction and maintenance therapy for ulcerative colitis.new engl j med 2017;376:1723
–
36;reinisch w,sandborn wj,hommes dw,et al.adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis:results of a randomised controlled trial.gut 2011;60:780
–
7;sandborn wj,ferrante m,bhandari br,et al.efficacy and safety of mirikizumab in a randomized phase 2study of patients with ulcerative colitis.gastroenterology 2020;158:537
–
49)。据我们所知,几乎没有其他中度至重度uc研究早在第6周就评估了主要终点(参见feagan bg,rutgeerts p,sands be,et al.vedolizumab as induction and maintenance therapy for ulcerative colitis.new eng j med 2013;369:699
–
710;sandborn wj,feagan bg,marano c,et al.subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis.gastroenterology 2014;146:85
–
95)。主要分析使用nri,通常被认为是处理缺失数据的最保守方法,其假设有缺失数据的患者不符合主要结果和次要结果的标准。
[0327]
通过tlr9激活的独特和创新机制,这些发现进一步支持了可比托莫德在结肠粘膜中的局部免疫调节作用。我们相信这是第一次基于dna寡核苷酸的疗法在uc中证明对主要研究终点具有统计学意义的影响。这些数据扩展了先前研究的结果,在这些研究中,患有各种程度的活动性疾病(不包括直肠炎)的uc患者接受了较低剂量的可比托莫德。
[0328]
总之,在中度至重度活动性左侧uc患者中,当作为灌肠剂施用时,在施用之前没有清洁患者结肠的情况下,以两剂量250mg局部施用可比托莫德显示出在第6周时诱导临床缓解的疗效。可比托莫德耐受性良好,没有发现安全问题。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。