1.本发明属于药物中间体合成技术领域,具体涉及一种异喹啉类药物中间体的合成方法。
背景技术:
2.这里的陈述仅提供与本发明相关的背景技术,而不必然地构成现有技术。
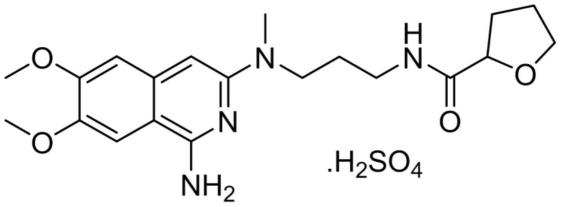
3.结构式如式i所示的化合物,是一种药物中间体:
[0004][0005]
目前,该药物中间体的制备方法中需要用到烷基化试剂,常用的烷基化试剂要么是碘甲烷、重氮甲烷等沸点较低毒性较强的化合物,要么是硫酸二甲酯、三氟甲磺酸甲酯等沸点高但毒性更强的化合物。在后续的放大生产过程中一旦泄露,容易对周围环境造成严重污染,危及工作人员的生命健康。
技术实现要素:
[0006]
针对现有技术存在的不足,本发明的目的是提供一种异喹啉类药物中间体的合成方法。
[0007]
为了实现上述目的,本发明是通过如下的技术方案来实现:
[0008]
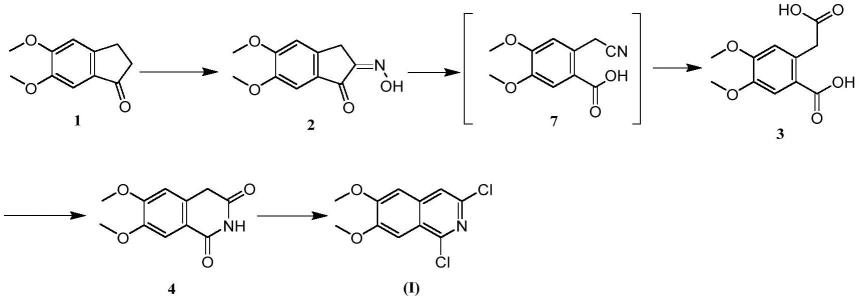
一种异喹啉类药物中间体的合成方法,其合成路线如下:
[0009][0010]
向碱液中加入化合物2,然后加入对甲苯磺酰氯,先进行化合物2的对甲苯磺酰基取代反应、然后在碱的作用下开环反应,开环反应完成后,向反应体系中补加碱,在碱的作用下再进行水解反应,通过“一锅煮”制备得到化合物3;
[0011]
化合物3通过环化反应制得化合物4,化合物4与氯化试剂进行氯化反应,制得目标产物。
[0012]
上述本发明的有益效果如下:
[0013]
发明人在试验过程中发现,如果在化合物2制备化合物3的过程中,在加入对甲苯磺酰氯之前一次加入过量的碱(以保证后续的水解反应)时,则反应体系中碱的浓度过大,
从而在反应过程中伴随着更多复杂的副反应发生(如引发化合物2降解、因碱过量引发开环过程中的重排等),结果产生过多的副产物,严重影响化合物3的纯度和收率。
[0014]
本发明中,在化合物2合成化合物3的过程中,分批加入碱,即先控制碱的用量可以支持取代和开环反应,反应过程中加入反应监控,即化合物2的剩余量小于等于2%时,再向反应体系中补加碱,进行水解反应。相对一次加入过量的碱(以保证后续的水解反应),分批加碱使得反应过程中碱的浓度较为合适,避免了反应过程中产生过多的副反应(如引发化合物2降解、因碱过量引发开环过程中的重排等),有利于化合物3纯度和收率的提高,进而有利于提高最终产物的收率和纯度。
[0015]
此外,本发明的合成方法中没有采用低沸点毒性较强的化合物,更适用于放大生产。
附图说明
[0016]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0017]
图1是本发明实施例1的化合物2的hplc图谱;
[0018]
图2是本发明实施例1的化合物2的nmr图谱;
[0019]
图3是本发明实施例1的化合物3的hplc图谱;
[0020]
图4是本发明实施例1的化合物3的nmr图谱;
[0021]
图5是本发明实施例1的化合物4的hplc图谱;
[0022]
图6是本发明实施例1的化合物4的nmr图谱
[0023]
图7是本发明实施例1的化合物i的hplc图谱;
[0024]
图8是本发明实施例1的化合物i的nmr图谱;
[0025]
图9是本发明实施例2的化合物2的hplc图谱;
[0026]
图10是本发明实施例2的化合物3的hplc图谱;
[0027]
图11是本发明实施例2的化合物4的hplc图谱;
[0028]
图12是本发明实施例2的化合物i的hplc图谱;
[0029]
图13是本发明实施例3的化合物2的hplc图谱;
[0030]
图14是本发明实施例3的化合物3的hplc图谱;
[0031]
图15是本发明实施例3的化合物4的hplc图谱;
[0032]
图16是本发明实施例3的化合物i的hplc图谱;
[0033]
图17是本发明对比例1的化合物3的hplc图谱。
具体实施方式
[0034]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0035]
发明人在进行该药物中间体(式i)的合成路径探索时,试验了如下工艺路线(工艺路线1),该种工艺路线在化合物7制备化合物8的过程中需要使用沸点较低毒性较大的化合物如碘甲烷、重氮或使用硫酸二甲酯、三氟甲磺酸甲酯沸点高但毒性更强的化合物,不适用
于后续的放大试验。
[0036]
工艺路线1:
[0037][0038]
在工艺路线1的基础上,发明人又进行了进一步试验,尝试进行了工艺路线2。
[0039]
工艺路线2:
[0040][0041]
工艺路线2中,向碱液中加入化合物2和对甲苯磺酰氯,进行化合物2的对甲苯磺酰基取代反应、然后在碱的作用下进行开环反应,从而得到化合物7。然后化合物7在碱性条件下经过水解,得到化合物3。
[0042]
发明人在化合物2至化合物3制备过程中对每一步进行监控、检测,当对化合物7进行反应监控时,通常只能检测到反应液中含有微量的化合物7,进而对化合物3进行检测时,反应体系中含有较多的杂质,严重影响化合物3的收率和纯度。
[0043]
发明人经过进一步研究发现,化合物7因为存在羧酸衍生物官能团(如氰基),其结构在碱性环境中不稳定,容易水解,生成化合物3,这种水解反应也是伴随着开环反应进行,从而导致反应体系中化合物7的浓度很低,甚至难以对其浓度进行监控。
[0044]
而在化合物2取代、开环步骤中一次加入过量的碱(以保证后续的水解反应)时,反应体系中碱的浓度过大,从而在反应过程中伴随着更多复杂的副反应发生(如引发化合物2降解、因碱过量引发开环过程中的重排等),结果产生过多的副产物,严重影响化合物3的纯度和收率。
[0045]
所以,发明人对工艺路线2进一步优化,得到本发明的技术方案,采用该技术方案制备最终产物,可以得到较好的收率和产物纯度,更加适用于工业生产。
[0046]
一种异喹啉类药物中间体的合成方法,其合成路线如下:
[0047][0048]
发明人根据碱的作用调整碱的用量,向碱液中加入化合物2和对甲苯磺酰氯,此时碱用量可以支持取代和开环反应,控制用量尽量减少副反应。反应过程中进行反应监控,即化合物2的剩余量小于等于2%时,向反应体系中补加碱,进行水解反应,制备得到化合物3;
[0049]
化合物3在通过环化反应制得化合物4,化合物4与氯化试剂进行氯化反应,制得目标产物。
[0050]
在一些实施例中,化合物2的合成步骤中,向化合物1的醇溶液中加入亚硝酸酯,升温后,向反应体系加入盐酸,继续反应,制得。
[0051]
优选的,所述亚硝酸酯选自硝酸异戊酯、亚硝酸正戊酯、亚硝酸正丁酯、亚硝酸异丙酯、亚硝酸正丙酯、亚硝酸叔丁酯或亚硝酸异丁酯中的一种或多种的混合物。
[0052]
优选的,化合物1与亚硝酸酯的摩尔比为1-4,其中摩尔比优选1.5-2.5。
[0053]
优选的,反应温度为10~60℃,反应时间为8~10h。
[0054]
进一步优选的,反应温度为40-50℃。
[0055]
在一些实施例中,化合物2合成化合物3的过程中,采用“一锅煮”的方式,先进行化合物2的对甲苯磺酰基取代反应、然后再碱性条件下开环反应,其中化合物2与对甲苯磺酰氯的摩尔比为1:2-4;
[0056]
化合物2与碱的摩尔比为1:3-4
[0057]
在一些实施例中,开环反应的温度为50~100℃,优选为60℃~70℃。
[0058]
在一些实施例中,开环反应后,向反应体系中补加氢氧化钠,化合物2与需要补加的氢氧化钠摩尔比1:1-2。
[0059]
优选的,水解反应后,将反应体系温度降至15-20℃,向其中加酸,调节ph值至3-4,终止反应。
[0060]
在一些实施例中,化合物4的合成步骤中,向化合物3的溶剂中加入氮源,进行环化反应,即得。
[0061]
优选的,环化反应的温度为95-150℃,优选为95-125℃。
[0062]
优选的,化合物3和溶剂体积比1:3-8;优选为1:4-6。
[0063]
优选的,化合物3与氮源摩尔比为1:3-7,优选为1:4-5。
[0064]
在一些实施例中,化合物4的合成过程中,溶剂为乙酸、乙二醇、氯苯、甲苯、1,4-二氧六环、邻二氯苯等。优选乙酸。
[0065]
在一些实施例中,化合物4的合成过程中,氮源为尿素、氨水、氨/甲醇溶液等。优选尿素。
[0066]
在一些实施例中,化合物i的合成过程中,氯化试剂为苯膦酰二氯、三氯氧磷、氯化
亚砜、五氯化磷等,优选苯膦酰二氯。
[0067]
优选的,氯化反应的温度为100-160℃;优选为110-140℃。
[0068]
在一些实施例中,氯化反应完毕后,向反应体系加入碱进行淬灭。
[0069]
在一些实施例中,还包括向反应体系加入有机溶剂进行析晶的步骤。
[0070]
优选的,加入的有机溶剂为乙腈或/和甲醇。
[0071]
进一步优选的,乙腈和甲醇的混合溶剂中,乙腈和甲醇的质量比为5:1-3。用该种特殊配比的混合溶剂时,有利于将反应产物充分析出,以提高产物的收率。
[0072]
下面结合具体实施例对本发明作进一步说明。
[0073]
实施例1
[0074]
化合物2合成
[0075]
将甲醇772kg(10v)加入2000l反应釜,搅拌下加入75.0kg化合物1(1.0eq),搅拌溶解,然后将亚硝酸异戊酯91.4kg(2.0eq),搅拌升温至50℃,然后缓慢滴加盐酸11.7kg(0.3eq),控制温度45℃,搅拌反应10h,然后降温至20℃保温搅拌2h,过滤,采用甲醇洗涤,滤饼45℃干燥,得到化合物2,收率95.4%,hplc:94.74%,如图1所示,nmr如图2所示。nmr解析如下:
[0076]1h nmr:(400mhz,dmso-d6)δ12.38(s,1h)7.15(s,1h),7.14(s,1h),3.86(s,3h),3.79(s,3h),3.62(s,2h)。
[0077]
化合物3合成
[0078]
将纯化水773kg(10v)加入2000l反应釜,然后加入氢氧化钠55.9kg(4.0eq),搅拌,降温至20-30℃,缓慢加入77.3kg化合物2,搅拌后溶液颜色加深,然后再加入对甲苯磺酰氯226.4kg(4.0eq),溶液搅拌升温至60℃,搅拌反应监控化合物2的剩余量小于等于2%时,再次补加氢氧化钠28.0kg(2.0eq),搅拌反应12-15h,降温至20℃,加入hcl 245kg(3.17x)调节ph值至4,离心,滤饼用纯化水386kg(5v)然后50-55℃真空干燥,得到70.41kg化合物3,收率89.6%,hplc:98.52%,如图3所示,nmr如图4所示。nmr解析如下:
[0079]1h nmr:(400mhz,dmso-d6)δ12.33(brs,2h),7.45(s,1h),6.94(s,1h),3.89(s,2h),3.81(s,3h),3.78(s,3h)。
[0080]
13
c nmr:(100mhz,dmso-d6)δ173.1,168.2,151.8,147.3,131.6,122.3,116.0,114.0,56.1,56.0,40.2。
[0081]
化合物4合成
[0082]
将乙酸466.2kg(6v)加入1000l反应釜,搅拌加入74kg化合物3,然后加入尿素93.1kg(5.0eq)搅拌,溶液为白色混悬液,搅拌升温至95-105℃,搅拌反应20h。降温至15℃,加入纯化水370kg(5v)搅拌1h,离心,滤饼用纯化水洗涤,并置于40℃真空干燥,得到52.7kg化合物4,收率77.3%,hplc:99.92%,如图5所示。nmr如图6所示。nmr解析如下:
[0083]1h nmr:(400mhz,dmso-d6)δ11.15(brs,1h)7.43(s,1h),6.96(s,1h),7.39(s,1h),3.93(s,3h),3.83(s,3h),3.81(s,3h)。
[0084]
化合物i合成
[0085]
将苯膦酰二氯256kg(4v)加入500l反应釜,搅拌,然后加入45kg化合物4,开启加热,搅拌反应,升温至110℃,反应4h后,降温至80℃,加入乙腈142.2kg(4v),回流2h后降温至20-30℃。反应液采用8%碳酸氢钠淬灭直至溶液为中性。淬灭完毕,搅拌2h。离心,滤饼用
纯化水45kg(1v)淋洗。滤饼加入177.8kg(5v)乙腈中,加热搅拌至70℃,开始滴加甲醇72kg(2v),降温至15℃缓慢析晶,搅拌2h,离心,滤饼40℃干燥,得到35.2kg,收率66.8%,hplc:99.67%(如图7所示);nmr(如图8);
[0086]
nmr解析如下:
[0087]1h nmr:(400mhz,dmso-d6)δ7.87(s,1h),7.46(s,1h),7.39(s,1h),3.98(s,3h),3.96(s,3h)。
[0088]
13
c nmr:(100mhz,dmso-d6)δ155.8,152.0,147.2,140.5,136.8,121.3,119.3,105.7,103.7,56.7,56.4。
[0089]
lc-ms(c
11
h9cl2no2):258.0[m h]
,260.0[m 2 h]
。
[0090]
实施例2
[0091]
化合物2合成
[0092]
将甲醇18.2kg(10v)加入50l反应釜,搅拌下加入2.3kg化合物1(1.0eq),搅拌溶解,然后将亚硝酸异戊酯3.5kg(2.5eq),搅拌升温至45℃,然后缓慢滴加盐酸0.6kg(0.5eq),控制温度45℃,搅拌反应10h,然后降温至20℃保温搅拌2h,过滤,采用甲醇洗涤,滤饼45℃干燥,得到2.5kg化合物2,收率92.8%,hplc:95.54%(图9)。
[0093]
化合物3合成
[0094]
将纯化水24kg(10v)加入50l反应釜,然后加入氢氧化钠0.92kg(3.0eq),搅拌,降温至30℃,缓慢加入2.4kg化合物2,搅拌后溶液颜色加深,然后再加入对甲苯磺酰氯6.2kg(3.0eq),溶液搅拌升温至85℃,搅拌反应监控化合物2的剩余量小于等于2%时,再次补加氢氧化钠0.8kg(2.0eq),搅拌反应15h,降温至20℃,加入hcl 7.6kg(3.17x)调节ph至3,离心,滤饼用纯化水12kg(5.0v)然后50℃真空干燥,得到2.34kg化合物3,收率89.8%。hplc:98.83%(图10)。
[0095]
化合物4合成
[0096]
将乙酸11.6kg(5v)加入50l反应釜,搅拌加入2.2kg化合物3,然后加入尿素2.8kg(5.0eq)搅拌,溶液为白色混悬液,搅拌升温至95-105℃,搅拌反应18h。降温至20℃,加入纯化水11kg(5v)搅拌1h,离心,滤饼用纯化水洗涤,并置于50-55℃真空干燥,得到1.63kg化合物4,收率76.9%。hplc:99.38%(图11)。
[0097]
化合物i合成
[0098]
将苯膦酰二氯7.5kg(4v)加入20l反应釜,搅拌,然后加入1.36kg化合物4,开启加热,搅拌反应,升温至115℃,反应4h后,降温至80℃,加入乙腈5.4kg(5v),升温回流2h后降温至25℃。反应液采用8%碳酸氢钠淬灭直至溶液为中性。淬灭完毕,搅拌2h。离心,滤饼用纯化水1.6kg淋洗。滤饼加入5.4kg(5v)乙腈中,加热搅拌至75℃,开始滴加甲醇2.1kg(2v),降温至15℃缓慢析晶,搅拌2h,离心,滤饼45℃干燥,得到950g化合物5,收率59.9%,hplc:99.33%(图12)。
[0099]
实施例3
[0100]
化合物2合成
[0101]
将甲醇1000ml(5v)加入2500ml反应瓶,搅拌下加入200g化合物1(1.0eq),搅拌溶解,然后将亚硝酸异戊酯182.8g(1.5eq),搅拌升温至50℃,然后缓慢滴加盐酸10.4g(0.1eq),控制温度50℃,搅拌反应10h,然后降温至20℃保温搅拌2h,过滤,采用甲醇洗涤,
滤饼45℃干燥,得到218.9g化合物2,收率95.1%,hplc:93.2%(图13)。
[0102]
化合物3合成
[0103]
将纯化水2000ml(10v)加入5l反应瓶,然后加入氢氧化钠144.7g(3.0eq),搅拌,降温至20-30℃,缓慢加入200g化合物2,搅拌后溶液颜色加深,然后再加入对甲苯磺酰氯334.7g(2.0eq),溶液搅拌升温至60℃,搅拌反应监控化合物2的剩余量小于等于2%时,再次补加氢氧化钠48.2g(1.0eq),搅拌反应15h,降温至20℃,加入hcl634g(3.17x)调节ph至4,离心,滤饼用纯化水1000ml(5.0v)然后55℃干燥,得到194.6g化合物3,收率89.6%,hplc:98.67%(图14)。
[0104]
化合物4合成
[0105]
将乙酸580ml(4v)加入2500ml反应瓶,搅拌加入145g化合物3,然后加入尿素145.0g(4.0eq)搅拌,溶液为白色混悬液,搅拌升温至95-105℃,搅拌反应15h。降温至30℃,加入纯化水725ml(5v)搅拌1h,离心,滤饼用纯化水洗涤,然后50-55℃真空干燥,得到102.68g化合物4,收率76.9%,hplc:99.57%(图15)。
[0106]
化合物i合成
[0107]
将苯膦酰二氯400ml(4v)加入1000l三口反应瓶,搅拌,然后加入100g化合物4,开启加热,搅拌反应,升温至110℃,反应4h后,降温至80℃,加入乙腈400ml(4v),反应回流2h后降温至30℃。反应液采用8%碳酸氢淬灭直至溶液为中性。淬灭完毕,搅拌2h。离心,滤饼用纯化水100ml淋洗。滤饼加入500ml(5v)乙腈中,加热搅拌至70℃,开始滴加甲醇200ml(2v),降温至20℃缓慢析晶,搅拌2h,离心,滤饼50-55℃干燥,得到68.49g化合物5,收率58.7%,hplc:99.45%(图16)。
[0108]
对比例1
[0109]
与实施例3中化合物3合成相比,对比例1为一步加碱操作,具体操作如下:
[0110]
将纯化水1000ml(10v)加入3l反应瓶,然后加入氢氧化钠144.7g(8.0eq),搅拌,降温至25℃,缓慢加入100g化合物2,搅拌后溶液颜色加深,然后再加入对甲苯磺酰氯167.3g(2.0eq),溶液搅拌升温至65℃,搅拌反应20h,降温至15-20℃,加入hcl 317g(3.17x)调节ph至3,离心,滤饼用纯化水500ml(5.0v)然后50-55℃干燥,得到87.8g化合物3,收率80.9%,hplc:95.03%(图17)。
[0111]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。