1.本技术涉及细胞技术领域,更具体地说,它涉及动物脐带间充质干细胞外泌体提取方法。
背景技术:
2.外泌体是指包含了复杂rna和蛋白质的小膜泡,直径在30-150nm之间,其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中,外泌体含有其来源细胞的胞膜和胞质蛋白成分,因此它较易与邻近细胞的胞膜发生融合,进而将一个细胞的胞膜及胞质蛋白传递给另一个细胞,在不同细胞间进行信息传递。此外泌体还包含着能够在细胞间进行转移的rna(mrna及micrornas),通过在细胞间水平转移方式激活靶细胞产生一系列生物学效应。因此,外泌体在细胞微环境中具有十分重要的作用。
3.间充质干细胞(mesenchymal stem cells,mscs)是具有自我更新和多向分化能力的细胞,研究发现间充质干细胞分泌的外泌体中含有丙酮酸激酶、人乳脂肪球egf因子蛋白、跨膜四蛋白等多种蛋白质,他们在参与细胞结构的维持运动信息交流以及组织的修复与再生方面产生着重要作用。
4.然而目前通过脐带间充质干细胞提取外泌体的产量低,从而阻碍了外泌体的大规模应用。
技术实现要素:
5.为了提高了通过脐带间充质干细胞提取外泌体的产量,本技术提供动物脐带间充质干细胞外泌体提取方法。
6.第一方面,本技术提供动物脐带间充质干细胞外泌体提取方法,采用如下的技术方案:动物脐带间充质干细胞外泌体提取方法,包括以下步骤:取动物脐带组织并对脐带间充质干细胞进行培养;外泌体的提取:使用完全培养基培养p3~p20代脐带间充质干细胞,收集上清液,对上清液进行离心去除死细胞和细胞碎片,过滤去除微粒,然后对上清液使用离心法沉淀外泌体;对外泌体沉淀使用pbs重悬后置于-70~-80℃环境下保存。
7.优选的,取动物脐带组织并对脐带间充质干细胞进行培养包括以下步骤:s1动物脐带组织的处理,剔除脐带组织中膜组织和血管组织,s2将经过处理后的脐带组织转移至离心管中,加入胶原酶35~37℃下处理3~6h;s3将经过s2处理后的组织液过滤,滤液经离心后得到沉淀部分;s4沉淀部分用完全培养基重悬,重悬液接种至细胞培养皿中培养24h;s5使用pbs缓冲液清洗培养细胞,并更换新鲜培养基;s6每隔36~48h重复步骤s5;
s7当细胞铺满培养皿70-80%,对细胞进行传代培养。
8.在本技术的一些实施方案中,动物脐带间充质干细胞外泌体提取方法,包括以下步骤:(1)取羊脐带组织并对脐带间充质干细胞进行培养:s1动物脐带组织的处理,剔除脐带组织中膜组织和血管组织,剩余的胶质组织剪至1mm2;s2将经过处理后的脐带组织转移至离心管中,加入ⅰ型胶原酶,35~37℃下处理3~6h;s3将经过s2处理后的组织液用100目细胞筛过滤,滤液经1200r/min离心5min,离心后得到沉淀部分;s4沉淀部分用完全培养基重悬,重悬液接种至细胞培养皿中培养24h;s5使用pbs缓冲液清洗培养细胞,并更换新鲜的完全培养基;s6每隔36~48h重复步骤s5;s7当细胞铺满培养皿70-80%,对细胞进行传代培养。
9.(2)外泌体的提取:s1使用完全培养基培养p3~p20代脐带间充质干细胞48h;s2培养完成后收集上清液,在4℃,300g的条件下离心上清液10min,去除死细胞和细胞碎片,使用0.22μm的滤膜过滤去除微粒;s3低温超高速离心沉淀外泌体,包括:首先在4~6℃环境下,300g~600g离心10min,收集上清液;接着在4~6℃环境下,2000g~3000g离心10min。收集上清液;继续在4~6℃环境下,10000g~12000g离心10min,收集上清液;最后再在4~6℃环境下,100000g~150000g离心1.5~2.5h,得到外泌体沉淀。
10.(3)对外泌体沉淀使用1~2ml的pbs重悬后置于-70~-80℃环境下保存。
11.优选的,所述完全培养基,按重量百分比计,包括基础培养基80-90%、无外泌体胎牛血清8%~12%、双抗溶液0.5%~1.5%、维生素c 0.1~0.4%、l-谷氨酰胺1.5%~3%、转铁蛋白0.01~0.05%、硝酸铁0.1~0.18%。
12.优选的,所述转铁蛋白与所述硝酸铁用量比为1:(2~6)。
13.更优选的,所述转铁蛋白与所述硝酸铁用量比为1:4。
14.在本技术的一些实施方案中,转铁蛋白用量占完全培养基5.根据权利要求4所述的动物脐带间充质干细胞外泌体提取方法,其特征在于,按重量百分比计,所述完全培养基包括基础培养基86.65%、无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.03%、硝酸铁0.12%。
15.优选的,所述基础培养基为dmem/f12培养基。
16.优选的,使用完全培养基培养p3~p20代脐带间充质干细胞时,还包括电刺激培养,对脐带间充质干细胞进行交流电刺激,电场强度为100~500mv/cm,频率为5~20hz。
17.在本技术的一种实施方案中,动物脐带间充质干细胞外泌体提取方法,包括以下步骤:(1)取养脐带组织并对脐带间充质干细胞进行培养:s1动物脐带组织的处理,剔除脐带组织中膜组织和血管组织,剩余的胶质组织剪至1mm2;s2将经过处理后的脐带组织转移至离心管中,加入ⅰ型胶原酶,35~37℃下处理3~
6h;s3将经过s2处理后的组织液用100目细胞筛过滤,滤液经1200r/min离心5min,离心后得到沉淀部分;s4沉淀部分用完全培养基重悬,重悬液接种至细胞培养皿中培养24h;s5使用pbs缓冲液清洗培养细胞,并更换新鲜的完全培养基;s6每隔36~48h重复步骤s5;s7当细胞铺满培养皿70-80%,对细胞进行传代培养。
18.(2)外泌体的提取:s1使用完全培养基培养p3~p20代脐带间充质干细胞48h,细胞培养期间用c-pace电刺激器引入双向方形脉冲电信号进行双极电刺激,电场强度为200~400mv/cm,频率为10~20hz。;s2培养完成后收集上清液,在4℃,300g的条件下离心上清液10min,去除死细胞和细胞碎片,使用0.22μm的滤膜过滤去除微粒;s3低温超高速离心沉淀外泌体,得到外泌体沉淀。
19.(3)对外泌体沉淀使用1~2ml的pbs重悬后置于-70~-80℃环境下保存。
20.优选的,所述电场强度为200~400mv/cm,所述频率为10~20hz。
21.优选的,交流电刺激时交流电的波形为双向方形。
22.优选的,所述离心法包括,首先在4~6℃环境下,300~600g离心10min,收集上清液;接着在4~6℃环境下,2 000~3 000g离心10min。收集上清液;继续在4~6℃环境下,10000~12000g离心10min,收集上清液;最后在4~6℃环境下,100000~150000g离心1.5~2.5h,得到所述外泌体沉淀。
23.综上所述,本技术具有以下有益效果:1、本技术的动物脐带充质干细胞外泌体提取方法,通过对脐带组织间充质干细胞进行处理培养,进一步的将间充质干细胞分泌的外泌体提取出来。得到的外泌体提取物具有产量大,纯度高的优点。本技术通过使用特定组分配比的完全培养基培养间充质干细胞可以得到更多的外泌体产量。尤其是当完全培养基中按照特定比例添加转铁蛋白和硝酸铁后,外泌体的产量和纯度可以获得明显的提高。
24.2、本技术中优选电刺激法培养间充质干细胞,通过在间充质干细胞的两侧加入交变电场对间充质干细胞进行电刺激,从而加快间充质干细胞分泌外泌体。
具体实施方式
25.本技术所使用的离心机为5810r,eppendorf。
26.以下结合实施例对本技术作进一步详细说明。
27.一种动物脐带间充质干细胞外泌体提取方法,包括以下步骤:(1)取养脐带组织并对脐带间充质干细胞进行培养:s1动物脐带组织的处理,剔除脐带组织中膜组织和血管组织,剩余的胶质组织剪至1mm2;s2将经过处理后的脐带组织转移至离心管中,加入ⅰ型胶原酶,35~37℃下处理3~6h;s3将经过s2处理后的组织液用100目细胞筛过滤,滤液经1200r/min离心5min,离心后得到沉淀部分;
s4沉淀部分用完全培养基重悬,重悬液接种至细胞培养皿中培养24h;s5使用pbs缓冲液清洗培养细胞,并更换新鲜的完全培养基;s6每隔36~48h重复步骤s5;s7当细胞铺满培养皿70-80%,对细胞进行传代培养。
28.(2)外泌体的提取:s1使用完全培养基培养p3~p20代脐带间充质干细胞48h;s2培养完成后收集上清液,在4℃,300g的条件下离心上清液10min,去除死细胞和细胞碎片,使用0.22μm的滤膜过滤去除微粒;s3低温超高速离心沉淀外泌体,包括:首先在4~6℃环境下,300g~600g离心10min,收集上清液;接着在4~6℃环境下,2000g~3000g离心10min。收集上清液;继续在4~6℃环境下,10000g~12000g离心10min,收集上清液;最后再在4~6℃环境下,100000g~150000g离心1.5~2.5h,得到外泌体沉淀。
29.(3)对外泌体沉淀使用1~2ml的pbs重悬后置于-70~-80℃环境下保存。
30.优选的,在步骤(2)外泌体的提取,s1使用完全培养基培养p3~p20代脐带间充质干细胞时,用c-pace电刺激器引入双向方形脉冲电信号进行双极电刺激,电场强度为100~500mv/cm,频率为5~20hz。
31.电场强度更优选为200~400mv/cm,最优选为300mv/cm;频率更优选为为10~20hz,最优选为15hz。
32.上述制备方法中使用的完全培养基包括:基础培养基80-90%、无外泌体胎牛血清8%~12%、双抗溶液0.5%~1.5%、维生素c 0.1~0.4%、l-谷氨酰胺1.5%~3%、转铁蛋白0.01~0.1%、硝酸铁0.1~0.2%。
33.双抗溶液为青链霉素混合液,青霉素-链霉素溶液(100x)中,青霉素的含量为10000u/ml,链霉素的含量为10mg/ml。
34.基础培养基为dmem/f12培养基。
35.优选的,转铁蛋白与硝酸铁用量比为1:(2~6);更优选的,转铁蛋白与硝酸铁用量比为1:4。
36.在本技术的一种实施方案中,完全培养基中转铁蛋白的重量百分比为0.03%、硝酸铁的重量百分比为0.12%。
37.在本技术的一种实施方案中,完全培养基中转铁蛋白的重量百分比为0.04%、硝酸铁的重量百分比为0.16%。
38.在本技术的一种实施方案中,完全培养基包括基础培养基、无外泌体胎牛血清8%~12%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.03%、硝酸铁0.12%。实施例
39.实施例1一种动物脐带间充质干细胞外泌体提取方法,包括以下步骤:(1)取羊脐带组织并对脐带间充质干细胞进行培养:s1动物脐带组织的处理,剔除脐带组织中膜组织和血管组织,剩余的胶质组织剪至1mm2;s2将经过处理后的脐带组织转移至离心管中,加入ⅰ型胶原酶,37℃下处理5h;
s3将经过s2处理后的组织液用100目细胞筛过滤,滤液经1200r/min离心5min,离心后得到沉淀部分;s4沉淀部分用完全培养基重悬,重悬液接种至细胞培养皿中培养24h;s5使用pbs缓冲液清洗培养细胞,并更换新鲜的完全培养基;s6每隔48h重复步骤s5;s7当细胞铺满培养皿80%,对细胞进行传代培养。
40.(2)外泌体的提取:s1使用完全培养基培养p3代脐带间充质干细胞48h,培养期间用c-pace电刺激器引入双向方形脉冲电信号对充质干细胞进行双极电刺激,电场强度为300mv/cm,频率为15hz;s2培养完成后收集上清液,在4℃,300g的条件下离心上清液10min,去除死细胞和细胞碎片,使用0.22μm的滤膜过滤去除微粒;s3低温超高速离心沉淀外泌体,包括:首先在4℃环境下,400g离心10min,收集上清液;接着在4℃环境下,2000g离心10min。收集上清液;继续在4℃环境下,10000g离心10min,收集上清液;最后在4℃环境下,120000g离心2h,得到外泌体沉淀。
41.(3)对外泌体沉淀使用1ml的pbs重悬后置于-70~-80℃环境下保存。
42.按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c0.2%、l-谷氨酰胺2%、转铁蛋白0.02%、硝酸铁0.1%,基础培养基为余量。
43.实施例2与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.03%、硝酸铁0.1%,基础培养基为余量。
44.实施例3与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.04%、硝酸铁0.1%,基础培养基为余量。
45.实施例4与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.05%、硝酸铁0.1%,基础培养基为余量。
46.实施例5与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.03%、硝酸铁0.12%,基础培养基为余量。
47.实施例6与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液
1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.03%、硝酸铁0.15%,基础培养基为余量。
48.实施例7与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.03%、硝酸铁0.18%,基础培养基为余量。
49.实施例8与实施例1的不同之处在于,完全培养基的配比不同;本实施例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.04%、硝酸铁0.16%,基础培养基为余量。
50.实施例9与实施例5的不同之处在于,电刺激培养时施加在细胞两侧的电场强度为200mv/cm。
51.实施例10与实施例5的不同之处在于,电刺激培养时施加在细胞两侧的电场强度为400mv/cm。
52.实施例11与实施例5的不同之处在于,电刺激培养时施加在细胞两侧的交流电频率为10hz。
53.实施例12与实施例5的不同之处在于,电刺激培养时施加在细胞两侧的交流电频率为20hz。
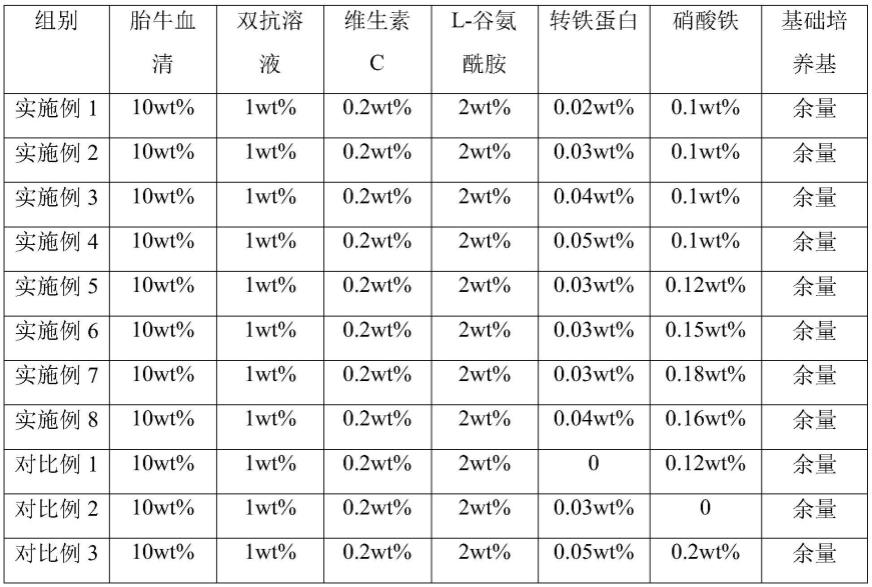
54.实施例13与实施例5的不同之处在于,细胞培养时未施加电刺激。
55.对比例对比例1与实施例5的不同之处在于,本对比例中完全培养基中未添加转铁蛋白。
56.对比例2与实施例5的不同之处在于,本对比例中完全培养基中未添加硝酸铁。
57.对比例3与实施例1的不同之处在于,本对比例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.05%、硝酸铁0.16%,基础培养基为余量。
58.对比例4与实施例1的不同之处在于,本对比例中,按重量百分比计,完全培养基包括无外泌体胎牛血清10%、双抗溶液1%、维生素c 0.2%、l-谷氨酰胺2%、转铁蛋白0.04%、硝酸铁0.08%,基础培养基为余量。
59.对比例5与实施例5的不同之处在于,电刺激培养时施加在细胞两侧的电场强度为500mv/cm。
60.对比例6与实施例5的不同之处在于,电刺激培养时施加在细胞两侧的交流电频率为30hz。
61.实施例1-8,对比例1-4中使用的完全培养基配比如表1表1实施例1-8,对比例1-4使用的完全培养基中各组分配比(wt%)4使用的完全培养基中各组分配比(wt%)实施例5、9-12,对比例5、6电刺激的参数调整如表2组别电场强度(mv/cm)频率(hz)实施例530015实施例920015实施例104005实施例1130010实施例1230020对比例550015对比例630030性能检测试验1、外泌体的western blot检测向外泌体悬液中滴入蛋白裂解液,4℃放置10min,然后4℃条件下,12000rpm的转速离心5min,取上清转进行western blot检测cd9、cd63蛋白和钙连蛋白的表达情况。
62.western印迹结果分析,发现实施例1-13提取的外泌体中可见到清晰的阳性蛋白标志物cd9和cd63,同时阴性蛋白标志物钙连蛋白无表达,说的,证明得到的提取物中含有外泌体,且外泌体的含量高、杂质少。
63.2、外泌体的纳米粒径浓度分析将步骤(3)中的悬液加入到排阻柱中,待液体流尽,加入2.5mlpbs,同时开始收集流出液,将流出液转移到超滤管中,4℃,3000~5 000g离心1~5min,留取截留液200~500μ
l,使用纳米颗粒追踪分析仪(zeta view pmx 110),对截留液中的外泌体进行尺寸和颗粒浓度的检测。
64.经检测,实施例1-13所得的外泌体直径在80-140nm之间。
65.实施例1-13,对比例1-6的外泌体粒子浓度、主峰粒子大小、主峰百分比(%)如表3表3实施例1-13,对比例1-6的外泌体粒子浓度(粒子/ml)、主峰粒子大小(nm)、主峰百分比(%)峰百分比(%)参考表3,结合实施例1-8和对比例1-4可以看出,通过在完全培养基中加入转铁蛋白和硝酸铁,可以促进间充质干细胞分泌外泌体,提高外泌体的产量。尤其是当转铁蛋白用量在0.01wt%-0.05wt%,硝酸铁用量在0.1wt%-0.8wt%时,使用这种完全培养基可以显著的提高外泌体的产量。实施例5中,当硝酸铁用量为0.03wt%,硝酸铁的用量为0.12wt%时,外泌体的产量最高,提取液中外泌体的浓度可以达到11.4
×
10
10
粒子/ml。
66.本技术进一步探究了转铁蛋白与硝酸铁用量比对外泌体分泌量的影响,参考实施例1-8,当转铁蛋白与硝酸铁的重量比为1:(2-6),外泌体的分泌量更多,尤其是当转铁蛋白与硝酸铁的重量比为1:4,外泌体的分泌量最为明显。
67.参考实施例5、9-13,对比例5、6,在培养间充质干细胞时,施加电刺激可以提高外泌体的产量,当电场强度在200-400mv/cm,频率在10-20时,电刺激对外泌体的产量影响更加明显。
68.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。