猫传染性腹膜炎病毒荧光定量rt-pcr检测试剂盒
技术领域
1.本发明涉及生物技术领域中病毒分子生物学检测用试剂盒,具体涉及一种猫传染性腹膜炎病毒荧光定量rt-pcr检测试剂盒。
背景技术:
2.猫传染性腹膜炎(feline infectious peritonitis,fip)是由猫传染性腹膜炎病毒(feline infectious peritonitis virus,fipv)引起的猫临床常见的一种传染病,死亡率高,严重危害猫的健康。fipv属于猫冠状病毒(feline coronavirus,fcov),是一种有包膜的单股正链rna病毒。猫传染性腹膜炎病毒主要编码刺突蛋白、膜蛋白、包膜蛋白和核衣壳蛋白4种结构蛋白。研究表明,冠状病毒的核衣壳蛋白(nucleocapsid protein,n蛋白)作为免疫原性最强的蛋白,其对应的抗体是最早产生的,所以n蛋白常被用来作为早期诊断的指标。猫冠状病毒分为胃肠炎型(fecv)和传染性腹膜炎型(fipv)两种,fecv存在于大多数健康猫肠道内,通常不致死,只引起猫轻微的肠道症状。fipv主要感染单核细胞,具有很强的致病性,能引起猫的致死性腹膜炎。猫传染性腹膜炎的诊断分为临床诊断和实验室诊断。临床诊断依赖于临床症状的表现以及诊断者的经验,而患猫传染性腹膜炎的猫初期症状不明显,病程进展有较大差异,易导致诊断结果不准确,往往因误诊而贻误最佳治疗时机,最终导致病猫死亡。实验室诊断包括病理学检查、血清学检测和rt-pcr检测等。rt-pcr检测虽然成本低、易于操作,但灵敏度较低,fipv感染的早期阶段,病毒在腹腔液中含量极少,rt-pcr检测容易导致漏检,不能准确检测出fipv。此外,由于其扩增产物需通过凝胶电泳分析,极易产生交叉污染,也比较容易出现假阳性结果,并且该实验时间也相对较长。实时荧光定量pcr技术由于其灵敏度高、速度快、特异性强且操作简便而被广泛应用于定性和定量检测等方面。实时荧光定量pcr技术是一种在pcr体系中加入荧光基团,利用荧光信号积累实时监测整个pcr进程,最后通过标准曲线对未知模板进行定量分析的方法。目前较常用的实时荧光定量pcr为sybr greenⅰ荧光定量pcr和taqman探针荧光定量pcr,sybr greenⅰ由于能够结合所有dsdna双螺旋小沟区域,致使检测的特异性不如taqman水解探针法强。
3.目前国内尚未见用taqman探针实时荧光定量rt-pcr技术对猫传染性腹膜炎病毒进行定量检测试剂盒的报道。因此,为了进一步提高检测的灵敏度,实现临床样本中猫传染性腹膜炎病毒的定量检测,为猫传染性腹膜炎的早期诊断提供技术手段,也为猫传染性腹膜炎的防控和净化奠定基础,制造猫传染性腹膜炎病毒的taqman探针实时荧光定量pcr检测试剂盒具有重要意义,市场前景广阔。
技术实现要素:
4.本发明提供了猫传染性腹膜炎病毒荧光定量rt-pcr检测试剂盒。
5.猫传染性腹膜炎病毒荧光定量rt-pcr检测试剂盒,该试剂盒包括猫传染性腹膜炎病毒n基因的保守区域片段纯化产品,所述的保守区域片段为atggccacacagggacaacgcgtcaactggggagatgaaccttccaaaagacgtggtcgttctaactctcgtggtcggaagaatagtaatatacct。
6.本发明的试剂盒包括猫传染性腹膜炎病毒荧光定量rt-pcr检测的特异性引物和taqman探针;其中,正向引物的序列为:5
’‑
cacagggacaacgcgtcaa-3’,反向引物的序列为:5
’‑
cgaccacgagagttagaacga-3’;所述taqman探针的序列为:5
’‑
tggggagatgaaccttccaaaagacgt-3’。
7.本发明的试剂盒包括说明书,该说明书记载有以下内容:所述的荧光定量rt-pcr反应体系总体积为20μl,包括:2 x rt-pcr buffer 10μl、25 x rt-pcr enzyme mix 1μl、正向引物(10pmol/μl)0.4μl、反向引物(10pmol/μl)0.4μl、taqman探针(10μmol/μl)0.2μl、50 x rox 0.4μl、模板1~5μl,用ddh20补充总体积至20μl。
8.本发明的试剂盒包括说明书,该说明书记载有以下内容:所述的荧光定量rt-pcr反应条件如下:55℃,15min;95℃,30s;95℃,10s,60℃,30s,共45个循环,在每个循环的延伸结束时进行荧光信号检测。
9.本发明所提供的特异性引物和taqman探针是根据猫传染性腹膜炎病毒n基因的保守区域设计的,用以定量检测样本中猫传染性腹膜炎病毒的核酸拷贝数。
10.所述taqman探针为经过荧光标记的,其5’端标记有报告荧光基团,3’端标记有淬灭荧光基团。
11.所述报告荧光基团为fam,淬灭荧光基团为tamra。
12.使用本发明试剂盒还包括荧光定量pcr标准曲线的建立,方法为:用含有目的片段的重组质粒作为标准品,将其10倍系列稀释成
①
:3.4
×
108copies/μl;
②
:3.4
×
107copies/μl;
③
:3.4
×
106copies/μl;
④
:3.4
×
105copies/μl;
⑤
:3.4
×
104copies/μl;
⑥
:3.4
×
103copies/μl;
⑦
:3.4
×
102copies/μl;
⑧
:3.4
×
101copies/μl。将标准重组质粒作为模板进行实时荧光定量rt-pcr检测,得到用于猫传染性腹膜炎病毒检测的荧光定量pcr标准曲线。
13.本发明的有益效果为:
14.1、本发明为国内首次建立的猫传染性腹膜炎病毒taqman探针荧光定量rt-pcr检测试剂盒;通过特性试验表明:使用该试剂盒对猫传染性腹膜炎病毒进行检测,检测灵敏度高,最小核酸检出量为3.4x101copies/μl;使用该试剂盒对猫传染性腹膜炎病毒进行检测,具有较高的特异性,与狂犬病毒、猫疱疹病毒、杯状病毒、猫细小病毒、犬流感病毒、犬瘟热病毒均无交叉反应;使用该试剂盒对猫传染性腹膜炎病毒进行检测,具有很好的可稳定性,批内和批间试验变异系数均小于5%。
15.2、使用本试剂盒与猫传染性腹膜炎病毒的其它检测方法如病毒的分离培养鉴定、rt-pcr相比,具有取样便捷,灵敏度较高,检测效率高,能有效防止污染的特点。
16.3、本试剂盒具有操作程序简单易用的特点,操作程序化,适合大面积推广和应用。
17.4.使用本试剂盒不仅能够评价猫传染性腹膜炎病毒感染状况,也可为猫传染性腹膜炎病毒的流行病学、致病机理等相关领域的研究提供依据。
18.下面结合附图和具体实施例对本发明做进一步阐述。
附图说明
19.图1 puc57-fipv-n质粒图。
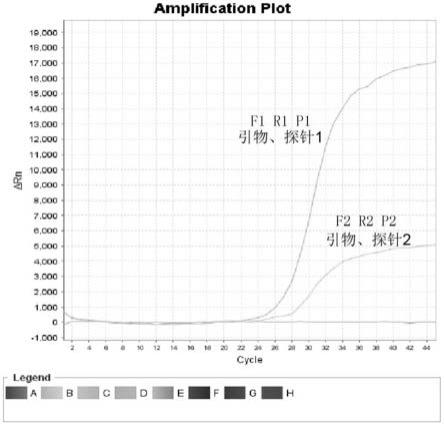
20.图2引物探针筛选结果图。
21.图3探针浓度筛选结果图。
22.图4实施例中荧光定量rt-pcr标准曲线示意图。
23.图5实施例中荧光定量rt-pcr灵敏性检测的荧光信号图。其中,图中扩增曲线从左到右标准品浓度依次为3.4
×
108copies/μl、3.4
×
107copies/μl、3.4
×
106copies/μl、3.4
×
105copies/μl、3.4
×
104copies/μl、3.4
×
103copies/μl、3.4
×
102copies/μl、3.4
×
101copies/μl。
24.图6实施例中荧光定量rt-pcr特异性检测的荧光信号图。
具体实施方式
25.应理解,下述实施例仅用于说明本发明而不用于限制本发明的范围。下述实施例中所使用的实验如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
26.实施例1:
27.根据猫传染性腹膜炎病毒的n基因全序列设计四组引物和taqman探针,如下:
28.f3:5
’‑
agaagcctgaggaattgtctgt-3’(seq id no:8)
29.r3:5
’‑
tcgtaacctcatcaatcatctca-3’(seq id no:9)
30.p3:5
’‑
(fam)cacagatgtgtttgatgacacacaggt-3’(tamra)(seq id no:10)
31.f4:5
’‑
ccaacaacacttggcactcg-3’(seq id no:11)
32.r4:5
’‑
ccagcttcttcagcagacca-3’(seq id no:12)
33.p4:5
’‑
(fam)cgttgccaatggtaacgctgcc-3’(tamra)(seq id no:13)
34.f5:5
’‑
ttgtcagaggccagcgtaag-3’(seq id no:14)
35.r5:5
’‑
ttccacgagtgccaagtgtt-3’(seq id no:15)
36.p5:5
’‑
(fam)gggttgcaagggatggagcca-3’(tamra)(seq id no:16)
37.f6:5
’‑
cggtctaactctcgtggtcg-3’(seq id no:17)
38.r6:5
’‑
aagttccttacgctggcctc-3’(seq id no:18)
39.p6:5
’‑
(fam)acagacaggtgcgttaccgca-3’(tamra)(seq id no:19)
40.经荧光定量rt-pcr检测,上述四组引物和taqman探针检测猫传染性腹膜炎病毒感染大量临床阳性样品,不能达到检测样品的全覆盖,均无良好的预期结果。
41.实施例2:
42.寻找猫传染性腹膜炎病毒的n基因保守区域;设计合成引物和taqman探针
43.根据genbank公布的猫传染性腹膜炎病毒的n基因序列(ab086903.1,fj917524.1,a22378.1,fj917535.1,ab0866881.1,fj943764.1,fj917533.1,fj917532.1,fj917530.1,fj917529.1),分析其保守区域,得到猫传染性腹膜炎病毒n基因的特异性保守序列(seq id no:1):
44.atggccacacagggacaacgcgtcaactggggagatgaaccttccaaaagacgtggtcgttctaactctcgtggtcggaagaatagtaatatacct。
45.针对该保守序列进行引物设计,得到两对特异性引物和两条taqman探针,探针5’端荧光报告基团为fam,3’端的荧光淬灭基团为tamra。
46.特异性检测引物和taqman探针均由宝日医生物技术有限公司合成。
47.引物和探针位于猫传染性腹膜炎病毒n基因的保守区域,目的扩增片段为96bp。引物和探针序列如下:
48.f1:5
’‑
cacagggacaacgcgtcaa-3’;(seq id no:2)
49.r1:5
’‑
cgaccacgagagttagaacga-3’;(seq id no:3)
50.p1:5
’‑
fam-tggggagatgaaccttccaaaagacgt-tamra-3’(seq id no:4)
51.f2:5
’‑
atggccacacagggacaac-3’;(seq id no:5)
52.r2:5
’‑
acgagagttagaacgaccacg-3’;(seq id no:6)
53.p2:5
’‑
fam-gcgtcaactggggagatgaacct-tamra-3’(seq id no:7)
54.实施例3:
55.定量标准质粒的构建和制备
56.1、定量标准质粒的构建
57.根据设计的pcr引物,利用dna重组技术将包含目的扩增片段的基因克隆到质粒载体puc57中,并进行dna序列测定。构建的重组质粒作为检测猫传染性腹膜炎病毒的定量标准质粒,命名为puc57-fipv-n(图1)。重组质粒由擎科生物公司提供合成。
58.2、定量标准质粒的制备
59.标准质粒puc57-fipv-n用碱裂法进行提取纯化,经微量核酸蛋白分析仪测定浓度,用公式计算拷贝数(拷贝数=6.02
×
10
23
×
dna浓度/质量mw,mw=dna碱基数
×
330),经计算,标准质粒拷贝数为3.4x10
11
copies/μl,-20℃保存。
60.实施例4:
61.taqman探针荧光定量rt-pcr方法的建立和优化
62.1、绝对定量标准曲线的建立
63.(1)标准质粒制备
64.标准质粒puc57-fipv-n用碱裂法进行提取纯化,经微量核酸蛋白分析仪测定浓度,用公式计算拷贝数(拷贝数=6.02
×
10
23
×
dna浓度/质量mw,mw=dna碱基数
×
330),经计算,标准质粒拷贝数为3.4x10
11
copies/μl,-20℃保存。
65.(2)定量rt-pcr反应条件优化
66.对反应体系中不同pcr引物、taqman探针等实验结果进行比较,选择反应灵敏度高,本底荧光信号低、具有典型s型扩增曲线,反应效率接近1的反应体系(图2、图3)。本发明使用的荧光定量pcr仪为abi stepone plus reat-time pcr system。荧光定量rt-pcr检测程序(表1)设置在扩增阶段每个循环第二步结束时检测荧光信号。
67.表1 荧光定量pcr反应条件
[0068][0069]
表2 反应体系的筛选
[0070]
试剂浓度选择定量rt-pcr引物(上下游)各10pmol/μltaqman探针2μmol/μl,5μmol/μl,10μmol/μl
[0071]
表3 经优化后的荧光定量pcr反应体系(20μl反应体系)
[0072][0073][0074]
(3)荧光定量rt-pcr标准曲线的建立
[0075]
用灭菌双蒸水将含有目的片段的标准质粒puc57-fipv-n进行10倍系列稀释成
①
:3.4
×
108copies/μl;
②
:3.4
×
107copies/μl;
③
:3.4
×
106copies/μl;
④
:3.4
×
105copies/μl;
⑤
:3.4
×
104copies/μl;
⑥
:3.4
×
103copies/μl;
⑦
:3.4
×
102copies/μl;
⑧
:3.4
×
101copies/μl。每个稀释度重复平行试验3次。
[0076]
采用经优化的反应体系进行反应,反应条件为:55℃,15min;95℃,30s;95℃,10s,60℃,30s,共45个循环。在每个循环的延伸阶段结束时收集荧光信号进行实时检测。
[0077]
检测结束后利用计算机软件自动生成以起始模板数对数为x轴,ct值为y轴的标准曲线(图4)。
[0078]
对图4所示的检测标准曲线进行分析可见,模板的8个稀释点均在同一条直线上,表明本检测方法在3.4
×
10
1-3.4
×
108copies/reaction范围内具有良好的线性关系。回归分析显示,r2=0.9989,荧光定量rt-pcr反应的扩增效率为100.5%。其检测范围可达8个数量级(图5),其灵敏度可到3.4
×
101copis/μl。可见本发明设计的引物和taqman探针的灵敏度高。
[0079]
2、荧光定量rt-pcr的特异性分析
[0080]
利用本发明建立的实时定量rt-pcr检测方法,分别检测1份经rt-pcr、测序检测呈猫传染性腹膜炎病毒阳性的猫腹水,狂犬病毒疫苗株(rv),猫疱疹病毒疫苗株(fhv),杯状病毒疫苗株(fcv),猫细小病毒疫苗株(fpv),犬流感病毒(civ),犬瘟热病毒疫苗株(cdv),评价该方法的特异性。
[0081]
结果显示只有阳性的猫腹水呈阳性反应,其它病毒均呈阴性(图6)。结果表明,本发明建立的猫传染性腹膜炎病毒的n基因taqman探针荧光定量rt-pcr检测方法扩增效果良
好,特异性强。
[0082]
3、荧光定量rt-pcr的稳定性
[0083]
选取3.4x108copies/μl、3.4x106copies/μl、3.4x104copies/μl、3.4x102copies/μl4个浓度的标准质粒作为模板,按照建立的荧光定量rt-pcr检测方法进行检测,每份样本重复平行试验3次,分三个批次进行,试验结果取ct平均值,通过统计计算ct标准差(sd)、ct变异系数(cv),评价建立方法的稳定性。稳定性试验结果(表4)显示无论是批内还是批间ct值变异系数均小于5%,说明本发明构建的检测方法具有良好的稳定性。
[0084]
表4 荧光定量rt-pcr稳定性试验结果
[0085][0086]
4、检测结果判定及病毒的定量
[0087]
(1)阳性对照c
t
值小于35,阴性对照无c
t
值并且无典型的s型扩增曲线。阳性模板为质粒定量标准品puc57-fipv-n,阴性对照为无菌双蒸水;
[0088]
(2)若c
t
值小于40,且呈现典型的s型扩增曲线,则判断为阳性结果,表明检测样品中含有fip病毒核酸;
[0089]
(3)若c
t
值大于40或无扩增信号,则判断为阴性结果,表明检测样品中无fip病毒核酸;
[0090]
(4)若c
t
值在40-45之间,则视为可疑结果,样本需重复检测一次,若检测结果仍在此范围内,则判断为阴性结果。
[0091]
(5)阳性样品的病毒定量,根据建立的定量标准曲线计算其病毒含量。
[0092]
计算公式为:y=10
(-3.3083x 38.445)
[0093]
y:样品中病毒cdna拷贝数;x:样品c
t
值。
[0094]
以上所述的仅是本发明的部分具体实施例(由于本发明包含数值相关内容,故实施例不能穷举),方案中公知的具体内容或常识在此未作过多描述。应当指出,上述实施例不以任何方式限制本发明,对于本领域的技术人员来说,凡是采用等同替换或等效变换的方式获得的技术方案均落在本发明的保护范围内。本技术要求的保护范围应当以其权利要
求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
