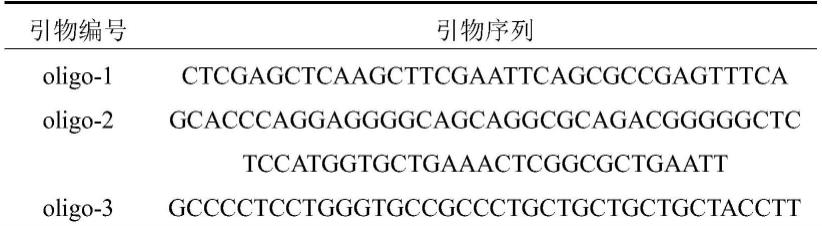
氯喹在增效替莫唑胺治疗ptrf高表达的胶质母细胞瘤中的应用
技术领域
1.本发明属于生物医药技术领域,具体地,本发明涉及氯喹在增效替莫唑胺治疗ptrf高表达的胶质母细胞瘤中的应用。
背景技术:
2.胶质母细胞瘤(glioblastoma,gbm)是成人中枢神经系统最常见和最致命的原发性脑肿瘤。胶质母细胞瘤呈侵袭性生长、手术切除困难、并且复发率和致死率都极高,是当今神经外科领域的国际性难题。针对胶质母细胞瘤,目前治疗方式强调最大程度手术切除联合放射治疗和化学治疗等综合治疗策略,尽管如此,患者生存预后极差,中位生存期仅约15个月。由于胶质瘤浸润性生长模式,手术切除只能在肉眼可见的范围内进行切除,但脑部精微结构要求在不扩大切除范围的基础上尽可能的将胶质瘤切除干净;且放疗易引发相关不良反应,如恶心、呕吐、脱发等,严重影响患者的身体健康。
3.替莫唑胺(temozolomide,tmz)是一种口服烷化剂,能透过血脑屏障直达病灶,是临床上化疗脑胶质瘤的一线常用药物之一。tmz通过攻击肿瘤细胞的dna,致使dna烷基化受损,损伤的部位主要在n7、n3、o6位的鸟嘌呤以及o3位腺嘌呤上,dna烷基化受损以后会产生交联,从而诱导癌细胞死亡,可以极大延长患者的生存期。但有研究表明,用tmz治疗人脑胶质瘤的有效率约为45%,其治疗效果受到获得性耐药的限制,且其中涉及的治疗机制尚不明确。可见胶质瘤对tmz产生耐药是导致化疗失败的最主要原因。因此,发现可以评价替莫唑胺治疗预后的分子标志物及减轻替莫唑胺耐药尤为重要。
4.聚合酶ⅰ和转录释放因子(polymeraseⅰand transcript release factor,ptrf),也称为cavin-1,参与小凹(caveolae)的形成和分泌。相关研究学者经研究表明,caveolae在许多生理过程中发挥了重要作用,例如细胞信号,内吞作用,脂质和胆固醇稳态和细胞迁移。发明人之前的研究阐明了ptrf介导了外泌体的分泌,参与了胶质瘤细胞之间的通信。此外,还有报道显示外泌体可以携带rna,蛋白和药物,并向受体细胞传递许多分子信息。ptrf存在于细胞膜表面,与胞膜小泡转运,胆固醇平衡和脂类分解的调控有关。ptrf突变与人类先天性全身性脂肪代谢障碍有关。但是,目前本领域关于ptrf对胶质母细胞瘤中tmz耐药的研究尚不清楚。
5.氯喹(chloroquine,cq)在临床上作为一线抗疟药物被人们所熟知已近70年,而现在氯喹更被广泛用作自噬抑制剂,氯喹及其衍生物羟氯喹是获美国食品药品监督管理局(food and drug administration,fda)批准的唯一可用于临床的自噬抑制剂。氯喹可以增加溶酶体的ph值,而且可以阻止溶酶体与自噬体的融合。由于抑制内吞作用,氯喹已被用于治疗多种病毒感染。众所周知,cq具有起效快,半衰期长,毒性小,血脑屏障的高渗透性和人体易耐受性等特点,氯喹作为临床常用药物,因此氯喹的临床安全性毋庸置疑,这也为临床使用氯喹治疗胶质瘤提供了保障。迄今为止,尚未有氯喹在增效替莫唑胺治疗ptrf高表达的胶质瘤中的应用的相关报道。
技术实现要素:
6.鉴于此,为了解决目前本领域存在的由于胶质瘤对tmz产生耐药而导致化疗失败等问题,本发明提供了氯喹在增效替莫唑胺治疗ptrf高表达的胶质母细胞瘤中的应用。
7.本发明的上述目的通过以下技术方案得以实现:
8.本发明的第一方面提供了一种检测分子标志物ptrf的试剂盒。
9.进一步,所述试剂盒包括检测胶质母细胞瘤受试者样本中分子标志物ptrf表达水平的试剂;
10.优选地,所述试剂包括检测分子标志物ptrf mrna表达水平的试剂、检测分子标志物ptrf蛋白表达水平的试剂;
11.更优选地,所述试剂包括特异性扩增分子标志物ptrf的引物、特异性识别分子标志物ptrf的探针和/或特异性结合分子标志物ptrf编码的蛋白的结合剂;
12.最优选地,所述结合剂包括抗体、抗体片段、亲和性蛋白、肽、肽模拟物、核酸适配体、镜像l-rna适体、锚蛋白重复蛋白和/或kunitz型域;
13.优选地,所述胶质母细胞瘤受试者样本中分子标志物ptrf的表达水平高于健康对照者样本中分子标志物ptrf的表达水平时,采用先替莫唑胺后氯喹的联合治疗方法;
14.更优选地,所述ptrf高表达的胶质母细胞瘤受试者中ptrf通过增加细胞外囊泡的分泌降低细胞内替莫唑胺的浓度,产生替莫唑胺耐药;
15.更优选地,所述替莫唑胺和氯喹联合通过增加细胞内替莫唑胺的浓度减轻替莫唑胺的耐药;
16.更优选地,所述样本选自血液或组织。
17.进一步,所述检测分子标志物ptrf mrna表达水平的试剂还包括以下方法中使用到的试剂:基于pcr的定量检测方法、southern杂交、northern杂交、点杂交、荧光原位杂交(fish)、dna微阵列、aso法、高通量测序平台。
18.进一步,所述检测分子标志物ptrf蛋白表达水平的试剂还包括以下方法中使用到的试剂:蛋白质印迹(western blot法)、酶联免疫吸附测定(elisa)、放射性免疫测定(ria)、夹心测定、免疫组织化学染色、质谱法、免疫沉淀分析法、补体结合分析法、流式细胞荧光分边技术和蛋白质芯片。
19.进一步,所述试剂盒包括qpcr试剂盒、elisa试剂盒、免疫印迹检测试剂盒、免疫层析检测试剂盒、免疫组化检测试剂盒、流式细胞分析试剂盒、电化学发光检测试剂盒。
20.进一步,所述试剂盒中还包括ptrf mrna表达水平辅助检测试剂、ptrf蛋白表达水平辅助检测试剂、ptrf mrna表达水平辅助检测仪器、ptrf蛋白表达水平辅助检测仪器;
21.优选地,所述ptrf mrna表达水平辅助检测试剂包括但不限于:使所述引物对应的扩增子可视化的反应试剂,例如通过琼脂糖凝胶电泳法、酶联凝胶法、化学发光法、原位杂交法、荧光检测法等使扩增子可视化的试剂;rna提取试剂;逆转录试剂;cdna扩增试剂;制备标准曲线所用的标准品;阳性对照品;阴性对照品。
22.优选地,所述ptrf蛋白表达水平辅助检测试剂包括但不限于:封闭液、抗体稀释液、洗涤缓冲液、显色终止液、制备标准曲线的标准品。
23.进一步,所述试剂盒中还包括使用说明书,所述使用说明书上记载了如何对胶质母细胞瘤受试者的样本进行ptrf表达水平的检测。
24.进一步,所述抗体包括单克隆抗体、多克隆抗体;
25.优选地,所述抗体包括完整的抗体分子、抗体的任何片段或带有修饰的抗体,具体地,所述抗体包括嵌合抗体、scfv、fab、f(ab’)2、fv等。只要所述片段能够保留与蛋白的结合能力即可。用于检测蛋白表达水平的抗体的制备是本领域技术人员公知的,并且本发明可以使用任何方法来制备所述抗体。
26.此外,本发明还提供了用于检测分子标志物ptrf的芯片。
27.进一步,所述芯片包括检测分子标志物ptrf表达水平的探针;
28.优选地,所述芯片上还包括内参探针;
29.优选地,所述内参包括gapdh或β-actin;
30.优选地,所述芯片包括蛋白芯片和/或基因芯片;
31.更优选地,所述蛋白芯片为用于检测胶质母细胞瘤受试者样本中分子标志物ptrf蛋白表达水平的芯片;
32.更优选地,所述基因芯片为用于检测胶质母细胞瘤受试者样本中分子标志物ptrf mrna表达水平的芯片;
33.最优选地,所述样本选自血液或组织。
34.本发明的第二方面提供了检测分子标志物ptrf的试剂盒在胶质母细胞瘤患者个性化用药指导中的应用;
35.优选地,所述胶质母细胞瘤患者样本中分子标志物ptrf的表达水平高于健康对照者样本中分子标志物ptrf的表达水平时,采用先替莫唑胺后氯喹的联合治疗方法;
36.更优选地,所述ptrf高表达的胶质母细胞瘤受试者中ptrf通过增加细胞外囊泡的分泌降低细胞内替莫唑胺的浓度,产生替莫唑胺耐药;
37.更优选地,所述替莫唑胺和氯喹联合通过增加细胞内替莫唑胺的浓度减轻替莫唑胺的耐药;
38.更优选地,所述样本选自血液或组织。
39.在本发明的具体实施例中,本发明通过细胞实验和动物实验验证发现,ptrf能够增强胶质母细胞瘤对替莫唑胺的耐药性,ptrf通过增加细胞外囊泡的分泌(即通过外泌体将替莫唑胺泵出细胞外)降低细胞内替莫唑胺浓度,进而增强了胶质母细胞瘤对替莫唑胺的耐药性,此外,令人惊讶地发现本发明所述的替莫唑胺联合氯喹可通过增加细胞内替莫唑胺浓度减轻胶质母细胞瘤对替莫唑胺的耐药性,进而提高了替莫唑胺对ptrf高表达胶质母细胞瘤的治疗疗效。
40.本发明的第三方面提供了一种用于治疗ptrf高表达的胶质母细胞瘤的药物组合物。
41.进一步,所述药物组合物包含替莫唑胺、氯喹;
42.优选地,所述药物组合物包括两层结构,分别为外层结构和内层结构;
43.更优选地,所述外层结构为替莫唑胺;
44.更优选地,所述内层结构为氯喹;
45.最优选地,所述药物组合物在受试者体内先释放替莫唑胺再释放氯喹。
46.进一步,所述药物组合物还包括药学上可接受的载体和/或辅料。
47.进一步,所述载体和/或辅料包括药学上可接受的载体、稀释剂、填充剂、结合剂及
其它赋形剂,这依赖于给药方式及所设计的剂量形式。本领域技术人员已知的治疗惰性的无机或有机的载体包括但不限于:乳糖、玉米淀粉或其衍生物、滑石、植物油、蜡、脂肪、多羟基化合物(例如聚乙二醇、水、蔗糖、乙醇、甘油),各种防腐剂、润滑剂、分散剂、矫味矫臭剂、湿润剂、甜味剂、香味剂、乳化剂、悬浮剂、保存剂、抗氧化剂、着色剂、稳定剂、盐、缓冲液,诸如此类的也可加入其中,适合的药学上可接受的载体和/或辅料在remington'spharmaceutical sciences(19th ed.,1995)中有详细的记载。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味,在这种药物组合物中可以使用的制剂可以是其原始化合物本身的形式,或任选地使用其药物学可接受的盐的形式。如此配制的药物组合物根据需要可选择本领域技术人员已知的任何适当的方式把药物进行给药,使用药物组合物时,是将安全有效量的本发明的药物施用于人。
48.进一步,所述药物组合物的适合的给药剂量根据制剂化方法、给药方式、患者的年龄、体重、性别、病态、饮食、给药时间、给药途径、排泄速度及反应灵敏性之类的因素而可以进行多种处方,熟练的医生通常能够容易地决定处方及处方对所希望的治疗有效的给药剂量。
49.此外,本发明还提供了本发明第三方面所述的药物组合物在制备用于治疗胶质母细胞瘤产品中的应用;
50.优选地,所述产品包括药物制剂、联合用药物。
51.本发明的第四方面提供了氯喹在制备用于治疗替莫唑胺耐药性的药物中的应用;
52.优选地,所述对替莫唑胺产生耐药性者为ptrf高表达的胶质母细胞瘤患者。
53.进一步,所述药物包含氯喹;
54.优选地,所述药物在受试者体内先释放替莫唑胺再释放氯喹。
55.进一步,所述药物还包括如前所述的药学上可接受的载体和/或辅料。
56.本发明的第五方面提供了氯喹在制备用于提高替莫唑胺对胶质母细胞瘤治疗疗效的药物中的应用;
57.优选地,所述胶质母细胞瘤为ptrf高表达的胶质母细胞瘤。
58.进一步,所述药物包含氯喹。
59.进一步,所述药物还包括如前所述的药学上可接受的载体和/或辅料。
60.本发明的第六方面提供了分子标志物ptrf在评估胶质母细胞瘤患者替莫唑胺治疗的疗效中的应用。
61.在本发明的具体实施例中,本发明通过数据分析和实验验证发现,分子标志物ptrf在替莫唑胺治疗预后差的胶质母细胞瘤患者中高表达,且ptrf的表达水平与替莫唑胺治疗后的胶质母细胞瘤患者的总生存期呈显著负相关,进一步的实验验证表明ptrf通过增加细胞外囊泡的分泌(即通过外泌体将替莫唑胺泵出细胞外)降低细胞内替莫唑胺浓度,进而增强了胶质母细胞瘤对替莫唑胺的耐药性,而敲除ptrf能够显著提高替莫唑胺在胶质母细胞瘤小鼠模型中的治疗疗效。
62.本发明的第七方面提供了一种胶质母细胞瘤患者替莫唑胺治疗疗效评估和个性化用药指导的方法。
63.进一步,所述方法包括如下步骤:
64.(1)获取胶质母细胞瘤受试者样本;
65.(2)检测胶质母细胞瘤受试者样本中分子标志物ptrf表达水平;
66.(3)所述胶质母细胞瘤受试者样本中分子标志物ptrf的表达水平高于健康对照者样本中分子标志物ptrf的表达水平时,该受试者对替莫唑胺耐药,经评估得到的对替莫唑胺耐药的受试者采用先替莫唑胺后氯喹的联合治疗方法能够使受试者获益;
67.优选地,所述ptrf高表达的胶质母细胞瘤受试者中ptrf通过增加细胞外囊泡的分泌降低细胞内替莫唑胺的浓度,产生替莫唑胺耐药;
68.更优选地,所述替莫唑胺和氯喹联合通过增加细胞内替莫唑胺的浓度减轻替莫唑胺的耐药使受试者获益;
69.更优选地,所述样本选自血液或组织。
70.本发明的第八方面提供了一种胶质母细胞瘤患者替莫唑胺治疗疗效评估和个性化用药指导的预测系统。
71.进一步,所述系统包括如下单元:
72.(1)被配置为接收数据输入的至少一个存储器单元,该数据输入包含胶质母细胞瘤受试者样本中分子标志物ptrf的表达水平、健康对照者样本中分子标志物ptrf的表达水平;
73.(2)与所述至少一个存储器单元可操作地耦合的计算机处理器,其中所述计算机处理器被编程为可执行程序,可执行程序用于实现本发明第七方面所述的方法。
74.本发明的第九方面提供了一种胶质母细胞瘤患者替莫唑胺治疗疗效评估和个性化用药指导的预测装置。
75.进一步,所述装置包括处理器、存储器以及存储在所述存储器中且被配置为由所述处理器执行的计算机程序;
76.优选地,所述处理器在执行所述计算机程序时实现本发明第七方面中所述的方法。
77.本发明的第十方面提供了一种计算机可读存储介质。
78.进一步,所述计算机可读存储介质包括存储的计算机程序;
79.优选地,在所述计算机程序运行时控制所述计算机可读存储介质实现本发明第七方面中所述的方法。
80.相对于现有技术,本发明具有的优点和有益效果:
81.本发明通过数据分析、细胞实验验证和动物实验验证发现,ptrf能够增强胶质母细胞瘤对替莫唑胺的耐药性。ptrf通过增加细胞外囊泡的分泌降低细胞内替莫唑胺浓度,进而增强了胶质母细胞瘤对替莫唑胺的耐药性,而氯喹可通过增加细胞内替莫唑胺的浓度减轻胶质母细胞瘤对替莫唑胺的耐药性,进而提高替莫唑胺对ptrf高表达胶质母细胞瘤的治疗疗效,这一首次发现为胶质母细胞瘤的治疗提供了新的思路,临床应用前景广阔。
附图说明
82.以下,结合附图来详细说明本发明的实施方案,其中:
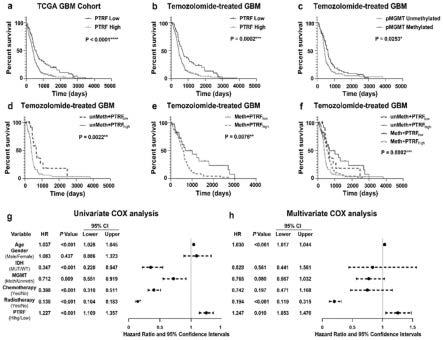
83.图1为tcga数据库分析结果图,其中,a图:通过tcga数据库分析,ptrf表达水平与胶质母细胞瘤患者总生存期呈负相关,b图:通过tcga数据库分析,ptrf表达水平与替莫唑
胺治疗后的胶质母细胞瘤患者总生存期呈负相关,c图、d图、e图和f图:通过tcga数据库分析,ptrf对替莫唑胺治疗的胶质母细胞瘤患者的预后是独立于mgmt,g图和h图:单因素与多因素回归分析显示ptrf表达水平与胶质瘤患者有很高的相关性;
84.图2为ptrf对替莫唑胺耐药影响的结果图,其中,a图:蛋白印迹显示u87,u87-ptrf和u87 ptrf
ko
组ptrf表达情况,n=3每个组,b图:测定u87,u87-ptrf
ko-ptrf,u87-ptrf
ko-ptrf gw4869组给予tmz处理后细胞存活率,n=7每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,c图:蛋白印迹显示tbd0220,tbd0220-siptrf,tbd0220-ptrf组的ptrf表达,n=3每个组,d图:测定tbd0220,tbd0220-siptrf,tbd0220-ptrf,tbd0220-ptrf gw4869组给予tmz处理后细胞存活率,n=7每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,e图:在u87细胞中进行菌落形成测定,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,f图:在tbd0220细胞中进行菌落形成测定,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,g图:蛋白印迹分析在u87,u87-ptrf
ko
,u87-ptrf
ko-ptrf,u87-ptrf
ko-ptrf gw4869组细胞进行200μm tmz处理后bax、bcl-2、caspase3、caspase7和r-h2ax的蛋白表达,h图:免疫荧光显示在u87,u87-ptrf
ko
,u87-ptrf
ko-ptrf,u87-ptrf
ko-ptrf gw4869组细胞给予200μm tmz治疗后tunel、r-h2ax的表达,标尺=20μm;
85.图3为ptrf降低细胞内替莫唑胺浓度的机制研究结果图,其中,a图:扫描电镜观察u87、u87-ptrf
ko
、u87-ptrf
ko-ptrf,u87-ptrf
ko-ptrf gw4869组细胞的细胞外囊泡,b图:统计u87,u87-ptrf
ko
,u87-ptrf
ko-ptrf,u87-ptrf
ko-ptrf gw4869细胞中细胞外囊泡数量,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,c图:透射电镜观察u87,u87-ptrf
ko
,u87-ptrf
ko-ptrf,u87-ptrf
ko-ptrf gw4869细胞小凹,d图:细胞外囊泡提取及hplc测tmz浓度模式图,e图:蛋白印迹分析细胞外囊泡中cd63、alix、cd81、cd9、tsg101的蛋白质表达水平,n=3每个组,f图和g图:通过hplc分析细胞内、外泌体、微囊泡、上清液中的tmz浓度,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001;
86.图4为敲除ptrf对替莫唑胺在原位异种种植胶质瘤小鼠中的治疗效果影响的结果图,其中,a图:gbm原位异种种植胶质瘤模型的示意图,b图:在肿瘤植入后7、14、21和28天监测肿瘤生长的生物发光图像,每组n=6,c图和d图:通过量化成像信号强度定量小鼠肿瘤生长曲线,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,e图和f图:kaplan-meier显示裸鼠的生存曲线,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,g图和h图:小鼠重量随着时间的变化,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,i图:he染色用于显示裸鼠的肿瘤体积大小,j图:免疫组化染色脑肿瘤样品中的ki67,标尺=50μm,k图:免疫荧光测定脑肿瘤中r-h2ax的表达,标尺=50μm;
87.图5为替莫唑胺联合氯喹序贯疗法减轻替莫唑胺耐药的机制研究结果图,其中,a图和b图:u87和tbd0220细胞中菌落形成的结果图,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,c图:蛋白印迹显示u87和tbd0220细胞中用200μm tmz或25μm cq处理后bax、bcl-2、caspase3、caspase7、cyclinb、p-cdc2和r-h2ax蛋白表达情况,n=3每个组,d图:流式细胞术测定u87和tbd0220细胞用200μm tmz或25μm cq处理后细胞的凋亡率,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****
p《0.0001,e图:流式细胞术测定u87和tbd0220细胞用200μmtmz或25μm cq处理后细胞的周期变化,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,f图:蛋白印迹显示u87和tbd0220细胞中用200μm tmz联合25μm cq不同序贯方法处理后bax、bcl-2、caspase3、caspase7和r-h2ax蛋白表达情况,n=3每个组,g图:流式细胞术测定u87和tbd0220细胞用用200μm tmz联合25μm cq不同序贯方法处理后细胞的凋亡率,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,h图:蛋白印迹显示u87细胞用cq处理后细胞ptrf和caveolin1表达情况,i图:透射电镜观察u87细胞ctrl、cq后细胞外囊泡的形态,j图:蛋白印迹分析u87细胞ctrl、cq组细胞外囊泡中cd63、cd81、cd9的蛋白质表达,n=3每个组,k图:通过lc-ms分析细胞tmz浓度,n=3每个组,数据表示平均值
±
sd,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,l图:替莫唑胺联合氯喹序贯疗法增加细胞内替莫唑胺浓度示意图;
88.图6为替莫唑胺氯喹序贯治疗对在原位异种种植胶质瘤小鼠中替莫唑胺治疗疗效影响的结果图,其中,a图:在肿瘤植入后第7、14、21和28天监测ctrl、cq、tmz组小鼠肿瘤生长的生物发光图像,每组n=6,b图:kaplan-meier显示ctrl,cq,tmz组小鼠的生存曲线,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,c图:ctrl、cq、tmz组小鼠的体重变化曲线,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,d图:he染色ctrl、cq、tmz组小鼠的肿瘤体积大小的结果图,e图:免疫组化染色ctrl、cq、tmz组小鼠脑肿瘤样品中的ki67,标尺=50μm,f图:免疫荧光测定ctrl、cq、tmz组小鼠脑肿瘤中r-h2ax的表达,标尺=50μm,g图:在肿瘤植入后第7、14、21和28天监测cq tmz、cq-tmz、tmz cq组小鼠肿瘤生长的生物发光图像,每组n=6,h图:cq tmz、cq-tmz、tmz cq组小鼠肿瘤生存曲线,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,i图:cq tmz、cq-tmz、tmz cq组小鼠的体重变化曲线,每组n=6,*p《0.05,**p《0.01,***p《0.001,****p《0.0001,j图:he染色cq tmz、cq-tmz、tmz cq组小鼠的肿瘤体积大小的结果图,k图:免疫组化染色cq tmz、cq-tmz、tmz cq组小鼠脑肿瘤样品中的ki67,标尺=50μm,l图:免疫荧光测定cq tmz、cq-tmz、tmz cq组小鼠脑肿瘤中r-h2ax的表达的结果图,标尺=50μm。
具体实施方式
89.下面结合具体实施例,进一步阐述本发明,仅用于解释本发明,而不能理解为对本发明的限制。本领域的普通技术人员可以理解为:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商所建议的条件实施检测。
90.实施例1 ptrf的表达和胶质瘤患者替莫唑胺治疗预后的相关性研究
91.本实施例使用tcga数据库中的胶质母细胞瘤数据进行生物信息学分析,采用的分析软件为graphpad8和spss 25。
92.1、实验方法
93.(1)数据下载:tcga数据在ucsc xena(https://xenabrowser.net/)网站进行下载,所述tcga数据中包括基因表达数据和临床数据。
94.(2)gbm患者筛选,ptrf表达水平高低以中位数为界将所述gbm患者划分为高ptrf
表达患者和低ptrf表达患者,将gbm患者数据导入graphpad进行统计分析。
95.(3)通过spss进行单因素,多因素cox回归分析。
96.2、统计学分析
97.统计学分析使用spss21.0版本软件,执行t检验,单因素多元方差分析和两因素方差分析,*p《0.05,**《0.01,***《0.001,****《0.0001具有统计学意义。
98.3、实验结果
99.通过对tcga数据库中的胶质母细胞瘤患者的数据进行分析,结果显示ptrf高表达的胶质母细胞瘤患者替莫唑胺治疗预后差(见图1a),ptrf表达水平与胶质母细胞瘤患者总生存期呈显著负相关(见图1b),通过对tcga数据库中的替莫唑胺治疗的胶质母细胞瘤患者的数据进行分析,结果显示,ptrf表达水平与替莫唑胺治疗后的胶质母细胞瘤患者总生存期呈显著负相关(见图1c、图1d、图1e和图1f),通过tcga数据库分析,ptrf对替莫唑胺治疗的胶质母细胞瘤患者的预后的影响是独立于mgmt,单因素与多因素回归分析的结果显示,ptrf表达水平与胶质母细胞瘤患者有很高的相关性(p<0.001)(见图1g和图1h)。
100.实施例2 ptrf能够增强替莫唑胺耐药
101.1、实验方法
102.(1)细胞培养和获取
103.u87细胞购买于atcc,原代tbd0220细胞从河北大学附属医院胶质母细胞瘤病人手术切块分离培养获得。
104.(2)crispr/cas9技术敲除u87细胞ptrf
105.ptrf敲除u87细胞系(u87-ptrf
ko
)由crispr/cas9(biotech solutions inc.)产生。crispr是使用crispr设计网络工具(http://crispr.mit.edu)设计的。针对ptrf的sgrna序列包括sgrna4:tacccggagccgtgcgggaccgg(seq id no:1)和sgrna6:atcaagtcggaccaggtgaacgg(seq id no:2)。将sgrna克隆到pgk1.1/crispr/cas9载体中。用sgrna载体转染u87细胞,在核酸酶靶位点通过pcr扩增基因组序列进行扩大和筛选突变,随后进行dna测序和免疫印迹。
106.(3)慢病毒感染
107.取生长状态良好的肿瘤细胞,铺到六孔板,12小时后按照说明书将egfp-ptrf慢病毒加入到u87-ptrf
ko
和tbd0220细胞中,培养2-3天后,在荧光显微镜下观察细胞绿色荧光转染,根据慢病毒载体的抗性加入嘌呤霉素,筛选1周后,提取rna及蛋白质以用于对细胞进行过表达鉴定。u87-ptrf
ko-ptrf和tbd0220-ptrf细胞系构建成功并进行后续实验。
108.(4)转染
109.取生长状态良好的肿瘤细胞,铺到六孔板,每个孔使用无血清培养基125μl混合lipo3000 3.75μl,另外用p3000转染试剂混合sirna 2.5μg充分轻柔混合上述2种混合物,室温孵育10分钟,加入到6孔板中,轻轻混匀。转染2天后,提取rna及蛋白质以用于对细胞进行敲低鉴定。至此,tbd0220 siptrf构建成功(结果证实siptrf1转染效率高)并进行后续实验。
110.ptrf1序列:gccgcaacuuuaaagucaugaucua(seq id no:3)
111.uagaucaugacuuuaaaguugcggc(seq id no:4)
112.ptrf2序列:aggagucccgcgcagagcguaucaa(seq id no:5)
113.uugauacgcucugcgcgggacuccu(seq id no:6)
114.阴性对照:uucuccgaacgugucacgutt(seq id no:7)
115.acgugacacguucggagaatt(seq id no:8)
116.(5)cck8检测细胞增殖
117.取对数生长期的u87、u87-ptrf
ko
、u87-ptrf
ko-ptrf、tbd0220、tbd0220-siptrf、tbd0220-ptrf细胞接种3000个细胞于96孔板中,每组7个复孔。将培养板放在培养箱预贴壁培养24小时(37℃,5%co2的孵育条件)。按需求对培养板进行分组处理,加药处理结束后每孔加入10%体积的cck-8溶液,避光放置于37℃、2h,用酶标仪测定其在450nm处的吸光度值,并记录数据。
118.(6)平板克隆
119.取生长状态良好的肿瘤细胞,用0.25%胰蛋白酶消化,离心后,用培养基重悬细胞并吹打成单细胞悬液备用。每孔按2000个细胞的数量接种,孔里包含2ml培养基,把细胞晃动均匀。24小时后向u87、u87 ptrf
ko
、u87-ptrf
ko-ptrf、tbd0220、tbd0220-siptrf、tbd0220-ptrf组细胞加入200μm tmz,u87-ptrf
ko-ptrf gw4869,tbd0220-ptrf gw4869组在加入tmz的同时加入20μm gw4869(中性鞘磷脂酶抑制剂)。然后在培养箱中培养2周。当培养板里出现肉眼可见的细胞团块时,即可终止培养。用pbs洗2次,然后加入4%多聚甲醛室温固定30分钟。然后弃掉固定液,加入少量结晶紫染液室温30分钟,然后用缓慢的水流冲洗六孔板,空气干燥。将六孔板倒置并在下面放一张带网格的胶片,计数克隆数量,并拍照。
120.(7)rna抽提
121.细胞:将待提取rna的mbvp培养容器,弃去细胞培养液,用pbs洗2次,根据培养容器面积每25cm2加入1ml trizol,室温裂解5min后用枪头反复吹打,然后将裂解产物完全转移到无rnase的1.5ml ep管里。
122.按照每1ml trizol需加入200μl氯仿加入相应体积氯仿,随后用手上下颠倒ep管20s,室温静置5min后在4℃条件离心12000g
×
15min。离心结束后上层为水相(含rna),下层为苯酚/氯仿有机相,中间为蛋白层。吸取约400μl上层水相到另一个1.5ml无rnase的ep管里,其它弃去。需注意吸取上层水相时一定要慢,避免吸到蛋白层。向含有rna水相的ep管内加入600μl异丙醇,随后颠倒混匀在室温静置5-10min,4℃条件下离心12000g
×
10min后,弃去上清,留取管底部上的白色沉淀。向ep管中加入1ml 75%的乙醇(用depc水和无水乙醇配置)洗涤离心得到的白色rna沉淀,轻轻混匀,在4℃离心8000g
×
5min,弃上清。将rna沉淀在室温下晾干或干燥大概5-10分钟,最后,加入适量depc水溶解,并长期保存于-80℃。rna质量检测:实验中通过测定rna在od260和od280处的吸光度值来评估提取的rna含量和纯度。rna在od260处存在最大吸收峰,当od260/od280越接近2时,认为提取的rna越纯。比值较大通常预示着rna可能发生降解,而比值较小通常表示rna可能存在有机溶剂或蛋白污染。如果提取的rna浓度不纯,应重新进行提取。
123.(8)逆转录
124.按照promaga逆转录试剂盒说明书的要求进行如下操作,所有操作均在冰上进行:使用前,将每种成分混合并短暂离心。在70℃的加热块中加热5分钟。立即在冰水中冷却至少5分钟。在微量离心机中离心10秒。储存在冰上,直到加入逆转录混合物。准备反转录反应混合物,每个cdna反应15μl。按照所列顺序在冰上混合。goscript
tm 5x反应缓冲液4.0μl,
mgcl2(终浓度1.5
–
5.0mm)3μl,pcr核苷酸混合物(每个dntp终浓度为0.5mm)1.0μl,重组核糖核酸酶抑制剂20单位0.5μl,goscript
tm
逆转录酶1.0μl,无核酸酶的水6μl,最终体积15μl。
125.将15μl的逆转录混合物与5μl的rna和引物混合物混合在一起。在25℃的条件下退火5分钟,在42℃的条件下延伸最多一小时。在70℃的条件下加热15分钟,冷冻后可长期保存。
126.实时定量pcr:通过结合使用qpcr master mix,pcr引物和不含核酸酶的水,如下所述。组分体积最终浓度:qpcr预混液(2x)10μl1x,正向引物(20x)200nm
–
1μm,反向引物(20x)200nm
–
1μm,每个反应0.2μl,300nm,不含核酸酶的水,最终体积为20μl。将适当体积的反应混合物添加到每个pcr试管或光学级pcr板的孔中。将dna模板(或用于无模板对照反应的水)添加到反应的适当孔中。密封试管或光学板,并短暂离心以收集底部孔的内容物。样品已准备好进行热循环。避免长时间曝光或高温。
127.热循环:按照sybr green pcr master mix试剂盒说明书和实时定量pcr仪的操作方法,对逆转录的所得产物进行扩增检测;在冰上配置qpcr反应体系,每孔加入sybr mix 10μl,正向引物(forward primer)和反向引物(reverse primer)各1μl,逆转录获得的cdna模板1μl,然后用灭菌蒸馏水将反应体系补充至20μl。在反应体系配置中,每个检测样本均设置3个副孔,每孔配置20μl反应体系。
128.qpcr的反应程序设置如下所示:
[0129][0130]
所用到的pcr引物包括:
[0131]
mgmt基因:
[0132]
正向引物为5
’‑
cctggctgaatgcctatttccac-3’(seq id no:9)
[0133]
反向引物为5
’‑
gcagcttccataacacctgtctg-3’(seq id no:10)
[0134]
ptrf基因:
[0135]
正向引物为5
’‑
ggcagatcaagaagctggaggt-3’(seq id no:11)
[0136]
反向引物为5
’‑
cagcgatttgctgatgctcagtt-3’(seq id no:12)
[0137]
gapdh基因:
[0138]
正向引物为5
’‑
gtctcctctgacttcaacagcg-3’(seq id no:13)
[0139]
反向引物为5
’‑
accaccctgttgctgtagccaa-3’(seq id no:14)
[0140]
(9)蛋白免疫印迹分析
[0141]
将不同处理组的细胞培养皿从培养箱取出后,弃去细胞培养液后,使用预冷的pbs洗涤细胞培养皿2~3次,随后加入适量细胞裂解液(ripa∶pmsf=100∶1),放置在冰上裂解30min,之后将其转移到1.5ml离心管。将离心管中收集的细胞裂解液在低温(4℃)下离心12000rpm
×
15min,吸取含有蛋白的上清转移到新的1.5ml离心管,使用bca试剂盒检测收集蛋白的浓度,根据所测得蛋白浓度,使用5
×
loading buffer将各处理组蛋白稀释成一样的浓度。然后将稀释的蛋白溶液在沸水中煮7分钟使蛋白变性。变性完毕后将蛋白放入-80℃
冰箱内长期存放,避免反复冻存。配胶。根据所需要检测蛋白的分子量来配相应浓度大小分离胶,加到制胶板的下层;之后用去离子水压胶直到凝固。分离胶凝固之后弃去双离子水,并在制胶板的上层加入5%的浓缩胶,随后及时插入梳子,待浓缩胶凝固后,即配胶完成。每孔上样蛋白量为30-50μg。将电泳槽连接好电泳仪。浓缩胶在80v恒压下进行电泳,待到分离胶时于120v恒压下进行电泳,待溴酚蓝跑到分离胶底部时,可以终止电泳。转膜前将裁剪好的pvdf膜先放入甲醇中进行激活,随后可以放入提前预冷的转膜液中,裁剪pvdf膜时应避免用手接触。在转膜夹子上按照转膜黑色夹板-海绵-滤纸-分离胶-pvdf膜-滤纸-海绵-转膜白色夹板的顺序放好后,把转膜夹夹紧,然后插入到转膜槽里。在操作过程中,注意pvdf膜始终保持湿润,注意每层之间避免有气泡。向转膜槽里倒入预冷转膜液,可以放置一块冰袋,盖上盖子,连上电极后在300ma恒流下转膜1个半小时,转膜过程中整个转膜槽应放置在冰盒中。提前用pbs溶解bsa配成5%bsa,并在摇床上溶解彻底。等到转膜时间结束后取出pvdf膜并做好标记,随后放在5%bsa中在摇床上摇2h封闭pvdf膜上的非特异性结合位点。孵育抗体,按照抗体说明书用tbst提前配好蛋白相应浓度的一抗和二抗。封闭结束后,将pvdf膜取出后用tbst溶液洗涤一下,随后放进配好的一抗盒子中,4℃过夜。把pvdf膜从一抗稀释液中取出,使用tbst洗涤3次,每次10分钟左右。随后将pvdf膜于室温下孵育二抗1h,从二抗稀释液中取出pvdf膜后继续tbst洗涤,方式同一抗。依据超敏ecl发光试剂盒,吸取适量a液与b液等体积混匀来配置发光液。将pvdf膜放置在曝光板后,在pvdf膜上滴加ecl发光液,来使整个膜被发光液浸没,放置在凝胶成像仪上进行曝光拍照。曝光所得的条带用imagej软件测定灰度值,所有目的蛋白以gapdh或β-tubulin的灰度值作为内参来计算其自的蛋白相对表达量。
[0142]
(10)免疫荧光染色
[0143]
将处理过的玻片放于12孔板,将细胞以适当密度铺于上述12孔板,处理结束后,用pbs洗2次,用4%多聚甲醛固定10min,pbs洗3次,1%triton破膜15min,pbs洗3次,5%bsa封闭30min,之后将爬片在4℃孵一抗过夜,pbs洗涤3次,每次5分钟,将切片在37℃二抗孵育1h,pbs洗涤3次,每次5分钟,所有片子均用dapi染色10min,最后用共聚焦显微镜(tcs sp5,leica)照相。
[0144]
2、实验结果
[0145]
蛋白免疫印迹的结果显示,u87、u87-ptrf和u87 ptrf
ko
组ptrf表达情况,结果显示了u87细胞转染ptrfegfp慢病毒后ptrf表达增加,通过crisp/cas9技术成功敲除u87细胞的ptrf,结果表明了u87细胞ptrf过表达和敲除细胞系构建成功(见图2a);对u87、u87-ptrf
ko
、u87-ptrf
ko-ptrf、u87-ptrf
ko-ptrf gw4869组给予不同浓度tmz处理后细胞存活率进行测定,结果显示了与u87组相比,u87-ptrf
ko
组细胞tmz的ic50值降低,与u87-ptrf
ko
组相比,u87-ptrf
ko-ptrf组细胞tmz的ic50值升高,而与u87-ptrf
ko-ptrf组相比,u87-ptrf
ko-ptrf gw4869组细胞tmz的ic50值降低,结果表明了ptrf敲除降低了u87细胞tmz耐药,ptrf过表达增加了tmz耐药,但给予外泌体拮抗剂gw4869后降低了tmz耐药(见图2b);蛋白免疫印迹的结果显示,tbd0220、tbd0220-siptrf、tbd0220-ptrf组的ptrf表达,结果显示了tbd0220细胞转染ptrfegfp慢病毒后使ptrf表达增加,通过sirna转染使tbd0220细胞ptrf表达降低,结果表明tbd0220细胞ptrf过表达和敲低细胞系构建成功(见图2c);对tbd0220、tbd0220-siptrf、tbd0220-ptrf、tbd0220-ptrf gw4869组给予tmz处理后细胞存活率进行测定,结果
ptrf
ko-ptrf gw4869细胞小凹的结果见图3c,结果显示了u87-ptrf
ko
降低了细胞小凹数量,ptrf过表达增加了细胞小凹数量,但给予外泌体拮抗剂gw4869后降低了细胞小凹数量,表明了细胞小凹的形成与ptrf表达呈正相关;蛋白免疫印迹分析各组细胞外囊泡中cd63、alix、cd81、cd9、tsg101的蛋白质表达水平的结果见图3e,结果显示了u87-ptrf
ko
降低了细胞外囊泡中cd63、alix、cd81、cd9、tsg101的蛋白质表达,ptrf过表达增加了细胞外囊泡中cd63、alix、cd81、cd9、tsg101的蛋白质表达,但给予外泌体拮抗剂gw4869后降低了细胞外囊泡中cd63、alix、cd81、cd9、tsg101的蛋白质表达,表明了细胞外囊泡蛋白质表达与ptrf表达呈正相关;通过hplc分析细胞内、外泌体、微囊泡、上清液中的tmz浓度的结果见图3f和图3g,结果显示与u87组相比,u87-ptrf
ko
组细胞内tmz浓度升高,细胞外囊泡替莫唑胺浓度降低,u87-ptrf
ko
组相比,u87-ptrf
ko-ptrf组细胞内tmz浓度降低,细胞外囊泡替莫唑胺浓度升高,而与u87-ptrf
ko-ptrf组相比,u87-ptrf
ko-ptrf gw4869组细胞内tmz浓度升高,细胞外囊泡tmz浓度降低,表明了ptrf通过增加细胞外囊泡的分泌降低细胞内tmz浓度。
[0151]
实施例4敲除ptrf增强了替莫唑胺在原位异种种植胶质瘤小鼠中的功效
[0152]
1、实验方法
[0153]
gbm原位异种移植胶质瘤小鼠模型构建过程的示意图见图4a,5周大的雌性裸鼠(中国医学科学院肿瘤研究所)被用来建立颅内原位肿瘤模型。u87、u87-ptrf
ko
、u87-ptrf
ko-ptrf细胞被用来进行颅内注射,随后腹膜内注射tmz(5mg/kg/d)或dmso 2周(5天和2天)和gw4869持续2周。用小动物的立体定向仪将培养好的细胞立体定位植入裸鼠的颅内区域。手术在无菌环境下进行,具体步骤包括麻醉小鼠,然后切开头部皮肤,在颅骨中线右侧2mm处钻孔,之后在立体定向仪辅助下将100万细胞打入颅内2mm处,最后缝合皮肤。在第7、14、21和28天,使用生物发光成像检测小鼠的颅内肿瘤生长状态并记录生存情况。
[0154]
he染色用于显示裸鼠的肿瘤体积大小,免疫组化染色脑肿瘤样品中的ki67,免疫荧光测定脑肿瘤中r-h2ax的表达。免疫组化he染色的方法如下:冰冻切片用4%多聚甲醛固定15分钟,pbs洗涤3次,每次5分钟,随后将切片放进1%triton里破膜20分钟,pbs洗涤3次,每次5分钟,洗涤完毕后将切片用5%bsa封闭半小时,之后将切片在4℃孵一抗过夜,pbs洗涤3次,每次5分钟,将切片在37℃二抗孵育1h,pbs洗涤3次,每次5分钟,所有切片均用dapi染色10min,最后用共聚焦显微镜(tcs sp5,leica)照相。
[0155]
2、实验结果
[0156]
在肿瘤植入后7、14、21和28天监测肿瘤生长情况得到的生物发光图像见图4b和通过量化成像信号强度定量得到小鼠肿瘤生长曲线见图4c,结果显示与u87植瘤小鼠相比,tmz处理显著降低了u87-ptrf
ko
组小鼠胶质瘤生长,与u87-ptrf
ko
tmz组植瘤小鼠相比,u87-ptrf
ko-ptrf tmz处理组胶质瘤生长加快,与u87-ptrf
ko-ptrf tmz组相比,u87-ptrf
ko-ptrf tmz gw4869处理组胶质瘤生长速度明显降低,结果表明了ptrf敲除增强了tmz对胶质瘤的抑制作用,ptrf过表达降低了tmz对胶质瘤的抑制作用,但给予外泌体拮抗剂gw4869后增强了tmz对胶质瘤的生长抑制;kaplan-meier显示裸鼠的生存曲线见图4d,结果显示与u87植瘤小鼠组相比,tmz处理明显延长了u87-ptrf
ko
组小鼠的生存期,与u87-ptrf
ko
tmz组植瘤小鼠相比,u87-ptrf
ko-ptrf tmz处理组小鼠生存期缩短,与u87-ptrf
ko-ptrf tmz组相比,u87-ptrf
ko-ptrf tmz gw4869处理组小鼠生存期延长,结果表明了降低胶质瘤ptrf表达改善了tmz的预后,过表达ptrf胶质瘤降低了tmz对胶质瘤的治疗作用,但给予外泌体拮抗
剂gw4869后增强了tmz对胶质瘤的疗效;he染色显示裸鼠的肿瘤体积大小的结果见图4e,结果显示与u87植瘤小鼠相比,tmz处理显著降低了u87-ptrf
ko
组小鼠胶质瘤生长,与u87-ptrf
ko
tmz组植瘤小鼠相比,u87-ptrf
ko-ptrf tmz处理组胶质瘤生长加快,与u87-ptrf
ko-ptrf tmz组相比,u87-ptrf
ko-ptrf tmz gw4869处理组胶质瘤生长明显降低,结果表明了ptrf敲除增强了tmz对胶质瘤的生长抑制,ptrf过表达降低了tmz对胶质瘤的抑制作用,但给予外泌体拮抗剂gw4869后增强了tmz对胶质瘤的生长抑制;免疫组化染色脑肿瘤样品中的ki67的结果见图4j,结果显示与u87植瘤小鼠相比,tmz处理显著降低了u87-ptrf
ko
组小鼠胶质瘤增殖,与u87-ptrf
ko
tmz组植瘤小鼠相比,u87-ptrf
ko-ptrf tmz处理组增加了胶质瘤增殖,与u87-ptrf
ko-ptrf tmz组相比,u87-ptrf
ko-ptrf tmz gw4869处理组降低了胶质瘤增殖,结果表明了ptrf敲除增强了tmz对胶质瘤增殖的抑制,ptrf过表达降低了tmz对胶质瘤增殖的抑制作用,但给予外泌体拮抗剂gw4869后增强了tmz对胶质瘤增殖的抑制;免疫荧光测定脑肿瘤中r-h2ax的表达情况的结果见4k,结果显示与u87植瘤小鼠相比,tmz处理显著增加了u87-ptrf
ko
组小鼠胶质瘤dna的损伤,与u87-ptrf
ko
tmz组植瘤小鼠相比,u87-ptrf
ko-ptrf tmz处理组降低了胶质瘤dna的损伤,与u87-ptrf
ko-ptrf tmz组相比,u87-ptrf
ko-ptrf tmz gw4869处理组增加了胶质瘤dna的损伤,结果表明了ptrf敲除增强了tmz对胶质瘤dna的损伤,ptrf过表达降低了tmz对胶质瘤dna的损伤,但给予外泌体拮抗剂gw4869后增强了tmz对胶质瘤dna的损伤。
[0157]
实施例5替莫唑胺联合氯喹序贯疗法通过增加细胞内替莫唑胺浓度减轻替莫唑胺耐药
[0158]
1、实验方法
[0159]
(1)平板克隆
[0160]
取生长状态良好的肿瘤细胞,用0.25%胰蛋白酶消化,离心后,用培养基重悬细胞并吹打成单细胞悬液备用。每孔按2000个细胞的数量接种,孔里包含2ml培养基,把细胞晃动均匀。12小时后,u87/tbd0220 cq组加入25μm cq(氯喹),tmz组加入200μm tmz,tmz cq组先给予tmz 8小时后再加入25μmcq,然后在培养箱中培养2周。当培养板里出现肉眼可见的细胞团块时,即可终止培养。加入4%多聚甲醛室温固定30分钟。然后弃掉固定液,加入少量结晶紫染液室温30分钟,然后用缓慢的水流冲洗六孔板,空气干燥。将六孔板倒置并在下面放一张带网格的胶片,计数克隆数量,并拍照。
[0161]
(2)蛋白电泳
[0162]
将不同处理组的细胞培养皿从培养箱取出后,弃去细胞培养液后,使用预冷的pbs洗涤细胞培养皿2-3次,随后加入适量细胞裂解液(ripa∶pmsf=100∶1),放置在冰上裂解30min,之后将其转移到1.5ml离心管。将离心管中收集的细胞裂解液在低温(4℃)下离心12000rpm
×
15min,吸取含有蛋白的上清转移到新的1.5ml离心管,使用bca试剂盒检测收集蛋白的浓度,根据所测得蛋白浓度,使用5
×
loading buffer将各处理组蛋白稀释成一样的浓度。然后将稀释的蛋白溶液在沸水中煮7分钟使蛋白变性。变性完毕后将蛋白放入-80℃冰箱内长期存放,避免反复冻存。配胶。根据所需要检测蛋白的分子量来配相应浓度大小分离胶,加到制胶板的下层;之后用去离子水压胶直到凝固。分离胶凝固之后弃去双离子水,并在制胶板的上层加入5%的浓缩胶,随后及时插入梳子,待浓缩胶凝固后,即配胶完成。每孔上样蛋白量为30-50μg。将电泳槽连接好电泳仪。浓缩胶在80v恒压下进行电泳,待到分离
胶时于120v恒压下进行电泳,待溴酚蓝跑到分离胶底部时,可以终止电泳。转膜前将裁剪好的pvdf膜先放入甲醇中进行激活,随后可以放入提前预冷的转膜液中,裁剪pvdf膜时应避免用手接触。在转膜夹子上按照转膜黑色夹板-海绵-滤纸-分离胶-pvdf膜-滤纸-海绵-转膜白色夹板的顺序放好后,把转膜夹夹紧,然后插入到转膜槽里。在操作过程中,注意pvdf膜始终保持湿润,注意每层之间避免有气泡。向转膜槽里倒入预冷转膜液,可以放置一块冰袋,盖上盖子,连上电极后在300ma恒流下转膜1个半小时,转膜过程中整个转膜槽应放置在冰盒中。提前用pbs溶解bsa配成5%bsa,并在摇床上溶解彻底。等到转膜时间结束后取出pvdf膜并做好标记,随后放在5%bsa中在摇床上摇2h封闭pvdf膜上的非特异性结合位点。孵育抗体,按照抗体说明书用tbst提前配好蛋白相应浓度的一抗和二抗。封闭结束后,将pvdf膜取出后用tbst溶液洗涤一下,随后放进配好的一抗盒子中,4℃过夜。把pvdf膜从一抗稀释液中取出,使用tbst洗涤3次,每次10分钟左右。随后将pvdf膜于室温下孵育二抗1h,从二抗稀释液中取出pvdf膜后继续tbst洗涤,方式同一抗。依据超敏ecl发光试剂盒,吸取适量a液与b液等体积混匀来配置发光液。将pvdf膜放置在曝光板后,在pvdf膜上滴加ecl发光液,来使整个膜被发光液浸没,放置在凝胶成像仪上进行曝光拍照。曝光所得的条带用imagej软件测定灰度值,所有目的蛋白以gapdh或β-tubulin的灰度值作为内参来计算其自的蛋白相对表达量。
[0163]
(3)免疫荧光染色
[0164]
将处理过的玻片放于12孔板,将细胞以适当密度铺于上述12孔板,处理结束后,用pbs洗2次,用4%多聚甲醛固定10min,pbs洗3次,1%triton破膜15min,pbs洗3次,5%bsa封闭30min,之后将爬片在4℃孵一抗过夜,pbs洗涤3次,每次5分钟,将切片在37℃二抗孵育1h,pbs洗涤3次,每次5分钟,所有片子均用dapi染色10min,最后用共聚焦显微镜(tcs sp5,leica)照相。
[0165]
2、实验结果
[0166]
结果显示了与tmz和cq组相比,tmz cq处理组降低了胶质瘤细胞增殖,结果表明了tmz cq治疗增强了tmz对胶质瘤的抑制作用(见图5a和图5b);蛋白印迹显示u87和tbd0220细胞给予200μm tmz或25μm cq处理后bax、bcl-2、caspase3、caspase7、cyclinb、p-cdc2和r-h2ax蛋白表达情况,结果显示与tmz和cq组相比,tmz cq处理组增加了bax、cleav-caspase3、caspase7、γ-h2ax、cyclinb和p-cdc2表达,结果表明了tmz cq治疗增加了tmz对胶质瘤的抑制作用(见图5c);流式细胞术测定u87和tbd0220细胞用200μmtmz或25μm cq处理48小时后细胞的凋亡率。结果显示与tmz和cq组相比,tmz cq处理组增加了胶质瘤细胞的凋亡(见图5d);流式细胞术测定u87和tbd0220细胞用200μm tmz或25μm cq处理后细胞的周期变化,结果显示与tmz和cq组相比,tmz cq组(先给予200μm tmz 8小时后再给予cq 25μm处理40小时)增强了tmz对胶质瘤细胞g2/m周期阻滞(见图5e);蛋白印迹显示u87和tbd0220细胞中用200μm tmz联合25μm cq不同序贯方法处理后bax、bcl-2、caspase3、caspase7和r-h2ax蛋白表达情况。结果显示cq tmz(先给予25μm cq 8小时后再给予tmz 200μm处理48小时)和tmz-cq组(200μm tmz和cq 25μm同时加入细胞处理48小时)相比,tmz cq处理组增加了胶质瘤细胞增加了bax、cleav-caspase3、caspase7、γ-h2ax的表达,结果表明了tmz cq序贯疗法最大程度的增加tmz疗效(见图5f);流式细胞术测定u87和tbd0220细胞用用200μm tmz联合25μm cq不同序贯方法处理后细胞的凋亡率。结果显示cq tmz和tmz-cq组相比,tmz
cq处理组最大程度地增加了胶质瘤细胞的凋亡,结果表明了tmz cq序贯疗法最大程度的增加胶质瘤的凋亡(见图5g);蛋白印迹显示u87细胞用cq处理后细胞ptrf和caveolin1表达情况,结果显示了cq可以降低胶质瘤细胞ptrf的表达(见图5h);透射电镜观察u87细胞ctrl、cq组细胞外囊泡的形态。结果显示了cq治疗可以降低胶质瘤细胞外囊泡的分泌(见图5i);蛋白印迹分析u87细胞ctrl、cq组细胞外囊泡中cd63、cd81、cd9的蛋白质表达。结果显示了cq可以降低胶质瘤细胞外囊泡中cd63、cd81、cd9的蛋白质表达(见图5j);通过lc-ms测定5μm tmz联合25μm cq不同序贯方法处理后细胞内tmz浓度。结果显示与tmz、cq tmz、tmz-cq组相比,tmz cq治疗组增加了细胞内tmz浓度。结果表明tmz cq序贯疗法通过增加胶质瘤细胞内tmz浓度进而增强tmz疗效(见图5k);tmz联合cq序贯疗法增加细胞内替莫唑胺浓度示意图(见图5l)。
[0167]
实施例6替莫唑胺氯喹序贯治疗增加了在原位异种种植胶质瘤小鼠中替莫唑胺疗效
[0168]
1、实验方法
[0169]
gbm原位异种移植胶质瘤小鼠模型构建过程的示意图见图4a,5周大的雌性裸鼠(中国医学科学院肿瘤研究所)被用来建立颅内原位肿瘤模型。tbd0220细胞被用来进行颅内植瘤,用小动物的立体定向仪将培养好的细胞立体定位植入裸鼠的颅内区域。手术在无菌环境下进行,具体步骤包括麻醉小鼠,然后切开头部皮肤,在前囟与后囟中点颅骨中线右侧2mm处钻孔,之后在立体定向仪辅助下将100万细胞打入颅内2mm处,最后缝合皮肤。1周后,小鼠随机分为ctrl组,小鼠给予tmz(5mg/kg/d,5d/w),cq(20mg/kg,3d/w),cq tmz组(20mg/kg cq,3d/w,从第3天开始5mg/kg/d tmz,5d/w),tmz-cq组(20mg/kg cq,3d/w,5mg/kg/d tmz,5d/w),tmz cq组(5mg/kg/d tmz,5d/w,从第5天开始20mg/kg cq,3d/w),持续2周灌胃治疗。在第7、14、21和28天,使用生物发光成像检测小鼠的颅内肿瘤生长状态并记录生存情况。
[0170]
he染色用于显示裸鼠的肿瘤体积大小,免疫组化染色脑肿瘤样品中的ki67,免疫荧光测定脑肿瘤中r-h2ax的表达。免疫组化he染色的方法如下:冰冻切片用4%多聚甲醛固定15分钟,pbs洗涤3次,每次5分钟,随后将切片放进1%triton里破膜20分钟,pbs洗涤3次,每次5分钟,洗涤完毕后将切片用5%bsa封闭半小时,之后将切片在4℃孵一抗过夜,pbs洗涤3次,每次5分钟,将切片在37℃二抗孵育1h,pbs洗涤3次,每次5分钟,所有切片均用dapi染色10min,最后用共聚焦显微镜(tcs sp5,leica)照相。
[0171]
2、实验结果
[0172]
结果显示了与ctrl、cq组相比,tmz处理组小鼠肿瘤生长速度降低(见图6a);kaplan-meier显示ctrl、cq、tmz组小鼠的生存曲线,每组n=6。结果显示了与ctrl、cq组相比,tmz处理组小鼠生存期延长(见图6b);记录ctrl、cq、tmz组小鼠的体重变化曲线,每组n=6,结果显示了与ctrl组相比,tmz处理组小鼠体重增加(见图6c);he染色用于显示ctrl、cq、tmz组小鼠的肿瘤体积大小。结果显示了与ctrl、cq组相比,tmz处理组小鼠肿瘤体积减小(见图6d);免疫组化染色ctrl、cq、tmz组小鼠脑肿瘤样品中的ki67。标尺=50μm。结果显示了与ctrl、cq组相比,tmz处理组小鼠肿瘤增殖减慢(见图6e);免疫荧光测定ctrl、cq、tmz组小鼠脑肿瘤中r-h2ax的表达。标尺=50μm。结果显示了与ctrl、cq组相比,tmz处理组小鼠胶质瘤dna损伤明显(见图6f);在肿瘤植入后第7、14、21和28天监测cq tmz、cq-tmz、tmz cq
组小鼠肿瘤生长的生物发光图像。(每组n=6)。结果显示了与cq tmz、cq-tmz组相比,tmz cq处理组小鼠肿瘤生长速度降低(见图6g);kaplan-meier显示cq tmz、cq-tmz、tmz cq组小鼠肿瘤生存曲线。每组n=6,结果显示了与cq tmz、cq-tmz组相比,tmz cq处理组小鼠生存期延长(见图6h);记录cq tmz、cq-tmz、tmz cq组小鼠的体重变化曲线,每组n=6,结果显示了与cq tmz、cq-tmz组相比,tmz cq处理组小鼠体重下降变慢(见图6i);he染色用于显示cq tmz、cq-tmz、tmz cq组小鼠的肿瘤体积大小。结果显示了与cq tmz、cq-tmz组相比,tmz cq处理组小鼠肿瘤体积明显减小(见图6j);免疫组化染色cq tmz、cq-tmz、tmz cq组小鼠脑肿瘤样品中的ki67。标尺=50μm。结果显示了与cq tmz、cq-tmz组相比,tmz cq处理组小鼠肿瘤增殖降低(见图6k和图6l);免疫荧光测定cq tmz、cq-tmz、tmz cq组小鼠脑肿瘤中r-h2ax的表达。标尺=50μm。结果显示了与cq tmz、cq-tmz组相比,tmz cq处理组小鼠肿瘤组织dna损伤加重,结果表明了tmz cq序贯疗法治疗胶质瘤最有效(见图6j)。
[0173]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。