一种牛cart基因真核过表达载体的构建与应用
技术领域
1.本发明涉及基因表达载体构建与应用技术领域,具体为一种牛cart基因真核过表达载体的构建与应用。
背景技术:
2.可卡因-苯丙胺调节转录肽(cocaine-and amphetamine-regulated transcript peptide,cart)是一种在动物体内广泛分布的内源性神经肽,参与摄食调控、激素释放、药物依赖与卵泡发育等多种生物学功能。通常过表达载体只将基因的cds区构建在载体上,细胞转录后的mrna没有utr区,存在无法研究mirna对mrnautr调控的问题。
3.mirna是一类由内源基因编码的长度约为22nt的非编码单链rna,在动物中,多数情况下mirna与mrna的3
′
utr不完全互补结合,从而阻碍该mrna的翻译,并以此来调控基因表达。普通过表达载体只构建了cds区,存在研究mirna对mrna 3
′
utr的调控机制不可行的问题。
技术实现要素:
4.本发明的目的在于提供一种牛cart基因真核过表达载体的构建与应用,以解决上述背景技术中提出的问题。
5.为实现上述目的,发明提供如下技术方案:一种牛cart基因真核过表达载体的构建与应用,具体包括以下步骤:
6.步骤一:利用pcr方法得到牛cartmrna utr序列片段:
7.①
目的基因上下游引物分别加上pex-3载体上ecori和bamhi两侧同源序列,用于载体的亚克隆;
8.②
将oligo浓度溶解至50μmol/l,分别取相同体积oligo至一1.5ml离心管,混合均匀,配成oligo mix;
9.③
用配制好的oligo mix进行第一轮pcr反应;
10.④
用oligo-1和oligo-20进行第二轮pcr反应,模板为第一轮pcr反应的产物;
11.⑤
反应条件与第一轮相同,第一轮pcr得到混有目的基因条带的非单一条带pcr产物混合物,再用第一轮的pcr产物为模板,通过第二轮pcr获得单一的目的基因条带;
12.⑥
pcr反应完成后,利用agarose电泳并切胶回收cartmrna utr基因片段;
13.步骤二:目的基因cartmrna utr克隆到载体pex-3中:
14.①
pex-3酶切并纯化;
15.②
cartmrna utr与pex-3定向连接;
16.③
感受态细胞制备;
17.④
连接产物转化;
18.⑤
阳性克隆鉴定并测序验证;
19.⑥
正确重组质粒抽提;
20.步骤三:cartmrna utr在293t细胞中的过表达:
21.①
进行293t细胞的培养;
22.②
将pex-3-cartmrna utr重组过表达载体转染293t细胞。
23.优选的,所述pex-3酶切并纯化,具体包括
24.①
用ecori和bamhi对pex-3进行酶切,37℃酶切2h
25.②
通过电泳方法用dna凝胶回收试剂盒回收载体pex-3。
26.优选的,所述cartmrna utr与pex-3定向连接,具体包括
27.①
利用entry one step cloning kit将扩增好的cartmrna utr片段重组克隆到线性化的pex-3载体中;
28.②
使用移液器上下吹打数次,轻轻混匀各组分,置于37℃反应30min,反应完成后立即将反应管置于冰水浴中,冷却5min。
29.优选的,所述感受态细胞制备,具体包括
30.①
从经37℃培养16h的新鲜平板中挑取一个单菌落,转到含有100ml lb培养基的1l烧瓶中,于300rpm的旋转摇床上振摇培养3h,培养温度37℃;
31.②
在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50ml离心管中,在冰上放置10min,使培养物冷却至0℃;
32.③
于4℃,以4000rpm离心10min,回收细胞;
33.④
倒出培养液,将管倒置1min,使最后残留的痕量培养液流尽;
34.⑤
以10ml用冰预冷的0.1mol/l cacl2重悬每份沉淀,放置于冰浴上;
35.⑥
于4℃,以4000rpm离心10min,回收细胞;
36.⑦
倒出培养液,将管倒置1min,使最后残留的痕量培养液流尽;
37.⑧
每50ml初始培养物用2ml用冰预冷的0.1mol/l、含20%甘油的cacl2重悬每份细胞沉淀;
38.⑨
将细胞分装成小份,按照100μl/支,放于-80℃冻存。
39.优选的,所述连接产物转化,具体包括:
40.①
从-80℃中取出感受态细胞,将装有感受态细胞的离心管冰上放置4min,待感受态细胞解冻后,加入10μl重组连接产物,轻柔混匀内容物,在冰中放置30min;
41.②
将离心管放到预加温到42℃的水浴锅中放好的试管架上,放置90s,不要摇动离心管;
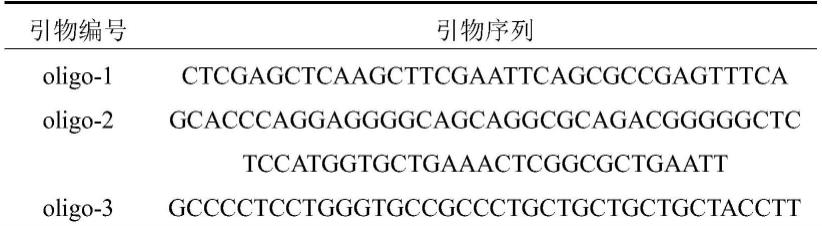
42.③
快速将离心管转移到冰浴中,使细胞冷却3min;
43.④
向每支离心管加入800μl不含抗生素的lb培养基,然后将离心管转移到37℃摇床,250rpm,培育45min使细菌复苏;
44.⑤
取200μl培育后的细胞均匀涂布于含50μg/mlkanamycin lb平板上;
45.⑥
等平板上液体被吸收后,将平板倒置于37℃培养箱中,培养16h。
46.优选的,所述阳性克隆鉴定并测序验证,具体包括:
47.①
从培养好的平板上挑取4个单独、饱满的菌落,置于含有5ml lb培养基(含50μg/mlkanamycin)的试管中;
48.②
将上述试管置于细菌摇床中培养,37℃,250rpm,培养16h;
49.③
将培养好的菌液,用质粒小提试剂盒抽提质粒;
50.④
将抽提好的质粒进行双酶切鉴定;
51.⑤
37℃酶切,1h后电泳,在目的条带大小对应区域有酶切得到的条带对应的克隆即为阳性克隆;
52.⑥
取200μl阳性克隆对应的菌液送测序,并将剩余的菌液用甘油保存。
53.优选的,所述正确重组质粒抽提,具体为:将测序结果与目的基因序列进行比对,确认无误后,用保存的甘油菌液接菌lb培养基,进行大量质粒抽提,得到足够量的重组质粒。
54.优选的,所述进行293t细胞的培养,具体为:将冻存在液氮中的293t细胞取出后于37℃水浴锅中进行解冻,加入2倍体积的终止液,轻轻吹打混匀后转移至15ml ep管中,离心,1000rpm,7min;弃去上清液后加入完全培养液重悬细胞;将细胞浓度调整为5
×
105细胞/ml后接种于t25细胞培养瓶中;将完全培养液补足至6ml后置于37℃,5%co2恒温培养箱中静置培养;细胞培养至80-90%融合时,将细胞浓度调整为2
×
105细胞/ml后接种于六孔板中,将完全培养液补足至2ml/每孔后置于37℃,5%co2恒温培养箱中静置培养。
55.优选的,所述将pex-3-cartmrna utr重组过表达载体转染293t细胞,具体为:在细胞达到70-80%汇合度时,进行细胞转染;将4μg cartmrna utr过表达载体/pex-3加入到200μl dmem basic(1
×
)培养基中轻柔混匀,室温放置5min;将12μl transintrotm el加入到200μl dmem basic(1
×
)培养基中轻柔混匀,室温放置5min;将稀释后的transintrotm el加入到稀释后的cartmrna utr过表达载体/pex-3中轻柔混匀,室温放置15-20min;弃去旧培养液,用适量pbs清洗细胞两次;每孔加入2ml rpmi medium 1640basic(1
×
),再加入各组的转染混合物后置于37℃,5%co2恒温培养箱中静置培养;4-6h后弃去转染液更换为完全培养液,继续培养24-48h。
56.与现有技术相比,发明的有益效果是:
57.1、本发明将cartcds区与utr区共同构建在空载上,转录后的mrna结构完整,更好的模拟原代细胞中mirna对mrnautr区的调控。
58.2、本发明将cart基因cds区与utr区同时构建在过表达载体上,可在293t细胞中模拟cartmrna转录后被mirna调控的情况。解决了牛下丘脑原代细胞采集与培养难的问题。该发明为研究cart转录后调控机制以及cart调控牛卵泡发育机理奠定基础。
59.3、本方案并且通过全基因合成牛cartmrna utr序列以及pex-3载体酶切并纯化后,将cartmrna utr与pex-3定向连接产物转化感受态细胞,获得的阳性克隆进行测序验证,测序结果无误后进行质粒抽提。将pex-3-cartmrna utr与pex-3空载分别转染293t细胞,通过cart mrna与cart蛋白的表达,来检测pex-3-cartmrna utr的过表达情况。
附图说明
60.图1为重组质粒酶切鉴定结果示意图;
61.图2为pex-3过表达载体图谱;
62.图3为重组质粒酶切条带测序结果示意图一;
63.图4为重组质粒酶切条带测序结果示意图二;
64.图5为重组质粒酶切条带测序结果示意图三;
65.图6为重组质粒酶切条带测序结果示意图四;
66.图7为重组质粒酶切条带测序结果示意图五;
67.图8为重组质粒酶切条带测序结果示意图六;
68.图9为重组质粒酶切条带测序结果示意图七;
69.图10为重组质粒酶切条带测序结果示意图八;
70.图11为重组质粒酶切条带测序结果示意图九;
71.图12为重组质粒酶切条带测序结果示意图十;
72.图13为重组质粒酶切条带测序结果示意图十一;
73.图14为cartmrna相对表达量示意图;
74.图15为cart蛋白westernblot结果图示意图。
具体实施方式
75.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
76.请参阅图1-15,发明提供一种技术方案:一种牛cart基因真核过表达载体的构建与应用,具体包括以下步骤:
77.步骤一:利用pcr方法得到牛cartmrna utr序列片段:
78.①
目的基因上下游引物分别加上pex-3载体上ecori和bamhi两侧同源序列,用于载体的亚克隆;引物序列见下表1,引物由上海吉玛制药技术有限公司合成。
79.表1pcr引物序列
80.[0081][0082]
②
将oligo浓度溶解至50μmol/l,分别取相同体积oligo至一1.5ml离心管,混合均匀,配成oligo mix;
[0083]
③
用配制好的oligo mix进行第一轮pcr反应;第一轮pcr反应体系如表2所示,pcr循环条件如表3所示。
[0084]
表2第一轮pcr反应体系
[0085][0086]
表3pcr循环条件
[0087][0088]
④
用oligo-1和oligo-20进行第二轮pcr反应,模板为第一轮pcr反应的产物;第二轮pcr反应体系如表4所示。
[0089]
表4第二轮pcr反应体系
[0090][0091][0092]
⑤
反应条件与第一轮相同,第一轮pcr得到混有目的基因条带的非单一条带pcr产物混合物,再用第一轮的pcr产物为模板,通过第二轮pcr获得单一的目的基因条带;
[0093]
⑥
pcr反应完成后,利用agarose电泳并切胶回收cartmrna utr基因片段;
[0094]
步骤二:目的基因cartmrna utr克隆到载体pex-3中:
[0095]
①
pex-3酶切并纯化;
[0096]
②
cartmrna utr与pex-3定向连接;
[0097]
③
感受态细胞制备;
[0098]
④
连接产物转化;
[0099]
⑤
阳性克隆鉴定并测序验证;
[0100]
⑥
正确重组质粒抽提;
[0101]
步骤三:cartmrna utr在293t细胞中的过表达:
[0102]
①
进行293t细胞的培养;
[0103]
②
将pex-3-cartmrna utr重组过表达载体转染293t细胞。
[0104]
本实施例中,所述pex-3酶切并纯化,具体包括
[0105]
①
用ecori和bamhi对pex-3进行酶切,37℃酶切2h;pex-3酶切体系如表5所示。
[0106]
表5pex-3酶切体系
[0107][0108][0109]
②
通过电泳方法用dna凝胶回收试剂盒回收载体pex-3。
[0110]
本实施例中,所述cartmrna utr与pex-3定向连接,具体包括
[0111]
①
利用entry one step cloning kit将扩增好的cartmrna utr片段重组克隆到线性化的pex-3载体中;cartmrna utr与pex-3反应体系如表6所示。
[0112]
表6cartmrna utr与pex-3反应体系
[0113][0114]
②
使用移液器上下吹打数次,轻轻混匀各组分,置于37℃反应30min,反应完成后立即将反应管置于冰水浴中,冷却5min。
[0115]
本实施例中,所述感受态细胞制备,具体包括
[0116]
①
从经37℃培养16h的新鲜平板中挑取一个单菌落,转到含有100ml lb培养基的1l烧瓶中,于300rpm的旋转摇床上振摇培养3h,培养温度37℃;
[0117]
②
在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50ml离心管
中,在冰上放置10min,使培养物冷却至0℃;
[0118]
③
于4℃,以4000rpm离心10min,回收细胞;
[0119]
④
倒出培养液,将管倒置1min,使最后残留的痕量培养液流尽;
[0120]
⑤
以10ml用冰预冷的0.1mol/l cacl2重悬每份沉淀,放置于冰浴上;
[0121]
⑥
于4℃,以4000rpm离心10min,回收细胞;
[0122]
⑦
倒出培养液,将管倒置1min,使最后残留的痕量培养液流尽;
[0123]
⑧
每50ml初始培养物用2ml用冰预冷的0.1mol/l、含20%甘油的cacl2重悬每份细胞沉淀;
[0124]
⑨
将细胞分装成小份,按照100μl/支,放于-80℃冻存。
[0125]
本实施例中,所述连接产物转化,具体包括:
[0126]
①
从-80℃中取出感受态细胞,将装有感受态细胞的离心管冰上放置4min,待感受态细胞解冻后,加入10μl重组连接产物,轻柔混匀内容物,在冰中放置30min;
[0127]
②
将离心管放到预加温到42℃的水浴锅中放好的试管架上,放置90s,不要摇动离心管;
[0128]
③
快速将离心管转移到冰浴中,使细胞冷却3min;
[0129]
④
向每支离心管加入800μl不含抗生素的lb培养基,然后将离心管转移到37℃摇床,250rpm,培育45min使细菌复苏;
[0130]
⑤
取200μl培育后的细胞均匀涂布于含50μg/ml kanamycin lb平板上;
[0131]
⑥
等平板上液体被吸收后,将平板倒置于37℃培养箱中,培养16h。
[0132]
本实施例中,所述阳性克隆鉴定并测序验证,具体包括:
[0133]
①
从培养好的平板上挑取4个单独、饱满的菌落,置于含有5ml lb培养基(含50μg/ml kanamycin)的试管中;
[0134]
②
将上述试管置于细菌摇床中培养,37℃,250rpm,培养16h;
[0135]
③
将培养好的菌液,用质粒小提试剂盒抽提质粒;
[0136]
④
将抽提好的质粒进行双酶切鉴定;双酶切每管反应体系如表7所示。
[0137]
表7双酶切每管反应体系
[0138][0139]
⑤
37℃酶切,1h后电泳,在目的条带大小对应区域有酶切得到的条带对应的克隆即为阳性克隆;
[0140]
⑥
取200μl阳性克隆对应的菌液送测序,并将剩余的菌液用甘油保存。
[0141]
本实施例中,所述正确重组质粒抽提,具体为:将测序结果与目的基因序列进行比对,确认无误后,用保存的甘油菌液接菌lb培养基,进行大量质粒抽提,得到足够量的重组
质粒。
[0142]
本实施例中,所述进行293t细胞的培养,具体为:将冻存在液氮中的293t细胞取出后于37℃水浴锅中进行解冻,加入2倍体积的终止液,轻轻吹打混匀后转移至15ml ep管中,离心,1000rpm,7min;弃去上清液后加入完全培养液重悬细胞;将细胞浓度调整为5
×
105细胞/ml后接种于t25细胞培养瓶中;将完全培养液补足至6ml后置于37℃,5%co2恒温培养箱中静置培养;。细胞培养至80-90%融合时,将细胞浓度调整为2
×
105细胞/ml后接种于六孔板中,将完全培养液补足至2ml/每孔后置于37℃,5%co2恒温培养箱中静置培养。
[0143]
本实施例中,所述将pex-3-cartmrna utr重组过表达载体转染293t细胞,具体为:在细胞达到70-80%汇合度时,进行细胞转染;将4μg cart mrna utr过表达载体/pex-3加入到200μl dmem basic(1
×
)培养基中轻柔混匀,室温放置5min;将12μltransintrotm el加入到200μl dmem basic(1
×
)培养基中轻柔混匀,室温放置5min;将稀释后的transintrotm el加入到稀释后的cartmrna utr过表达载体/pex-3中轻柔混匀,室温放置15-20min;弃去旧培养液,用适量pbs清洗细胞两次;每孔加入2ml rpmi medium 1640basic(1
×
),再加入各组的转染混合物后置于37℃,5%co2恒温培养箱中静置培养;4-6h后弃去转染液更换为完全培养液,继续培养24-48h。
[0144]
鉴定:pex-3-cartmrna utr重组质粒酶切鉴定结果:
[0145]
为了鉴定pex-3-cartmrna utr重组质粒,以ecori和bamhi双酶切回收的质粒,经过1%琼脂糖凝胶电泳分析,结果如图1所示,图1泳道1显示ecori和bamhi双酶切得到的cartmrna utr(806bp)和pex-3骨架(4,000bp),pex-3过表达载体图谱如图2所示。
[0146]
pex-3-cartmrna utr重组质粒酶切条带测序结果
[0147]
将测序结果与ncbi中牛cartmrna utr序列(nm_001007820.3)进行比对,结果如图3~图13所示,序列一致。
[0148]
结果分析:细胞转染24h后,提取总rna进行qrt-pcr检测,如图14所示,与pex-3组相比,pex-3 cart组cartmrna的表达量极显著增加(p<0.0001)。
[0149]
细胞转染48h后,提取总蛋白进行westernblot检测,结果如图15所示,pex-3 cart组cart蛋白表达量较pex-3组极显著增加(p<0.001)。
[0150]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
