1.本发明属于化学合成领域,具体涉及一类异噁唑类药物氟雷拉纳及其类似化合物的制备方法。
背景技术:
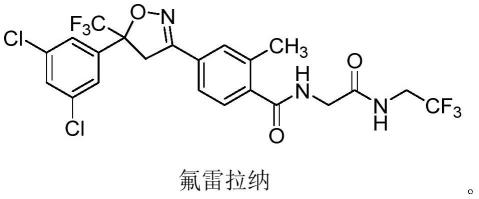
2.异噁唑啉类化合物是一类新型的高效杀虫剂,它通过干扰γ-氨基丁酸(gaba)门通道发挥作用导致神经系统过度兴奋而死亡。早在2004年日产化学工业株式会社(nissan chemical industries japan)就成功研发合成了异噁唑啉类的广谱驱虫剂(氟雷拉纳),并在2005年取得了国际专利的授权,该化合物专利到期时间为2025年。2014年氟雷拉纳已作为杀虫类兽药(商品名bravectotm)在德国、西班牙、意大利、法国、荷兰及英国上市销售,主要用于动物体内外杀虫;2016年7月美国fda批准了默克公司申请用于治疗猫和狗身上的跳蚤和扁虱,一次给药有效期长达12周。研究表明,氟雷拉纳是一类非常有效的杀虫活性化合物;氟雷拉纳的化学名称为4-[5-(3,5-二氯苯基)-4,5-二氢-5-(三氟甲基)-3-异噁唑基]-2-甲基-n-[2-氧代-2-[(2,2,2-三氟-2-乙基)氨基]乙基]苯甲酰胺,该化合物具有一对对映异构体,药物以r和s的混旋体上市,但后来进一步的研究结果表明,氟雷拉纳的s构型才是其主要的杀虫活性组分。目前市售制剂产品为消旋化合物,氟雷拉纳化学结构如下:
[0003]
目前,已有不少专利和文献报道了氟雷拉纳的合成。
[0004]
专利wo2005085216/wo2009080250描述了氟雷拉纳的合成。该专利以2-甲基-4-甲醛肟苯甲酸叔丁酯为起始物料,在ncs作用下制备得到肟氯化合物后再与1,3-二氯-5-(1-三氟甲基-乙烯基)-苯进行1,3-偶极环加成反应,最后再在碱性条件下与2-氨基-n-(2,2,2-三氟乙基)乙酰胺发生酰胺化反应制备得到氟雷拉纳。合成路线如下:
[0005]
专利cn109879826描述了氟雷拉纳的另外合成路线。该专利提前将2-氨基-n-(2,2,2-三氟乙基)乙酰胺基团和苯甲酸进行缩合,最后和1,3-二氯-5-(1-三氟甲基-乙烯基)-苯进行1,3-偶极环加成反应制备得到氟雷拉纳。该条路线由于2-氨基-n-(2,2,2-三氟乙基)乙酰胺基团含有裸露的氨基活性反应位点,因此在卤化和最后1,3-偶极环加成反应过程中会产生大量副反应,导致最终产品纯化困难和总收率偏低。合成路线如下:
[0006]
专利wo2009001942/ep2172462/wo2021038501描述了氟雷拉纳的另外合成路线。该路线以1-(3,5-二氯苯基)-2,2,2-三氟乙-1-酮和4-乙酰基-2-甲基苯甲酸作为起始物料,在碱的作用下反应得到化合物4-(3-(3,5-二氯苯基)-4,4,4-三氟-3-羟基丁酰基)-2-甲基苯甲酸三乙胺盐,后者使用ac2o/dmap条件脱除一分子水得到α,β-不饱和酮化合物;α,β-不饱和酮化合物在盐酸羟胺作用下发生异噁唑成环反应得到相应的羧酸中间体;后者再和2-氨基-n-(2,2,2-三氟乙基)乙酰胺发生缩合反应实现氟雷拉纳的合成。相关合成路线如下:
[0007]
美国hoveyda小组开发了一条制备手性氟雷拉纳路线(nat.chem.,2016,8,768-777)。该合成路线首先通过硼试剂制备得到手性的(s)-2-(3,5-二氯苯基)-1,1,1-三氟戊-4-烯-2-醇,然后使用臭氧对末端双键进行氧化得到(s)-3-(3,5-二氯苯基)-4,4,4-三氟-3-羟基丁醛;所得到的醛化合物和(4-(甲氧羰基)-3-甲基苯基)氯化镁氯化锂络合物反应后的产物直接进行dess-martin氧化,得到(s)-4-(3-(3,5-二氯苯基)-4,4,4-三氟-3-羟基
丁酰基)-2-甲基苯甲酸甲酯;随后(s)-4-(3-(3,5-二氯苯基)-4,4,4-三氟-3-羟基丁酰基)-2-甲基苯甲酸甲酯在盐酸羟胺以及phi(oh)ots和p(ome)3作用下关环制备得到(s)-4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸甲酯;最后,(s)-4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸甲酯和2-氨基-n-(2,2,2-三氟乙基)乙酰胺缩合实现s构型的氟雷拉纳的制备。相关合成路线如下:
[0008]
综合目前氟雷拉纳的制备方法,我们不难发现方法都涉及关环制备4,5-二氢异噁唑中间体步骤,且关环前体都含有多个活泼的基团,诸如酯基、酰氨基、羧基等,而关环的试剂都为盐酸羟胺或羟胺衍生的肟,这些活泼的基团非常易于和盐酸羟胺或羟胺衍生的肟发生副反应,从而导致合成工艺产生杂质,为后续的产品纯化和产业化生产带来瓶颈。因此,开发新的氟雷拉纳的制备方法对于氟雷拉纳的产业化以及降低产业化成本、提高该产品的市场竞争力都非常重要。
技术实现要素:
[0009]
本发明的目的在于提供一条制备氟雷拉纳及其类似物的方法,旨在规避目前报道关环制备4,5-二氢异噁唑中间体会产生副产物,从而导致整个制备工艺产生杂质并为后续的产品纯化和产业化生产带来瓶颈。
[0010]
研究发现,1-取代-3-取代-5-(3,3,3-三氟丙-烯-2-基)苯(式i)在碱/溶剂作用下和1,1-二溴甲醛肟(式ii)发生反应制备得到3-溴-5-(3-取代-5-取代-苯基)-5-(三氟甲基)-4,5-二氢异噁唑(式iii);化合物3-溴-5-(3-取代-5-取代-苯基)-5-(三氟甲基)-4,5-二氢异噁唑和2-甲基-4-(4,4,5,5-四甲基-1,3-二氧戊环-2-基)苯甲酸发生suzuki偶联反应,制备得到4-(5-(3-取代-5-取代-苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸;最后,4-(5-(3-取代-5-取代-苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸和2-氨基-n-(2,2,2-三氟乙基)乙酰胺盐酸盐发生缩合反应,制备得到氟雷拉纳及其类似物。反应路线如下:
[0011]
反应第一步所使用的碱为na2co3、nahco3、k2co3、khco3。
[0012]
反应第一步所使用的溶剂为etoac、thf、2-me-thf、1,4-二氧六环、甲基叔丁基醚。
[0013]
反应第二步所使用的溶剂为suzuki偶联反应常用的溶剂,包括甲醇、异丙醇、四氢呋喃、乙二醇二甲醚、甲基吡咯烷酮、1,4-二氧六环、甲苯、乙醇和n,n-二甲基甲酰胺。
[0014]
反应第二步所使用的催化剂为含钯催化剂,包括pd(oac)2、pd(pph3)4、pdcl2、[3-(1,3-(meo)
2-c6h
3-)c6h
4-cy2p]2pdcl2、pdcl2(pph3)2、pd(dppf)cl2、pdcl2(dppf)
·
ch2cl2、pd2(dba)3、pd2(dba)3·
chcl3和(t-bu3p)2pd。
[0015]
反应第二步所使用的碱为nahco3、khco3、k2co3、na2co3、et3n、csf、cs2co3、naoh、koh、koac、lioh、(i-pr)2net、k3po4。
[0016]
式i、式iii、式iv中r1为cl、cf3。
[0017]
式i、式iii、式iv中r2为cl、cf3。
[0018]
反应第三步所使用的条件为常规羧酸和胺类化合物之间的缩合反应条件。
[0019]
本发明描述的方法简单方便地实现氟雷拉纳及其类似物的制备,具有产业化前景。
具体实施方式
[0020]
以下典型实施例用来说明本发明,在本领域内的技术人员对本发明所做的简单替换和改进等均属于本发明所保护的技术方案之内。实施例一:3-溴-5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑的制备
[0021]
于100ml的三口瓶中加入1,3-二氯-5-(1-三氟甲基-乙烯基)苯(3.0g,12.45mmol),乙酸乙酯(40ml),碳酸氢钠(5.30g,63.10mmol)和1,1-二溴甲醛肟(2.50g,12.33mmol),于30-35℃保温反应24h。反应结束后过滤除去不溶物,滤液减压浓缩至干,残留物经硅胶柱层析纯化(展开剂:正庚烷/乙酸乙酯=15:1-8:1),得到3-溴-5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑(白色固体,4.07g,91%)。1h nmr(600mhz,cdcl3)δ7.72(s,2h),7.67(s,1h),4.01-3.98(d,j=18.0hz,1h),3.63-3.60(d,j=18.0hz,1h)。实施例二:3-溴-5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑的制备
[0022]
于100ml的三口瓶中加入1,3-二氯-5-(1-三氟甲基-乙烯基)苯(3.30g,12.02mmol),甲基叔丁基醚(40ml),碳酸钾(8.30g,60.06mmol)和1,1-二溴甲醛肟(2.45g,12.08mmol),于35-40℃保温反应过夜,反应结束后过滤除去不溶物,滤液减压浓缩至干,残留物经硅胶柱层析纯化(展开剂:正庚烷/乙酸乙酯=20:1-6:1),得到3-溴-5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑(4.1g,86.7%)白色固体。1h nmr(600mhz,cdcl3)δ7.46(s,1h),7.42(s,2h),3.95-3.92(d,j=18.0hz,1h),3.60-3.507(d,j=18.0hz,1h)。实施例三:4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸的制备
[0023]
于100ml的三口瓶中,氮气保护,加入3-溴-5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑(700mg,1.93mmol),2-甲基-4-(4,4,5,5-四甲基-1,3-二氧戊环-2-基)苯甲酸(560mg,2.14mmol),醋酸钾(379mg,3.86mmol),1,4-二氧六环(15ml),水(1.5ml)和pd(dppf)cl2(141mg,0.19mmol),于85
±
5℃保温反应8h,停止加热降至室温,然后再加入水(50ml)淬灭后再用二氯甲烷(45ml
×
2)萃取,合并有机相,有机相再用饱和食盐水(50ml)洗涤一次,然后有机相再用无水硫酸钠(10.0g)干燥2h,有机相减压浓缩至干,浓缩残留物经硅胶柱层析纯化(展开剂:正庚烷/乙酸乙酯=10:1-3:1),得到4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸(694mg,86%)浅黄色固体。1h nmr(600mhz,cdcl3)δ8.12-8.10(d,j=12.0hz,1h),7.60(s,2h),7.53(s,2h),7.45(s,2h),4.14-4.11(d,j=18.0hz,1h),3.75-3.73(d,j=12.0hz,1h),2.69(s,3h)。实施例四:4-(5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸的制备
[0024]
于100ml的三口瓶中,氮气保护,加入3-溴-5-(3-氯-5-(三氟甲基)笨基)-5-(三氟甲基)-4,5-二氢异噁唑(760mg,1.92mmol),2-甲基-4-(4,4,5,5-四甲基-1,3-二氧戊环-2-基)苯甲酸(515mg,1.96mmol),碳酸钾(555mg,4.0mmol),甲苯(15ml),水(1.5ml)和pd2(dba)3(110mg,0.12mmol),于90
±
5℃保温反应8h,停止加热降,体系降温至室温,然后再加入水(50ml)淬灭后再用二氯甲烷(40ml
×
2)萃取,合并有机相,有机相再用饱和食盐水(50ml)洗涤一次,然后再用无水硫酸钠(15.0g)干燥2h,有机相减压浓缩至干,残留物经硅胶柱层析纯化(展开剂:正庚烷/乙酸乙酯=10:1-2:1),得到4-(5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸的(浅黄色固体,729mg,84%)。1h nmr(600mhz,cdcl3)δ8.15-8.13(d,j=12.0hz,1h),7.62(s,2h),7.55(s,2h),7.45(s,2h),4.18-4.16(d,j=18.0hz,1h),3.75-3.73(d,j=12.0hz,1h),2.70(s,3h)。实施例五:4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基-n-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)苯甲酰胺(氟雷拉纳)的制备
[0025]
于25ml的三口瓶中,氮气保护,加入4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸(100mg,0.24mmol),2-氨基-n-(2,2,2-三氟乙基)乙酰胺盐酸盐(46mg,0.24mmol),edci(65mg,0.34mmol),hobt(60mg,0.44mmol),三乙胺(60mg,0.60mmol)和dcm(10ml),于20-25℃保温反应8h,反应结束后加入水(20ml)淬灭,然后再用二氯甲烷(30ml
×
2)萃取,合并有机相,有机相再用饱和食盐水(20ml)洗涤一次,然后再用无水硫酸钠(5.0g)干燥2h,有机相减压浓缩至干,残留物经硅胶柱层析纯化(展开剂:二氯
甲烷/甲醇=20:1-10:1),得到4-(5-(3,5-二氯苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基-n-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)苯甲酰胺(白色固体,118mg,88%)。1h nmr(600mhz,cdcl3)δ7.56-7.53(m,4h),7.49-7.48(d,j=6hz,1h),7.45(s,1h),6.80(s,1h),6.66(s,1h),4.21-4.20(d,j=6.0hz,1h),4.12-4.09(d,j=18.0hz,1h),3.99-3.97(m,2h),3.74-3.71(d,j=18hz,1h),2.49(s,3h)。实施例六:4-(5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基-n-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)苯甲酰胺的制备
[0026]
于25ml的三口瓶中,氮气保护,加入4-(5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基苯甲酸(110mg,0.24mmol),2-氨基-n-(2,2,2-三氟乙基)乙酰胺盐酸盐(47mg,0.24mmol),edci(70mg,0.37mmol),hobt(59mg,0.44mmol),三乙胺(62mg,0.61mmol)和dcm(10ml),于20-25℃保温反应过夜,反应结束后加入水(25ml)淬灭后再用二氯甲烷(40ml
×
2)萃取,合并有机相,有机相再用饱和食盐水(30ml)洗涤一次,然后再用无水硫酸钠(7.0g)干燥2.5h,有机相减压浓缩至干,残留物经硅胶柱层析纯化(展开剂:二氯甲烷/甲醇=15:1-9:1),得到4-(5-(3-氯-5-(三氟甲基)苯基)-5-(三氟甲基)-4,5-二氢异噁唑-3-基)-2-甲基-n-(2-氧代-2-((2,2,2-三氟乙基)氨基)乙基)苯甲酰胺(白色固体,122mg,86%)1h nmr(600mhz,cdcl3)δ7.58-7.57(m,4h),7.51-7.50(d,j=6hz,1h),7.47(s,1h),6.83(s,1h),6.71(s,1h),4.24-4.23(d,j=6.0hz,1h),4.16-4.13(d,j=18.0hz,1h),3.41-3.99(m,2h),3.75-3.72(d,j=18.0hz,1h),2.53(s,3h)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。