敲低或抑制egr3的试剂在制备心肌缺血再灌注损伤药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及敲低或抑制egr3的试剂在制备心肌缺血再灌注损伤药物中的应用。
背景技术:
2.心肌缺血再灌注损伤指冠状动脉部分或完全急性阻塞后,在一定时间又重新获得再通时,缺血心肌虽然得以恢复正常灌注,但其组织损伤反而呈进行性加重的病理过程。缺血期引起的心肌超微结构、能量代谢、心功能和电生理等一系列损伤性变化,在血管再通后表现得更为突出,甚至可发生严重的心律失常而导致猝死。心内直视手术、冠状动脉搭桥术、冠状动脉腔内成形术、溶栓术后以及心肌内侧支循环血量突然增加等情况下,都可发生心肌缺血后再灌注损伤。对其发生机制认为主要与细胞内氧自由基的大量产生、钙离子超负荷、白细胞的炎症作用及高能磷酸化合物缺乏等有关。除了心脏,缺血再灌注损伤还可见于脑、肺、肝、胰、肾及胃肠道等器官。
3.早期生长反应基因3(egr3)是早期生长反应基因家族的一员,可通过转录调控,介导与神经系统/免疫系统等相关的信号通路。目前,egr3蛋白在心肌缺血再灌注损伤中的作用及其机制尚未有任何相关的研究和报道。
技术实现要素:
4.本发明的目的在于提供敲低或抑制egr3的试剂在制备心肌缺血再灌注损伤药物中的应用,增加egr3的医药用途。
5.本发明提供了敲低或抑制egr3的试剂在制备心肌缺血再灌注损伤药物中的应用。
6.优选的,所述心肌缺血再灌注损伤包括心室病理性重构和/或心力衰竭。
7.优选的,所述试剂包括敲低egr3基因表达的shrna。
8.优选的,所述shrna的正链核苷酸序列如seq id no.1所示,反链核苷酸序列如seq id no.2所示。
9.优选的,所述试剂包括egr3抑制剂。
10.优选的,所述egr3抑制剂的活性成分包括aav-shegr3。
11.优选的,所述药物还包括药学可接受的辅料。
12.优选的,所述药学可接受的辅料选自缓冲剂、包囊剂、填充剂、粘合剂、透皮吸收剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、着色剂、矫味剂和吸附载体中的一种或多种组合。
13.本发明提供了一种心肌缺血再灌注损伤药物,所述药物的有效成分包括敲低或抑制egr3的试剂。
14.本发明提供了一种敲低或抑制egr3基因表达的试剂盒,所述试剂盒包括敲低或抑制egr3的试剂。
15.本发明提供了敲低或抑制egr3的试剂在制备心肌缺血再灌注损伤药物中的应用。动物实验表明,敲低egr3能够改善心肌缺血再灌注后心功能,降低心肌缺血再灌注后心脏纤维化,改善心肌缺血再灌注后心肌肥大。本发明首次明确egr3能够改善心肌缺血再灌注损伤和/或心力衰竭,为心肌缺血再灌注损伤和/或心力衰竭的诊断及治疗提供新的防治药物研发途径和药物作用靶点,具有十分重要的药用价值。
附图说明
16.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
17.图1为干扰载体phbaav-u6-mcs-cmv-egfp载体图谱;
18.图2为aav9-shegr3测序结果;
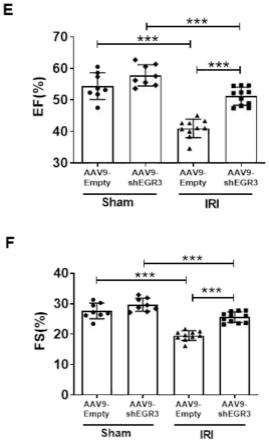
19.图3~4为敲低egr3干预心肌缺血再灌注损伤小鼠心功能的超声心脏图检测结果;
20.图5为rt-qpcr动物水平验证aav9-shegr3效率结果;
21.图6为敲低egr3干预心肌缺血再灌注损伤小鼠心肌细胞横截面积的he染色结果;
22.图7为敲低egr3干预心肌缺血再灌注损伤小鼠心肌细胞横截面积的wga 染色结果;
23.图8为敲低egr3干预心肌缺血再灌注损伤小鼠心脏纤维化的马松染色结果。
具体实施方式
24.本发明提供了敲低或抑制egr3的试剂在制备心肌缺血再灌注损伤药物中的应用。
25.在本发明中,所述心肌缺血再灌注损伤优选包括心室病理性重构和/或心力衰竭。本发明所述心肌缺血再灌注优选包括心血管疾病诱发的心肌缺血再灌注。
26.在本发明中,所述试剂优选包括敲低egr3基因表达的shrna。本发明所述敲低egr3基因表达的shrna的正链核苷酸序列如seq id no.1所示,反链核苷酸序列如seq id no.2所示。
27.本发明所述各核苷酸序列的碱基序列,从5
’‑3’
依次如下:
28.seq id no.1:aattcgccggaactctcttattcgagctcttctcgaga agagctcgaataagagagttccggttttttg;
29.seq id no.2:gatccaaaaaaccggaactctcttattcgagctcttct cgagaagagctcgaataagagagttccggcg。
30.本发明所述shrna存在茎环(5
’‑
ctcgag-3’)结构,将反向重复序列分隔开,形成发夹结构,从而达到敲低egr3基因表达的效果。
31.在本发明中,所述试剂优选包括egr3抑制剂。本发明所述egr3抑制剂的活性成分优选包括aav-shegr3,进一步优选为aav9-shegr3。本发明对所述aav-shegr3的来源没有严格要求,采用常规构建质粒的方式,将上述敲低 egr3基因表达的shrna重组到腺病毒载体,经过腺相关病毒载体的制备、腺相关病毒包装及纯化得到重组腺病毒aav9-shegr3即可。本发明所述腺病毒载体的优选为aav9。在本发明具体实施过程中,重组腺病毒aav9-shegr3优选由汉恒生物科技(上海)有限公司提供。
32.得重组腺病毒aav9-shegr3后,本发明优选对重组腺病毒aav9-shegr3 进行包装。
本发明对所述包装的方式不做具体的限定,将重组腺病毒 aav9-shegr3的滴度确定为1
×
10
11
~1
×
10
12
个病毒基因组/ml即可,优选为3
ꢀ×
10
11
~6
×
10
11
个病毒基因组/ml。
33.本发明对所述egr3的来源没有特殊限制,化学合成或者微生物代谢获得均可。
34.本发明还提供了一种心肌缺血再灌注损伤药物,有效成分包括敲低或抑制 egr3的试剂。本发明通过敲低或抑制egr3能够在心肌缺血再灌注损伤后改善心功能,并且有助于降低心肌缺血再灌注损伤后心脏的纤维化,抑制心肌缺血再灌注损伤后的心肌肥厚,抑制心室病理性重构、改善心力衰竭,将具备敲低或抑制egr3的试剂作为药物的活性成分,能够改善心肌缺血再灌注损伤。
35.在本发明中,所述药物优选还包括药学可接受的辅料。本发明所述药学可接受的辅料选自稀释剂、缓冲剂、混悬剂、乳剂、颗粒剂、包囊剂、赋形剂、填充剂、粘合剂、喷雾剂、透皮吸收剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、着色剂、矫味剂和吸附载体中的一种或多种组合。本发明在具体实施过程中,根据药物的剂型选择合适的辅料即可。
36.为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
37.实施例1
38.1.aav9-shegr3腺相关病毒载体构建
39.利用限制性内切酶酶切干扰载体phbaav-u6-mcs-cmv-egfp(图1)后和shrna片段(正链核苷酸序列如seq id no.1所示:5
’‑
aattcgccggaa ctctcttattcgagctcttctcgagaagagctcgaataagagagttccggt tttttg-3’;反链核苷酸序列如seq id no.2:5
’‑
gatccaaaaaaccggaa ctctcttattcgagctcttctcgagaagagctcgaataagagagttccggc g-3’)连接,随后进行大肠杆菌转化,转化后使用条件培养基(无抗性的lb培养基)筛选目标菌株后送至擎科公司测序,利用核酸提取试剂盒进行质粒抽提,得重组腺病毒aav9-shegr3,测序结果如图2所示。根据图2测序结构可以看出,测序结果与目的序列一致,表明该重组腺病毒aav9-shegr3构建成功(所述腺相关病毒构建过程由汉恒生物技术有限公司进行,构建的aav9-shegr3由汉恒生物技术有限公司提供,滴度为1.4
×
10
13
μg/ml。
40.2.aav9-empty腺相关病毒载体构建
41.同步骤1,使用的shrna片段的正链核苷酸序列如seq id no.3所示:5
’ꢀ‑
gatccgttctccgaacgtgtcacgtaattcaagagattacgtgacacgttc ggagaattttttc-3’;反链核苷酸序列如seq id no.4所示:5
’‑
aattgaa aaaattctccgaacgtgtcacgtaatctcttgaattacgtgacacgttcgg agaacg-3’,重组腺病毒aav9-empty由汉恒生物技术有限公司提供,滴度为 1.8
×
10
13
μg/ml。
42.实施例2
43.1.小鼠分组和模型建立
44.将购自北京维通利华实验动物技术有限公司的40只实验小鼠,平均分为心肌缺血再灌注损伤(iri)组(实验组)和假手术(sham)组(对照组);
45.实验组:用4%水合氯醛按照10μl/g给药量腹腔注射麻醉小鼠。用镊子对鼠尾末端及四肢施加压力,小鼠没有反应,可认为小鼠已充分麻醉。将充分麻醉的小鼠放置在温度为37℃的恒温垫上,对其颈部和胸部进行脱毛处理,暴露小鼠颈部,用75%酒精进行消毒。在显微镜下沿直线分离覆盖气管上的颈部皮肤、肌肉及组织,当气管暴露后,在声门下两个气
strand cdna synthesis kit(thermo scientific#k1622)反转录总rna。使用itaq universal sybr green supermix(bio-rad#1725121/-20℃)在 lightcycler480ii(roche)中通过实时荧光定量聚合酶链反应(qpcr)对cdna 进行定量。采用18s作为内参,检测egr3的相对表达量。所有qpcr反应均为3个重复,并在每个周期结束时采集信号。用2-δδct
法计算相对表达量。检测结果统计图见图5。
56.根据图5可以看出,aav9-shegr3 sham组小鼠心脏组织中egr3的mrna 相对表达量与aav9-empty sham组相比降低了0.4倍,说明aav9-shegr3有效敲除egr3的mrna表达,**表示p《0.01。
57.测试例3
58.1.1.小鼠心肌组织he染色:实施例2处理结束后,将得到的小鼠心脏样本在4%多聚甲醛溶液中固定,然后通过脱水包埋制备心脏组织的石蜡样本。石蜡切片,每片厚度为5μm。将小鼠心脏的石蜡样本先投入二甲苯中脱蜡,再逐级降乙醇浓度水化,之后采用he染色试剂盒(凯基cat:kga224)对切片进行染色。具体染色步骤为:首先样本上滴加1滴(50-100μl)苏木素染液染色5-10 分钟,用蒸馏水冲掉染液。其次滴加1滴(50-100μl)复合染液染色5分钟,冲掉染液。再滴加一滴(50-100μl)磷钼酸染色1分钟,甩干或自然晾干。最后滴加一滴(50-100μl)亮绿染液染色5分钟,冲掉染液,放入烘箱50-60℃烘干,中性树胶封片。将载玻片置于显微镜下观察和拍照,心肌组织细胞质呈红色,细胞核呈紫蓝色。通过nis-elements br软件采集图像并用imagej进行测量心肌细胞横截面积。结果见图6,比例尺:50μm。
59.图6中a为假手术小鼠尾静脉注射aav9-empty的小鼠心脏横截面代表图; b为假手术小鼠尾静脉注射aav9-shegr3的小鼠心脏横截面代表图;c为缺血再灌注损伤模型下小鼠尾静脉注射aav9-empty的小鼠心脏横截面代表图;d 为缺血再灌注损伤模型下小鼠尾静脉注射aav9-shegr3的小鼠心脏横截面代表图;e为心肌横截面的细胞大小统计结果图,从左到右分别为 aav9-empty sham、aav9-shegr3 sham、aav9-empty iri和 aav9-shegr3 iri处理组,各组心肌细胞横截面积依次为401.0μm2,408.0μm2, 549.6μm2,461.4μm2,说明敲低egr3能够改善缺血再灌注损伤小鼠心肌细胞横截面积的大小。
60.1.2.麦胚凝集素(wga)染色:实施例2处理结束后,将小鼠心脏组织横切样本置于oct复合物中并于-80℃冷冻定型。通过冰冻切片机制备小鼠心脏组织的冰冻切片,进行wga染色,具体染色步骤为:首先将冰冻切片复温15-30分钟,用pbs缓冲液洗涤3次,每次5分钟。其次用4%多聚甲醛固定15分钟, pbs缓冲液洗涤3次,每次5分钟。再用wga-fitc(sigma#l4895),染液避光孵育30分钟,pbs缓冲液洗涤。最后用hoechst(keygen#kga212-1)染液,避光孵育30分钟,pbs缓冲液洗涤后,避光条件下用50%甘油封片。在荧光显微镜(carlzeiss microscopy gmbh)下观察(hoechst激发波长为375nm,对应的发射波长425nm,以蓝光表示;wga-fitc激发波长485nm,发射波长 525nm,以绿光表示。),通过zen软件采集图像并用imagej测量心肌细胞横截面积。结果见图7,比例尺:50μm。
61.图7中a为假手术小鼠尾静脉注射aav9-empty的小鼠心脏横截面代表图; b为假手术小鼠尾静脉注射aav9-shegr3的小鼠心脏横截面代表图;c为缺血再灌注损伤模型下小鼠尾静脉注射aav9-empty的小鼠心脏横截面代表图;d 为缺血再灌注损伤模型下小鼠尾静脉注射aav9-shegr3的小鼠心脏横截面代表图,e为心肌横截面的细胞大小统计结果图,**表示p《0.01,***表示p《0.001,图7中e从左到右分别为aav9-empty sham、aav9-shegr3 sham、
aav9-empty iri和aav9-shegr3 iri处理组,各组心肌细胞横截面积依次为 423.4μm2,421.8μm2,563.8μm2,464.4μm2,说明敲低egr3能够改善缺血再灌注损伤小鼠心肌细胞横截面积的大小。
62.1.3马松染色:实施例2处理结束后,将小鼠心脏样本在质量浓度4%的多聚甲醛溶液中固定,然后通过脱水包埋制备心脏组织的石蜡样本。石蜡切片,每片厚度为5μm。将小鼠心脏的石蜡样本先投入二甲苯中脱蜡,再逐级降乙醇浓度水化。自来水冲洗15分钟后采用马松三色法染色试剂盒 (servicebio,cat:g1006)对切片进行染色。具体染色步骤为:首先用重铬酸钾 (massona液)浸泡过夜,流水冲洗15-20分钟。其次苏木素(masson b液: masson c液=1:1)染色,5-10分钟,流水冲洗。再用丽春红酸性复红染液(massond液)染色2-5分钟,流水冲洗。最后用磷钼酸水溶液(masson e液)分化2 分钟,苯胺蓝(masson f液)染色1分钟,流水冲洗。待切片自然晾干后,用中性树胶及盖玻片封片。将载玻片置于正置显微镜(nikon eclipse 80i)下观察和拍照,胶原纤维为蓝色,心肌组织细胞质呈红色,细胞核呈蓝黑色。通过 nis-elements br软件采集图像并用imagej进行计算胶原纤维面积及心肌组织面积,最后计算得到胶原纤维面积百分比,结果如图8,比例尺:50μm。
63.图8中a为假手术小鼠尾静脉注射aav9-empty的小鼠心脏纤维化代表图; b为假手术小鼠尾静脉注射aav9-shegr3的小鼠心脏纤维化代表图;c为缺血再灌注损伤模型下小鼠尾静脉注射aav9-empty的小鼠心脏纤维化代表图;d 为缺血再灌注损伤模型下小鼠尾静脉注射aav9-shegr3的小鼠心脏纤维化代表图;e为小鼠心脏纤维化统计结果图,图中,***表示p《0.001,从左到右分别为aav9-empty sham、aav9-shegr3 sham、aav9-empty iri和 aav9-shegr3 iri处理组,各组胶原纤维面积百分比依次为0.2898%,0.3202%, 10.22%,5.455%,说明敲低egr3能够改善缺血再灌注损伤小鼠心脏纤维化。
64.本发明提供的敲低或抑制egr3的试剂能够改善心肌缺血再灌注后心功能,降低心肌缺血再灌注后心脏纤维化,改善心肌缺血再灌注后心肌细胞肥大,为心肌缺血再灌注损伤和/或心力衰竭的诊断及治疗提供新的防治药物研发途径和药物作用靶点,具有十分重要的药用价值。
65.尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。