用于分析两性电解质批次变化的液相色谱法-质谱法(lc-ms)方法
1.相关申请交叉引用
2.本技术要求于2019年10月10日提交的美国临时专利申请序列号62/913,450的优先权的权益,所述美国临时专利申请的内容通过引用整体并入本文。
技术领域
3.本公开涉及通过电荷表征蛋白质组合物和使用液相色谱法-质谱法(lc-ms)表征两性电解质组合物的方法。
背景技术:
4.许多蛋白质经历产生蛋白质电荷变体的二次修饰,如脱酰胺、n端焦谷氨酸的形成、聚集、异构化、唾液酸化聚糖、碎片化和赖氨酸残基的糖化。在一些情况下,这些二次修饰和由此产生的电荷变体会影响蛋白质的结合、生物活性、患者安全和保质期。如等电聚焦凝胶电泳(ief)等工具和如毛细管等电聚焦(cief)和成像cief(icief)等毛细管等效工具可以用于分析蛋白质的电荷。这些技术对于表征和监测治疗性蛋白质(如基于蛋白质的药物产品和药物物质)的质量、纯度、稳定性和可变性非常重要。一种此类技术icief以其高分辨率、最短的开发时间、减少的样品量和快速的运行时间为生物制药开发做出了显著贡献。这些优势允许在整个制药过程中应用,从细胞培养开发和优化到商业质量控制(qc)释放和稳定性活动。
5.在cief和icief中,具有不同净电荷的蛋白质的分离是通过施加的电场将蛋白质聚焦在两性ph梯度中,基于固有等电电荷分离异构体来实现的。这种分离技术依赖于两性电解质在置于电势下时产生ph梯度。然后蛋白质种类基于其等电点或pi值迁移到毛细管上的不同区域。然而,在这些方法中用于产生ph梯度的两性电解质组合物的批次间变化会影响测定结果。先前表征两性电解质组合物对icief和相似技术的合适性的方法依赖于间接方法,如使用两性电解质组合物产生icief电泳图或参考蛋白的相似读数,并且比较由不同两性电解质组合物产生的所得电泳图。然而,这些方法成本高、耗时且使用大量蛋白质。因此,本领域需要改进的表征两性电解质组合物对如icief等方法的合适性的方法。本发明通过提供改进的方法来直接分析两性电解质组合物来满足这种需要。
技术实现要素:
6.本公开提供了鉴定具有合适的活性的测试两性电解质组合物的方法,所述方法包括:(a)使用液相色谱法-质谱法(lc-ms)鉴定至少一种测试两性电解质组合物和参考两性电解质组合物中的至少一种标志物;以及(b)确定所述至少一种标志物在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间的相似性或差异程度,其中如果所述至少一种标志物具有低协方差并且所述至少一种标志物的水平在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间不同,则所述至少一种测试两性电解质
组合物具有合适的活性,或者其中如果所述至少一种标志物具有高协方差并且所述至少一种标志物的水平在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间相似,则所述至少一种测试两性电解质组合物具有合适的活性;由此鉴定具有合适的活性的测试两性电解质组合物。
7.在本公开的方法的一些实施例中,步骤(a)包括(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的多种组分的准确质量/保留时间(amrt)或碰撞横截面(ccs)测量结果;(ii)使用s绘图绘制来自所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述多种组分的所述amrt或碰撞横截面测量结果的协方差;以及(iii)选择在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间不同的至少一种组分,其中所述差异包括在所述s绘图中为非0的协方差;由此鉴定用于表征所述至少一种测试两性电解质组合物的合适性的至少一种标志物。在一些实施例中,所述差异包括在所述s绘图中小于0的协方差。在一些实施例中,所述s绘图中的所述至少一种组分的协方差小于所述s绘图中的所述多种组分的至少20%、至少30%、至少40%、至少50%、至少60%、至少70%或至少80%的协方差。在一些实施例中,如果所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的水平不同,则所述至少一种测试两性电解质组合物具有合适的活性。
8.在本公开的方法的一些实施例中,所述至少一种标志物的水平的差异包括相对于所述至少一种标志物的归一化水平至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的水平差异。
9.在本公开的方法的一些实施例中,步骤(a)包括(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的多种组分的准确质量/保留时间(amrt)或碰撞横截面测量结果;(ii)使用s绘图绘制来自所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述多种组分的所述amrt或碰撞横截面测量结果的协方差;以及(iii)选择在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间相似的至少一种组分,其中所述相似性包括在所述s绘图中为非0的协方差;由此鉴定用于表征所述至少一种测试两性电解质组合物的合适性的至少一种标志物。在一些实施例中,所述差异包括在所述s绘图中大于0的协方差。在一些实施例中,所述s绘图中的所述至少一种组分的协方差大于所述s绘图中的所述多种组分的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的协方差。在一些实施例中,如果所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的水平相似,则所述至少一种测试两性电解质组合物具有合适的活性。
10.在本公开的方法的一些实施例中,所述至少一种标志物的所述水平的相似性包括相对于所述至少一种标志物的归一化水平至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%相似的水平。
11.在本公开的方法的一些实施例中,所述至少一种标志物通过质荷比(m/z)来鉴定。在一些实施例中,所述至少一种标志物的水平由质谱中的所述m/z的相对强度表征。
12.在本公开的方法的一些实施例中,步骤(b)包括:(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的lc-ms质谱;(ii)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述质谱中的
所述至少一种标志物的基峰的相对强度;(iii)相对于从所述至少一种测试两性电解质组合物或所述参考两性电解质组合物测得的所述基峰的最大相对强度,归一化所述至少一种标志物的所述基峰的所述相对强度;以及(iv)比较所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的所述基峰的归一化相对强度。
13.在本公开的方法的一些实施例中,所述至少一种标志物包括1种、2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种或16种具有不同m/z的标志物。在一些实施例中,所述至少一种标志物包括16种具有不同m/z的标志物。在一些实施例中,所述16种标志物包括m/z为280、m/z为319、m/z为329、m/z为347、m/z为373、m/z为375、m/z为376、m/z为431、m/z为504、m/z为506、m/z为508、m/z为520、m/z为534、m/z为562、m/z为906和m/z为980的标志物。
14.在本公开的方法的一些实施例中,所述质谱法包括离子迁移率四极飞行时间质谱法(ims-q-tof-ms)。
15.在本公开的方法的一些实施例中,所述液相色谱法包括高效液相色谱法(hplc)。在一些实施例中,所述hplc包括c4硅胶柱。
16.在本公开的方法的一些实施例中,所述方法进一步包括通过使用所述参考两性电解质组合物和所述至少一种测试两性电解质组合物产生参考蛋白的成像毛细管等电聚焦(icief)电泳图,由此产生至少一个测试电泳图和参考电泳图来验证所述至少一种测试两性电解质组合物。
17.在本公开的方法的一些实施例中,如果所述至少一个测试电泳图和所述参考电泳图相似,则验证所述测试两性电解质组合物。在一些实施例中,所述至少一个测试电泳图和所述参考电泳图的相似性由峰的数量、大小或等电点(pi)或其组合来确定。
18.在本公开的方法的一些实施例中,所述合适的活动包括毛细管等电聚焦(cief)或成像毛细管等电聚焦(icief)。在一些实施例中,所述icief用于表征蛋白质药物产品或药物物质。
附图说明
19.图1a-1b是一对使用成像毛细管等电聚焦(icief)测定分析参考蛋白产品的电泳图。x轴示出了时间(以分钟为单位),而y轴示出了吸光度。图1a使用两性电解质批次1。图1b示出了示例性候选两性电解质批次,其从相同的参考蛋白产生与图1a所示的两性电解质批次不同的电泳图。电泳图的差异被圈出。
20.图2是示出了基于icief中使用的两性电解质梯度的基线干扰的绘图。icief在没有参考蛋白的情况下运行。两性电解质浓度的增加使基线倾角下降。峰曲线的这种变化是由于两性电解质,而不是蛋白质或仪器。
21.图3是示出了两性电解质(两性电解质)浓度使区域面积变化的电泳图。两性电解质浓度变化2%会使区域1面积减少1%。
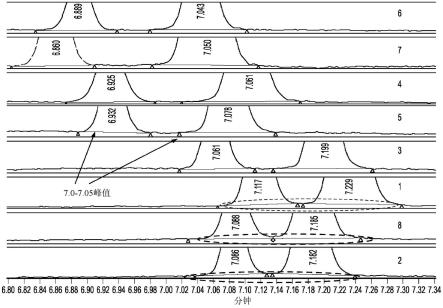
22.图4a-4b是一系列电泳图(图4a)和表格(图4b),示出了两性电解质批次内的分辨率变化。批次7和2是最适合用于与批次1最相似的批次进行统计分析的候选者。
23.图5a-5c是示出了两性电解质批次的等电点(pi或pi)标志物测试的一系列绘图。每个两性电解质批次的峰分辨率被计算在7.0与7.05之间。图5a示出了具有两个峰的示例
性电泳图。图5b展示了如何从电泳图计算分辨率。基于迁移(运行)时间(rt)和峰宽(w)计算分辨率。图5c示出了示例性电泳图,其中峰之间有0.15%的相互重叠,或分辨率为1.5,这是色谱最小标准。
24.图6是概述通过本公开的方法解决的问题的图。
25.图7是示出了两性电解质lc-ms分析工作流程的图。
26.图8a是示出了测试通用电气医疗集团ief载体两性电解质批次的分子组分的表格。
27.图8b是沃特世s绘图,示出了两性电解质批次的分子组成变化测试,而不是性能测试。液相色谱法-质谱法(lc-ms)用于鉴定两性电解质批次中的所关注组分,所述组分在批次之间具有高度变化。使用具有内置数据分析和工作流程的unifi软件进行分析。s绘图示出了两性电解质之间的准确质量/保留时间(amrt)差异。amrt对通过协方差绘制,其中x轴示出了变化的振幅,y轴示出了相关性,即变化的一致性。
28.图9a-9c是比较使用沃特世vion ims qtof离子迁移率四极飞行时间质谱法(lc-ims-q-tof-ms)表征的两性电解质批次的沃特世s绘图。图9a示出了批次1和2的比较。图9b示出了批次1和3的比较。图9c示出了批次1和5的比较。沃特世s绘图鉴定样品之间的相似性和差异,并提供强大的可视化过滤工具。为两性电解质组分文库选择了独特的特征,例如选择了批次1与批次5s绘图(图9c)中的突出显示点。
29.图10a是示出了两性电解质组分文库的表格,其特征在于m/z值(质荷比)和其在两性电解质批次编号1(在标准操作程序中使用的当前批,或sop批次)、2、3、4和5中的归一化相对强度。相对于所有两性电解质批次的最高相对强度,归一化相对强度。在excel中评估和比较标志物响应值。
30.图10b示出了使用5个不同的两性电解质批次分析参考蛋白1产品的icief电泳图。从上到下:批次1(sop)、批次3、批次4和批次5。icief曲线中的差异被圈出。
31.图10c示出了使用两性电解质批次1(顶部,sop)和2(底部)分析参考蛋白1产品的icief电泳图。批次2在分析lc-ms结果之后运行,并且预测其是与批次1最相似的批次(参见图10a)。
32.图11a是示出了来自所指示的每批两性电解质的标志物m/z 906.261的离子迁移率过滤的提取离子色谱图(xic)的绘图。xic的响应用于批次间比较。
33.图11b是示出了所指示的两性电解质批次的三个复制中的标志物(x轴指示批次和复制),对标志物强度(y轴,计数)的趋势绘图。如果标志物在当前批次的所有三个复制中都被鉴定并且在空白中未检测到,则认为标志物是相关的。
34.图12示出了来自用于表征两性电解质批次的文库中的三种标志物的结构。结构对应于具有底部处的m/z值的标志物。这些是可商购获得的阐明结果。
35.图13是将当前两性电解质测试过程与本文所描述的新的两性电解质测试方法进行比较的图。当前方法减少了分析时间,因为对新的两性电解质批次进行液相色谱法-质谱法(lc-ms)分析花费4小时。进一步,新的两性电解质测试方法允许在不消耗任何蛋白质产品的情况下进行两性电解质表征。最后,新的两性电解质测试方法适用于任何新的两性电解质供应商。对于每个供应商,可以使用本文所描述的方法创建新的标志物文库来比较两性电解质批次。
具体实施方式
36.本公开提供了为期望的下游应用鉴定具有合适的活性的两性电解质组合物的方法,所述方法包括:(a)使用液相色谱法-质谱法(lc-ms)鉴定至少一种测试两性电解质组合物和参考两性电解质组合物中的至少一种标志物;以及(b)确定所述至少一种标志物在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间的相似性或差异程度。在一些实施例中,基于参考两性电解质组合物与测试两性电解质组合物之间的差异选择标志物,并且如果至少一种测试两性电解质组合物与参考两性电解质组合物之间的至少一种标志物不同,则至少一种测试两性电解质组合物具有合适的活性。在一些实施例中,基于参考两性电解质组合物与测试两性电解质组合物之间的相似性选择标志物,并且如果至少一种测试两性电解质组合物与参考两性电解质组合物之间的至少一种标志物相似,则至少一种测试两性电解质组合物具有合适的活性。标志物可以通过质谱法测得的特定质荷比(m/z)来鉴定,并且水平或标志物可以通过指定的m/z峰的相对强度来确定,所述峰可以任选地进行归一化。可以相对于针对在分析中跨两性电解质组合物的指示m/z峰测得的最大相对强度进行这种归一化。标志物可以通过液相色谱分离步骤中的保留时间进一步表征。
37.合适下游应用的活性包含但不限于等电聚焦凝胶电泳(ief)和毛细管等效物,如毛细管等电聚焦(cief)和成像cief(icief)。
38.在一些实施例中,所述方法进一步包括通过使用所述参考两性电解质组合物和所述至少一种测试两性电解质组合物产生参考蛋白的成像毛细管等电聚焦(icief)电泳图,由此产生至少一个测试电泳图和参考电泳图来验证所述至少一种测试两性电解质组合物。测试电泳图和参考电泳图的相似性可以通过比较参考电泳图和测试电泳图的数量、大小、面积、分辨率和等电点(pi)或所有这些特性的组合来确定。
39.两性电解质组合物的用途
40.本公开提供了用于确定两性电解质组合物对一种或多种下游应用的合适性的方法。
41.有时被称为两性电解质的两性电解质组合物(例如,来自通用电气医疗集团(ge healthcare)的商业生产的两性电解质)用于多种基于等电电荷分离蛋白质的方法。可以使用本文所描述的方法优化两性电解质组合物的示例性方法包含但不限于等电聚焦凝胶电泳(ief)和毛细管等效物,如毛细管等电聚焦(cief)和成像cief(icief)。
42.如本文所用,“两性电解质”是指在其等电点(pi)值处和附近表现为两性离子的同时含有正电荷和负电荷两者的化合物。两性电解质可以充当酸或碱,这取决于引入它的溶液的ph。两性电解质有助于形成ph梯度,例如在icief和cief中聚焦期间。
43.等电点(pi)是分子不带净电荷的ph。对于蛋白质,等电点是蛋白质总电荷为零时的ph。
44.等电聚焦凝胶电泳(ief)
45.ief是用于基于电荷分离蛋白质的技术,所述技术涉及将两性电解质溶液添加到固定化ph梯度(ipg)凝胶中。ipg包括与ph梯度共聚的丙烯酰胺凝胶基质,其可以通过将载体两性电解质包埋在丙烯酰胺基质中来产生。所得ph梯度在电场中是稳定的,除了在高碱性(》12)的ph值下。用于蛋白质分离的ph梯度在添加蛋白质分析物之前通过首先将具有不同pi值的小分子(如聚两性电解质)溶液进行电泳已完全建立。
46.当施加电场时,处于低于其等电点(pi)的ph区域内的蛋白质将带正电,并且因此将向阴极(带负电的电极)迁移。当它通过增加ph的梯度迁移时,蛋白质的总电荷将减少,直到蛋白质达到与其pi相对应的ph区域。此时它不具有净电荷,并且因此迁移停止(因为对任一电极都没有电吸引力)。因此,蛋白质被聚焦成尖锐的固定带,其中每种蛋白质都定位于与其pi相对应的ph梯度中的某个点处。
47.毛细管等电聚焦(cief)和成像毛细管等电聚焦(icief)
48.毛细管等电聚焦(cief)和成像毛细管等电聚焦(icief)是主要基于蛋白质的等电(pi)固有净电荷使用分离蛋白质变体的分析技术。在cief和icief中,通过施加的电场将蛋白质样品聚焦在两性ph梯度中来进行样品分离。蛋白质样品与载体两性电解质、添加剂和pi标志物预先混合。然后将蛋白质样品在每端处带有电解槽的毛细管盒中分离。一个槽填充有酸(阳极液)并且另一个填充有碱(阴极液)。注射样品混合物以填充毛细管柱,并且将电压施加到阳极液槽和阴极液槽。这会产生ph梯度,所述梯度基于蛋白质(分析物)的pi沿毛细管分离和聚焦所述蛋白质。
49.在cief中,聚焦步骤之后是移动步骤,其中聚焦的分析物沿毛细管移动到毛细管出口并经过检测器,如uv或荧光检测器。移动方法包含流体动力或压力移动,即通过向毛细管施加气体,以及化学移动,其中阳极液或阴极液被具有高离子强度或不同ph的不同电解质溶液替代。
50.与cief相比之下,cief涉及跨检测器移动蛋白质样品,而在icief中,全柱检测器(如uv或荧光检测器)实时监测跨毛细管的整个过程。这允许对聚焦步骤进行密切监测,然后是即时的最终电荷变化曲线。因此,icief优于其它技术的优势包含高分辨率、高效运行时间和低样品消耗,使其成为生物制药行业中用于蛋白质表征的优选技术。
51.可变性和两性电解质组合物
52.蛋白质的cief或icief分析的输出可以是电泳图。在电泳图中,x轴示出了等电点或迁移时间。y轴示出了检测器的读数,通常以吸光度为单位。电泳图中的峰有时被称为吸光度峰。两性电解质组合物的变化会导致输出电泳图谱的变化。
53.使用测试两性电解质组合物产生的参考蛋白的电泳图相对于使用参考两性电解质组合物产生的相同参考蛋白的电泳图可以具有以下变化中的一个或多个变化:(1)增加一个或多个峰;(2)损失一个或多个峰;(3)一个或多个峰的pi或移动时间的移位;(4)一个或多个峰的峰下面积的变化;以及(4)一个或多个峰的分辨率变化。
54.因此,本公开提供了确定测试两性电解质组合物是否会产生与通过参考两性电解质产生的相同参考蛋白的电泳图相似的参考蛋白的电泳图的方法。在一些实施例中,所述方法包括:(a)使用液相色谱法-质谱法(lc-ms)鉴定至少一种测试两性电解质组合物和参考两性电解质组合物中的至少一种标志物;以及(b)确定所述至少一种标志物在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间的相似性或差异程度,其中如果所述至少一种标志物具有低协方差并且所述至少一种标志物的水平在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间不同,则所述至少一种测试两性电解质组合物具有合适的活性,并且其中如果所述至少一种标志物具有高协方差并且所述至少一种标志物的水平在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间相似,则所述至少一种测试两性电解质组合物具有合适的活性;由此鉴定具有合
适的活性的测试两性电解质组合物。
55.本公开进一步提供了验证使用本文所描述的方法表征的两性电解质组合物的活性的方法,所述方法包括使用参考两性电解质组合物和至少一种测试组合物产生电泳图,并且比较所述电泳图以确定其是否相似。
56.在一些实施例中,所述至少一个测试电泳图和所述参考电泳图的相似性由峰的数量、大小、分辨率或等电点(pi)或其组合来确定。
57.在一些实施例中,相似的电泳图具有相似或相同数量的峰(例如,峰数量变化3、2、1或0个峰)。作为另外的实例,测试电泳图和参考电泳图两者均包括以下或基本上由以下组成:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20个峰。
58.在一些实施例中,至少一个测试电泳图和参考电泳图的相似性包括相似的分辨率。
59.如本文所用,“分辨率”或“r”是分离(例如电泳图中一对吸光度峰的分离)的质量的量度。计算两个峰之间的分辨率的方法在图5a-5c中示出。1.5的分辨率(0.15%相互重叠)被认为是两个峰的基线分离和色谱最低标准。分辨率越高,两个峰的分离效果越好。分辨率是两个因素的组合,分离的选择性和效率。选择性考虑了两个峰的最大值之间的距离。峰越窄,分离效率越高。因此,窄峰和大峰间分离会产生大的r值。分辨率的计算使用两个峰的迁移时间或pi的差异(rt1,rt2)和峰的基宽(w1,w2)。
60.在一些实施例中,测试电泳图和参考电泳图的相似性包括小于0.30、小于0.25、小于0.20、小于0.175、小于0.15、小于0.13、小于0.12、小于0.11、小于0.10、小于0.08、小于0.075、小于0.07、小于0.05、小于0.03、小于0.02或小于0.01的分辨率差异。在一些实施例中,测试电泳图和参考电泳图的相似性包括小于0.075的分辨率差异。在一些实施例中,测试电泳图和参考电泳图的相似性包括小于0.072的分辨率差异。
61.在一些实施例中,测试电泳图和参考电泳图的相似性包括电泳图的区域中具有相似面积的一个或多个峰。在一些实施例中,测试电泳图和参考电泳图的特定区域中的一个或多个峰的面积差异具有小于或等于0.05的概率值(p值)。计算峰下面积的方法对于本领域技术人员或普通技术人员来说是已知的,并且包含例如将曲线方程拟合到峰并进行积分以找到封闭的面积。在一些实施例中,其峰面积被计算的参考电泳图和测试电泳图的特定区域可以由包含在分析物混合物中的特定pi标志物来定义。在一些实施例中,其峰面积被计算的参考电泳图和测试电泳图的特定区域可以通过共同跨电泳图的主峰的存在来定义。例如,电泳图可以分为主峰和相对于主峰呈酸性或碱性的区域。
62.显著性可以通过计算p值或概率值来确定,所述概率值是空模型(例如,两个峰偶然具有相同面积)为真的概率。计算p值的方法对于本领域普通技术人员来说是已知的,并且包含学生t测试、卡方测试(chi-square test,)、方差分析(anova)、皮尔逊相关系数和邦费罗尼-邓恩(bonferroni-dunn)。在一些实施例中,如果p值小于0.05,则认为结果是显著的。在一些实施例中,如果p值小于0.04、小于0.03、小于0.02或小于0.01,则认为结果是显著的。
63.在一些实施例中,测试电泳图和参考电泳图的特定区域中的一个或多个峰的面积差异具有小于或等于5%的变异系数(rsd%)。rsd百分比被定义为标准偏差与平均值的比率,并示出了与总体平均值相关的变异程度(例如,电泳图的复制)。计算rsd百分比的方法
对于本领域普通技术人员来说是已知的。在一些实施例中,如果rsd%小于5%,则数据集是可重现的。在一些实施例中,如果rsd%小于4%、小于3%、小于2%或小于1%,则数据集是可重现的。
64.使用液相色谱法-质谱法(lc-ms)表征两性电解质组合物
65.本文提供了使用液相色谱法-质谱法(lc-ms)表征两性电解质组合物的方法。在一些实施例中,所述方法包括:使用液相色谱法-质谱法(lc-ms)鉴定至少一种测试两性电解质组合物和参考两性电解质组合物中的至少一种标志物;以及确定所述至少一种标志物在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间的相似性或差异程度。至少一种标志物可以通过下文讨论的ms质荷比(m/z)来鉴定,并且所述至少一种标志物的水平由ms测量具有给定m/z的每种标志物的相对强度确定。在一些实施例中,所述方法包括:使用液相色谱法-质谱法(lc-ms)鉴定至少一种测试两性电解质组合物和参考两性电解质组合物中的多种标志物;以及确定所述多种标志物在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间的相似性或差异程度。
66.液相色谱法-质谱法(lc-ms)是组合了液相色谱法(例如,高效液相色谱法,或hplc)的物理分离能力与质谱法(ms)的质量分析能力的分析化学技术。液相色谱法分离具有多种组分的混合物,而质谱法提供具有高分子特异性和检测灵敏度的单独组分的结构同一性和水平。
67.在ep3143392中描述了液相色谱法和质谱法,所述文献的内容通过引用并入本文。
68.如本文所用,术语“色谱法”是指其中包括液体或气体的化学混合物由于化学实体在围绕、流过和/或通过固定液相或固相时的不同分布而被分离成组分的过程。“液相色谱法”或“lc”是指当流体均匀地渗透通过细碎物质柱或通过毛细管通道时选择性延迟流体溶液的一种或多种组分的过程。当此流体相对于固定相移动时,所述延迟是由一种或多种固定相与本体流体(即,流动相)之间的混合物的组分的分布引起的。液相色谱法包含但不限于反相液相色谱法(rplc)、高效液相色谱法(hplc)、高湍流液相色谱法(htlc)和超高效液相色谱法。“保留时间”是指特定分析物(如两性电解质组合物组分)在洗脱之前被液相色谱底物保留的时间长度。
69.如本文所用,术语“高效液相色谱法”或“hplc”是指其中通过迫使流动相在压力下通过固定相,通常是密集填充柱来增加分离度的液相色谱法。
70.如本文所用,术语“超高效液相色谱法”或“uplc”是指与hplc相比具有增强的速度、灵敏度和分辨率的液相色谱方法。通常,uplc适用于直径小于2μm的粒子。uplc中的分离和定量是在极高的压力(至多100m pa)下进行的。
71.气相色谱法(gc)是一种使用流过柱(如玻璃或金属柱)的气体以基于挥发性和与液体固定相的相互作用来分离化合物的分离技术。流动相,即载气,通常是惰性气体如氦气或非反应性气体如氮气。
72.使用质谱仪进行质谱法,所述质谱仪包含用于电离样品并产生带电分子以进行进一步分析的离子源。在各个实施例中,两性电解质组合物和其组分可以通过本领域技术人员已知的任何方法进行电离。用于各种ms技术的电离源包含但不限于电子电离、化学电离、电喷雾电离(esi)、光子电离、大气压化学电离(apct)、光电离、大气压光电离(appi)、快速原子轰击(fab)/液体二次电离(lsims)、基质辅助激光解吸电离(maldi)、场电离、场解吸、
热喷雾/等离子喷雾电离、表面增强激光解吸电离(seldi)、电感耦合等离子体(icp)、粒子束电离和离子迁移率分离(ims)。本领域技术人员将理解,可以基于待测量分析物、样品类型、检测器类型、正模式与负模式的选择等来确定电离方法的选择。
73.如本文所用,术语“质谱法”或“ms”是指通过其质量识别化合物的分析技术。ms是指基于离子的质荷比(m/z)过滤、检测和测量离子的方法。ms技术通常包含将化合物电离以形成带电物质(例如,离子)并检测离子的确切质量除以其电荷,被称为m/z。化合物可以通过任何合适的方式被电离和检测。“质谱仪”通常包含离子发生器和离子检测器。通常,一个或多个所关注分子被电离,并且随后离子被引入到质谱仪器中,其中由于磁场和电场的组合,离子遵循空间中的路径,这取决于质量(“m”)和电荷(“z”)。参见例如,美国专利第6,204,500号;第6,107,623号;第6,268,144号以及第6,124,137号。
74.ms可以产生和检测正离子和负离子两者。如本文所用,术语“电离(ionization)”或“电离(ionizing)”是指产生具有等于一个或多个电子单位的净电荷的分析物离子的过程。正离子是那些具有一个或多个电子单元的净正电荷的离子。负离子是那些具有一个或多个电子单元的净负电荷的离子。在“电子电离”或“ei”方法中,气相或汽相的分析物与电子流相互作用。电子与分析物的碰撞产生分析物离子,所述分析物离子然后可以经历质谱技术。ei可以与气相色谱法(gc)或液相色谱方法组合使用。在“化学电离”或“ci”中,反应气(例如氨)经历电子撞击,并且分析物离子通过反应气离子和分析物分子的相互作用形成。在“快速原子轰击”或“fab”中,高能原子(通常是xe或ar)束撞击非挥发性样品,使样品中含有的分子解吸和电离。将测试样品溶解在粘性液体基质中,如甘油、硫代甘油、间硝基苄基醇、18-冠-6冠醚、2-硝基苯基辛基醚、环丁砜、二乙醇胺和三乙醇胺。为化合物或样品选择适当的基质是经验过程。
75.如本文所用,术语“基质辅助激光解吸电离”或“maldi”是指其中将非挥发性样品暴露于激光辐照的方法,所述方法通过各种电离途径,包含光-电离、质子化、去质子化和团簇衰变,解吸和电离样品中的分析物。对于maldi,样品与能量吸收基质混合,这促进分析物分子的解吸。maldi-tof是指基质辅助激光解吸/电离飞行时间(maldi-tof)质谱法(ms)。maldi-tof适用于至多约15,000道尔顿的化合物。
[0076]“表面增强激光解吸电离”或“seldi”是指其中将非挥发性样品暴露于激光照射下的另一种方法,所述方法通过各种电离途径,包含光电离、质子化、去质子化和团簇衰变,解吸和电离样品中的分析物。对于seldi,样品通常与优选地保留一种或多种所关注分析物的表面结合。与maldi一样,此过程也可以采用能量吸收材料来促进电离。
[0077]“电喷雾电离”或“esi”是指其中溶液沿较短长度的毛细管通过,在其末端施加高正电或负电势的方法。到达试管的末端的溶液被蒸发(雾化)成溶剂蒸汽中的非常小的溶液液滴的喷射或喷雾。这种液滴雾流过蒸发室,所述蒸发室被轻微加热以防止冷凝和蒸发溶剂。随着液滴变小,表面电荷密度增加,直到相似电荷之间的自然排斥使离子以及中性分子被释放。
[0078]“大气压化学电离”或“apci”是指相似于esi的质谱方法;然而,apci通过在大气压下等离子体内发生的离子-分子反应产生离子。等离子体通过喷射毛细管与对电极之间的放电来维持。然后离子通常通过使用一组差动泵浦分离器级被提取到质量分析器中。干燥和预热的n2气的逆流可以用于改善溶剂的去除。apci中的气相电离可以比esi更有效地分
析极性较小的物质。
[0079]
如本文所用,术语“大气压光电离”或“appi”是指质谱的形式,其中分子m的光电离机制是光子吸收和电子发射以形成分子m 。因为光子能量通常刚好高于电离势,所以分子离子不易解离。
[0080]
如本文所用,术语“电感耦合等离子体”或“icp”是指样品在足够高的温度下与部分电离的气体相互作用以使大多数元素原子化和电离的方法。
[0081]
如本文所用,“离子迁移率光谱法”有时也被称为“离子迁移率分离”或“ims”是指基于气相离子与碰撞气体和其质量的相互作用来分离气相离子的分析化学方法。在第一步骤中,使用离子迁移率谱仪在毫秒时间尺度上通过缓冲气体根据其迁移率分离离子。然后在第二步骤中将分离的离子引入到质量分析器中,在所述步骤中可以在微秒时间尺度上确定其质荷比。
[0082]
如本文所用,术语“场解吸”是指将非挥发性测试样品置于电离表面上并使用强电场产生分析物离子的方法。
[0083]
如本文所用,术语“解吸”是指从表面去除分析物和/或分析物进入气相。
[0084]
在将两性电解质组合物或其组分电离之后,可以分析由此产生的离子以确定m/z。用于确定m/z的合适的分析器包含四极分析器、离子阱分析器、飞行时间分析器、傅里叶变换离子回旋共振(fticr)分析器和orbitrap光谱仪。可以使用几种检测模式之一来检测离子。例如,可以使用选择性离子监测模式(sim)仅检测所选离子,或者可替代地,可以使用扫描模式(例如,多反应监测(mrm)或所选反应监测(srm))检测多个离子。
[0085]
在一些实施例中,使用四极分析器(仪器)确定m/z。在“四极”或“四极离子阱”仪器中,振荡射频场中的离子经历与施加在电极之间的dc电势、rf信号的振幅和m/z成正比的力。可以选择电压和振幅,使得仅具有特定m/z的离子行进四极的长度,而所有其它离子都被偏转。因此,四极仪器既可以充当“质量过滤器”,又可以充当注射到仪器中的离子的“质量检测器”。在飞行时间(tof)中,离子在使用接地电极和排斥电极的均匀静电场中被加速。动能保持恒定,并且离子沿无场tof管向下行进。因为动能是恒定的(ke=1/2mv^2),与较大的m/z相比,具有较小m/z的那些将具有更大的速度。“四极飞行时间”或“qtof”质谱法是指一种使用将用作碰撞池的四极与飞行时间分析器配对的质谱仪的质谱法。这允许同时对所有离子进行高分辨率、高质量准确度分析。在示例性qtof系统中,样品由在线液相色谱系统递送并电离。在进入tof分析器之前,粒子束然后行进穿过离子导向器进入四极。在一些实施例中,ms技术可以采用“串联质谱法”或“ms/ms”。在此技术中,从所关注分子产生的前体离子(也被称为母离子)可以在ms仪器中过滤,并且前体离子随后被碎片化以产生然后在第二ms程序中进行分析的一个或多个碎片离子(也被称为子离子或产物离子)。通过仔细选择前体离子,仅某些分析物产生的离子才能进入碎片化室,在所述碎片化室中,与惰性气体的原子碰撞产生碎片离子。由于前体离子和碎片离子两者都是在给定的电离/碎片化条件下以可重复的方式产生的,因此ms/ms技术可以提供极其强大的分析工具。例如,过滤/碎片化的组合可以用于消除干扰物质,并且可以特别用于复杂样品,如生物样品。
[0086]
质谱仪通常为用户提供离子扫描或质谱;即,在给定范围(例如,400到1600m/z)内具有特定m/z的每个离子的相对丰度。质谱可以通过本领域已知的多种方法与样品中的分析物(例如两性电解质组合物的组分)的量相关。例如,如果仔细控制采样和分析参数,则可
以将给定离子的相对丰度(有时被称为相对强度)与将所述相对丰度转换为原始分子绝对量的表格进行比较。可替代地,分子标准可以与样品一起运行,并且基于从这些标准产生的离子信号构建标准曲线。产生和使用此类标准曲线的方法在本领域中是众所周知的,并且普通技术人员能够选择适当的内部标准。用于使离子的量与原始分子的量相关的许多其它方法对于本领域普通技术人员来说是众所周知的。
[0087]
当离子与检测器碰撞时,所述离子会产生电子脉冲,所述电子被转换为数字信号。所获取的数据被中继到计算机,所述计算机绘制每单位时间的离子计数。测量与特定离子相对应的峰下面积或此类峰的振幅,并且所述面积或振幅与两性电解质组合物中的所关注组分或标志物的量相关。在某些实施例中,测量碎片离子和/或前体离子的曲线下面积或峰的振幅,以确定具有给定m/z的分析物的量。如上文所描述的,相对丰度(有时被称为相对强度)或给定离子的响应可以使用基于内部分子标准的一个或多个离子的峰的校准标准曲线转换成原始分析物的绝对量。然后可以将通过lc-ms检测到的两性电解质组合物组分的绝对量转换成原始样品中存在的组分的绝对量。
[0088]
相对丰度或相对强度也可以定义为质谱的y轴。在一些实施例中,可以相对于质谱的最丰富离子(基峰)的量来定量标志物的量。在一些实施例中,可以使用响应因子或标准曲线来定量标志物的量。在一些实施例中,定量标志物的量包括:(1)包含样品中的内部标准物,例如参考两性电解质和/或测试两性电解质组合物;以及(2)相对于样品中的内部标准物归一化所述标志物。在一些实施例中,定量标志物的量进一步包括(3)相对于跨多种两性电解质组合物测量的标志物的最大校正量归一化所述标志物。例如,可以相对于从来自同一制造商的多个两性电解质批次测量的标志物的最大校正响应(也被称为相对强度)归一化所述标志物。内部标准物包含但不限于
13c6-卡马西平(carbamazepine),其在运行中洗脱并具有高电离效率。
[0089]
在一些实施例中,内部标准物的响应可以用于归一化每个m/z的响应值,以解释仪器漂移。
[0090]
在一些实施例中,保留时间(rt)的变化、碰撞横截面(ccs)的变化或两者的变化以及内部标准物在运行过程中的m/z可以用于设置用于标志物分配的参数的公差。
[0091]
在一些实施例中,例如相对于跨多种两性电解质组合物测量的所述标志物的最大相对强度,归一化两性电解质组合物的标志物或组分的相对强度。
[0092]
如本文所用,“准确质量”,有时被称为“测量的准确质量”是来自ms的实验确定的质量,其允许确定分析物如两性电解质组合物组分的元素组成。“准确质量/保留时间”或“amrt”是指(1)两性电解质组合物的组分在液相色谱法期间的保留时间和(2)通过质谱法测量的组分的准确质量的组合。
[0093]
如本文所用,“碰撞横截面”或ccs数据可以通过离子迁移率实验获得。所述碰撞横截面是单独离子与中性气体分子之间相互作用的有效区域,并且与离子的如化学结构和尺寸等特性有关。所述碰撞横截面可以使用如漂移管离子迁移率测量或行进波ims等方法得出。例如,在不同的电场下进行多次测量以计算ccs值。
[0094]
在一些实施例中,lc-ms包括超高效液相色谱串联离子迁移率四极飞行时间质谱法(uplc-ims-q-tof_ms)。
[0095]
合适的lc-ms仪器和系统包含但不限于用于生物制药公司的bioaccord lc-ms系
统(沃特世(waters))、与沃特世vion ims-q-tof-ms组合的waters acquity uplc h-class、安捷伦ultivo lc/ms系统和orbitrap lc-ms系统(赛默飞世尔公司(thermofisher))。
[0096]
确定两性电解质组合物的标志物
[0097]
本公开提供了鉴定两性电解质组合物中的至少一种标志物的方法,所述方法包括:(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的多种组分的准确质量/保留时间(amrt)测量结果或碰撞横截面测量结果;(ii)使用s绘图绘制来自所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述多种组分的所述amrt测量结果的协方差;以及(iii)选择在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间不同的至少一种组分,或者选择在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间相似的至少一种组分,由此鉴定用于表征所述至少一种测试两性电解质组合物的合适性的至少一种标志物。
[0098]
可以通过本领域已知的任何统计方法来确定两性电解质组合物组分的amrt测量结果之间的相似性和差异。一种方法涉及计算和绘制至少一种测试两性电解质组合物与参考组合物的组分之间的amrt对的协方差。如本文所用,协方差是指两个随机变量的联合可变性。如果一个变量的较大值主要与另一个变量的较大值相对应,并且较小的值也是如此(即,变量倾向于示出相似的行为),则协方差为正。在相反的情况下,当一个变量的较大值主要与另一个变量的较小值相对应时(即,变量倾向于示出相反的行为),协方差为负。
[0099]
可以使用如主分量分析(pca)、潜在结构的正交投影-判别分析(opls-da)和沃特世s绘图等方法来计算协方差,这些方法对于本领域的普通技术人员来说是已知的。
[0100]“主分量分析”或“pca”是使用正交变换将一组可能相关的变量转化成被称为主分量的线性不相关的变量的一组值的统计程序。此变换是以此方式定义的:第一主分量具有最大可能方差(也就是说,尽可能多地考虑数据中的可变性),并且每个后续分量进而在与前面的分量正交的约束下具有最高方差。因此,pca允许将大量多变量数据减少为不相关的变量,也被称为主分量。pca的局限性在于无法从绘图中确定关于单独样品组的信息。
[0101]
在一些实施例中,可以使用对潜在结构的正交投影-判别分析(opls-da)进一步挖掘数据。此统计分析允许鉴定有助于观察到两组之间的总体差异的特定特征(例如,两性电解质种类)。
[0102]
在一些实施例中,pca和任选地opls-da数据可以被视为s绘图。s绘图是一种绘制两组值之间差异的统计方法。因此,s绘图比较了两个样品(例如,其中n=3个测量结果,最小值)。例如,来自参考两性电解质组合物和测试两性电解质组合物的组分的amrt对和/或ccs测量结果可以使用s绘图绘制。在s绘图中,协方差或变化振幅绘制在x轴上,而相关性(即变化的一致性)绘制在y轴上。标志物定位于x轴距离原点越远,其对组之间的方差的贡献越大,而沿y轴越远的标志物代表分析结果的可靠性越高。在示例性s绘图中,绘制了来自至少一种测试两性电解质组合物和参考两性电解质的amrt对的协方差。s绘图上的每个点都是特定的m/z,具有相关的rt和ccs值。标志物是通过复制品之间的一致性对变化的振幅来绘制的。沿x轴离原点越远,样品之间的强度(或相对浓度)差异越大。组之间的差异可以来自仅存在于一组中的标志物,或者来自组之间强度变化很大的标志物。在y轴上离原点越远,分析结果在三次测量中越可靠。s绘图可以用于鉴定批次之间哪些特征差异最大,并且
那些标志物可以用于产生筛选文以表征两性电解质批次。
[0103]
在一些实施例中,鉴定至少一种标志物以确定两性电解质组合物的合适性的方法包括:(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的多种组分的准确质量/保留时间(amrt)测量结果;(ii)使用s绘图绘制来自所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述多种组分的所述amrt测量结果的协方差;以及(iii)选择在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间不同的至少一种组分,其中所述差异包括在所述s绘图中小于0的协方差;由此鉴定用于表征所述至少一种测试两性电解质组合物的合适性的至少一种标志物。当s绘图上的协方差小于0时,amrt配对值在参考两性电解质组合物与测试两性电解质组合物之间呈负相关。因此,基于参考两性电解质组合物与测试两性电解质组合物之间的差异选择至少一种标志物,并且所述至少一种标志物在参考两性电解质组合物与测试两性电解质组合物之间的存在和/或水平的差异确定测试两性电解质组合物的合适性。
[0104]
在一些实施例中,例如其中所述至少一种标志物是参考两性电解质组合物与测试两性电解质组合物之间的差异的标志物的那些实施例中,所述s绘图中的被选择作为标志物的至少一种组分的协方差小于所述s绘图中的所述多种组分的至少20%、至少30%、至少40%、至少50%、至少60%、至少70%或至少80%的协方差。
[0105]
在一些实施例中,所述至少一种标志物的水平的差异包括相对于所述至少一种标志物的归一化水平至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%或至少90%的水平差异。例如,参考两性电解质组合物包括标准化水平为100%的至少一种标志物,并且测试两性电解质组合物包括标准化水平为30%的至少一种标志物。标志物可以通过质荷比(m/z)来表征,并且标志物的水平由相对于本文所描述的最大相对强度归一化的相对强度确定。
[0106]
在一些实施例中,鉴定至少一种标志物以确定两性电解质组合物的合适性的方法包括:(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的多种组分的准确质量/保留时间(amrt)测量结果;(ii)使用s绘图绘制来自所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述多种组分的所述amrt测量结果的协方差;以及(iii)选择在所述至少一种测试两性电解质组合物与所述参考两性电解质组合物之间相似的至少一种组分,其中所述相似性包括在所述s绘图中大于0的协方差;由此鉴定用于表征所述至少一种测试两性电解质组合物的合适性的至少一种标志物。当s绘图上的协方差大于0时,amrt配对值在参考两性电解质组合物与测试两性电解质组合物之间呈正相关。因此,基于参考两性电解质组合物与测试两性电解质组合物之间的相似性选择至少一种标志物,并且所述至少一种标志物在参考两性电解质组合物与测试两性电解质组合物之间的存在和/或水平的相似性确定测试两性电解质组合物的合适性。
[0107]
在一些实施例中,例如其中所述至少一种标志物是参考两性电解质组合物与测试两性电解质组合物之间的相似性的标志物的那些实施例中,所述s绘图中的被选择作为标志物的至少一种组分的协方差大于所述s绘图中的所述多种组分的至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的协方差。
[0108]
在一些实施例中,如果所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的水平相似,则所述至少一种测试两性电解质组合物具
有合适的活性。在一些实施例中,所述至少一种标志物的所述水平的相似性包括相对于所述至少一种标志物的归一化水平至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%相似的水平。例如,参考两性电解质组合物包括标准化水平为100%的至少一种标志物,并且测试两性电解质组合物包括标准化水平为至少90%的至少一种标志物。作为另外的实例,参考两性电解质组合物包括标准化水平为100%的至少一种标志物,并且测试两性电解质组合物包括标准化水平为至少80%的至少一种标志物。标志物可以通过质荷比(m/z)来表征,并且标志物的水平由相对于本文所描述的最大相对强度归一化的相对强度确定。
[0109]
本公开提供了确定至少一种标志物在至少一种测试两性电解质组合物与参考两性电解质组合物之间的相似度或差异程度的方法。在一些实施例中,所述方法包括:(i)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的lc-ms质谱;(ii)确定所述至少一种测试两性电解质组合物和所述参考两性电解质组合物的所述质谱中的所述至少一种标志物的基峰的相对强度;(iv)相对于从所述至少一种测试两性电解质组合物或所述参考两性电解质组合物测得的所述基峰的最大相对强度,归一化所述至少一种标志物的所述基峰的所述相对强度;以及(iv)比较所述至少一种测试两性电解质组合物和所述参考两性电解质组合物中的所述至少一种标志物的所述基峰的归一化相对强度的相对强度。
[0110]
在一些实施例中,所述至少一种标志物包括多种标志物。在一些实施例中,所述至少一种标志物包括至少2种、3种、4种、5种、10种、15种、20种、25种、30种、35种、40种、45种、50种、75种或100种具有不同m/z的标志物。
[0111]
在一些实施例中,所述至少一种标志物包括1种、2种、3种、4种、5种、6种、7种、8种、9种、10种、11种、12种、13种、14种、15种或16种具有不同m/z的标志物。
[0112]
在一些实施例中,所述至少一种标志物包括16种具有不同m/z的标志物。在一些实施例中,所述16种标志物包括m/z为280、m/z为319、m/z为329、m/z为347、m/z为373、m/z为375、m/z为376、m/z为431、m/z为504、m/z为506、m/z为508、m/z为520、m/z为534、m/z为562、m/z为906和m/z为980的标志物。
[0113]
可以使用本文所描述的方法相对于参考两性电解质组合物从头确定可以用于表征测试两性电解质组合物的具有不同m/z的合适的多种标志物。例如,通过lc-ms表征参考两性电解质组合物和测试两性电解质组合物,通过s绘图绘制amrt对,并且基于协方差选择至少一种或多种标志物。
[0114]
可替代地或另外地,测试两性电解质组合物可以使用本文所描述的方法通过与先前使用本文所描述的方法确定的标志物的预定文库进行比较来表征。例如,测试两性电解质组合物的至少一种或多种标志物的相对强度可以通过lc-ms确定,并且与预定的参考或标准标志物文库进行比较。
[0115]
本说明书阐述了大量示例性配置、方法、参数等。然而,应认识到,此描述并非旨在限制本公开的范围,而是作为示例性实施例的描述而提供。
[0116]
实例
[0117]
实例1:用于确定蛋白质电荷变异水平和/或蛋白质产品的身份的成像毛细管等电聚焦(icief)方案
[0118]
icief用于对已建立书面规范的药物物质、调配的药物物质、药物产品和过程中材料进行实验室测试。当用于针对规格的释放测试时,必须遵循icief的标准操作程序(sop),并且必须解决任何偏差。以下是示例性icief sop方案,其结果受sop方案中使用的两性电解质批次的批次间变化的影响。
[0119]
定义
[0120]
icief-成像毛细管等电聚焦。
[0121]
pi-等电点,其中净电荷为零的分子的ph值。
[0122]
区域1(酸性)-与icief电泳图的最大峰相比,酸性相对较高的一组峰。
[0123]
区域2(中性)-对应于最大蛋白质峰/峰的主峰/峰。
[0124]
区域3(碱性)-与icief电泳图的最大峰相比,相对碱性的一组峰。
[0125]
两性电解质-含有正电荷和负电荷两者的化合物,其在其pi值处或附近表现为两性离子。两性电解质有助于在聚焦期间形成ph梯度。
[0126]
转移时间测量-为确保适当样品注射而进行的实验。在启动ice3仪器或安装新盒时执行测量。
[0127]
预混模式-蛋白质样品与载体两性电解质、添加剂和pi标志物预混。
[0128]
材料
[0129]
·
安全锁艾本德管,1.5ml(vwr,目录号21008-959)或相同结构材料的相似管
[0130]
·
cief盒fc涂层(proteinsimple,pn 101701)
[0131]
·
10ml琥珀色小瓶,22
×
75,带盖(薄隔垫)(proteinsimple,pn 045-139)
[0132]
·
具有300μl模制插件的聚丙烯小瓶(proteinsimple,pn 045-133)
[0133]
·
隔垫包ice3(300μl盖)(proteinsimple,pn 045-134)
[0134]
·
电解质移液器(proteinsimple,pn 101788)或相同构建材料的相似移液器
[0135]
·
显微注射器转移毛细管,涂层(proteinsimple,pn 102694)
[0136]
·
5ml天然微管(阿戈斯技术公司(argos technologies),目录号t2076)或相同构建材料的相似管
[0137]
·
带有ultracel-10膜的amicon ultra-0.5离心过滤单元(密理博(millipore),目录号ufc501096)
[0138]
化学品
[0139]
·
水,通过milli-q系统纯化或购买,例如hplc级水(vwr,目录号jt4218-3)或注射用水(wfi),(app制药公司(app pharmaceuticals),目录号918510)
[0140]
·
适当的抗体参考标准(当前标准批次)
[0141]
·
尿素(西格玛-奥德里奇公司(sigma-aldrich),百奥素(bioxtra)目录号u0631)
[0142]
·
3-10种两性电解质(vwr目录号17-0456-01或西格玛目录号p1522-25ml)储存在2-8℃下。
[0143]
·
0.5%甲基纤维素(mc)溶液(proteinsimple,pn 102505)
[0144]
·
1%甲基纤维素(mc)溶液(proteinsimple,pn 101876)
[0145]
·
电解质试剂盒(proteinsimple,pn 102506):
[0146]
ο100ml 0.08m h3po4
[0147]
ο100ml 0.1m naoh
[0148]
·
pi标志物pi 5.12(proteinsimple,pn 102224)
[0149]
·
pi标志物pi 9.50(proteinsimple,pn 101996)
[0150]
设备
[0151]
·
用于测试制备的微型离心机
[0152]
·
proteinsimple ice3电荷变异分析器
[0153]
·
vwr单通道移液器(vwr#89130-554、556、560、562、566)或相似量程的移液器
[0154]
·
无菌移液器吸头(vwr)或与所用移液器匹配的吸头
[0155]
·
容积式移液器(rainin#mr-10、mr-100、mr-250、mr-1000)
[0156]
·
rainin阳性移液器吸头(rainin#c-10、c-100、c-250、c-1000)
[0157]
·
eppendorf repeater plus移液器(vwr,目录号21516-002)
[0158]
·
eppendorf combitips移液器吸头(vwr,目录号21516-138)
[0159]
·
分析天平
[0160]
试剂溶液
[0161]
可以根据需要调整试剂溶液的体积。
[0162]
8m尿素溶液:要制备8m尿素溶液,在5ml锥形管中称取2.4g尿素。缓慢添加水至大约4ml刻度,搅拌混合物直至尿素溶解。用水使溶液达到5ml的最终体积。均匀混合。每天新鲜制备。
[0163]
主混合物:以下是应根据需要进行缩放的单一制剂。对于通用icief方法,推荐使用pi 5.12标志物和pi 9.50标志物作为酸性标志物和碱性标志物。主混合物应充分混合,并且每天新鲜制备。
[0164]
表1.主混合物
[0165]
组分量8m尿素溶液50μl3-10种两性电解质8μl1%甲基纤维素(mc)溶液70μl水30μlpi标志物(酸性)1μlpi标志物(碱性)1μl
[0166]
程序
[0167]
可以使用标准启动程序来启动ice3。
[0168]
参考标准制备:任何当前的参考标准都可以用于证明系统合适性。适当的参考样品用水稀释至2mg/ml。标准物通过轻轻倒置混合,并且离心管在微型离心机中旋转大约15秒。
[0169]
在单独的试管中,将40μl的2mg/ml参考标准或测试制品制剂与160μl的主混合物混合。为了进行所需的系统合适性进样,必须至少制备2个小瓶。这种制备可以相应地缩放。轻轻倒置混合并旋转大约15秒以将内容物驱动至管的底部。
[0170]
过程中样品制备:用水将过程中样品稀释至2mg/ml。通过轻轻倒置进行混合。通过将过滤器放置在干净的微型离心管中来组装离心过滤装置。通过将400μl水移液到过滤器中来预润湿过滤器的膜,确保覆盖整个膜。通过移液器从过滤器中去除水,并且将水丢弃在
废液容器中。将200μl的稀释2mg/ml过程中样品装载到预湿过滤器中。通过在附接的过滤器中盖上微型离心管来关闭离心过滤装置。以14,000相对离心力(rcf)将装置离心持续15分钟。
[0171]
从离心机中去除装置。从装置中去除过滤器并将其倒置到干净的微型离心管中。丢弃含有已去除缓冲液的微型离心管。一旦将过滤器放置在干净的微型离心管中,所述微型离心管将无法加盖。将带有倒置过滤器的无盖装置放置在离心机中并以1,000rcf旋转持续2分钟。离心后,浓缩的蛋白质将处于微型离心管中。丢弃过滤器。
[0172]
在180μl水中重组浓缩蛋白质。轻轻倒置混合并旋转大约15秒以将内容物驱动至管的底部。
[0173]
将40μl的经过滤的样品与160μl主混合物混合。轻轻倒置混合并旋转大约15秒以将内容物驱动至管的底部。
[0174]
药物物质、调配的药物物质和/或药物产品制剂:如果样品浓度低于20mg/ml,则应遵循上文针对过程中样品描述的缓冲液更换程序,而不是下文针对药物物质、调配的药物物质或药物产品制剂的方案。
[0175]
如果药物物质、调配的药物物质或药物产品是抗体,则在制备期间的任何时间都不应涡旋。
[0176]
使用水将测试制品(药物物质、调配的药物物质或药物产品)稀释至2mg/ml。通过轻轻倒置进行混合,并且在微型离心机中旋转离心管大约15秒。在单独的试管中,将40μl的2mg/ml测试制品制剂与160μl的主混合物混合。轻轻倒置混合并旋转大约15秒以将内容物驱动至管的底部。
[0177]
空白制备:将40μl水与160μl主混合物混合。轻轻倒置混合并旋转大约15秒以将内容物驱动至管的底部。
[0178]
使用ice3仪表化装载样品:使用ice3预混模式。将如上文所描述制备的150μl的样品上清液(参考标准物/参考溶液、测试制品和空白制备)转移到具有300μl模制插件的聚丙烯小瓶中。确保小瓶的底部没有气泡。
[0179]
将样品瓶放置到alcott 720自动采样器中。用大约8ml的0.5%甲基纤维素(mc)填充10ml琥珀色小瓶,并且将其放置在自动采用器中的“d”位置中。每天使用新鲜的mc溶液以防止微生物生长。将水管线插入到一瓶新鲜的milli-q水中,并且放置在仪器上方。将废液管线放置到指定的废液容器中。
[0180]
批量设置和启动(ice3):打开cfr软件。单击批处理/数据并选择开发。将出现“批处理文件控制”窗口。使用以下选项之一创建批处理文件:
[0181]
(1)创建新的批处理文件,输入批处理文件名并且选择文件夹来保存批处理。选择注射运行的编号并单击新文件。
[0182]
(2)使用先前保存的批处理文件作为模板启动新的批处理文件,在“批处理文件控制”窗口的左窗格中找到期望的文件。单击打开文件。单击“另存为”按钮,输入新文件名,并且然后单击“确定”。
[0183]
在批次中,初始注射应为空白。测试制品必须包含至少五次注射适当的产品参考标准物。对于总共五次参考标准注射,建议在测试制品注射之前注射三个参考标准,并且然后注射两个。
[0184]
有时可能会出现干扰蛋白质谱的错过注射或随机尖峰,从而产生非典型电泳图(在峰的强度、数量和模式方面)。如果使用的参考标准适合相关的样品注射,则可以在初始注射24小时内使用至少五次参考标准注射作为括号重新注射空白、参考标准物和测试制品。
[0185]
设置批次聚焦周期设置:为每次注射输入唯一且描述性的文件名。对于样品id,输入参考标准物/参考溶液名称、lims#或其它样品标识符。按顺序对小瓶编号。聚焦期1(预聚焦)使用以下设置:1500v时为1分钟。聚焦期2(聚焦)使用以下设置:3000v时为7分钟。清洗持续时间为90秒,并且转移时间延迟为0.00分钟。
[0186]
设置自动采用器参数:
[0187]
·
温度控制:确定;设置为10℃。
[0188]
·
缓冲注射持续时间:默认值。
[0189]
·
样品注射持续时间:默认值。
[0190]
·
装载持续时间:6秒。
[0191]
·
小瓶类型:2ml,带300μl插入件。
[0192]
·
针深度:48mm。
[0193]
样品和缓冲液注射持续时间在转移时间测量期间确定(系统检查启动/盒安装),并且基于出现平台的时间长度。建议比平台时间长度长至少10秒。
[0194]
在样品条件下输入以下信息:
[0195]
·
载体两性电解质:4%3-10种两性电解质
[0196]
·
添加剂:2m尿素,0.35%mc
[0197]
·
低pi标志物:主混合物中的酸性标志物的pi值(5.12)
[0198]
·
高pi标志物:主混合物中的碱性标志物的pi值(9.50)
[0199]
·
浓度[μg/μl]:0.40
[0200]
·
选择样品类型(任选的)
[0201]
应注意,对于浓度,空白浓度为0。过程中样品的最终浓度可以因使用的稀释因子而异。
[0202]
数据转换
[0203]
可以使用ice cfr软件进行数据转换。cfr软件可以用于产生电泳图并为空白、参考标准和测试样品电泳图设置pi标志物。cfr软件还可以用于将数据转换为其它格式,如empower,以进行另外的分析。
[0204]
系统合适性
[0205]
酸性(低)和碱性(高)pi标志物必须存在于空白、参考标准和测试样品注射的电泳图中。复制的参考标准注射必须在轮廓上相似(即在峰的强度、数量和模式方面)。至少五次复制参考标准注射的区域1和区域2的平均面积%结果必须各自满足产品规格的rsd%≤5%。
[0206]
测定有效性检查
[0207]
在峰的强度、数量和模式方面,测试制品曲线必须在质量上与来自产品特定工作辅助工具的示例电泳图相似。在适当的产品特定工作辅助工具中集成的所关注空白注射蛋白质区域中不应有峰。
[0208]
蛋白质电荷变体分析
[0209]
结果报告到小数点后一位。对于参考标准,报告了所有注射的区域1、2和3的平均复制%面积。区域1、2和3的所有复制注射之间的rsd%和区域2的平均pi值(仅供参考)也被报告。报告适当产品规范或方案中规定的测试制品(有时被称为测试样品)的数据。如果没有可用的方案,则报告区域1、2和3的面积%。报告了区域2的平均pi值,仅供参考。
[0210]
实例2:两性电解质批次的变化引起电泳图变化
[0211]
两性电解质是用于icief测定的关键试剂。然而,即使在分析相同的参考蛋白时,不同批次的两性电解质也会给出不同的电泳图,从而导致质量控制测试失败(比较图1a和1b)。
[0212]
参考蛋白1使用icief进行分析,如上文实例1所描述,使用两性电解质批次1(当前标准)和各种测试两性电解质批次。下表1总结了在整个此分析过程中测试的ge两性电解质批次。
[0213]
表1.通用电气医疗集团两性电解质ph 3-10批次
[0214]
ge批次分析1(当前标准)2345
[0215]
在以其它方式相同的条件但具有不同两性电解质批次下产生的参考蛋白1的icief电泳图显示出显著差异(比较图1a与图1b,例如比较图4a或图10b中的电泳图)。
[0216]
icief分析中不同的药物浓度表明,两性电解质浓度的2%变化可能会引起电泳图的变化。例如,将两性电解质浓度从4%更改为6%使参考蛋白1的区域1面积减少1%(图3)。
[0217]
两性电解质批次的差异也会影响icief电泳图中的峰的分辨率。如图5a-5c所示,针对pi在7.0与7.05之间计算每种两性电解质的分辨率。如图4a-4b所示,不同的两性电解质批次在7.0与7.05之间示出了不同的峰分辨率。
[0218]
实例3:通过lc-ms表征两性电解质批次并创建标志物文库
[0219]
传统上,两性电解质批次是通过评估icief测定性能来间接评估的。发明人开发了直接两性电解质批次表征的方法。这些方法使用lc-ms分析两性电解质本身,而不是分析两性电解质批次产生已知蛋白质参考的电泳图的能力。所述方法通过uplc ims-q-tof-ms表征两性电解质本身的化学组成,并且使其与使用已知参考蛋白的icief测定性能相关。
[0220]
ge两性电解质批次1用于建立标准操作程序(sop)中的标准。然而,需要替代批次。在ge两性电解质批次中观察到批次间的变化,并且这些差异导致在重复分析同一样品期间得到不同的电泳图,从而导致qc测试失败。这可以在实例2中看到。
[0221]
因此,已开发出一种使用uplc ims-q-tof-ms来评估候选批次的两性电解质表征方法。目的是对两性电解质批次进行化学表征并监测它们之间变化的组分。这为未来的ge候选批次提供了两性电解质表征方法,并且用作可以应用于其它供应商的工作流程。即使没有供应商提供的两性电解质组合物,此方法也允许使用多变量统计分析将候选批次与当前批次进行比较,以评估差异。
[0222]
作为另外的优势,使用这些方法,不消耗蛋白质参考标准,并且有70:1的样品节省,或样品消耗的减少。
[0223]
两性电解质测试方法的概要在图7中示出。简言之,两性电解质批次一式三份进行分析。使用具有c4色谱柱和全扫描的沃特世vion ims qtof离子迁移率四极飞行时间质谱法(lc-ims-q-tof-ms)分离两性电解质批次,所述质谱法通过在50与2000之间的质荷比(m/z)鉴定两性电解质批次组分,尽管这个范围可能会有所不同。在离子迁移率谱(ims)、m/z和保留时间(rt)公差范围内分配组分。通过多变量分析分析通过lc-ms鉴定的组分差异,并使用沃特世s绘图绘制。多变量分析鉴定两性电解质批次之间的差异,所述多变量分析用于创建组分文库,所述组分文库可以用于评估批次间差异,预测在使用参考蛋白的icief测定中哪些批次的行为与标准两性电解质批次相似。
[0224]
图8a示出了通过lc-ms分析以创建组分文库的两性电解质批次。
[0225]
图8b示出了两性电解质lc-ms数据的示例沃特世s绘图。沃特世s绘图示出了两个批次的两性电解质之间的准确质量/保留时间(amrt)差异。amrt对通过协方差绘制。变化的振幅在x轴上示出,并且相关性或变化的一致性在y轴上示出。即,标志物组分沿x轴的位置越远,所述标志物对两性电解质批次之间差异的贡献越大,并且所述标志物在批次之间的浓度差异就越大。标志物组分沿y轴的位置越远,复制之间的结果一致性就越大。两性电解质之间的差异可能是由于一个或多个两性电解质批次中存在或不存在的组分,和/或批次之间的选择标志物的浓度变化。
[0226]
uplc ims-q-tof-ms程序:
[0227]
在具有脱气机、冷却器、四元泵和自动采样器的沃特世acquity uplc h-class系统上进行分离。粒度为1.7μm的沃特世behtm c4 2.1
×
100mm分析柱以0.2毫升/分钟的流速运行。10μl等分试样用于样品注射。流动相由0.1%甲酸水溶液(a)和0.1%甲酸乙腈溶液(b)组成。梯度从95%a和5%b开始,保持5分钟,然后在35分钟之后线性上升至95%b。在50分钟时切换回95%a之前,此条件维持持续5分钟。将色谱柱在此条件下再保持另外10分钟以进行色谱柱重新平衡;总运行时间为60分钟。
[0228]
沃特世vion ims-q-tof-ms在正电喷雾电离( esi)下以mse数据模式进行准确质量筛选。质谱仪具有以下设置:毛细管电压(2.00kv)、源温度(150℃)、去溶剂化温度(200℃)、锥形气体(25升/小时)和去溶剂化气体(800升/小时)。使用unifi
tm
软件版本1.9.4.0进行数据收集和分析。
[0229]
评估了五个两性电解质批次(-1、-2、-3、-4和-5),并且每个批次的500μl掺入有25μl的1μg ml-1的
13c6-卡马西平,其被选择作为内部标准物,因为其中间运行洗脱和高电离效率。内部标准物的响应可以用于归一化每个m/z标志物的响应值,以解释仪器漂移。另外地,保留时间(rt)的变化、碰撞横截面(ccs)的变化以及内部标准物在运行过程中的m/z用于设置用于标志物分配的参数的公差。每个两性电解质样品均从同一个小瓶中纯注射(n=3)。还在每批之间分析起始流动相组成空白。
[0230]
数据处理始于过滤和统计分析。主分量分析(pca)允许将大量多变量数据减少为不相关的变量,被称为主分量。pca的局限性在于无法从绘图中确定关于单独样品组的信息,但可以使用对潜在结构的正交投影-辨别分析(opls-da)进一步挖掘数据。此统计分析允许鉴定有助于观察到两组之间的总体差异的特定特征(即两性电解质种类),并且可以被
视为s绘图。s绘图比较两个样品(n=3个测量结果,最小值);s绘图上的每个点都是特定的m/z,具有相关的rt和ccs值。标志物是通过复制品之间的一致性对变化的振幅来绘制的。沿x轴离原点越远,样品之间的强度(或相对浓度)差异越大。组之间的差异可以来自仅存在于一组中的标志物,或者来自组之间强度变化很大的标志物。在y轴上离原点越远,分析结果在三次测量中越可靠。s绘图用于鉴定批次之间哪些特征差异最大,并且将那些标志物添加到筛选文库中。选择的标志物必须存在于两性电解质样品的所有3次测量中,并且不得存在于空白中。然后使用此文库来评估每个批次存在或不存在特定标志物,以及特定强度的存在。通过阐明结构并执行数据库搜索以进行鉴定,进一步研究了怀疑对测定性能具有更大影响的标志物。
[0231]
结果:
[0232]
图10b-10c示出了使用批次1、3、4和5产生的icief曲线的变化。icief的测试发现,与批次1相比时,批次5的表现差异最大(图10b-10c)。在图10b中,电泳图与批次1越来越不相似,从批次1开始向下。使用批次2(图10c)产生的电泳图与批次1产生的电泳图最相似。根据图10a中的标志物文库,批次2预测与批次1(当前标准两性电解质批次)在两性电解质组分方面最具有相似性。如从图10c可以看出的,当使用批次2产生参考蛋白1的icief曲线时,此曲线比批次3、4或5产生的任何icief曲线更相似于批次1参考蛋白1曲线(图10b)。因此,两性电解质组分文库可以用于直接鉴定产生相似于标准批次(批次1)的icief曲线的两性电解质批次。
[0233]
图9a-9c示出了将三个不同的两性电解质批次与当前的标准批次(批次1)进行比较的沃特世s绘图。1对5的s绘图示出了批次1中有许多特征在批次5中不存在或强度较低(图9c)。变化最大的标志物被添加到用于表征其它两性电解质批次的文库中(参见图10a)。图9a中的1对2的s绘图示出了两个批次之间的一致性。此发现得到了icief结果的支持,所述结果发现在所有测试的ge批次中,2给出的结果与1最相似。没有从此s绘图中选择任何标志物。
[0234]
图10c中的方框点指示为用于表征两性电解质批次的组分文库选择的组分。手动评估从s绘图鉴定的标志物,以确保它们存在于检测到它们的批次的所有三个测量中,并且它们对于两性电解质是独特的并且不存在于空白中(图11b)。
[0235]
此外,监测提取离子色谱图(xic)以验证观察到高斯峰(图11a)。所有符合标准的标志物都被添加到筛选文库中。然后使用此库来评估哪些标志物存在于哪些批次中,以及以何种强度存在。创建所关注标志物的热图,其中每个批次中的内部标准归一化响应除以5个批次的最大归一化响应并乘以100得到百分比(图10a)。在热图中观察到的趋势得到了icief测试结果的支持。批次1中检测到的标志物与其它批次之间的差异越大,电泳图偏离sop越大。使用基于元素组成计算、结构数据库搜索和高碰撞能量数据的碎片匹配的unifi科学信息系统,通过阐明结构和执行数据库搜索以进行鉴定(图12),进一步研究怀疑对测定性能有更大影响的标志物(参见图12的结构,图11a的用于鉴定的示例色谱图)。
[0236]
结论:
[0237]
使用uplc ims-q-tof-ms表征两性电解质批次间的变化在icief测试期间成功预测批次性能。此方法将增加选择新两性电解质批次的效率,减少icief测试量,并且节省参考标准蛋白。如果观察到未来的批次间变化,同样的工作流程可以适用于多种材料和供应商。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
