植物中cast介导的dna靶向
1.相关申请的交叉引用
2.本技术要求于2019年8月7日提交的美国临时申请62/883,933的权益,其通过引用以其整体并入本文。
3.序列表的并入
4.于2020年8月5日创建的99,319字节(在中测量)的包含在名为“p34780wo00_sl.txt”的文件中的序列表与本技术一起以电子方式提交并且通过引用以其整体并入。
技术领域
5.本公开涉及组合物和方法,所述组合物和方法涉及使用cast系统将所需序列靶向转座到植物基因组中。
背景技术:
6.包含crispr相关蛋白(如cas9和cas12a)以及它们的向导rna的系统已被用于通过产生靶向的双链断裂而在植物基因组中产生遗传多样性,所述双链断裂被植物的dna修复机制不准确地修复,或通过与crispr相关蛋白、胞苷和腺嘌呤脱氨酶拴系通过靶向而不准确地修复。这些系统还已经用于通过同源重组或非同源末端连接促进供体dna在crispr-产生的双链断裂的位点的靶向插入,然而,植物中crispr-介导的靶向dna整合是低效的。由tn7样转座酶亚基tnsb、tnsc和tniq以及v-k型crispr效应子cas12k组成的crispr相关转座酶(cast)催化定点dna转座。cas12k与部分互补的非编码rna种类、crrna和tracrrna形成复合物,并且由三部分组成的核糖核酸蛋白(rnp)复合物基于原型间隔区相邻基序(pam)的存在和crrna的可变部分与靶dna之间的互补性来识别用于转座的染色体位点。相关的转座酶tnsb、tnsc和tniq通过保守的“左端”(le)和“右端”(re)边界识别转座子,并且它们将其插入到通过cas12k识别的靶序列附近的染色体位点中,优选在ta二核苷酸之间。已经证实在蓝细菌物种霍氏双岐藻(scytonema hofmanni)(utex b 2349)和鱼腥蓝细菌(anabaena cylindrica)(pcc 7122)中天然的两种同源cast系统在大肠杆菌中具有转座功能(参见strecker et al.,science10.1126/science.aax9181,2019)。
7.需要在植物细胞中有功能的cast系统以促进供体dna在植物基因组中所需位置的有效靶向插入。
8.发明概述
9.本文描述了利用cast系统在植物中进行靶向基因组修饰的方法和组合物。若干实施例涉及用于在植物染色体上产生巨基因座(megalocus)的方法,包括:(a)获得包含第一基因座的植物,其中所述第一基因座包含内源性状基因座或转基因;(b)向所述植物提供tnsb、tnsc、tniq、cas12k、向导核酸和供体盒;和(c)选择由步骤(b)产生的后代植物,其中所述供体盒的靶向转座发生在通过所述向导核酸靶向的第二基因座,其中所述第一和第二基因座遗传连锁但物理分离。在一些实施方案中,第一和第二基因座位于彼此隔开约
0.1cm-约20cm。在一些实施方案中,第一和第二基因座位于彼此隔开约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20cm。在一些实施方案中,所述植物包含编码一种或多种选自下组的蛋白质的一种或多种表达盒:tnsb、tnsc、tniq和cas12k。在一些实施方案中,所述植物包含编码一种或多种向导核酸的一种或多种表达盒。在一些实施方案中,一种或多种向导核酸不与植物中的靶位点互补。在一些实施方案中,通过粒子轰击向植物提供tnsb、tnsc、tniq、cas12k、向导核酸和供体盒中的一种或多种。
10.若干实施方案涉及包含巨基因座的植物、种子或植物部分,所述巨基因座通过以下产生:(a)获得包含第一基因座的植物,其中所述第一基因座包含内源性状基因座或转基因;(b)向所述植物提供tnsb、tnsc、tniq、cas12k、向导核酸和供体盒;和(c)选择由步骤(b)产生的后代植物、种子或植物部分,其中所述供体盒的靶向转座发生在通过所述向导核酸靶向的第二基因座,其中所述第一和第二基因座遗传连锁但物理分离。在一些实施方案中,第一和第二基因座位于彼此隔开约0.1cm-约20cm。在一些实施方案中,第一和第二基因座位于彼此隔开约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5或20cm。在一些实施方案中,后代植物、种子或植物部分包含编码一种或多种选自下组的蛋白质的一种或多种表达盒:tnsb、tnsc、tniq和cas12k。在一些实施方案中,后代植物、种子或植物部分包含编码一种或多种向导核酸的一种或多种表达盒。在一些实施方案中,一种或多种向导核酸不与后代植物、种子或植物部分中的靶位点互补。在一些实施方案中,通过粒子轰击向植物提供tnsb、tnsc、tniq、cas12k、向导核酸和供体盒中的一种或多种。
11.若干实施方案涉及t-dna,其包含:a.)编码shtnsb蛋白的第一表达盒,其包含与seq id no:1、2、13-15中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;b.)编码shtnsc蛋白的第二表达盒,其包含与seq id no:3、4、16-18中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;和c.)编码shtnsq蛋白的第三表达盒,其包含与seq id no:5、6、19-21中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码shcas12k蛋白的第四表达盒,所述shcas12k蛋白包含与seq id no:7、8、22-24中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码向导核酸的第五表达盒。在一些实施方案中,表达盒包含与seq id no:54具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列,其中所述重组酶识别序列选自下组:loxp、lox.tata-r9、frt、rs和gix。在一些实施方案中,t-dna还包含编码位点特异性重组酶的表达盒。在一些实施方案中,t-dna还包含编码位点特异性重组酶的表达盒,所述位点特异性重组酶选自下组:cre-重组酶、flp-重组酶和r-重组酶。在一些实施方案中,t-dna还包含供体盒,其中供体盒破坏编码位点特异性重组酶的表达盒。
12.若干实施方案涉及包含t-dna的植物,所述t-dna包含:a.)编码shtnsb蛋白的第一表达盒,其包含与seq id no:1、2、13-15中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;b.)编码shtnsc蛋白的第二表达盒,其包含与seq id no:3、4、16-18中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;和c.)编码shtnsq蛋白的第三表达盒,其包含与seq id no:5、6、19-21中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码shcas12k蛋白的第四表达盒,所述shcas12k蛋白包含与seq id no:7、8、22-24中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码向导核酸的第五表达盒。在一些实施方案中,表达盒包含与seq id no:54具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,所述植物还包含供体盒。在一些实施方案中,所述植物包含供体盒,所述供体盒包含与seq id no:45具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列和与seq id no:46具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。
13.若干实施方案涉及包含t-dna的根癌土壤杆菌细菌,所述t-dna包含:a.)编码shtnsb蛋白的第一表达盒,其包含与seq id no:1、2、13-15中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;b.)编码shtnsc蛋白的第二表达盒,其包含与seq id no:3、4、16-18中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;和c.)编码shtnsq蛋白的第三表达盒,其包含与seq id no:5、6、19-21中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码shcas12k蛋白的第四表达盒,所述shcas12k蛋白包含与seq id no:7、8、22-24中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码向导核酸的第五表达盒。在一些实施方案中,表达盒包含与seq id no:54具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列,其中重组酶识别序列选自下组:loxp、lox.tata-r9、frt、rs和gix。在一些实施方案中,t-dna还包含编码位点特异性重组酶的表达盒。在一些实施方案中,t-dna还包含编码位点特异性重组酶的表达盒,所述位点特异性重组酶选自下组:cre-重组酶、flp-重组酶和r-重组酶。在一些实施方案中,t-dna还包含供体盒,其中供体盒破坏编码位点特异性重组酶的表达盒。
14.若干实施方案涉及t-dna,其包含:a.)编码actnsb蛋白的第一表达盒,其包含与seq id no:9、25-27中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;b.)编码actnsc蛋白的第二表达盒,其包含与seq id no:10、28-30中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;和c.)编码actnsq蛋白的第三表达盒,其包含与seq id no:11、31-33中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码accas12k蛋白的第四表达盒,所述accas12k蛋白包含与seq id no:12、34-36中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方
案中,t-dna还包含编码向导核酸的表达盒。在一些实施方案中,表达盒包含与seq id no:55具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列,其中重组酶识别序列选自下组:loxp、lox.tata-r9、frt、rs和gix。在一些实施方案中,t-dna还包含编码位点特异性重组酶的表达盒。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列,其中位点特异性重组酶选自下组:cre-重组酶、flp-重组酶和r-重组酶。在一些实施方案中,t-dna还包含供体盒,其中供体盒破坏编码位点特异性重组酶的表达盒。
15.若干实施方案涉及包含t-dna的植物,所述t-dna包含:a.)编码actnsb蛋白的第一表达盒,其包含与seq id no:9、25-27中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;b.)编码actnsc蛋白的第二表达盒,其包含与seq id no:10、28-30中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;和c.)编码actnsq蛋白的第三表达盒,其包含与seq id no:11、31-33中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码accas12k蛋白的第四表达盒,所述accas12k蛋白包含与seq id no:12、34-36中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码向导核酸的表达盒。在一些实施方案中,表达盒包含与seq id no:55具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,所述植物还包含供体盒。在一些实施方案中,所述植物还包含供体盒,所述供体盒包含与seq id no:47具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列和与seq id no:48具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。
16.若干实施方案涉及包含t-dna的根癌土壤杆菌细菌,所述t-dna包含:所述t-dna包含:a.)编码actnsb蛋白的第一表达盒,其包含与seq id no:9、25-27中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;b.)编码actnsc蛋白的第二表达盒,其包含与seq id no:10、28-30中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列;和c.)编码actnsq蛋白的第三表达盒,其包含与seq id no:11、31-33中任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码accas12k蛋白的第四表达盒,所述accas12k蛋白包含与seq id no:12、34-36中的任一个具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含编码向导核酸的表达盒。在一些实施方案中,表达盒包含与seq id no:55具有至少90%、95%、96%、97%、98%、99%或100%序列同一性的dna序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列,其中重组酶识别序列选自下组:loxp、lox.tata-r9、frt、rs和gix。在一些实施方案中,t-dna还包含编码位点特异性重组酶的表达盒。在一些实施方案中,t-dna还包含一对位于编码cast系统组分的表达盒侧翼的重组酶识别序列,其中位点特异性重组酶选自下组:cre-重组酶、flp-重组酶和r-重组酶。在一些实施方案
中,t-dna还包含供体盒,其中供体盒破坏编码位点特异性重组酶的表达盒。
17.若干实施方案涉及在植物细胞的基因组中产生目标序列的靶向转座的方法,所述方法包括向所述植物细胞提供cast系统,其中所述cast系统包含:tnsb;tnsc;tniq;cas12k;向导核酸;和供体盒,其中所述cast系统将所述目标序列转移到所述植物基因组中由所述向导核酸识别的靶位点中。在一些实施方案中,包含cast系统的植物包含:tnsb;tnsc;tniq;cas12k;向导核酸;并且将供体盒与单倍体诱导植物杂交成包含由向导核酸识别的靶位点的植物。
附图说明
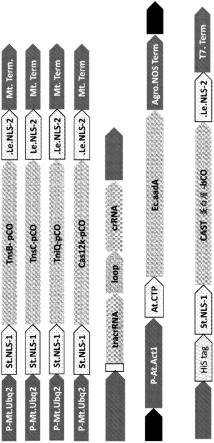
18.图1:设计用于测试大豆原生质体中shcast和accast系统的表达盒的示意图。(a)编码shcast或accast蛋白的表达盒的设计。pco=植物密码子优化的。nls=核定位信号。(b)用于shcast或accast系统的编码单片向导rna的表达盒的设计。(c)包含携带目标序列(例如:可选择标记)的转座子的供体盒的示意图,所述目标序列的侧翼为sh或ac左端(le)或右端(re)序列。(d)用于表达和纯化来自细菌的shcast或accast蛋白的盒的示意图,所述盒用于基于核糖核蛋白(rnp)将cast系统递送到植物细胞中。bco=为在细菌中表达而优化的密码子。
19.图2:阐明对于通过“侧翼pcr”检测靶向转座的靶区域(p1)和转座子(p2)特异性的引物的示意图。
20.图3:阐明包含植物优化的ac或sh cast表达盒的土壤杆菌t-dna载体的构型的示意图,所述表达盒用于将cast蛋白、castsgrna和供体盒递送到植物中,以将供体盒定点整合到基因组中。tnsb、tnsc、tniq和cas12k在一端或两端包含核定位信号肽序列。供体盒包含侧翼为保守的sh或ac le和re序列的soi(目标序列)。lb和rb表示t-dna的左边界和右边界序列。p表示启动子。ires表示内部核糖体进入位点。
21.图4:阐明shcas12a的融合sgrna的示意图。
22.图5:阐明设计用于灭活转座酶活性的土壤杆菌t-dna载体的构型的示意图。切除供体盒导致cre的表达,其切除序列(pro-tnsb;pro-tns-c;pro-tni-q;pro-cre)的侧翼为lox位点。lb和rb表示t-dna的左边界和右边界序列。pro=启动子;goi=目标基因;le=左端;re=右端。
23.图6:阐明设计用于灭活转座酶活性的土壤杆菌t-dna载体的构型的示意图。切除供体盒导致产生用于沉默cast系统的tniq组分的rnai构建体。lb和rb表示t-dna的左边界和右边界序列。pro=启动子;goi=目标基因;le=左端;re=右端。
24.图7:设计用于灭活转座酶活性的表达盒的示意图。编码shcast或accast蛋白的表达盒的设计。ltr=长末端重复序列;sine=短穿插核元素;helends=helitrons的保守末端重复序列;itr=反向末端重复序列。
25.发明详述
26.除非另有定义,否则使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。在以单数提供术语的情况下,也可以设想由该术语的复数形式描述的方面。当在以引用的方式并入的参考文献中使用的术语和定义存在差异时,本技术中使用的术语应具有给定的定义。所使用的其他技术术语具有其使用的领域中
的普通含义,如由各种领域专用字典例示的,所述词典例如“the american科学词典”(美国传统词典(the american heritage dictionaries)的编辑,2011,houghton mifflin harcourt、boston和new york),麦格劳-希尔英汉双解科技大词典(the“mcgraw-hill dictionary of scientific and technical terms)”(第6版、2002、mcgraw-hill、new york)或“牛津生物学词典(oxford dictionary of biology)”(第6版、2008、oxford university press、oxford和new york)。本公开并不旨在限制作用机制或作用模式。提供的参考仅是为了进行示意性的说明。
27.除非另外指定,否则本公开的实践采用本领域技术范围内的生物化学、化学、分子生物学、微生物学、细胞生物学、植物生物学、基因组学、生物技术和遗传学的技术。参见,例如,green and sambrook、molecular cloning:a laboratory manual、第4版(2012);current protocols in molecular biology(f.m.ausubel,等人编辑,(1987));plant breeding methodology(n.f.jensen,wiley-interscience(1988));methods in enzymology系列(academic press、inc.):pcr 2:a practical approach(m.j.macpherson,b.d.hames和g.r.taylor编辑(1995));harlow和lane编辑(1988)antibodies、a laboratory manual;animal cell culture(r.i.freshney、ed.(1987));recombinant protein purification:principles and methods、18-1142-75、ge healthcare life sciences;c.n.stewart,a.touraev,v.citovsky,t.tzfira编辑(2011)plant transformation technologies(wiley-blackwell);以及r.h.smith(2013)plant tissue culture:techniques and experiments(academic press、inc.)。
28.本文引用的任何参考文献(包括例如所有专利、公开的专利申请和非专利出版物)通过引用以其整体并入本文。
29.本文提供的任何组合物、核酸分子、多肽、细胞、植物等被特别预期用于本文提供的任何方法。
30.本文描述的若干实施方案涉及用于在植物细胞中利用来源于霍氏双岐藻(shcast)和鱼腥蓝细菌(accast)的crispr相关转座酶(cast)系统的方法和组合物。所提供的方法可以在各种细胞、组织和发育类型中进行,包括植物的配子。还预期本文所述的一个或多个元件可与特定植物细胞、组织、部分和/或发育阶段特异性启动子(如减数分裂特异性启动子)组合使用。
31.若干实施方案涉及使用包含tn7样转座酶亚基tnsb、tnsc和tniq以及v-k型crispr效应子cas12k的shcast系统以在植物细胞中进行目标序列的靶向插入。在一些实施方案中,shcast系统还包含crrna和tracrrna。在一些实施方案中,shcast系统还包含含有seq id no:54所示核苷酸序列的向导核酸。在一些实施方案中,shcast系统还包含供体盒,所述供体盒包含侧翼为左端边界序列(le)和右端边界序列(re)的目标序列。在一些实施方案中,shcast系统还包含供体盒,所述供体盒包含侧翼为seq id no:45所示核苷酸序列和seq id no:46所示核苷酸序列的一个或多个表达盒。
32.若干实施方案涉及使用包含tn7样转座酶亚基tnsb、tnsc和tniq以及v-k型crispr效应子cas12k的accast系统以在植物细胞中进行目标序列的靶向插入。在一些实施方案中,accast系统还包含crrna和tracrrna。在一些实施方案中,accast系统还包含含有seq id no:55所示核苷酸序列的向导核酸。在一些实施方案中,accast系统还包含供体盒,所述
供体盒包含侧翼为左端边界序列(le)和右端边界序列(re)的目标序列。在一些实施方案中,accast系统还包含供体盒,所述供体盒包含侧翼为seq id no:47所示核苷酸序列和seq id no:48所示核苷酸序列的一个或多个表达盒。
33.将构建体装配并引入细胞的方法是本领域已知的,其方式是将可转录的dna分子转录为功能性mrna分子,再将功能性mrna分子翻译并表达为蛋白质。为了实施本发明,制备和使用构建体和宿主细胞的常规组合物和方法是本领域技术人员熟知的。用于在高等植物中表达核酸的典型载体是本领域熟知的,并且包括来源于根癌土壤杆菌ti质粒的载体和pcamvcn转移控制载体。
34.若干实施方案涉及为在植物细胞中表达而优化的accast系统。如本文所用,“密码子优化”是指通过用在宿主细胞的基因中更频繁或最频繁使用的密码子替换序列的至少一个密码子(例如,至少1、2、3、4、5、10、15、20、25、50或更多个密码子)同时维持原始氨基酸序列来修饰核酸序列以增强在目标宿主细胞中的表达的过程。各种物种对特定氨基酸的某些密码子表现出特定的偏倚。密码子偏倚(生物体之间密码子使用的差异)通常与信使rna(mrna)的翻译效率相关,这进而被认为取决于被翻译的密码子的性质和特定转移rna(trna)分子的可用性。细胞中所选trna的优势通常是肽合成中最频繁使用的密码子的反映。因此,基于密码子优化,可以为给定生物体中的优化基因表达定制基因。密码子使用表可容易地获得,例如可在www(dot)kazusa(dot)or(dot)jp/codon处获得的“密码子使用数据库”处获得,并且这些表可以多种方式修改。参见nakamura et al.、2000、nucl.acids res.28:292。用于密码子优化特定序列以在特定宿主细胞中表达的计算机算法也是可用的,例如基因伪造(aptagen;jacobus、pa)也是可用的。关于植物(包括藻类)中的密码子使用,参考campbell和gowri,1990,plant physiol.,92:1-11;and murray et al.,1989,nucleic acids res.,17:477-98。在一些实施方案中,编码cast系统组分的核酸针对玉米细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对水稻细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对小麦细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对大豆细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对棉花细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对苜蓿细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对大麦细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对高粱细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对甘蔗细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对油菜细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对番茄细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对拟南芥属细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对黄瓜细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对马铃薯细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对单子叶植物细胞是密码子优化的。另一方面,编码cast系统组分的核酸针对双子叶植物细胞是密码子优化的。
35.若干实施方案涉及为在植物细胞中表达而优化的shcast系统。优化编码shcast系统的cas12k、tnsb、tnsc和tniq蛋白的基因序列以在植物细胞中表达。在一些实施方案中,编码tnsb的密码子优化的序列选自seq id no:1、2、13、14和15。在一些实施方案中,编码tnsc的密码子优化的序列选自seq id no:3、4、16、17和18。在一些实施方案中,编码tniq的密码子优化的序列选自seq id no:5、6、19、20和21。在一些实施方案中,编码cas12k的密码
子优化的序列选自seq id no:7、8、22、23和24。
36.在一些实施方案中,编码accast系统的cas12k、tnsb、tnsc和tniq蛋白的基因序列被优化用于在植物细胞中表达。在一些实施方案中,编码tnsb的密码子优化的序列选自seq id no:9、25、26和27。在一些实施方案中,编码tnsc的密码子优化的序列选自seq id no:10、28、29和30。在一些实施方案中,编码tniq的密码子优化的序列选自seq id no:11、31、32和33。在一些实施方案中,编码cas12k的密码子优化的序列选自seq id no:12、34、35和36。
37.在一些实施方案中,编码accast和shcast系统的cas12k、tnsb、tnsc和tniq蛋白的序列与植物特异性调节元件可操作地连接。例如,为了在大豆中表达,来自蒺藜苜蓿(mtubq)的泛素启动子或来自大丽花花叶病毒(damv 35s)的35s启动子可用于驱动cast蛋白的表达。
38.在一些实施方案中,cast效应基因盒的蛋白质编码区含有功能性内含子序列,其被设计用于减少效应基因盒在根癌土壤杆菌中的渗漏表达的影响。在植物中,相对于缺少内含子的构建体,在基因构建体中包含一些内含子导致增加的mrna和蛋白质积聚。这种作用被称为基因表达的“内含子介导的增强”(ime)。已知刺激植物中表达的内含子已经在玉米基因(例如tuba1、adh1、sh1和ubi1)、水稻基因(例如tpi)和双子叶植物基因如来自矮牵牛(例如rbcs)、马铃薯(例如st-ls1)和来自拟南芥(例如ubq3和pat1)的那些中被鉴定。已经表明内含子剪接位点内的缺失或突变降低基因表达,表明ime可能需要剪接。然而,已经表明双子叶植物中的ime为来自拟南芥的pat1基因的剪接位点内的点突变。同一内含子在一种植物中的多种用途已显示出缺点。在这些情况下,需要具有用于构建合适的重组dna元件的基本控制元件的集合。
39.可能期望将cast系统组分引导至植物细胞核。在这种情况下,一个或多个核定位信号可用于引导cast系统组件的定位。如本文所用,“核定位信号”是指“标签”蛋白质(例如,tnsb、tnsc、tniq或cas12k)以导入细胞核中的氨基酸序列。在一个方面,本文提供的核酸分子编码核定位信号。在另一方面,本文提供的核酸分子编码两个或更多个核定位信号。在一个方面,本文提供的cast蛋白包含核定位信号。一方面,核定位信号位于cast蛋白的n端。另一方面,核定位信号位于cast蛋白的c端。另一方面,核定位信号位于cast蛋白的n端和c端。在一些实施方案中,将编码在植物细胞中有功能的核定位信号肽的序列融合至蛋白质开放阅读框的5'和/或3'端以将cast蛋白质定位至植物细胞的核酸酶。
40.在一些实施方案中,编码cast系统组分的序列可置于单独的表达载体中。在其它实施方案中,编码cast系统的两个或多个组分的序列可置于同一表达载体中。在一些实施方案中,可以将编码cast系统的所有四种蛋白质的序列置于同一表达载体中。在编码两种或多种cast蛋白的序列在同一表达载体中的实施方案中,编码cast系统的蛋白组分的基因可由不同或相似的调节元件驱动。在一些实施方案中,在两个、三个或全部四个cast蛋白编码基因中产生融合构建体,所述基因位于由柔性寡肽接头分开的相同开放阅读框内。不希望受特定理论的束缚,融合构型协调cast系统的蛋白质组分的表达,这在转基因的功能也意欲被协调时是重要的。在一些实施方案中,两个、三个或全部四个cast蛋白编码基因可操作地连接到单个启动子上,并且蛋白编码序列由编码自身切割肽的序列分开,例如病毒衍生的2a序列,导致分离蛋白的精确切割(参见lee et.al.,j exp bot.2012 aug;63(13):
1187,1992;and miki et al.,theor.appl.genet.,80:449,1990所述。也可以使用草甘膦的抗性基因(分别由突变体5-烯醇式丙酮酰-3-磷酸莽草酸合酶(epsps)和aroa基因赋予的抗性)和其它膦酰基化合物(如草铵膦(膦丝菌素乙酰转移酶(pat)和吸湿链霉菌磷酸三酸酯-乙酰转移酶(bar)基因))。参见例如shah等人的美国专利4,940,835,其公开了可赋予草甘膦抗性的epsps形式的核苷酸序列。美国专利号6,040,497提供了赋予草甘膦抗性的特定epsps表达盒的实例。编码赋予某些除草剂抗性的蛋白质的dna序列还包括wo2009/152359中描述的赋予草铵膦除草剂抗性的bar或pat基因或天蓝色链霉菌基因、编码草甘膦-n-乙酰转移酶的基因或编码草甘膦氧化还原酶的基因。其它合适的除草剂抗性性状包括至少一种als(乙酰乳酸合酶)抑制物(例如wo2007/024782)、突变的拟南芥als/ahas基因(例如美国专利6,855,533)、编码赋予2,4-d(2,4-二氯苯氧基乙酸)抗性的2,4-d-单加氧酶的基因和编码赋予麦草畏(3,6-二氯-2-甲氧基苯甲酸)抗性的麦草畏单加氧酶的基因。
46.在一些实施方案中,目标序列包含一个或多个赋予疾病抗性的基因。植物防御通常通过植物中抗病基因(r)的产物与病原体中相应非病原性(avr)基因的产物之间的特异性相互作用而活化。可在供体盒中提供抗性基因以产生对特定病原体菌株具有抗性的植物。参见,例如jones等人,science,266:7891,1994(用于抗黄枝孢霉的克隆番茄cf-9基因);martin等人,science,262:1432,1993(用于抗丁香假单胞菌pv.的番茄pto基因);和mindrinos等人,cell,78(6):1089-1099,1994(用于抗丁香假单胞菌的拟南芥rps2基因)。病毒侵入性蛋白或由其衍生的复合毒素也可用于病毒疾病抗性。例如,在植物细胞中表达的病毒外壳蛋白的积聚赋予了对病毒感染和/或疾病发展的抗性,所述病毒感染和/或疾病发展受外壳蛋白基因从其衍生的病毒以及相关病毒的影响(参见beachy等人,ann.rev.phytopathol.,28:451,1990)。外壳蛋白介导的抗性可赋予植物以对抗苜蓿花叶病毒、黄瓜花叶病毒、烟草条纹病毒、马铃薯x病毒、马铃薯y病毒、烟草蚀纹病毒、烟草脆裂病毒和烟草花叶病毒。
47.在一些实施方案中,目标序列包含一个或多个赋予昆虫抗性的基因。昆虫抗性基因的一个实例包括编码苏云金芽孢杆菌蛋白,其衍生物或其上模拟的合成多肽的基因。昆虫抗性基因的实例包括编码bt cry或vip蛋白的基因,包括cryla、cryiab、cryiac、cryiia、cryiiia、cryiiib2、cry9c cry2ab、cry3bb和cryif蛋白或其毒性片段以及杂种或其组合,特别是crylf蛋白或源自crylf蛋白的杂种(例如杂种cryla-crylf蛋白或其毒性片段),cryla-type蛋白或其毒性片段、crylac蛋白或源自crylac蛋白的杂种(例如杂种crylab-crylac蛋白)或crylab或bt2蛋白或其毒性片段,cry2ae、cry2af或cry2ag蛋白或其毒性片段,cry1a.105蛋白或其毒性片段,vip3aa19蛋白,vip3aa20蛋白,cot202或cot203棉花事件中产生的vip3a蛋白、vip3aa蛋白或其毒性片段,如estruch et al.(1996),proc natl acad sci us a.28;93(11):5389-94所述,如wo2001/47952所述的cry蛋白,来自致病杆菌属的杀虫蛋白(如wo98/50427中所述),沙雷氏菌属(特别是来自嗜虫沙雷氏菌)或发光杆菌属物种菌株如wo98/08932所述的来自发光杆菌属的tc-蛋白。本文还包括这些蛋白质中任何一种的任何变体或突变体,所述变体或突变体在一些氨基酸(1-10,优选1-5)上与任何上述命名的序列,特别是它们的毒性片段的序列不同,或与转运肽(如质体转运肽)或另一种蛋白质或肽融合。
48.在一些实施方案中,目标序列包含一个或多个赋予质量改进(如产量、营养增强、
环境或胁迫耐受性)、或植物生理学、生长、发育、形态学或植物产品(包括淀粉生产)(6,538,181;6,538,179;6,538,178;5,750,876;6,476,295)、改性油产量(美国专利号6,444,876;6,426,447;6,380,462)、高油产量(美国专利6,495,739;5,608,149;6,483,008;6,476,295)、改性的脂肪酸含量(美国专利6,828,475;6,822,141;6,770,465;6,706,950;6,660,849;6,596,538;6,589,767;6,537,750;6,489,461;6,459,018)、高蛋白产量(美国专利号6,380,466)、水果成熟(美国专利号5,512,466)、增强的动物和人营养(美国专利号6,723,837;6,653,530;6,541,259;5,985,605;6,171,640)、生物聚合物(美国专利re37,543;6,228,623;5,958,745和美国专利公开号us20030028917)的任何期望的改变的基因。此外,本公开所预期的具有农艺学目的的基因将包括但不限于赋予环境胁迫抗性(美国专利号no.6,072,103)、药物肽和可分泌肽(美国专利号6,812,379;6,774,283;6,140,075;6,080,560)、改进的加工性状(美国专利号6,476,295)、改进的可消化性(美国专利号6,531,648)、低棉子糖(美国专利号6,166,292)、工业酶生产(美国专利号5,543,576)、改进的风味(美国专利号6,011,199)、固氮(美国专利号5,229,114)、杂交种子生产(美国专利号5,689,041)、纤维生产(美国专利号6,576,818;6,271,443;5,981,834;5,869,720)和生物燃料生产(美国专利号5,998,700)的基因。任何这些或其它遗传元件、方法和转基因可用于本公开,如本领域技术人员根据本公开所理解。
49.在一些实施方案中,目标序列包含农艺学目的的基因,其可以通过编码引起内源基因的基因表达的靶向调节的rna分子来影响植物特征或表型,例如通过反义(参见例如美国专利5,107,065);抑制性rna(“rnai”,包括通过mirna-、sirna-、反式作用sirna-和相位srna-介导的机制调节基因表达,例如,如公开的申请u.s.2006/0200878和u.s.2008/0066206和美国专利申请11/974,469中所述);或共抑制介导的机制。rna也可以是催化性rna分子(例如核酶或核糖开关;参见例如,u.s.2006/0200878),其被工程化以切割期望的内源mrna产物。本领域已知以可转录dna分子转录成能够引起基因抑制的分子的方式构建构建体并将其引入细胞的方法。
50.在一些实施方案中,目标序列包含可选择标记。如本文所用,术语“可选择标记转基因”是指任何可转录的dna分子,其在转基因植物、组织或细胞中的表达或其缺乏可以以某种方式筛选或评分。用于实施本发明的可选择标记基因及其相关的选择和筛选技术是本领域已知的,包括但不限于编码β-葡糖醛酸糖苷酶(gus)的可转录dna分子、绿色荧光蛋白(gfp)、赋予抗生素抗性的蛋白和赋予除草剂抗性的蛋白。
51.递送用于植物外测定的cast试剂
52.可以使用本领域已知的这些标准方法中的任何一种将为植物外实验设计的cast构建体递送到植物原生质体中。微注射、电穿孔、真空渗透、压力、超声处理、碳化硅纤维搅拌、peg介导的转化等是本领域已知的一些方法。
53.在一个实施方案中,为大豆原生质体中的植物外实验设计的cast构建体可通过聚乙二醇(peg)介导的转化递送。使用本领域已知的方案从子叶产生大豆原生质体,并且将聚乙二醇(peg)介导的转化用于以设定摩尔比共递送编码cast系统组分的表达构建体。孵育2天后,分离总基因组dna,并使用对转座子盒特异性的引物和位于染色体靶位点附近的另一引物之间的分子测定如'侧翼pcr'来检测和定量靶向转座。所得扩增子的测序提供了靶向转座的证据(参见图2)。
54.将cast系统组分递送到植物中
55.若干实施方案涉及将四种cast系统蛋白作为mrna或蛋白和向导核酸直接递送至植物细胞。不希望受任何特定理论束缚,将rna或蛋白质直接递送至植物细胞可在递送后不久提供cast系统的快速一致的活性,因此避免对体内同步基因表达的依赖性。在一些实施方案中,cast系统的组分可以作为核糖核蛋白(rnp)复合物递送。这还可以允许在转化之前调节组分的摩尔比以改进功效。递送crispr rnp复合物的方法描述于pct/us2019/033976中,并且通过引用以其全文并入本文。对于基于rnp的递送,cast的蛋白编码元件经密码子优化以在细菌(例如大肠杆菌)中最佳表达。在一个实施方案中,所述序列可操作地连接到原核tac启动子,随后连接5'7xhis标签用于ni-柱纯化并引入合适的细菌表达载体(参见图1d)。在一些实施方案中,cast系统的蛋白质组分被工程化以去除半胱氨酸。蛋白质中的半胱氨酸残基能够形成二硫键,提供半胱氨酸之间的强可逆连接。为了以靶向方式控制和引导cast系统的蛋白质组分的连接,去除天然半胱氨酸以控制这些桥的形成。不希望受特定理论的束缚,从蛋白质骨架中除去半胱氨酸将使得能够靶向插入新的半胱氨酸残基以控制这些通过二硫键的可逆连接的位置。这可以在cast系统的蛋白质成分之间,或者在用于基因枪递送的颗粒(如金颗粒)之间。可以将包含几个半胱氨酸残基的标签添加到cast系统的蛋白质组分中,这将允许其以均匀的方式特异性地连接到金属珠(特别是金)上。
56.用重组dna分子转化植物细胞中的染色体或质体的许多方法是本领域已知的,其可根据本技术的方法用于产生包含cast系统的组分的植物细胞和植物。
57.在植物中,粒子轰击或基因枪递送可用于递送多组分体系,例如cast。粒子轰击适于用dna、rna、蛋白质或其任何组合转化植物。通过rnp复合物的基因枪递送转化植物的方法描述于pct/us2019/033976中,其全部内容通过引用并入本文。在pct/us2019/033984中描述了使用dna的基因枪递送转化植物的方法,其全部内容通过引用并入本文。
58.在植物中,土壤杆菌介导的转化是选择用于在一个或多个t-dna上提供的一个或多个表达盒上递送多组分系统(如cast)的合适方法。土壤杆菌介导的转化广泛应用于单子叶和双子叶物种。在一个实施方案中,包含cast系统的一个或多个组分的表达盒可以作为双肿瘤诱导(ti)质粒边界构建体提供,所述构建体具有从根癌土壤杆菌分离的ti质粒的右边界(rb或agrtu.rb)和左边界(lb或agrtu.lb)区域,其包含t-dna以及由根癌土壤杆菌细胞提供的转移分子,允许t-dna整合到植物细胞的基因组中(参见例如美国专利6,603,061)。构建体还可以含有质粒骨架dna片段,其在细菌细胞中提供复制功能和抗生素选择,例如大肠杆菌复制起点(如ori322),宽宿主范围复制起点(如oriv或oriri),和可选择标记如编码赋予壮观霉素或链霉素或庆大霉素(gm,gent)选择性标记基因抗性的tn7氨基糖苷腺苷基转移酶(aada)的spec/strp的编码区。在一些实施方案中,在具有低拷贝复制起点的t-dna二元载体,如oriri载体骨架中提供编码一种或多种cast系统组分的一种或多种表达盒。对于植物转化,宿主菌株通常是根癌土壤杆菌abi、c58或lba4404,然而植物转化领域的技术人员已知的其它菌株可在本发明中起作用。在一些实施方案中,利用缺乏某些dna重组功能的根癌土壤杆菌菌株(如reca)将编码cast系统组分的表达载体递送至植物细胞。
59.在一些实施方案中,在单个t-dna上提供编码本文所述cast系统的组分的表达盒。在一些实施方案中,在多个单独的t-dna上提供编码本文所述cast系统的组分的表达盒,并在单个转化过程中或在单独的连续转化过程中递送至植物细胞。在一些实施方案中,将编
码cast系统的蛋白质组分的序列在与编码cast系统的向导核酸组分的序列分开的t-dna载体上提供给植物细胞。在一些实施方案中,将编码cast系统的蛋白质组分的序列在与编码cast系统的向导核酸组分和供体盒的序列分开的t-dna载体上提供给植物细胞。在一些实施方案中,将编码cast系统的蛋白质组分的序列和编码cast系统的向导核酸组分的序列在与供体盒分开的t-dna载体上提供给植物细胞。在一些实施方案中,将编码cast系统的蛋白质组分的序列和编码cast系统的向导核酸组分的序列在与供体盒分开的t-dna载体上提供给植物细胞。在一些实施方案中,通过基于土壤杆菌的转化将编码cast系统和供体盒的蛋白质组分的序列提供给植物细胞,并通过粒子轰击提供编码cast系统的向导核酸组分的序列。在一些实施方案中,通过基于土壤杆菌的转化将供体盒提供给植物细胞,并且通过粒子轰击提供cast系统的蛋白质组分和编码cast系统的向导核酸组分的序列。
60.在一些实施方案中,将cast系统的遗传元件递送到分开的植物中,使得单个原代植物不含有激活转座所必需的所有元件。通过将所有必需的元件组合到含有一些元件的杂交植物产生的后代植物中来激活转座。在一些实施方案中,将含有所有效应蛋白(tnsb、tnsc、tniq和cas12k)的功能基因的植物与含有携带可识别的'转座子'的'供体'盒和向导核酸表达盒的植物杂交,由此在来自这种杂交的后代中发生供体盒靶向转座到特定位点。在一些实施方案中,将含有所有效应蛋白(tnsb、tnsc、tniq和cas12k)的功能基因和携带可识别的'转座子'的'供体'盒的植物与含有向导核酸表达盒的植物杂交,由此在来自这种杂交的后代中发生供体盒靶向转座到特定位点。在一些实施方案中,将含有所有效应蛋白(tnsb、tnsc、tniq和cas12k)的功能基因和向导核酸表达盒的植物与含有携带可识别的'转座子'的'供体'盒的植物杂交,由此在来自这种杂交的后代中发生供体盒靶向转座到特定位点。这种通过植物杂交组合元件的策略适用于利用粒子轰击的方法以及利用根癌土壤杆菌产生转基因植物的方法。例如,可以将包含所有效应蛋白(tnsb、tnsc、tniq和cas12k)和向导核酸的颗粒轰击到含有携带可识别的'转座子'的'供体'盒的植物中。
61.在一些实施方案中,利用tnsb、tnsc、tniq、cas12k和/或向导核酸表达的严格发育或诱导控制来防止过早转座。在一些实施方案中,乙醇诱导型启动子用于驱动cast系统组分的表达。防止过早转座的另一种选择是分离蛋白(tnsb、tnsc、tniq和cas12k),并将核酸组分引导入不同的载体中,并将它们转化到不同的植物中,然后杂交以激活后代中的靶向转座。供体盒可以在与转座酶和/或嵌合靶向grna相同的t-dna上或在单独的t-dna上转化入亲本植物。
62.在一些实施方案中,通过提供不识别转化种质中靶位点的向导核酸来防止过早转座。当含有cast组分的植物随后与含有靶位点的植物杂交时,发生靶向转座。
63.可以通过
‘
侧翼pcr’在原生质体和植物中检测靶向转座。然而,在大规模稳定的情况下,在产生数百(如果不是数千)个转化体的植物转化中,需要更高通量的检测方法。染色体定相是一种高通量的基于taqman的方法,其设计用于使用数字pcr检测标记的物理连锁(参见regan,j.and g.karlin-neumann,2018,methods mol biol 1768:489-512)。使用针对靶区域和目标转座子上设计的测定,染色体定相可以以高通量方式容易地鉴定目标转座事件。它还可以检测与靶上的转座并排的脱靶转座,而不需要额外的实验。
64.基因组编辑在分子育种和性状整合中的用途
65.在一些实施方案中,基因组知识用于靶向转座。在一个实施方案中,向导核酸可用
于将cas12k靶向基因组的至少一个区域以破坏植物细胞中基因组的该区域。然后,可以在该基因组区域内引入基于供体dna模板的修饰。从修饰的植物细胞再生的植物包含修饰的基因组,并且根据已经改变的遗传区域可以表现出修饰的表型或其它性质。可以使用cast系统靶向先前表征的突变等位基因或转基因以进行修饰,从而能够产生改进的突变体或转基因系。
66.在一些实施方案中,通过靶向转座而被靶向缺失或破坏的基因可以是预先引入到靶植物或细胞中的转基因。这具有允许引入不同转基因或允许破坏和/或去除编码可选择标记的序列的优点。在另一个实施方案中,通过基因组编辑而被靶向修饰的基因是至少一种转基因,所述转基因被引入与一种或多种其它目标转基因相同的载体或表达盒中,并位于与另一种转基因相同的基因座。本领域技术人员理解,这种类型的基因组修饰可导致在靶基因座缺失或插入额外的序列。在一些实施方案中,可以破坏特定的转基因,同时保留剩余的转基因完整。这避免了必须产生含有所需转基因而没有不需要的转基因的新转基因系。
67.在另一方面,本公开包括用于将目标供体dna序列插入植物基因组的特定位点的方法,其中目标dna序列来自植物的基因组或相对于植物是异源的。本公开允许选择其中基因组的特定区域已被修饰以通过靶向转座插入一个或多个表达盒的细胞。因此,基因组的靶向区域可以显示至少一种转基因与和至少一种表型性状相关的目标单倍型的连锁,并且还可以导致连锁阻断的发展以促进转基因堆叠和转基因性状整合,和/或连锁阻断的发展,同时还允许常规性状整合。
68.定向染色体重排允许在相同位点或不同位点将多个目标核酸(例如,性状堆叠或多重复用)添加到植物的基因组中。靶向转座的位点可基于对潜在育种值、该位点的转基因性能、该位点的潜在重组率、与靶向转座位点连接的现有转基因或其它因素的知识来选择。一旦堆叠的植物被组装,它可以被用作性状供体用于杂交到在育种程序中推进的或在育种程序中直接推进的种质。
69.本公开包括用于将至少一种目标核酸插入植物基因组中的至少一个位点的方法,其中所述目标核酸来自植物的基因组,例如qtl或等位基因,或者是转基因来源的。基因组的靶向区域因此可以显示至少一种转基因与和至少一种表型性状相关的目标单倍型的连锁(如美国专利申请公开号2006/0282911中所述),以促进转基因堆叠、转基因性状整合、qtl或单倍型堆叠和常规性状整合。
70.在一些实施方案中,通过利用基因组序列信息的知识和设计定制向导分子的能力,多个独特的向导分子可用于修饰包含在一个染色体上的一个连锁块内的特定基因座处的多个等位基因。根据需要设计或工程化对包含非靶等位基因的基因座上游的基因组靶位点特异的或可被引导的向导分子。还设计或工程化对包含非靶等位基因的靶基因座下游的基因组靶位点具有特异性或可被引导的第二向导分子。可以设计向导分子,使得它们补充与含有靶等位基因的非靶基因座没有同源性的基因组区域。可以使用本文所述的方法之一将两种向导分子引入细胞中。
71.若干实施方案涉及利用cast系统产生遗传连锁基因座(巨基因座)的区段的靶向转座,所述基因座可作为单一遗传单位通过性状渗入过程传递至其它植物、品种或物种。在一些实施方案中,通过靶向转座将供体盒插入与现有转基因插入位点或一组转基因插入位
点/事件遗传连锁但物理分离的基因座中。在一些实施方案中,通过将来自不同cast系统的供体盒插入遗传连锁但物理分离的基因座中形成巨基因座。在一些实施方案中,通过靶向转座将包含shle和shre的供体盒插入与包含acle和acre的现有供体盒遗传连锁但物理分离的基因座中。在一些实施方案中,通过靶向转座将包含acle和acre的供体盒插入与包含shle和shre的现有供体盒遗传连锁但物理分离的基因座中。在一个实施方案中,在植物中产生所需性状的至少一种转基因的靶向转座后,将第二转基因重组连锁以形成巨基因座。这种靶向转化然后重组以连锁所需转基因的方法具有载体堆叠和育种堆叠的优点而没有许多限制。例如,在一个实施方案中,单个转基因可以通过靶向转座一次引入一个并在以后组合。在一些实施方案中,至少一种转基因的靶向转座发生在与第二转基因遗传连锁的靶位点以形成大型基因座。在一些实施方案中,转座位点可以与目标基因座物理分开约0.1cm至约20cm的距离,包括0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19和20cm。在另一个实施方案中,单个供体盒的转座位点可以不是遗传连锁的,或可以不是紧密连锁的,例如隔开至少约10、20、30、40或更多cm。一旦供体盒顺式结合在同一染色体上,它们可被诱导通过插入序列的染色体重排而遗传连锁,从而允许许多独立的转基因容易地渗入不同的种质中。在进一步的实施方案中,可以将各自含有不同转基因的两个植物品系杂交在一起,以顺式产生一个含有所有转基因的大巨基因座,所述转基因已经在反式连锁位点组合形成巨基因座。
72.由于在性状整合过程中减少随机分离的转基因基因座的数目的能力,将转基因性状连锁在一起作为遗传连锁阻断可能是期望的。遗传连锁的转基因的堆叠也可以减少待筛选的后代的数目,以在性状整合过程中发现堆叠的转基因。另外,组合靶向转座并利用内源减数分裂重组机制来连锁转基因在加速产物递送时间线的产物概念中提供了额外的灵活性。
73.本发明的另一个实施方案是靶向转座与修饰减数分裂重组机制的技术的组合,其中这种技术包括基因表达的转基因修饰或调节重组的化学处理。在一些实施方案中,供体盒的靶向易位与通过位点特异性基因组修饰酶的切割组合以改变重组速率,所述位点特异性基因组修饰酶诸如锌指核酸酶、工程化或天然大范围核酸酶、tale-内切核酸酶或rna引导的内切核酸酶(例如,成簇规则散布的短回文重复(crispr)/cas9系统、crispr/cpf1系统、crispr/casx系统、crispr/casy系统、crispr/cascade系统)。通过重组遗传连接的性状有效地减少了性状基因渗入的性状基因座,同时仍然提供了灵活性。例如,通过使用本发明的方法,可以在相同的基因座测试赋予相同或不同性状的几种转基因,而不是矢量叠加这些性状,从而允许在决定商业产品之前同时测试性状和性状版本的几种组合。利用矢量叠加,有必要提前几年做出关于商业产品概念的决定,这降低了灵活性。根据本发明的一些实施方案,可以在与前一性状相同的基因座或附近的基因座测试下一代性状,然后可以通过重组出前一性状和重组入下一代性状来替换前一性状。本发明还预期在供体盒中包含靶识别位点,以便能够在至少一个供体盒中插入和缺失转基因和转基因元件。
74.若干实施方案涉及将供体盒靶向转座到靶位点中,所述靶位点与鉴定的质量性状基因座(qtl)隔开约0.1cm至约20cm,包括0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、
2、2.5、3、5、10、15和20cm。在一些实施方案中,将供体盒转座到与鉴定的qtl隔开约0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48或49cm。
75.若干实施方案涉及将供体盒靶向转座到靶位点中,所述靶位点与转基因事件隔开约0.1cm至约20cm,包括0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5.4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9.9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5和20cm。在一些实施方案中,cast系统用于将含有一个或多个转基因的供体盒靶向转座到基因座中,所述基因座与选自以下的转基因事件隔开0.1cm至约20cm,包括0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5.4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9.9.5、10、10.5、11、11.5、12、12.5、13、13.5、14、14.5、15、15.5、16、16.5、17、17.5、18、18.5、19、19.5和20cm:事件531/pv-ghbk04(棉花,昆虫控制,描述于2002/040677中);事件1143-14a(棉花,昆虫控制,未保藏,描述于wo2006/128569中);事件1143-51b(棉花,昆虫控制,未保藏,描述于wo2006/128570中);事件1445(棉花,除草剂抗性,未保藏,描述于us-a2002-120964或wo2002/034946中);事件17053(水稻,除草剂抗性,作为pta-9843保藏,描述于wo2010/117737中);事件17314(水稻,除草剂抗性,作为pta-9844保藏,描述于wo2010/117735中);事件281-24-236(棉花,昆虫控制-除草剂抗性,以pta-6233保藏,描述于wo2005/103266或us-a2005-216969中);事件3006-210-23(棉花,昆虫控制-除草剂抗性,以pta-6233保藏,描述于us-a2007-143876或wo2005/103266中);事件3272(玉米,品质性状,以pta-9972保藏,描述于wo2006/098952或us-a2006-230473中);事件33391(小麦,除草剂抗性,以pta-2347保藏,描述于wo2002/027004中),事件40416(玉米,昆虫控制-除草剂抗性,以atccpta-11508保藏,描述于wo11/075593中);事件43a47(玉米,昆虫控制-除草剂抗性,以atccpta-11509保藏,描述于wo2011/075595中);事件5307(玉米,昆虫控制,以atccpta-9561保藏,描述于wo2010/077816中);事件asr-368(常绿草,除草剂抗性,以atccpta-4816保藏,描述于us-a2006-162007或wo2004/053062中);事件b16(玉米,除草剂抗性,未保藏,描述于us-a2003-126634中);事件bps-cv127-9(大豆,除草剂抗性,以ncimb号41603保藏,描述于wo2010/080829中);事件blr1(油籽油菜,雄性不育恢复,以ncimb 41193保藏,描述于wo2005/074671中),事件ce43-67b(棉花,昆虫控制,以dsm acc2724保藏,描述于us-a2009-217423或wo2006/128573中);事件ce44-69d(棉花,昆虫控制,未保藏,描述于us-a2010-0024077中);事件ce44-69d(棉花,昆虫控制,未保藏,描述于wo2006/128571中);事件ce46-02a(棉花,昆虫控制,未保藏,描述于wo2006/128572中);事件cot102(棉花,昆虫控制,未保藏,描述于us-a2006-130175或wo2004/039986中);事件cot202(棉花,昆虫控制,未保藏,描述于us-a2007-067868或wo2005/054479中);事件cot203(棉花,昆虫控制,未保藏,描述于wo2005/054480中);事件das 21606-3/1606(大豆,除草剂抗性,以pta-11028保藏,描述于wo2012/033794中),事件das 40278(玉米,除草剂抗性,以atcc pta-10244保藏,描述于wo2011/022469中);事件das-44406-6/pdab8264.44.06.l(大豆,除草剂抗性,以pta-11336保藏,描述于wo2012/075426
中),事件das-14536-7/pdab8291.45.36.2(大豆,除草剂抗性,以pta-11335保藏,描述于wo2012/075429中),事件das-59122-7(玉米,昆虫控制-除草剂抗性,以atcc pta 11384保藏,描述于us-a2006-070139中);事件das-59132(玉米,昆虫控制-除草剂抗性,未保藏,描述于wo2009/100188中);事件das 68416(大豆,除草剂抗性,以atcc pta-10442保藏,描述于wo2011/066384或wo2011/066360中);事件dp-098140-6(玉米,除草剂抗性,以atcc pta-8296保藏,描述于us-a2009-137395或wo08/112019中);事件dp-305423-1(大豆,品质性状,未保藏,描述于us-a2008-312082或wo2008/054747中);事件dp-32138-1(玉米,杂交系,以atccpta-9158保藏,描述于us-a2009-0210970或wo2009/103049中);事件dp-356043-5(大豆,除草剂抗性,以atccpta-8287保藏,描述于us-a2010-0184079或wo2008/002872中);事件ee-i(茄子,昆虫控制,未保藏,描述于wo07/091277中);事件fil 17(玉米,除草剂抗性,以atcc 209031保藏,描述于us-a2006-059581或wo98/044140中);事件fg72(大豆,除草剂抗性,以pta-11041保藏,描述于wo2011/063413中),事件ga21(玉米,除草剂抗性,以atcc 209033保藏,描述于us-a2005-086719或wo98/044140中);事件gg25(玉米,除草剂抗性,以atcc 209032保藏,描述于us-a2005-188434或wo98/044140);事件ghb119(棉花,昆虫控制-除草剂抗性,以atcc pta-8398保藏,描述于wo2008/151780中);事件ghb614(棉花,除草剂抗性,以atcc pta-6878保藏,描述于us-a2010-050282或wo2007/017186中);事件gj11(玉米,除草剂抗性,以atcc 209030保藏,描述于us-a2005-188434或wo98/044140);事件gmrz13(甜菜,病毒抗性,以ncimb-41601保藏,描述于wo2010/076212中);事件h7-1(甜菜,除草剂抗性,以ncimb 41158或ncimb 41159保藏,描述于us-a2004-172669或wo2004/074492中);事件joplin1(小麦,抗病性,未保藏,描述于us-a2008-064032中);事件ll27(大豆,除草剂抗性,以ncimb 41658保藏,描述于wo2006/108674或us-a2008-320616中);事件ll55(大豆,除草剂抗性,以ncimb 41660保藏,描述于wo2006/108675或us-a2008-196127中);事件llcotton25(棉花,除草剂抗性,以atcc pta-3343保藏,描述于wo2003/013224或us-a2003-097687中);事件llrice06(水稻,除草剂抗性,以atcc 203353保藏,描述于us6,468,747或wo2000/026345中);事件llrice62(水稻,除草剂抗性,以atcc 203352保藏,描述于wo2000/026345中),事件llrice601(水稻,除草剂抗性,以atccpta-2600保藏,描述于us-a2008-2289060或wo2000/026356中);事件ly038(玉米,品质性状,以atccpta-5623保藏,描述于us-a2007-028322或wo2005/061720中);事件mir162(玉米,昆虫控制,以pta-8166保藏,描述于us-a2009-300784或wo2007/142840中);事件mir604(玉米,昆虫控制,未保藏,描述于us-a2008-167456或wo2005/103301中);事件mon 15985(棉花,昆虫控制,以atccpta-2516保藏,描述于us-a2004-250317或wo2002/100163中);事件mon810(玉米,昆虫控制,未保藏,描述于us-a2002-102582中);事件mon863(玉米,昆虫控制,以atcc pta-2605保藏,描述于wo2004/011601或us-a2006-095986中);事件mon 87427(玉米,授粉控制,以atcc pta-7899保藏,描述于wo2011/062904中);事件mon 87460(玉米,胁迫耐受性,以atcc pta-8910保藏,描述于wo2009/111263或us-a2011-0138504中);事件mon 87701(大豆,昆虫控制,以atcc pta-8194保藏,描述于us-a2009-130071或wo2009/064652中);事件mon 87705(大豆,品质性状-除草剂抗性,以atcc pta-9241保藏,描述于us-a2010-0080887或wo2010/037016中);事件mon 87708(大豆,除草剂抗性,以atcc pta-9670保藏,描述于wo2011/034704中);事件mon 87712(大豆,产量,以pta-10296保藏,描述于wo2012/051199中),事件mon 87754
(大豆,品质性状,以atcc pta-9385保藏,描述于wo2010/024976中);事件mon 87769(大豆,品质性状,以atcc pta-8911保藏,描述于us-a2011-0067141或wo2009/102873);事件mon 88017(玉米,昆虫控制-除草剂抗性,以atcc pta-5582保藏,描述于us-a2008-028482或wo2005/059103中);事件mon 88913(棉花,除草剂抗性,以atcc pta-4854保藏,描述于wo2004/072235或us-a2006-059590中);事件mon 88302(油菜,除草剂抗性,以pta-10955保藏,描述于wo2011/153186中),事件mon 88701(棉花,除草剂抗性,以pta-11754保藏,描述于wo2012/134808中),事件mon 89034(玉米,昆虫控制,以atcc pta-7455保藏,描述于wo07/140256或us-a2008-260932中);事件mon 89788(大豆,除草剂抗性,以atcc pta-6708保藏,描述于us-a2006-282915或wo2006/130436中);事件ms1 1(油菜,授粉控制-除草剂抗性,以atccpta-850或pta-2485保藏,描述于wo2001/031042中);事件ms8(油菜,授粉控制-除草剂抗性,以atcc pta-730保藏,描述于wo2001/041558或us-a2003-188347中);事件nk603(玉米,除草剂抗性,以atcc pta-2478保藏,描述于us-a2007-292854中);事件pe-7(水稻,昆虫控制,未保藏,描述于wo2008/114282中);事件rf3(油菜,授粉控制-除草剂抗性,以atcc pta-730保藏,描述于wo2001/041558或us-a2003-188347中);事件rt73(油菜,除草剂抗性,未保藏,描述于wo2002/036831或us-a2008-070260中);事件syht0h2/syn-000h2-5(大豆,除草剂抗性,以pta-11226保藏,描述于wo2012/082548中),事件t227-1(甜菜,除草剂抗性,未保藏,描述于wo2002/44407或us-a2009-265817中);事件t25(玉米,除草剂抗性,未保藏,描述于us-a2001-029014或wo2001/051654中);事件t304-40(棉花,昆虫控制-除草剂抗性,以atcc pta-8171保藏,描述于us-a2010-077501或wo2008/122406中);事件t342-142(棉花,昆虫控制,未保藏,描述于wo2006/128568中);事件tc1507(玉米,昆虫控制-除草剂抗性,未保藏,描述于us-a2005-039226或wo2004/099447中);事件vip1034(玉米,昆虫控制-除草剂抗性,以atcc pta-3925保藏,描述于wo2003/052073中),事件32316(玉米,昆虫控制-除草剂抗性,以pta-11507保藏,描述于wo2011/084632中),事件4114(玉米,昆虫控制-除草剂抗性,以pta-11506保藏,描述于w 02011/084621中),事件ee-gm3/fg72(大豆,除草剂抗性,atcc保藏号pta-11041),其任选与事件ee-gm1/ll27或事件ee-gm2/ll55(wo2011/063413a2)堆叠,事件das-68416-4(大豆,除草剂抗性,atcc保藏号pta-10442,wo2011/066360a1),事件das-68416-4(大豆,除草剂抗性,atcc保藏号pta-10442,wo2011/066384a1),事件dp-040416-8(玉米,昆虫控制,atcc保藏号pta-11508,wo2011/075595a1),事件dp-043a47-3(玉米,昆虫控制,atcc保藏号pta-11509、wo2011/075595al),事件dp-004114-3(玉米,昆虫控制,atcc保藏号pta-11506、wo2011/084621al),事件dp-032316-8(玉米,昆虫控制,atcc保藏号pta-11507、wo2011/084632al),事件mon-88302-9(油菜,除草剂抗性,atcc保藏号pta-10955,wo2011/153186a1),事件das-21606-3(大豆,除草剂抗性,atcc保藏号pta-11028,wo2012/033794a2),事件mon-87712-4(大豆,品质性状,atcc保藏号pta-10296,wo2012/051199a2),事件das-44406-6(大豆,堆叠除草剂抗性,atcc保藏号pta-11336,wo2012/075426al),事件das-14536-7(大豆,堆叠除草剂抗性,atcc保藏号pta-11335,wo2012/075429al),事件syn-000h2-5(大豆,除草剂抗性,atcc保藏号pta-11226,wo2012/082548a2),事件dp-061061-7(油菜,除草剂抗性,无保藏号可用,wo 2012071039a1),事件dp-073496-4(油菜,除草剂抗性,无保藏号可用,us 2012131692),事件8264.44.06.1(大豆,堆叠除草剂抗性,保藏号pta-11336,wo 2012075426a2),事件
8291.45.36.2(大豆,堆叠除草剂抗性,保藏号pta-11335,wo 2012075429a2),事件syht0h2(大豆,atcc保藏号pta-11226,wo2012/082548a2),事件mon 88701(棉花,atcc保藏号pta-11754,wo2012/134808a1),事件kk179-2(苜蓿,atcc保藏号pta-11833,wo2013/003558a1),事件pdab8264.42.32.1(大豆,堆叠除草剂抗性,atcc保藏号pta-11993,wo2013/010094a1),事件mzdt09y(玉米,atcc保藏号pta-13025,wo2013/012775a1)。
76.单倍体诱导杂交
77.性状整合是优良育种计划的瓶颈。使用基于标记的选择,将具有所需性状的转基因从供体系与优良亲本或轮回亲本回交许多次。在没有任何连锁拖拽的情况下,将转基因从供体选择性地转移到受体种质的快速和有效的方法对于这样的育种管线具有巨大的价值。如下文所述,在单倍体诱导植物中表达cast系统组分,随后进行杂交和选择是在单个杂交中实现快速性状整合和回收轮回亲本的一种方式。
78.若干实施方案涉及通过选择性激活一种或多种cast系统组分的转录而选择性激活cast系统以促进靶向转座到非诱导基因组中的方法。在一些实施方案中,单倍体诱导系(如ina133或ina133/elmys5)的可转化衍生物在其基因组中包含编码一种或多种cast系统组分的转基因。在一些实施方案中,单倍体诱导系包含编码cast系统的蛋白质组分的序列。在一些实施方案中,单倍体诱导系包含编码cast系统的蛋白质组分的序列和不识别单倍体诱导系中靶位点的向导核酸。在一些实施方案中,单倍体诱导系包含与优良系中的靶位点互补但不与单倍体诱导系互补的向导核酸。在一些实施方案中,所述单倍体诱导系包含表达盒,所述表达盒包含编码cast系统的序列,所述表达盒可操作地连接诱导型启动子,例如乙醇诱导型启动子。在一些实施方案中,所述单倍体诱导系包含表达盒,所述表达盒包含可操作地连接至编码向导核酸的核酸序列的诱导型启动子。在一些实施方案中,所述单倍体诱导系包含表达盒,所述表达盒包含可操作地连接至编码tnsb、tnsc、tniq、cas12k中的一个或多个的核酸序列的诱导型启动子。在一些实施方案中,单倍体诱导系包含表达盒,所述表达盒包含可操作地连接到编码tnsb、tnsc、tniq、cas12k中的一个或多个的核酸序列的诱导型启动子,其中蛋白质编码序列由2a自切割肽或内部核糖体进入位点分开以促进蛋白质的协调切割或各基因的协调表达。在一些实施方案中,单倍体诱导系包含表达盒和一个或多个表达盒,所述表达盒包含可操作地连接至编码cast系统的一个组分的核酸序列的诱导型启动子,并且所述一个或多个表达盒包含可操作地连接至编码其它cast系统组分的一个或多个序列的组成型启动子。在一些实施方案中,通过在进行单倍体诱导杂交时将植物暴露于诱导剂来诱导诱导型启动子的表达。在一些实施方案中,通过在杂交之前将单倍体诱导植物暴露于诱导剂来诱导诱导型启动子的表达。在一些实施方案中,通过将单倍体诱导亲本和受体亲本之间杂交的后代暴露于诱导剂来诱导诱导型启动子的表达。
79.在若干实施方案中,发育特异性启动子(如babyboom基因启动子)用于驱动来自一个或多个向导核酸或cast系统的tnsb、tnsc、tniq、cas12k组分的雄性亲本的合子基因表达。在一些实施方案中,发育特异性启动子可操作地连接至编码cast系统的tnsb、tnsc、tniq、cas12k组分的核酸序列,其中蛋白质编码序列由2a自切割肽或ires位点分开以促进蛋白质的协调切割或每个基因的协调表达(khanday et al.,2019,nature,jan 565(7737):91-95)。在一些实施方案中,发育特异性启动子与编码至少一种cast系统组分的序列可操作地连接,并且组成型启动子与编码一种或多种其它cast系统组分的序列可操作地
连接。在一些实施方案中,转基因植物作为雌性维持以避免在暴露于目标基因组(例如,在单倍体诱导杂交之后遇到的基因组)之前cast系统的早熟表达和转座。一旦进行单倍体诱导杂交,cast转基因植物被用作雄性,并且在合子形成后,babyboom启动子被激活,因此整个cast系统现在是有活性的并且能够促进rna引导的dna转座到非诱导基因组。
80.在一些实施方案中,将编码本文所述的cast系统组分的一种或多种表达载体转化到单倍体诱导植物中。在一些实施方案中,设计向导核酸以避免单倍体诱导基因组中的任何匹配,但保留与任何非诱导基因组的匹配,使得靶向转座不在单倍体诱导植物中发生,但在单倍体诱导系与受体种质杂交时被激活。
81.在一些实施方案中,将编码本文所述的cast系统组分的一种或多种表达载体转化到含有超数染色体(如b染色体)的诱导植物中。选择插入到超数染色体上的事件。在该事件中,在超数染色体上进行单倍体诱导杂交,并选择单倍体后代,使得它们保留超数染色体但没有来自诱导亲本的其它染色体。然后,选择单倍体后代,使其转座到含有供体转基因的靶位点。在一个实施方案中,乙醇诱导型启动子用于在回收含有携带供体和cast转基因的b染色体的单倍体植物后引发转座。
82.在一些实施方案中,将编码本文所述的cast系统组分的一种或多种表达载体转化到玉米植物中。选择事件,然后在小麦植物上杂交以产生单倍体。然后,筛选单倍体的供体转基因转座。在一些实施例中,嵌合grna的早熟表达通过利用小麦诱导型启动子(存在于玉米中但仅在暴露于小麦细胞时活化的启动子),或babyboom启动子或亲本基因组特异性的并且在受精时活化的一些其他早期合子启动子来防止(khanday et al.,2019,nature,jan 565(7737):91-95;anderson et al.,developmental cell,43,349-358e344)。
83.在另一个实施方案中,病毒或病毒复制子被工程化以表达cast系统的全部或部分和/或携带供体转基因。在感染包含cast系统和供体转基因的一种或多种病毒或复制子时,发生转座。这可以与单倍体诱导组合进行,其中在用单倍体诱导物受精之前、期间或之后局部施用病毒或复制子。
84.在任何上述实施方案中,染色体加倍方法可用于制备含有转座的加倍单倍体。
85.在任何上述实施方案中,可以应用任何基于杂交的单倍体诱导方法(cenh3,ig1,matrilineal,dmp,wide cross,supplemental radiation,phospholipid或derivative applications)。
86.通过上述“侧翼pcr”测定可以在原生质体和植物中正确检测靶向转座。然而,在大规模稳定的情况下,在产生数百(如果不是数千)个转化体的植物转化中,需要更高通量的检测方法。染色体定相是一种高通量的基于taqman的方法,其设计用于使用数字pcr检测标记的物理连锁。通过在目标区域附近设计的测定和在目标转座子上设计的另一种测定,染色体定相可以htp方式容易地鉴定目标转座事件。
87.靶向转座后cast系统的失活
88.在一些实施方案中,可能需要在靶向转座供体盒后使cast系统失活。在一些实施方案中,供体盒破坏编码位点特异性重组酶的表达盒,使得供体盒的切除导致切除cast系统的一个或多个组分的重组酶的表达。在一些实施方案中,在植物可表达的启动子和编码位点特异性重组酶的序列之间提供供体盒,使得供体盒的切除可操作地将启动子连接到编码位点特异性重组酶的序列。在一些实施方案中,位点特异性重组酶的表达切除了编码位
点特异性重组酶的表达盒。在一些实施方案中,重组酶识别序列的定位使得相应位点特异性重组酶的表达切除一个或多个编码tnsb、tnsc、tniq、cas12k和向导核酸中的一种或多种的表达盒。例如,参见图5。
89.在一些实施方案中,利用rna干扰(rnai)来抑制供体盒的靶向转座后cast系统的活性。在一些实施方案中,供体盒破坏编码dsrna发夹的表达盒,使得供体盒的切除导致与tnsb、tnsc、tniq或cas12k互补的反义rna的表达。在一些实施方案中,供体盒提供在植物可表达的启动子和与编码tnsb、tnsc、tniq或cas12k的序列的至少21个连续核苷酸互补的反义序列之间,使得供体盒的切除将启动子可操作地连接到反义序列。例如,参见图6。
90.基因间转座子可以通过rna引导的dna甲基化(rddm)触发基因沉默。通常,沉默被延迟,从而允许起始基因表达。在一些实施方案中,cast系统的活性可以通过将转座子的短保守基序或完整的非自主元件掺入cast基因的内含子或utr中而被抑制,所述cast基因的内含子或utr可以在允许sdi的初始活性之后使它们沉默。这些元件包括但不限于逆转录转座子的长末端重复序列(ltr),或它们的一些保守基序,如引物结合位点(pbs)、短散布的核元件(sine)、helitron的保守末端重复序列(helend),和dna转座子的反向末端重复序列(itr)。例如,参见图7。
91.定义
92.如本文所用,单数和单数形式的术语例如“一”、“一个”和“所述”包括复数指示物,除非内容另外清楚地指明。
[0093]“厘摩”或“cm”是指染色体位置之间的距离,对于该距离,单代中插入染色体互换的预期平均数为0.01。
[0094]
本文所用的“构建体”或“dna构建体”是指包含与第二多核苷酸序列可操作地连接的至少第一多核苷酸序列的多核苷酸序列。
[0095]
本文所用的“供体盒”或“转座子盒”是指包含侧翼为左端边界序列(le)和右端边界序列(re)的目标序列的多核苷酸。在一些实施方案中,目标序列包含一个或多个表达盒。
[0096]
如本文所用的“表达盒”是指包含至少第一多核苷酸序列和任选的转录终止序列的多核苷酸序列,所述第一多核苷酸序列能够启动可操作地连接的第二多核苷酸序列的转录,所述转录终止序列可操作地连接至所述第二多核苷酸序列。
[0097]
本文所用的“基因组靶位点”或“靶位点”是指位于宿主基因组中被选择用于靶向整合供体盒的区域。
[0098]
如本文所用,术语“内含子”是指可以从基因分离或鉴定的dna分子,并且通常可以定义为翻译前信使rna(mrna)加工期间剪接出的区域。或者,内含子可以是合成产生或操纵的dna元件。内含子可以含有影响可操作连接的基因转录的增强子元件,所述基因例如编码tnsb、tnsc、tniq和cas12k的基因。内含子可用作调节与编码tnsb、tnsc、tniq或cas12k的基因可操作连接的基因的表达的调节元件。构建体可以包含内含子,并且该内含子相对于编码tnsb、tnsc、tniq或cas12k分子的基因可以是或不是异源的。本领域内含子的实例包括水稻肌动蛋白内含子和玉米hsp70内含子。
[0099]
如本文所用,术语“巨基因座”是指通常作为单一单位遗传的至少两个遗传连锁的基因座的区段。在一些实施方案中,至少一个基因座是转基因。巨基因座可以向植物提供一种或多种期望的性状,其可以包括但不限于增强的生长、干旱耐受性、盐耐受性、除草剂抗
性、昆虫抗性、害虫抗性、抗病性等。在具体实施方案中,巨基因座至少包含约2、3、4、5、6、7、8、9、10、11、13或15个转基因基因座,所述转基因基因座是物理分离的但是遗传连锁的,使得它们可以作为单一单位遗传。在具体实施方案中,巨基因座包含至少一个天然性状基因座和至少一个转基因基因座,其是物理分离的但是遗传连锁的,使得它们可以作为单一单位遗传。巨基因座中的每个基因座可以彼此隔开0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48或49cm。
[0100]
如本文所用,术语“可操作地连接”是指第一dna分子与第二dna分子连接,其中第一和第二dna分子如此排列,使得第一dna分子影响第二dna分子的功能。两个dna分子可以是或不是单个连续dna分子的一部分,并且可以是或不是相邻的。例如,如果启动子调节细胞中目标可转录dna分子的转录,则启动子与可转录dna分子可操作地连接。例如,当前导序列能够影响dna序列的转录或翻译时,其与dna序列可操作地连接。
[0101]
如本文所用的“pam位点”或“pam序列”是指原型间隔区相邻基序(或pam),其为短dna序列(通常长度为2-6个碱基对),其与crispr相关蛋白/向导核酸系统(如crispr-cas9或crispr-cpf1)靶向切割的dna区域相邻。一些crispr相关蛋白(例如i型和ii型)需要pam位点以结合靶核酸。
[0102]“百分比同一性”或“%同一性”是指两个最佳比对的dna或蛋白质片段在组分(例如核苷酸序列或氨基酸序列)的比对窗口中不变的程度。测试序列和参考序列的比对片段的“同一性分数”是两个比对片段的序列共有的相同组分的数目除以比对窗口上参考片段中序列组分的总数,比对窗口是完整测试序列或完整参考序列中较小的一个。
[0103]“植物”是指整个植物的任何部分,或来源于植物的细胞或组织培养物,其包含以下中的任一种:完整植物、植物组分或器官(例如叶、茎、根等)、植物组织、种子、植物细胞和/或其后代。植物细胞是植物的生物细胞,取自植物或从取自植物的细胞培养物获得。
[0104]
本文所用的“启动子”是指位于基因的开放阅读框(或蛋白质编码区)的翻译起始密码子的上游或5',并且涉及于识别和结合rna聚合酶i、ii或iii以及其他蛋白质(反式作用性转录因子)以使转录起始的核酸序列。“植物启动子”是在植物细胞中具有功能性的天然或非天然启动子。组成型启动子在整个植物发育中在植物的大多数或所有组织中具有功能性。组织、器官或细胞特异性启动子分别仅或主要在特定组织、器官或细胞类型中表达。与在给定组织、植物部分或细胞类型中的“特异性”表达不同,相较于植物的其他部分,启动子可显示在植物的一种细胞类型、组织或植物部分中的“增强”表达,即较高水平的表达。在时间上调控的启动子仅或主要在植物发育的某些时期期间或在一天的某些时间具有功能性,如例如在与昼夜节律相关的基因的情况下。诱导型启动子响应于存在例如由化合物(化学诱导剂)达成的内源性或外源性刺激,或响应于环境、激素、化学和/或发育信号而使可操作地连接的dna序列选择性表达。
[0105]
关于核酸或多肽的“重组”是指材料(例如重组核酸、基因、多核苷酸、多肽等)已经通过人为干预而改变。术语重组体也可以指含有重组体材料的生物体,例如,含有重组核酸的植物被认为是重组植物。
[0106]
如本文所用,术语“序列同一性”是指两个最佳比对的多核苷酸序列或两个最佳比对的多肽序列相同的程度。通过人工比对两个序列(例如参考序列和另一个序列)产生最佳序列比对,以使序列比对中具有适当内部核苷酸插入、缺失或缺口的核苷酸匹配数目最大化。
[0107]
如本文所用,术语“百分比序列同一性”或“百分比同一性”或“%同一性”是同一性分数乘以100。与参考序列最佳比对的序列的“同一性分数”是最佳比对中核苷酸匹配的数目除以参考序列中核苷酸的总数,例如整个参考序列的全长中核苷酸的总数。因此,本发明的一个实施方案提供了包含这样的序列的dna分子,所述序列当与参考序列(本文提供为seq id no:4-13、16-19和24)最佳比对时,具有至少约85%同一性,至少约86%同一性,至少约87%同一性,至少约88%同一性,至少约89%同一性,至少约90%同一性,至少约91%同一性,至少约92%同一性,至少约93%同一性,至少约94%同一性,至少约95%同一性,至少约96%同一性,至少约97%同一性,至少约98%同一性,至少约99%同一性,或与参考序列至少约100%的同一性。
[0108]
如本文所用,“t-dna”分子或转移dna是某些细菌物种(如根癌土壤杆菌)的肿瘤诱导(ti)质粒的转移dna。将t-dna从细菌转移到宿主植物的核dna基因组中。t-dna以右和左边界dna序列为边界。转移在右边界处开始并在左边界处终止。在植物生物技术中,从t-dna中去除促肿瘤和opine合成基因,并用包含目标基因和/或选择标记的表达盒代替,这是建立成功转化的植物所需的。在植物生物技术中使用的土壤杆菌菌株包含vir基因,其曾经在ti-质粒的毒力区域中编码,在通过抗生素选择维持在宿主agro细胞中的可转化态ti质粒上。vir基因在t-dna转移和插入植物细胞染色体中是必需的。典型地,用于在生物技术中转化植物的植物二元载体质粒构建体包含t-dna,其包含左边界和右边界序列,在左边界和右边界之间具有转基因表达盒。质粒骨架包含在大肠杆菌和根癌土壤杆菌中维持质粒所必需的复制起点和抗生素选择基因。
[0109]“转基因”是指至少就其在宿主细胞基因组中的位置而言对于宿主细胞异源的可转录dna分子和/或在细胞的当前或任何先前世代中人工掺入宿主细胞基因组中的可转录dna分子。
[0110]“转基因植物”是指在其细胞内包含异源多核苷酸的植物。在一些实施方案中,异源多核苷酸被稳定地整合到基因组中,使得多核苷酸被传递到连续世代。异源多核苷酸可以单独或作为重组表达盒的一部分整合到基因组中。“转基因的”在本文中用于指任何细胞、细胞系、愈伤组织、组织、植物部分或植物,其基因型已通过异源核酸的存在而改变,包括最初如此改变的那些转基因生物体或细胞,以及由最初转基因生物体或细胞的杂交或无性繁殖产生的那些。本文所用的术语“转基因”不涵盖通过常规植物育种方法(例如杂交)或通过天然发生的事件如随机交叉杂交、非重组病毒感染、非重组细菌转化、非重组转座或自发突变改变基因组(染色体或染色体外)。
[0111]“载体”是指在细胞之间转移核酸的多核苷酸或其它分子。载体通常来源于质粒、噬菌体或病毒,并且任选地包含介导载体维持并使其能够用于预期用途的部分。“克隆载体”或“穿梭载体”或“亚克隆载体”包含促进亚克隆步骤的可操作连接的部分(例如,含有多个限制性内切酶位点的多克隆位点)。如本文所用的术语“表达载体”是指包含可操作地连接的多核苷酸序列的载体,所述多核苷酸序列促进编码序列在特定宿主生物体中的表达
(例如,细菌表达载体或植物表达载体)。
[0112]
在一些实施方案中,用于描述和要求保护本公开的某些实施方案的表示成分的量、性质(如分子量)、反应条件等的数目应理解为在一些情况下被术语“约”修饰。在一些实施方案中,术语“约”用于表示值包括用于确定该值的装置或方法的平均值的标准偏差。在一些实施方案中,在书面说明书和所附权利要求中阐述的数值参数是近似值,其可以根据特定实施方案寻求获得的所需性质而变化。在一些实施方案中,应根据所报告的有效数字的数目且通过应用常规舍入技术来解释数值参数。尽管阐述本公开的一些实施方案的宽范围的数值范围和参数是近似值,但在具体实施例中阐述的数值尽可能精确地报告。在本公开的一些实施方案中呈现的数值可以包含由在它们各自的测试测量中发现的标准偏差必然产生的某些误差。本文中数值范围的记载仅旨在用作单独提及落入该范围内的每个单独值的速记方法。除非本文另有说明,每个单独的值被并入说明书中,如同其在本文中被单独记载一样。
[0113]
术语“包含”、“具有”和“包括”是开放式连接动词。这些动词中的一个或多个的任何形式或时态,例如“包含”、“具有”和“包括”也是开放式的。例如,“包含”、“具有”和“包括”一个或多个步骤的任何方法不限于仅具有有那些一个或多个步骤,并且还可以涵盖其他未列出的步骤。类似地,“包含”、“具有”或“包括”一个或多个特征的任何组合物或装置不限于仅具有那些一个或多个特征,并且可涵盖其它未列出的特征。
[0114]
本文所述的组合物和方法适用于整个植物、植物部分和植物细胞。植物部分包括但不限于叶、茎、根、块茎、种子、胚乳、胚珠和花粉。植物部分可以是活的、非存活的、可再生的和/或不可再生的。可以提及的植物的实例是重要的作物植物,如谷物(小麦、水稻、黑小麦、大麦、黑麦、燕麦)、玉米、大豆、马铃薯、甜菜、甘蔗、番茄、豌豆和其他类型的蔬菜、棉花、烟草、油菜以及还有水果植物(水果苹果、梨、柑橘类水果和葡萄),其中特别强调的是玉米、大豆、小麦、水稻、马铃薯、棉花、甘蔗、烟草和油菜。
[0115]
本文还提供了由含有供体盒的目标序列的靶向转座或其部分产生的商品。本发明的商品含有可检测量的dna,所述dna包含选自下组的dna序列:seq id no:45-48。本文所用的“商品”是指由来源于含有本发明重组dna分子的转基因植物、种子、植物细胞或植物部分的材料组成的任何组合物或产品。商品包括但不限于加工的种子、谷粒、植物部分和粗粉。本发明的商品含有可检测量的对应于转座子盒的dna。样品中一种或多种这种dna的检测可用于确定商品产品的含量或来源。可以使用检测dna分子的任何标准方法,包括本文公开的检测方法。
[0116]
本文所述的所有方法可以任何合适的顺序进行,除非本文另有说明或与上下文明显矛盾。关于本文中的某些实施例提供的任何和所有实施例或示例性语言(例如,“诸如”)的使用仅旨在更好地说明本公开,而不对本公开另外要求保护的范围造成限制。说明书中的任何语言都不应被解释为指示对于本公开的实践而言必不可少的任何未要求保护的要素。
[0117]
本文公开的本公开的替代元件或实施方案的分组不应被解释为限制。每组成员可以单独地或以与该组的其他成员或本文中发现的其他要素的任何组合来提及和要求保护。出于方便或专利性的原因,组的一个或一个以上成员可包括于组中或从组中删除。例如,如果项目选自由a、b、c和d组成的组,则本发明人明确预期每个单独的替代方案(例如,单独的
a、单独的b等),以及诸如a、b和d;a和c;b和c的组合;等。
[0118]
已经详细描述了本公开,显而易见的是,在不脱离所附权利要求中限定的本公开的范围的情况下,修改、变化和等效实施方案是可能的。此外,应当理解,本公开中的所有实施例都作为非限制性实施例提供。
具体实施方案
[0119]
实施例1
[0120]
鱼腥蓝细菌grna、le和re序列
[0121]
strecker等(2019)报道了大多数cast元件的天然序列。然而,该研究未报道accast系统的crrna、tracrrna、le和re,因此使用生物信息学方法鉴定它们。使用clustalw(thompson et al.;nucleic acids res.1994;22(22):4673
–
4680)将霍氏双岐藻(sh)的非编码rna与鱼腥蓝细菌(ac)的相应基因组区域进行成对比对以鉴定鱼腥蓝细菌的crrna和tracrrna种类。就在鱼腥蓝细菌actnsb和cas12k上游和下游的500bp区域用于鉴定推定的acle和acre序列。acsgrna序列公开为seq id no:55。acre序列公开为seq id no:47。acre序列公开为seq id no:48。
[0122]
实施例2
[0123]
使用根癌土壤杆菌用cast组分转化植物
[0124]
将土壤杆菌t-dna载体设计用于将cast系统组分递送至植物细胞。如图3a所示,效应蛋白、tnsb、tnsc、tniq和cas12k由单独的基因表达盒编码,其在适合与根癌土壤杆菌菌株一起使用的二元载体中一起组装成单个t-dna分子。如图3b所示,将编码cast系统效应蛋白的序列作为单个转录单位克隆到t-dna分子中,其中tnsb、tnsc、tniq和cas12k编码序列由编码自身切割肽2a的序列分开,导致产生对应于功能性tnsb、tnsc、tniq和cas12k蛋白的单个多肽。如图3c所示,将编码cast系统的效应蛋白tnsb、tnsc、tniq和cas12k的序列作为单个转录单位克隆到t-dna分子中,其中内部核糖体进入位点(ires)序列位于tnsb、tnsc、tniq和cas12k编码序列之间以产生导致产生多种多肽的转录物。在t-dna载体中还提供了植物可选择标记基因的表达盒,例如抗生素抗性或除草剂抗性,以帮助选择转化的植物细胞。进一步设计t-dna载体以包含用于产生至少一种合适的grna的表达盒,所述grna与cas12k形成复合物并引导其与植物基因组中的靶位点杂交。还将t-dna载体设计成含有供体盒,所述供体盒包含位于目标核酸序列侧翼的保守le和re元件。
[0125]
选择基因表达调控元件,包括但不限于启动子、内含子、聚腺苷酸化序列和转录终止序列,以提供t-dna上每个表达元件的合适表达水平。利用以足够水平和定时表达基因盒的基因表达元件,以便在相同时间和相同组织中以足以导致靶向转座活性的水平提供所有必需组分。可以选择启动子和其它调节元件以提供系统所有组分的组成型基因表达。为了降低当以协同方式表达时转录后基因沉默的风险,可以使用在序列水平上彼此不同的基因表达元件。包括在t-dna中的遗传元件可以在t-dna中以任何顺序和方向排列,但优选排列和定向基因盒以降低对基因表达的非预期影响的可能性。优选在一些基因盒之间包括绝缘子或其它插入序列。
[0126]
基于可选择标记盒的存在和表达选择含有上述t-dna的转基因植物。在将t-dna插入基因组之前、期间或之后,将le和re元件侧翼的目标序列插入由cas12k和grna序列确定
的靶侧。该方法产生具有至少两个转基因dna插入的起始转基因植物;将全部或部分t-dna插入基因组的一个或多个随机位置,并将供体盒'转座子'插入所需靶位点。在大多数情况下,t-dna和供体盒'转座子'是遗传上不连锁的,使得在随后的植物世代中,t-dna和供体盒可以彼此独立地分离,导致缺乏含有cast效应蛋白表达盒的原始t-dna的植物。
[0127]
实施例3
[0128]
优化cas12k的grna功能
[0129]
优化grna结构和grna启动子以提高植物中的cast活性。为了确定grna表达水平或结构的差异如何影响cas12k结合,利用了依赖于从转染到玉米叶原生质体中的报告基因构建体中的基因gus上游的最小启动子激活转录的测定。由于cas12k不切割dna,它可以被直接修饰以编码添加到n端或c端的tale蛋白(seq id 67)的一个nls结构域和转录因子结构域。由具有三个相邻grna结合位点的最小camv启动子驱动的uida(gus)报告基因组成的报告基因构建体将监测cas12k-tale-tf与指示该结合的gus蛋白的表达的结合。具有grna的cas12k-tale-tf可以在有或没有cast系统组分、tnsb、tnsc和tniq的情况下表达,以监测在存在和不存在cast系统的其它效应蛋白的情况下cas12k结合的效率。如果cas12k-tale-tf可以在不存在tnsb、tnsc和tniq的情况下结合并激活转录,则由于cas12k的较小尺寸,它可能优于cas9或cpf1 crispr作为连接转录激活因子的骨架。
[0130]
启动子对于grna的优化通过设计一组grna(基于sgrna,strecker et.al.2019)表达构建体来进行,该构建体包含选自每类snrna基因的启动子,即u6、7sl、u2、u5和u3(参见us20170166912a1)。当cas12k-tale-tf和grna复合物结合gus报告基因构建体时,tale转录因子结构域将激活最小camv启动子,导致gus转录物的更高表达,并最终导致更高水平的gus蛋白表达。选择提供最佳grna表达的启动子,如通过gus蛋白表达所测定。对于cast系统的一些应用,选择提供最高gus表达水平的grna启动子。在cast系统的其它应用中,选择提供低或中等gus表达水平的grna启动子。
[0131]
cas12k-tale-tf/gus报告基因系统也用于确定最佳sgrna序列和/或结构。使用改变茎1-5的茎尺寸、环尺寸、凸起尺寸或核苷酸组成的一系列构建体优化cas12kg rna的结构(参见图4)。也可以通过改变序列去除四或五单核苷酸延伸而优化cas12k sgrna的序列,同时保持结构。当在poliii启动子下表达时,核苷酸43-46处的四t可过早终止sgrna,茎4的五c和g也可影响有效转录。预计在改变核苷酸组成的同时保持结构可增加总活性。cas12k-tale-tf和改变的sgrna与gus报告基因构建体的复合物的表达,通过tale结构域对最小camv启动子的活化水平来监测cas12k-tale-tf/改变的sgrna复合物的效率,最终影响gus蛋白表达。选择提供最佳cas12k结合的sgrna结构,如通过gus蛋白表达所测定。对于cast系统的一些应用,选择提供最高gus表达水平的sgrna序列和/或结构。在cast系统的其它应用中,选择提供低或中等gus表达水平的sgrna序列和/或结构。
[0132]
实施例4
[0133]
用于在植物和大肠杆菌中最佳表达的合成的密码子优化的cast序列:
[0134]
分析来自shcast和accast系统的tnsb、tnsc、tniq和cas12k基因的核苷酸序列,并对开放阅读框进行密码子优化以在植物和细菌中最佳表达。密码子优化的(co)变体列于表1中。
[0135]
表1:密码子优化的(co)shcast和accast序列。
[0136]
[0137]
[0138][0139]
实施例5
[0140]
测定大豆原生质体中cast活性
[0141]
用于cast蛋白的植物优化的表达盒:为了促进大豆中cast蛋白的核定位,将编码马铃薯核定位信号(nls)(wo 2019084148-81)和番茄nls(wo 2019084148-82)的序列并入表1中所述的植物密码子优化的sh/ac tnsb、tnsc、tniq和cas12k基因(seq id no 1-36,其缺乏编码终止密码子的最后3个核苷酸)的开放阅读框的5'和3'端。编码nls的开放阅读框与蒺藜状苜蓿启动子盒(us 20180230479-0031)和蒺藜状苜蓿转录终止子序列(us 20180230478-0001)可操作地连接(参见图1a)。随后,将表达盒引入合适的植物表达载体中。
[0142]
供体/转座子盒:产生包含转座子盒的sh供体和ac供体盒用于该测定(图1c)。两个盒均包含大肠杆菌腺苷酰转移酶基因(aada),其与编码叶绿体靶向肽的核苷酸序列融合,并可操作地连接至拟南芥肌动蛋白启动子和根癌土壤杆菌nos基因终止子序列。aada基因提供对壮观霉素的抗性并用作选择标记。aada盒的侧翼是来自sh或accast系统的保守le和re元件。shle公开为seq id no:45。shre公开为seq id no:46。ac供体盒的侧翼是来自accast系统的保守le和re元件。acle公开为seq id no:47。acre公开为seq id no:48。随后将表达盒引入合适的植物表达载体中。
[0143]
大豆基因组中靶位点的选择:选择染色体18(genbank accession cm000851)上的八氢番茄红素脱氢酶(gmpds)基因作为通过shcast系统定点整合供体盒的靶区域。基于5'末端的适当bgtt pam位点的出现选择5个gmpds1靶位点(参见表2)。
[0144]
表2:选择用于shcast介导的插入的大豆靶位点序列。
[0145][0146]
用于大豆的单向导rna表达盒:天然构型的cas12k利用crispr rna(crrna)和单独的反式激活crispr rna(tracrrna)。为了产生单向导rna(sgrna),使用五环(gaaaa)将tracrrna与crrna融合。设计独特的shsgrna构建体以将shcas12k蛋白引导至gmpds1内的选定靶位点。每个sgrna构建体包含编码tracrrna序列、五环序列和crrna序列的dna序列。crrna序列还包含重复序列和与大豆染色体上的靶位点互补的可变序列(seq id 49-53)。shsgrna的示踪剂rna-五环-重复序列的序列如seq id no 54所示。acsgrna的示踪剂rna-五环-重复序列的序列如seq id no 55所示。在所有sgrna的5'末端添加'g'核苷酸,并且所述序列可操作地连接至soyu6启动子盒(wo 2019084148-17)和polyt8终止子序列。随后将sgrna表达盒引入合适的植物表达载体中。
[0147]
用于供体的位点特异性整合的原生质体转化和测定:使用标准聚乙二醇(peg)介导的转化方案,将含有上述密码子优化的shtnsb、shtnsc、shtniq和shcas12k盒和至少一种shsgrna的设定摩尔比的植物表达载体与sh供体载体一起共递送到大豆原生质体中。转化后,将原生质体在黑暗中孵育,48小时后收获。分离基因组dna并测定供体表达盒整合到预选的gmpds靶位点。使用与wo 2019084148中所述相似的侧翼pcr测定来鉴定推定的靶向插入。还将对所得扩增子测序以确认靶向插入。
[0148]
实施例6
[0149]
测定大豆植物中的shcast活性
[0150]
产生在左边界(lb)和右边界(rb)序列之间包含7个表达盒的土壤杆菌t-dna载体。盒1是可选择标记基因aada的表达盒。盒2是包含与番茄hsfa基因(热激转录因子)nls(wo 2019084148-0010)在5'端和3'端融合的shtnsb-co2序列(seq id no:2)的表达盒,其可操作地连接至大丽花花叶病毒启动子盒(wo 2019084148,seq id 6-8)和来自蒺藜状苜蓿的转录终止子序列。盒3是包含与番茄hsfa基因(热激转录因子)nls(wo 2019084148-0010)在5'端和3'端融合的shtnsc-co2序列(seq id no:4)的表达盒,其可操作地连接至来自棉花的墨西哥黄瓜启动子盒和转录终止子序列(us 20180216129-0036)。盒4是包含与番茄hsfa nls(wo 2019084148-0010)在5'端和3'端融合的shtniq-co2序列(seq id no:6)的表达盒,其可操作地连接至拟南芥泛素10启动子盒和来自棉花的转录终止子序列(us 20180216129-0036)。盒5是包含与番茄hsfa nls在5'端和3'端融合的shcas12k-co2序列
(seq id no:8)的表达盒,其可操作地连接至蒺藜状苜蓿泛素2启动子盒和同样来自蒺藜状苜蓿的转录终止子序列(us 20180230478-0001)。盒6是包含靶向至少一个表2中描述的gm.pds chr18靶位点并可操作地连接至大豆u6启动子(wo 2019084148-017)的shsgrna的表达盒。或者,sgrna盒可操作地连接至gmu3启动子(seq id no 56)。盒7包含可操作地连接至camv 35s启动子和土壤杆菌nos终止子序列的gus报告基因。gus盒侧翼为保守的shle(seq id no:45)和shre(seq id no:46)转座子序列。
[0151]
用含有上述t-dna载体的土壤杆菌培养从a3555大豆植物切除的胚。在选择培养基上选择转化的植物,4周后收获来自再生小植株的叶样品,并提取基因组dna。分析基因组dna中供体表达盒整合入预选的gmpds1靶位点。侧翼pcr测定将用于鉴定推定的靶向插入。还将对所得扩增子测序以确认靶向插入。
[0152]
实施例7
[0153]
测定玉米植物中的cast活性
[0154]
玉米基因组中靶位点的选择:选择zm7基因座(seq.id.no:57)作为使用cast系统定点整合目标序列的靶区域。基于在5'端的适当pam位点的出现,选择3个zm7靶位点来测试accast系统,并且选择6个靶位点用于shcast系统(参见表3)。
[0155]
表3:为玉米选择的靶位点序列。
[0156][0157]
[0158]
产生包含7个表达盒的土壤杆菌t-dna载体。载体设计和组成类似于实施例6中描述的载体,除了将sgrna盒设计为将shcas12k或accas12k蛋白引导至表3中描述的zm7基因座内的选定靶位点。每个sgrna构建体包含编码tracrrna序列、五环序列和crrna序列的dna序列。crrna序列包含重复序列和与染色体上靶位点互补的可变间隔区序列。shsgrna盒的示踪剂rna-五环-重复序列的序列如seq id no 30所示。acsgrna盒的示踪剂rna-五环-重复的序列如seq id no 31所示。在所有sgrna的5'末端添加'g'核苷酸,并且所述序列与玉米u6启动子盒和polyt8终止子序列可操作地连接。
[0159]
用含有包含上述表达盒的t-dna载体的土壤杆菌转化玉米胚。在选择培养基上选择转化的植物,4周后收获来自再生小植株的叶样品,并提取基因组dna。分离基因组dna并测定供体表达盒整合到预选的zm7靶位点。侧翼pcr测定将用于鉴定推定的靶向插入。还将对所得扩增子测序以确认靶向插入。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
