1.本发明涉及药物化学和药物治疗学领域,具体涉及作为冠状病毒3cl蛋白酶或 rna病毒蛋白酶抑制剂的醛基类化合物、其制备方法、含此类化合物的药物组合物及 用途。
背景技术:
2.在急性传染病中,绝大部分都是病毒性传染病,病毒性传染病的发病率高,死亡 率也很高。由于检测和诊断手段有限,导致新病毒引发的新疫情爆发往往具有突发性、 随机性和不可预测性等特点,一旦爆发,如无有效的防治手段,极易造成大规模流行, 严重威胁人民健康生命安全。sars、mers、和covid-19等疾病的病原体均为rna 病毒,极易发生变异,很可能会在频繁的变异中获得新的特性,从而引发疫情不可控 制的变化。这些病原体感染者初期症状与感冒类似,但病程发展更快,危害更大,甚 至存在无症状感染者,让人难以防范。这些传染病的致病机制还有待研究,目前主要 的治疗方法是以对症支持治疗为主,普遍缺乏抗病毒特效药物和预防性疫苗。
3.sars-cov-2冠状病毒属于冠状病毒科冠状病毒属,为具有包膜的单链正义rna 病毒。和其他已知冠状病毒类似,sars-cov-2冠状病毒也经过吸附、穿入、脱壳、 生物合成、子代病毒的组装与释放等几个过程完成子代病毒的增殖。sars-cov-2冠 状病毒感染宿主细胞起始于病毒包膜表面的刺突糖蛋白与宿主细胞表面的受体结合, 随后发生膜融合,病毒进入宿主细胞,在细胞溶酶体等细胞器作用下,释放出病毒的 遗传物质单链正义rna,在宿主细胞的线粒体、核糖体等蛋白质合成元件以及必须的 原料等作用下,翻译产生多聚蛋白,之后,sars-cov-2冠状病毒的两大必需半胱氨 酸蛋白酶:木瓜样蛋白酶(papain-like protease,pl
pro
)和3c样蛋白酶(3c-likeprotease,3cl
pro
)在特定位点切割加工多聚蛋白前体,产生多个对病毒生命周期非常重 要的非结构蛋白。在这些非结够蛋白的作用下,病毒rna复制出子代病毒核酸物质, 并大量翻译出所需的结构蛋白,完成子代病毒的组装和释放。sars-cov-2冠状病毒 感染细胞的生命周期的任何环节或关键酶均可以作为抗病毒药物的研究靶点,如水解 切割多聚蛋白前体的半胱氨酸蛋白酶pl
pro
和3cl
pro
,负责完成子代病毒遗传物质复制 的rna聚合酶等。
4.3cl蛋白酶(3 chymotrypsin-like protease,3cl
pro
),又称主蛋白酶(m
pro
),是冠状病毒 rna翻译出多聚蛋白pp1a和pp1ab后水解产生多个非结构蛋白过程中的关键蛋白酶, 对病毒的复制和感染至关重要,抑制3cl蛋白酶的催化功能可有效抑制病毒多聚蛋白 前体的切割,阻断病毒复制,抑制子代病毒生成。3cl
pro
属于半胱氨酸蛋白酶,是催 化单正链rna病毒前体蛋白水解的关键蛋白酶,对sars-cov-2等冠状病毒的复制活 性具有重要的作用。因此,3cl
pro
是目前公认的研发抗冠状病毒药物的理想靶点。
5.目前,针对sars-cov-2冠状病毒导致的严重肺炎疾病尚无特效的疫苗和抗病毒药 物。这些感染性疾病严重影响了人们的生命健康,研发效果好的小分子抗病毒药物迫 在眉睫。针对sars-cov-2冠状病毒3cl
pro
开发出结构新颖、低毒高效且具有自主知识 产权的抗病毒药物,以满足国内外sars-cov-2冠状病毒感染患者的临床需求,具有 重大的社会意
义。
6.综上所述,本领域迫切需要开发针对sars-cov-2冠状病毒3cl蛋白酶的抑制剂用 于治疗sars-cov-2冠状病毒感染引起的肺炎。
技术实现要素:
7.本发明的目的是提供一种蛋白酶抑制剂。
8.在本发明第一方面,提供了一种通式(i)所示的醛基类化合物、或其药学上可接受 的盐、对映异构体、非对映异构体或外消旋体:
[0009][0010]
其中,
[0011]
手性碳原子c*、c*2、c*3各自独立地为s型、r型,或其组合;
[0012]
n=1或2;
[0013]
杂环为含氮5-12元杂环、或含氮5-12元杂芳环;其中,所述杂环或杂芳环各 自独立地含有1~3个选自氧、硫、氮或c=o的环原子;
[0014]
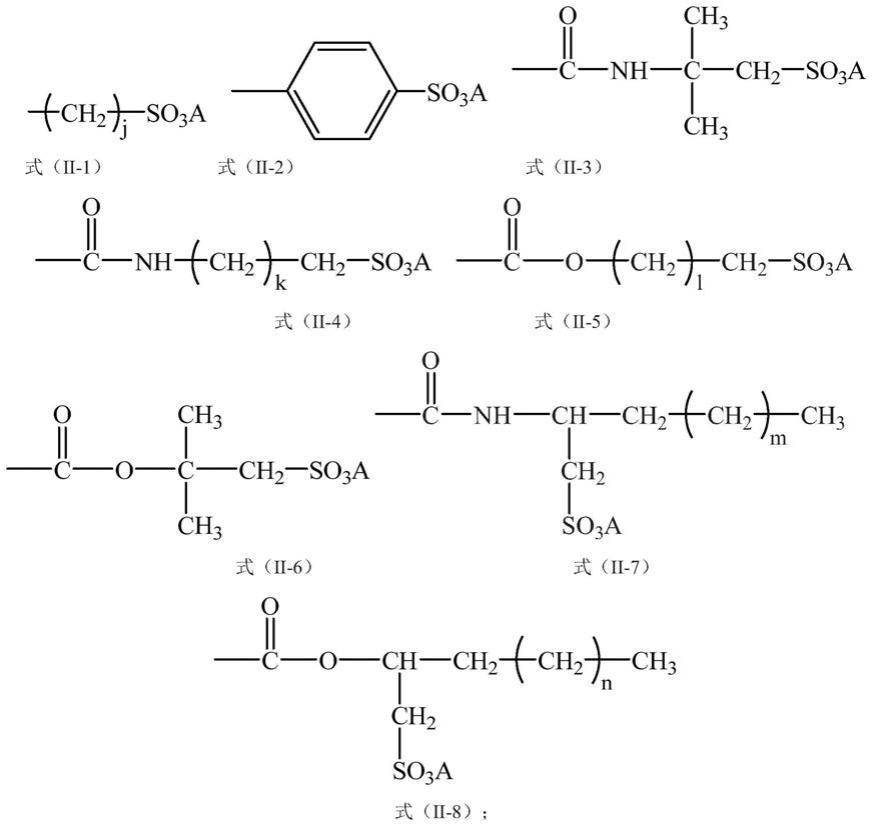
r1选自未被取代或者被1-3个取代基取代的以下基团:c3~c7环烷基、三氟甲 基、c2~c6炔基、4~7元杂环基、c5~c7芳基、5~7元杂芳基;所述杂环基和杂 芳基各自含有1~3个选自氧、硫和氮的杂原子;所述的取代基各自独立地选自下组: 卤素、c1~c4直链或支链烷基、c1~c4直链或支链烯基、c2~c4直链或支链炔基、 c1~c4直链或支链烷氧基、c1~c4直链或支链烷基羰氧基、氰基、硝基、羟基、氨 基、羟甲基、三氟甲基、羧基、巯基、c1-c4酰基、酰胺基、磺酰基、氨基磺酰基、 c1-c4烷基取代的磺酰基,或者两个相邻的取代基连同与其连接的碳原子构成5-7元 环;
[0015]
r2选自氢、r5o-、r5co-、r5coo-、r5n(r6)-、r5con(r6)-、、未被取代或者被1-3个取代基取代的c1~c6饱和或不饱和的直链或支链烃基、 未被取代或者被1-3个取代基取代的c3~c7环烷基、未被取代或者被1-3个取代基 取代的5~7元芳基或杂芳基,所述杂芳基含有1~3个选自氧、硫和氮的杂原子;其 中,所述的取代基各自独立地选自卤素、c1~c6直链或支链烷基、c2~c6直链或支 链烯基、c2~c6直链或支链炔基、c1~c6直链或支链烷氧基、c1~c6直链或支链 烷基羰氧基、氰基、硝基、羟基、氨基、羟甲基、三氟甲基、羧基、巯基、c1-c4酰 基、酰胺基、磺酰基、氨基磺酰基、c1-c4烷基取代的磺酰基,或者两个相邻的取代 基连同与其连接的碳原子构成5-7元环;
[0016]
r3、r4各自独立地选自氢,卤素、c1~c6直链或支链烷基、c2~c6直链或支 链烯基、c2~c6直链或支链炔基、c1~c6直链或支链烷氧基、c1~c6直链或支链 烷基羰氧基、氰基、硝基、羟基、氨基、羟甲基、三氟甲基、羧基、巯基、c1-c4酰 基、酰胺基、磺酰基、氨基磺酰基、c1-c4烷基取代的磺酰基,或者两个相邻的取代 基连同与其连接的碳原子构成5-7元环;
[0017]
r5选自氢、未被取代或者被1-3个取代基取代的以下基团:c1~c6饱和或不饱 和的直链或支链烃基、c3~c7环烷基、c1~c6直链或支链烷氧基、5~7元杂环基、 c6~c12芳基、苯并杂环基、5~12元杂芳基;所述杂环基或杂芳基含有1~3个选 自氧、硫和氮中的杂原子,所述取代基各自独立地选自卤素、c1~c6直链或支链烃 基、c1~c6直链或支链烷氧基、c1~c6直链或支链烷基羰氧基、氰基、硝基和羟基、 氨基、羟甲基、三氟甲基、羧基、巯基、c1-c4酰基、酰胺基、磺酰基、氨基磺酰基、 c1-c4烷基取代的磺酰基,或者两个相邻的取代基连同与其连接的碳原子构成5-7元 环;
[0018]
r6、r7、r8选自氢、未被取代或者被1-3个取代基取代的以下基团:c1~c6饱 和或不饱和的直链或支链烃基、c3~c7环烷基、c1~c6直链或支链烷氧基;所述取 代基各自独立地选自卤素、c1~c6直链或支链烃基、c1~c6直链或支链烷氧基、c1~ c6直链或支链烷基羰氧基、氰基、硝基和羟基、氨基、羟甲基、三氟甲基、羧基、 巯基、c1-c4酰基、酰胺基、磺酰基、氨基磺酰基、c1-c4烷基取代的磺酰基,或者 两个相邻的取代基连同与其连接的碳原子构成5-7元环。
[0019]
在另一优选例中,杂环选自选自
[0020]
在另一优选例中,r1选自未被取代或者被1-3个取代基取代的以下基团:三氟甲 基、炔基、环丙烷基、环丁烷基、环戊烷基、环己烷基、苯基、噻吩基、吡唑基、噻 唑基、吡啶基、呋喃基;
[0021]
在另一优选例中,r2选自氢、r5o-、r5co-、r5coo-、r5n(r6)-、r5con(r6)-、 未被取代或者被1-3个取代基取代的c1~c4饱和或不饱 和的直链或支链烃基、未被取代或者被1-3个取代基取代的c3~c7环烷基、未被取 代或者被1-3个取代基取代的5~7元芳基或杂芳基;
[0022]
在另一优选例中,r3、r4各自独立地选自氢,卤素、c1~c4直链或支链烷基、 c2~c4直链或支链烯基、c1~c4直链或支链烷氧基、c1~c4直链或支链烷基羰氧 基、氰基、硝基、羟基、氨基、羟甲基、三氟甲基、c1-c4酰基、酰胺基、磺酰基、 氨基磺酰基、c1-c4烷基取代的磺酰基,或者两个相邻的取代基连同与其连接的碳原 子构成5-7元环;
[0023]
在另一优选例中,手性碳原子c*、c*2、c*3各自独立地为s型;
[0024]
r2选自氢、r5o-、r5co-、r5n(r6)-、r5con(r6)-、未被取代或者被1-3个取代基取代的5~7元芳基或杂芳基;
[0025]
r5选自氢、未被取代或者被1-3个取代基取代的以下基团:c1~c4饱和或不饱 和的直链或支链烃基、c3~c6环烷基、c1~c4直链或支链烷氧基、苯基、苯乙烯基、 苯并杂环基、5~12元杂芳基;优选地,所述苯并杂环和5~12元杂芳环选自苯并二 氧杂环戊烯、吲哚、噁唑、异噁唑、2-氢丙吡喃、吡啶、吡唑、二氢咪唑并吡啶、咪 唑并吡啶、苯并噻吩、二氢苯并二氧六环、喹喔林、苯并呋喃、吲唑、苯并咪唑、喹 啉;
[0026]
r6、r7、r8选自氢、未被取代或者被1-3个取代基取代的以下基团:c1~c4饱 和或不饱和的直链或支链烃基、c3~c6环烷基、c1~c4直链或支链烷氧基;
[0027]
在另一优选例中,所述醛基类化合物选自以下化合物:
[0028]
[0029]
[0030]
[0031]
[0032]
[0033][0034]
本发明的第二方面,提供了一种如本发明第一方面所述通式(i)所示的化合物的制 备方法,包括步骤:
量的一种或多种本发明第一方面所述通式(i)所示化合物,或其药学上可接受的盐、 对映异构体、非对映异构体或外消旋体。
[0046]
本发明的第四方面,提供了一种如本发明第一方面所述通式(i)所示化合物, 或其药学上可接受的盐、对映异构体、非对映异构体或外消旋体的用途,用于制备治 疗或预防由sars-cov-2和/或sars-cov和/或mers-cov等冠状病毒,和/或ev71 和/或ev68和/或诺如病毒等rna病毒感染引起的相关疾病的药物组合物。
[0047]
在另一优选例中,所述由sars-cov-2和/或sars-cov和/或mers-cov等冠 状病毒感染引起的相关疾病选自下组:呼吸道感染、肺炎及其并发症、或其组合。
[0048]
在另一优选例中,所述由ev71和/或ev68和/或诺如病毒等rna病毒感染引起 的相关疾病选自下组:手足口病、中枢神经系统感染、腹泻及其并发症、或其组合。
[0049]
在本发明的第五方面,提供了一种治疗、预防、和/或缓解由sars-cov-2和/或 sars-cov和/或mers-cov等冠状病毒,和/或ev71和/或ev68和/或诺如病毒等 rna病毒感染引起的相关疾病的方法,包括步骤:给需要的对象施用安全有效量的通 式(i)所示的醛基类化合物、或其药学上可接受的盐、对映异构体、非对映异构体或外 消旋体,其中所述的通式(i)所示的醛基类化合物如上所述。
[0050]
在另一优选例中,所述的对象为灵长目哺乳动物,如人。
[0051]
在本发明的第六方面,提供了一种抑制2019新型冠状病毒(2019-ncov)的3cl蛋 白酶的活性的方法,包括步骤:将通式(i)所示的醛基类化合物、或其药学上可接受的 盐、对映异构体、非对映异构体或外消旋体与2019-ncov的3cl蛋白酶接触,从而抑 制2019-ncov的3cl蛋白酶的活性。
[0052]
在另一优选例中,所述的2019-ncov的3cl蛋白酶是重组的或2019-ncov表达的 3cl蛋白酶。
[0053]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具 体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇 幅,在此不再一一累述。
具体实施方式
[0054]
本发明人经过广泛而深入的研究,通过大量筛选,首次意外地开发了一类可有效 抑制sars-cov-2和/或sars-cov和/或mers-cov等冠状病毒,和/或ev71和/或 ev68和/或诺如病毒等rna病毒的活性成分,即通式i所示的化合物或或其药学上可 接受的盐、对映异构体、非对映异构体或外消旋体。试验表明,本发明的活性成分可 高效地抑制sars-cov-2和/或sars-cov和/或mers-cov和/或诺如病毒等病毒的 3cl蛋白酶的活性,也可抑制ev71和/或ev68等肠道病毒的3c蛋白酶的活性,从 而抑制相关病毒的复制和活力。在此基础上完成了本发明。
[0055]
术语
[0056]
在本文中,除特别说明之处,术语“取代”指基团上的一个或多个氢原子被选自下 组的取代基取代:c1~c
10
烷基、c3~c
10
环烷基、c1~c
10
烷氧基、卤素、羟基、羧 基(-cooh)、c1~c
10
醛基、c2~c
10
酰基、c2~c
10
酯基、氨基、苯基;所述的苯基包 括未取代的苯基或具有1-3个取代基的取代苯基,所述取代基选自:卤素、c
1-c
10
烷 基、氰基、oh、硝基、c3~c
10
环烷基、
c1~c
10
烷氧基、氨基。
[0057]
除特别说明之处,本发明的所有化合物之中,各手性碳原子可以任选地为r构 型或s构型,或r构型和s构型的混合物。
[0058]
术语“c1~c6烷基”指具有1~6个碳原子的直链或支链烷基,例如甲基、乙基、 丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、或类似基团。
[0059]
术语“3-8元杂环基”指具有选自下组的1-3个杂原子的3~8元饱和环失去一个氢 原子形成的基团:n、s、o;例如吡咯烷基、哌啶基、哌嗪基、吗啉基、或类似基团。
[0060]
术语“6-10元芳基”指6~10元芳基失去一个氢原子形成的基团;例如苯基、萘基, 或类似基团。
[0061]
术语“5-10元杂芳基”指具有选自下组的1-3个杂原子的5~8元芳基失去一个氢 原子形成的基团:n、s、o,其中每个杂芳基的环状体系可以是单环或多环的;例如 吡咯基、吡啶基、噻吩基、呋喃基、咪唑基、嘧啶基、苯并噻吩基、吲哚基、咪唑并 吡啶基、喹啉基或类似基团。
[0062]
术语“c1~c6烷氧基”指具有1-6个碳原子的直链或支链烷氧基,例如甲氧基、 乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基、叔丁氧基、或类似基团。
[0063]
术语“c2-c6酯基”指具有2-6个碳原子的r-o-c(=o)-基团,如-cooch3、
ꢀ-
cooc2h5、-cooc3h7、-cooc4h9,或类似基团。
[0064]
术语“c2-c6烯基”指具有2-6个碳原子的烯烃失去一个或两个氢原子所形成的基 团,所述的烯烃可以是单烯烃、二烯烃或三烯烃,例如-ch=ch2、-c2h4=ch2、
ꢀ-
ch=c2h4,或类似基团。
[0065]
术语“卤素”指f、cl、br和i。
[0066]
除非特别说明,本发明所描述的结构式意在包括所有的同分异构形式(如对映异构, 非对映异构和几何异构体(或构象异构体):例如含有不对称中心的r、s构型,双键的(z)、 (e)异构体和(z)、(e)的构象异构体。因此本发明的化合物的单个立体化学异构体或其对映 异构体、非对映异构体或几何异构体(或构象异构体)的混合物都属于本发明的范围。
[0067]
术语“互变异构体”表示具有不同能量的结构同分异构体可以超过低能垒,从而互 相转化。比如,质子互变异构体(即质子移变)包括通过质子迁移进行互变,如1h-吲 唑与2h-吲唑、1h-苯并[d]咪唑与3h-苯并[d]咪唑,化合价互变异构体包括通过一些 成键电子重组而进行互变。
[0068]
在本文中,形如“c1~c6”,表示该基团可以具有1个至6个碳原子,例如1个、 2个、3个、4个或5个。
[0069]
活性成分
[0070]
在本发明中,提供了一种可有效抑制sars-cov-2和/或sars-cov和/或 mers-cov等冠状病毒,和/或ev71和/或ev68和/或诺如病毒等rna病毒复制的活 性成分。该活性成分为通式i所示的化合物,该活性成分可有效预防、治疗和/或缓解 相关疾病。
[0071]
应理解,本发明的活性成分包括通式(i)所示的醛基类化合物、或其药学上可接受 的盐、对映异构体、非对映异构体或外消旋体、或其前药。应理解,本发明的活性成 分还包括通式(i)化合物的晶型、无定形化合物、以及氘代化合物等形式。
[0072]
所述“药学上可接受的盐”为通式(i)化合物与无机酸或有机酸反应形成常规的无 毒盐。例如,常规的无毒盐可通过通式(i)化合物与无机酸或有机酸反应制得,所述无 机酸包括盐酸、氢溴酸、硫酸、硝酸、胺基磺酸和磷酸等,所述有机酸包括柠檬酸、 酒石酸、乳酸、丙酮酸、乙酸、苯磺酸、对甲苯磺酸、甲磺酸、萘磺酸、乙磺酸、萘 二磺酸、马来酸、苹果酸、丙二酸、富马酸、琥珀酸、丙酸、草酸、三氟乙酸、硬 酯酸、扑酸、羟基马来酸、苯乙酸、苯甲酸、水杨酸、谷氨酸、抗坏血酸、对胺基苯 磺酸、2-乙酰氧基苯甲酸和羟乙磺酸等;或者通式(i)化合物与丙酸、草酸、丙二酸、 琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、天冬氨酸或谷氨酸形成 酯后再与无机碱形成的钠盐、钾盐、钙盐、铝盐或铵盐;或者通式(i)化合物与有机碱 形成的甲胺盐、乙胺盐或乙醇胺盐;或者通式(i)化合物与赖氨酸、精氨酸、鸟氨酸形 成酯后再与盐酸、氢溴酸、氢氟酸、硫酸、硝酸或磷酸形成的对应的无机酸盐或与 甲酸、乙酸、苦味酸、甲磺酸或乙磺酸形成的对应的有机酸盐。
[0073]
药物组合物和应用
[0074]
本发明还提供了以通式(i)所示的醛基类化合物、或其药学上可接受的盐、对映异 构体、非对映异构体或外消旋体及前药中的一种或多种的混合物为有效成分在制备治 疗或预防由sars-cov-2和/或sars-cov和/或mers-cov等冠状病毒,和/或ev71 和/或ev68和/或诺如病毒等rna病毒感染引起的相关疾病的药物中的用途。
[0075]
本发明所提供的药物组合物优选含有重量比为0.001-99wt%的活性成份,优选的 比例是通式i化合物作为活性成分占总重量的0.1wt%~90wt%,其余部分为药学可接 受的载体、稀释液或溶液或盐溶液。
[0076]
需要的时候,在本发明药物中还可以加入一种或多种药学上可接受的载体。所述 载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、吸收 促进剂、表面活性剂、吸附载体、润滑剂等。
[0077]
本发明所提供的化合物和药物组合物可以是多种形式,如片剂、胶囊、粉剂、糖 浆、溶液状、悬浮液和气雾剂等,并可以存在于适宜的固体或液体的载体或稀释液中 和适宜的用于注射或滴注的消毒器具中。
[0078]
本发明的药物组合物的各种剂型可按照药学领域的常规制备方法制备。其制剂配 方的单位计量中通常包含0.05-500mg通式i化合物,优选地,制剂配方的单位计量中 包含1mg-500mg通式i化合物。
[0079]
本发明的化合物和药物组合物可对哺乳动物临床使用,包括人和动物,可以通过 口、鼻、皮肤、肺、胃肠道或者静脉等的给药途径。最优选为静脉。最优选日剂量为 0.01-400 mg/kg体重,一次性服用,或0.01-200 mg/kg体重分次服用。不管用何种服 用方法,个人的最佳剂量应依据具体的治疗而定。通常情况下是从小剂量开始,逐渐 增加剂量一直到找到最适合的剂量。
[0080]
本发明的药物或抑制剂可通过各种不同方式施用,例如可通过注射、喷射、滴鼻、 滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘 膜组织;或是被其他物质混合或包裹导入机体。
[0081]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明 而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常 规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计 算。
mg,9.36mmol),随后逐滴加入甲醇3ml,室温下搅拌约2小时反应完全。待反应完毕 后,加入约20ml饱和氯化铵淬灭反应,加入乙酸乙酯萃取。有机相经饱和食盐水洗 涤、无水硫酸钠干燥后,柱层析分离得到1-7 0.46g,产率68%
[0096]
化合物1的合成:
[0097]
冰盐浴下将化合物1-7(0.44g,1.01mmol)溶于10ml无水二氯甲烷与无水dmso (1:1)中,氮气保护下加入dipea(0.78g),随后滴加三氧化硫吡啶的dmso溶 液(0.97g/5ml),加完后搅拌1h,tlc监测反应完全后,加入乙酸乙酯和水淬灭 反应,萃取分液,有机相经1m盐酸,饱和食盐水,饱和碳酸氢钠,饱和食盐水洗涤、 无水硫酸钠干燥后,柱层析分离,得到化合物1共0.24g,产率55%。esi-ms m/z 432.18[m h]
[0098]
实施例2:化合物2的合成
[0099][0100]
用化合物2-2替换实施例1中的1-2,合成方法参考化合物1的合成,得到化合 物2。esi-ms m/z 432.18[m h]
[0101]
实施例3:化合物3的合成
[0102][0103]
用化合物3-2替换实施例1中的1-2,3-5替换实施例1中1-5,合成方法参考化 合物1的合成,得到化合物3。esi-ms m/z 464.19[m h]
[0104]
实施例4:化合物4的合成
[0105][0106]
用化合物4-1替换实施例2中1-1,合成方法参考化合物2的合成,得到化合物4。esi-ms m/z 497.23[m h]
[0107]
实施例5:化合物5的合成
[0108][0109]
用化合物4-1替换实施例1中的1-1,合成方法参考化合物1的合成,得到化合 物5。esi-ms m/z 497.23[m h]
[0110]
实施例6:化合物6的合成
[0111][0112]
用化合物4-1替换实施例1中的1-1,6-2替换实施例1中1-2,6-5替换实施例1 中1-5,合成方法参考化合物1的合成,得到化合物6。esi-ms m/z 497.23[m h]
[0113]
实施例7:化合物7的合成
[0114][0115]
用化合物3-5替换实施例4中的1-5,合成方法参考化合物4的合成,得到化合 物7。esi-ms m/z 511.25[m h]
[0116]
实施例8:化合物8的合成
[0117][0118]
用化合物3-2替换实施例4中的1-2,合成方法参考化合物4的合成,得到化合 物8。esi-ms m/z 515.22[m h]
[0119]
实施例9:化合物9的合成
[0120][0121]
用化合物9-2替换实施例4中的1-2,合成方法参考化合物4的合成,得到化合 物9。esi-ms m/z 533.21[m h]
[0122]
实施例10:化合物10的合成
[0123][0124]
用化合物10-2替换实施例4中的1-2,合成方法参考化合物4的合成,得到化合 物10。esi-ms m/z 445.20[m h]
[0125]
实施例11:化合物11的合成
[0126][0127]
用化合物11-2替换实施例4中的1-2,合成方法参考化合物4的合成,得到化合 物11。esi-ms m/z 503.28[m h]
[0128]
实施例12:化合物12的合成
[0129][0130]
用化合物12-2替换实施例4中的1-2,合成方法参考化合物4的合成,得到化合 物12。esi-ms m/z 521.27[m h]
[0131]
实施例13:化合物13的合成
[0132][0133]
用化合物12-2替换实施例4中的1-2,3-5替换实施例4中1-5,合成方法参考化 合物4的合成,得到化合物13。esi-ms m/z 535.29[m h]
[0134]
实施例14:化合物14的合成
[0135][0136]
用化合物14-2替换实施例4中的1-2,合成方法参考化合物4的合成,得到化合 物14。esi-ms m/z 539.26[m h]
[0137]
实施例15:化合物15的合成
[0138][0139]
用化合物14-2替换实施例4中的1-2,3-5替换实施例4中1-5,合成方法参考化 合物4的合成,得到化合物15。esi-ms m/z 553.28[m h]
[0140]
实施例16:化合物16的合成
[0141][0142]
用化合物16-1替换实施例11中的1-1,合成方法参考化合物11的合成,得到化 合物16。esi-ms m/z 445.24[m h]
[0143]
实施例17:化合物17的合成
[0144][0145]
用化合物17-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物17。esi-ms m/z 479.26[m h]
[0146]
实施例18:化合物18的合成
[0147][0148]
用化合物18-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物18。esi-ms m/z 422.18[m h]
[0149]
实施例19:化合物19的合成
[0150][0151]
用化合物19-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物19。esi-ms m/z 406.21[m h]
[0152]
实施例20:化合物20的合成
[0153][0154]
用化合物20-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物20。esi-ms m/z 402.23[m h]
[0155]
实施例21:化合物21的合成
[0156][0157]
用化合物21-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物21。esi-ms m/z 479.20[m h]
[0158]
实施例22:化合物22的合成
[0159][0160]
用化合物22-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物22。esi-ms m/z 546.26[m h]
[0161]
实施例23:化合物23的合成
[0162][0163]
用化合物23-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物23。esi-ms m/z 577.26[m h]
[0164]
实施例24:化合物24的合成
[0165][0166]
用化合物24-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物24。esi-ms m/z 525.24[m h]
[0167]
实施例25:化合物25的合成
[0168]
[0169]
用化合物25-1替换实施例16中的16-1,合成方法参考化合物16的合成,得到 化合物25。esi-ms m/z 512.24[m h]
[0170]
实施例26:化合物26的合成
[0171][0172]
用化合物26-1替换实施例16中的16-1,3-2替换实施例16中的11-2合成方法 参考化合物16的合成,得到化合物26。esi-ms m/z 524.19[m h]
[0173]
实施例27:化合物27的合成
[0174][0175]
用化合物27-1替换实施例2中的1-1,合成方法参考化合物2的合成,得到化合 物27。esi-ms m/z 399.16[m h]
[0176]
实施例28:化合物28的合成
[0177][0178]
用化合物27-1替换实施例2中的1-1,3-5替换实施例2中1-5,合成方法参考化 合物2的合成,得到化合物28。esi-ms m/z 413.17[m h]
[0179]
实施例29:化合物29的合成
[0180][0181]
用化合物29-1替换实施例28中的1-1,11-2替换实施例28中的2-2,合成方法 参考化合物28的合成,得到化合物29。esi-ms m/z 467.20[m h]
[0182]
实施例30:化合物30的合成
[0183][0184]
用化合物30-1替换实施例29中的29-1,合成方法参考化合物29的合成,得到 化合物30。esi-ms m/z 451.23[m h]
[0185]
实施例31:化合物31的合成
[0186][0187]
用化合物30-1替换实施例2中的1-1,12-2替换实施例2中的2-2,合成方法参 考化合物2的合成,得到化合物31。esi-ms m/z 455.20[m h]
[0188]
实施例32:化合物32的合成
[0189][0190]
用化合物29-1替换实施例2中的1-1,14-2替换实施例2中的2-2,合成方法参 考化合物2的合成,得到化合物32。esi-ms m/z 489.16[m h]
[0191]
实施例33:化合物33的合成
[0192][0193]
用化合物30-1替换实施例2中的1-1,33-2替换实施例2中的2-2,合成方法参 考化合物2的合成,得到化合物33。esi-ms m/z 395.17[m h]
[0194]
实施例34:化合物34的合成
[0195][0196]
用化合物34-1替换实施例11中的4-1,合成方法参考化合物11的合成,得到化 合物34。esi-ms m/z 389.21[m h]
[0197]
实施例35:化合物35的合成
[0198][0199]
用化合物35-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物35。esi-ms m/z 361.22[m h]
[0200]
实施例36:化合物36的合成
[0201][0202]
用化合物36-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物36。esi-ms m/z 361.22[m h]
[0203]
实施例37:化合物37的合成
[0204][0205]
用化合物37-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物37。esi-ms m/z 411.23[m h]
[0206]
实施例38:化合物38的合成
[0207]
[0208]
用化合物38-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物38。esi-ms m/z 412.23[m h]
[0209]
实施例39:化合物39的合成
[0210][0211]
用化合物11-2替换实施例2中的2-2,合成方法参考化合物2的合成,得到化合 物39。esi-ms m/z 438.23[m h]
[0212]
实施例40:化合物40的合成
[0213][0214]
用化合物40-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物40。esi-ms m/z 413.22[m h]
[0215]
实施例41:化合物41的合成
[0216][0217]
用化合物41-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物41。esi-ms m/z 362.21[m h]
[0218]
实施例42:化合物42的合成
[0219][0220]
用化合物42-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物42。esi-ms m/z 444.19[m h]
[0221]
实施例43:化合物43的合成
[0222][0223]
用化合物43-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合
物43。esi-ms m/z 444.19[m h]
[0224]
实施例44:化合物44的合成
[0225][0226]
用化合物44-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物44。esi-ms m/z 427.23[m h]
[0227]
实施例45:化合物45的合成
[0228][0229]
用化合物45-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物45。esi-ms m/z 392.25[m h]
[0230]
实施例46:化合物46的合成
[0231][0232]
用化合物46-1替换实施例34中的34-1,合成方法参考化合物34的合成,得到 化合物46。esi-ms m/z 378.23[m h]
[0233]
活性测试例1:sars-cov-2 3cl蛋白酶抑制活性评价
[0234]
测定化合物对sars-cov-2 3cl蛋白酶的抑制活性:利用荧光共振能量转移 (fluorescence resonance energy transfer fret)技术测定针对3cl蛋白酶的抑制剂的酶 水平抑制活性。整个酶促反应体系的体积为120μl,蛋白酶的终浓度为30nm,底物 终浓度为20μm。反应体系的缓冲液包括50mm tris ph7.3、1mm edta。在96孔板 中加入3cl蛋白酶和不同浓度的化合物,30℃孵育10min,加入底物并迅速放入酶标 仪中读数。激发光和发射光分别为320nm和405nm。测试时间为10min,每隔30s 读一次荧光值。最终结果取前2min的读值拟合出反应速率,并与对照组(dmso) 比较,计算抑制率,实验结果如表1所示。
[0235]
表1:sars-cov-2 3cl蛋白酶抑制活性
[0236][0237][0238]
实验结果显示:多数化合物在1μm的条件下对sars-cov-2 3cl蛋白酶具有较 好的抑制活性,其中化合物14在1μmol下对2019-ncov 3cl蛋白酶的抑制率可以达 到98.6%。
[0239]
实施例2:化合物对sars-cov、mers-cov 3cl蛋白酶的抑制活性评价
[0240]
测定化合物对sars-cov、mers-cov各冠状病毒3cl蛋白酶抑制活性:利用荧 光共振能量转移(fluorescence resonance energy transfer fret)技术测定针对3cl蛋 白酶的抑制剂的酶水平抑制活性。整个酶促反应体系的体积为120μl,蛋白酶的终浓 度为30nm,底物终浓度为20μm。反应体系的缓冲液包括50mm tris ph7.3、1mmedta。在96孔板中加入各3cl蛋白酶和不同浓度的化合物,30℃孵育10min,加 入底物并迅速放入酶标仪中读数。激发光和发射光分别为320nm和405nm。测试时 间为10min,每隔30s读一次荧光值。最终结果取前2min的读值拟合出反应速率, 并与对照组(dmso)比较,计算抑制率,实验结果如表2所示。
[0241]
表2:sars-cov和mers-cov 3cl蛋白酶抑制活性
[0242][0243]
实验结果显示:多数化合物在1μm的条件下对sars-cov、mers-cov 3cl蛋 白酶具有较好的抑制活性。
[0244]
实施例3:化合物对ev71 3c蛋白酶和诺如病毒3cl蛋白酶抑制活性评价
[0245]
测定化合物对ev71 3c蛋白酶和诺如病毒3cl蛋白酶抑制活性:利用荧光共振 能量转移(fluorescence resonance energy transfer fret)技术测定针对蛋白酶的抑制 剂的酶水平抑制活性。整个酶促反应体系的体积为120μl,蛋白酶的终浓度为30nm, 底物终浓度为20μm。反应体系的缓冲液包括50mm tris ph 7.3、1mm edta。在96 孔板中加入各蛋白酶和不同浓度的化合物,30℃孵育10min,加入底物并迅速放入酶 标仪中读数。激发光和发射光分别为320nm和405nm。测试时间为10min,每隔30 s读一次荧光值。最终结果取前2min的读值拟合出反应速率,并与对照组(dmso) 比较,计算抑制率,实验结果如表2所示。
[0246]
表3:ev71 3c蛋白酶和诺如病毒3cl蛋白酶抑制活性
[0247][0248]
实验结果显示:本发明的多数化合物在1μm的条件下对ev71 3c蛋白酶和诺如 病毒3cl蛋白酶也具有较好的抑制活性。
[0249]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独 引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术 人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书 所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。