敲除谷氨酸棒杆菌中转录调控因子ncgl0580生产5-氨基乙酰丙酸的方法
技术领域
1.本发明属于生物工程技术与应用领域,具体地涉及一种敲除谷氨酸棒杆菌中转录调控因子ncgl0580合成5-氨基乙酰丙酸的方法。
背景技术:
2.5-氨基乙酰丙酸(5-aminolevulinic acid,5-ala),是生物体内合成维生素b
12
、血红素、叶绿素等四吡咯类化合物的重要前体,广泛存在于微生物和动植物细胞中。由于其绿色无毒、易降解且无残留的特性,作为光动力学药物、生物可降解除草剂、植物生长调节剂以及饲料添加剂等在医药以及农业等领域得到广泛应用。目前5-ala的大规模生产主要以化学法为主,但是合成过程中存在的高成本、高污染和低得率等问题大大限制了其大规模生产与应用。鉴于此,微生物合成法应运而生,并随着合成生物学,特别是代谢工程手段的兴起,5-ala的生物法合成得到了进一步发展。但是,大多数生物合成方法产量低,并不能达到工业化生产的要求,难以实现大规模应用。
3.微生物在合成目标产物过程中通过调节一系列基因的表达来实现自身细胞生长以及目标代谢物的合成。而通常在基因的表达过程中需要由特定的转录调控因子调控,转录调控因子通过与特定基因的dna序列结合来调节基因的表达。5-ala合成中涉及到诸多的转录调控因子,但是目前对5-ala合成起到调控作用的转录调控因子尚未经过报道。
技术实现要素:
4.本发明的目的是克服现有技术的不足,提供敲除谷氨酸棒杆菌中转录调控因子ncgl0580生产5-氨基乙酰丙酸的方法。
5.本发明的技术方案概述如下:
6.敲除谷氨酸棒杆菌中转录调控因子ncgl0580生产5-氨基乙酰丙酸的方法,转录调控因子ncgl0580的核苷酸序列如seq id no.1所示。
7.本发明的优点:
8.谷氨酸棒杆菌中转录调控因子ncgl0580的敲除使得谷氨酸棒杆菌工程菌株cb6中5-氨基乙酰丙酸产量提升2.49倍,同时5-ala合成途径、糖酵解途径中hema、suca、sucb、ncgl0282等基因转录水平分别提高29.96、38.41、41.12和31.16倍。
附图说明
9.图1为pd-sacb敲除载体的图谱。
10.图2为pd-ncgl0580敲除载体的图谱。
11.图3为pxk表达载体的图谱。
12.图4为pxp表达载体的图谱。
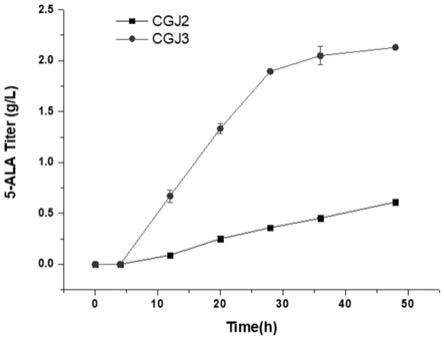
13.图5为菌株cgj2和cgj3在摇瓶条件下发酵示意图。
id no.9)/pd-ncgl05804(seq id no.12)为引物,扩增得到两个片段的融合产物,约2.0kb。
32.将融合后的片段用smai/bamhi双酶切与经过同样双酶切后的pd-sacb连接,经过化转,对得到的单菌落以pd-ncgl05801(seq id no.9)/pd-ncgl05804(seq id no.12)为引物进行pcr验证。条带大小一致的菌落转移至lb液体培养基培养后提取质粒,测序正确的即为得到ncgl0580基因的敲除质粒pd-ncgl0580。其质粒图谱如图2所示。
33.(3)基因ncgl0580的敲除
34.将测序结果正确的质粒pd-ncgl0580通过电转导入谷氨酸棒杆菌cb6(谷氨酸棒杆菌cb6的来源详见中国专利cn 106636171 a,发明名称为:生产5-氨基乙酰丙酸的谷氨酸棒杆菌工程菌株及构建)中,均匀涂布在含有卡那霉素和蔗糖的bhis固体平板上,并置于30℃培养箱培养24h。通过卡那霉素以及蔗糖筛选得到重组成功的阳性克隆菌株,挑取单菌落接种于5ml bhis液体培养基中,30℃,220rpm过夜培养,将菌液稀释100倍,涂布在bhis-sucrose固体平板上(添加蔗糖为10%(w/v))。将平板上长出的菌落分别对点无抗的bhis固体平板以及卡那霉素(终浓度15μg/ml)的bhis固体平板。选取在无抗平板上生长而卡那霉素平板不生长的菌落接种到5ml的bhis液体培养基中,确保在卡那霉素试管中不生长后提取其基因组,并以引物pd-ncgl05801(seq id no.9)/pd-ncgl05804(seq id no.12)进行pcr扩增,片段大小一致的则为最终得到的敲除ncgl0580基因的谷氨酸棒杆菌工程菌株cgj1,转录调控因子ncgl0580的核苷酸序列如seq id no.1所示。
35.表1菌株构建所用引物序列
[0036][0037]
实施例2:pxmj19过表达载体构建
[0038]
(1)pxk基本载体的构建
[0039]
谷氨酸棒杆菌本身不含有c4途径中的关键酶5-氨基乙酰丙酸合成酶,需要引入外
源基因合成5-ala。本发明构建了敲除tac以及laciq的质粒基本载体pxk。
[0040]
以质粒pxmj19为模板,以表1所示pk-1(seq id no.13)/pk-2(seq id no.14)为引物扩增质粒pxk的骨架片段,扩增得到约5.3kb的pcr产物。将该片段用hindiii经单酶切后,经过酶连、转化等步骤得到质粒pxk。其质粒图谱如图3所示。
[0041]
(2)pxp过表达载体的构建
[0042]
本发明中选用的是已报道的沼泽红假单细胞菌(rhodopseudomonas palustris)来源的5-氨基乙酰丙酸合酶突变体r365k/c75a
[1]
(其氨基酸序列如seq id no.21所示),并根据谷氨酸棒杆菌的密码子偏好性进行密码子优化,将优化后的基因用全基因合成的方法进行合成(核苷酸序列如seq id no.2所示)。以sodx为启动子,以质粒pxk为基本载体构建过表达hema的质粒pxp。分别以表1所示引物hema-1(seq id no.15)/hema-2(seq id no.16),sodx-1(seq id no.17)/sodx-2(seq id no.18)为上下游引物扩增得到优化后的hema片段以及启动子sodx片段,再以sodx-1(seq id no.17)/hema-2(seq id no.16)为上下游引物扩增得到两片段的融合产物,约1.4kb。将融合得到的产物用xbai/hindiii双酶切后,与经过相同双酶切后的穿梭质粒pxk连接,得到pxp质粒,质粒pxp的图谱见图4。
[0043]
实施例3:5-ala生产菌株构建及其摇瓶发酵
[0044]
(1)5-ala生产菌株构建
[0045]
将测序结果正确的质粒pxp通过电转导入谷氨酸棒杆菌cb6以及敲除ncgl0580基因的谷氨酸棒杆菌工程菌株cgj1中,均匀涂在氯霉素抗性(终浓度10μg/ml)的bhis固体平板上。分别挑取单菌落以如下引物test-pxp-1(seq id no.19)/test-pxp-2(seq id no.20)进行pcr验证。测序无误的即为插入质粒pxp的5-ala生产菌株cgj2、cgj3,其中cgj2为对照菌株,cgj3为敲除谷氨酸棒杆菌中转录调控因子ncgl0580的5-ala生产菌株。
[0046]
(2)生产菌株的摇瓶发酵
[0047]
对菌株cgj2、cgj3进行摇瓶发酵。
[0048]
接种方式:首先将cgj2、cgj3在bhis固体培养基上进行划线,置于30℃培养箱中培养约18h。挑取平板上的单菌落接种至5ml的bhis液体培养基中,30℃,220rpm培养约12h,取1ml转接至cgiii液体培养基继续培养12h。以初始od
600
约为0.5、葡萄糖10g/l进行转接,置于30℃,220rmp的恒温摇床中振荡培养4h至od
600
约为5.0左右时,添加7.5g/l的前体物质甘氨酸。在培养期间测定其5-ala产量(见图5)。培养48h后,菌株cgj3的5-ala产量比cgj2提升约2.49倍。
[0049]
实施例4:转录水平分析
[0050]
(1)总rna提取及cdna的合成
[0051]
以菌株cgj2为对照菌株,将cgj3按照上述示例中所述方法进行发酵培养。培养至12h左右,细胞达到对数生长期提取总rna,具体步骤如下:
[0052]
1.取约300μl菌液至ep管中,使细胞数量不多于1
×
109个,4℃,12000rpm离心1min收集菌体,倒掉上清;
[0053]
2.用10mg/ml溶菌酶溶液重悬菌体,37℃放置10min;
[0054]
3.取300μl的裂解液a到离心管中,用枪充分吹打,确保菌体全部裂解;
[0055]
4.向离心管中加入400μl氯仿,在振荡器上充分振荡混匀约30秒后,12000rpm室温离心3min;
[0056]
5.将上清液转移到实现准备的离心吸附柱中,取上清液时应注意避开中间层的dna和蛋白质,以及下层的有机相,避免所提取rna的污染;
[0057]
6.加入等体积(约400μl)的溶液b,充分混匀后上柱,12000rpm室温离心0.5min,弃上清;
[0058]
7.加入700μl通用洗柱液到离心吸附柱中,室温离心0.5min,弃上清;
[0059]
8.为保证充分去掉杂质,使样品od
260/280
比值在1.80-2.00之间,重复步骤7;
[0060]
9.室温12000rpm离心0.5min,倒掉废液,将吸附柱转移到提前备好的rnase-free收集管中,加入30μl的rna洗脱液,室温放置2min;
[0061]
10.12000rpm离心0.5min,离心管中溶液即为所提取的rna样品,可置于-80℃超低温冷冻冰箱中保存。
[0062]
11.用微量分光光度计测定rna浓度后按下表配置反转录体系,逆转录得到cdna并测定其浓度用于rt-pcr反应。
[0063]
表2反转录反应体系
[0064][0065]
(2)rt-pcr反应及数据分析
[0066]
rt-pcr反应过程中以谷氨酸棒杆菌中的16s核糖体rna的转录水平作为内参。按照下表配置反应体系。
[0067]
表3 rt-pcr反应体系
[0068][0069]
本研究中,rt-pcr的结果以ct值比较法进行分析。ct值比较法也称2-[
△
][
△
]ct
方法,该方法是将目标样品与对照样品的ct值进行比较,其中目标样品与对照样品的ct值都相对于一个特定的内源标定基因(本实验采用谷氨酸棒杆菌的16srna)进行均一化运算。具体计
算如下列公式:
[0070]
fold enrichment=2
‑△△
ct
[0071]
其中,
△△
ct=[
△
]ct(样品组)-[
△
]ct(对照组)。需要说明的是,[
△
]ct(样品组)表示样品组目的基因减去内源标定基因的ct值的差值,[
△
]ct(对照组)则表示对照组目的基因减去内源标定基因的ct值的差值。
[0072]
5-ala合成、下游血红素合成及中心碳代谢途径中各基因的转录水平变化如图6所示,与菌株cgj2相比,菌株cgj3中5-ala合成途径、下游血红素途径、糖酵解途径、葡萄糖转运途径等多条途径中的多个基因的转录水平发生明显变化。其中hema、suca、sucb、ncgl0282等基因转录水平分别提高29.96、38.41、41.12和31.16倍。琥珀酰-coa作为5-ala前体物之一,是由基因sucab编码的α-酮戊二酸脱氢酶催化得到。菌株cgj3中两基因的转录水平出现的明显变化,进一步解释了两基因转录水平的提高增加了前体物质供给,从而直接引起了5-ala合成关键基因hema转录水平的提升,促进了5-ala的合成。
[0073]
本发明中的菌株代号如cgj1~cgj3等是为了方便描述,但不应理解为对本发明的限定。
[0074]
本发明的菌株的构建,其步骤的前后顺序不限定,本领域的技术人员按本发明公开的内容达到本发明的目的均属于本发明的保护范围。
[0075]
[1]郑平,赵晶,谭子瑊,et al.5-氨基乙酰丙酸合成酶突变体及其宿主细胞和应用.6jul 2018,pat:cn 108251396 a.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。