rhdv2荧光定量rt-pcr检测方法
技术领域
1.本发明属于分子生物学技术领域,具体涉及一种荧光定量 rt-pcr检测兔病毒性出血症2型(rhdv2)的引物、试剂盒及其检测方法。
背景技术:
2.家兔养殖在我国已有悠久的历史,因兔肉口感好,营养价值高,一直受到广大人民群众的喜爱。自20世纪90年代以来,我国的兔肉产量一直以年均8.5%左右的速度增长,2016年我国的兔出栏量约 5.62亿只,占全球的55.4%,是世界上主要的家兔养殖国。四川兔产业处于全国前列,根据中国畜牧业协会兔业分会统计,2016年四川共销售近3亿只兔子,占全国市场近7成,兔产业成为四川农民致富的重要途径。
3.兔病毒性出血症2型,也称兔瘟2型,是由兔病毒性出血症2型病毒(rhdv2)引起的一种急性、高度接触性、高致病性的家兔传染病,死亡率高达90%,特别是幼龄兔,死亡率可达100%。从2010 年,该病首次在法国出现后,逐渐蔓延至意大利、西班牙、葡萄牙等国,给养兔业造成了非常重大的影响。2020年4月,四川某家兔养殖场首次发生了兔瘟2型疫情,虽然经过一系列严格的处置措施,没有造成更大的经济损失,但是目前,我国的兔瘟疫苗仅能预防经典兔瘟,对兔瘟2型缺乏针对性的保护力,也没有市售的兔瘟2型疫苗,因此兔瘟2型对我国养兔业仍然有非常大的威胁。
4.目前针对于该病的检测方法仍然没有统一的国家标准、地方标准和行业标准,现仅有中国畜牧兽业协会发布的一个团体标准。但该标准规定的诊断技术方法虽然很多,但是操作复杂,无法满足于临床对该病的快速诊断要求。
5.因此,急需开发一种能够针对于兔病毒性出血症2型进行快速检测的方法,以解决临床上难以通过肉眼判断经典兔病毒性出血症与兔病毒性出血症2型的难题。
技术实现要素:
6.本发明的目的就是为了解决上述技术问题,从而提供一种荧光定量rt-pcr检测兔病毒性出血症2型(rhdv2)的引物、试剂盒及其检测方法。本发明提供的检测方法能够针对于兔病毒性出血症2型进行快速检测,所得结果准确,灵敏度高,可用于临床快速判断经典兔病毒性出血症与兔病毒性出血症2型。
7.本发明的目的之一是提供一种荧光定量rt-pcr检测兔病毒性出血症2型的引物探针组,所述引物探针组是由引物f、引物r和探针t组成:
8.所述引物f的序列为:5
’‑
gagtgttgatggrtacttc-3’,
9.所述引物r的序列为:5
’‑
cccaagttgtacacaagc-3’,
10.所述探针t的序列为:5
’‑
agccaccctcatygacctgt-3’,所述探针t的5’端标记有荧光报告基团fam,3’端标记有荧光淬灭基团bhq1。
11.本发明的目的之二是提供一种包含上述引物探针组的时荧光定量rt-pcr检测兔病毒性出血症2型的试剂盒。
12.本发明的目的之三是提供上述引物探针组在制备用于荧光定量 rt-pcr检测兔病毒性出血症2型的试剂盒中的应用。
13.本发明的目的之四是提供一种用于兔病毒性出血症2型的荧光定量rt-pcr检测方法,包括如下步骤:
14.(1)按照病毒核酸提取试剂盒与反转录酶说明书提取rhdv2 病毒基因组rna,以提取的基因组rna为模板,反转录合成cdna,利用引物f和引物r进行pcr扩增vp60基因,克隆至t载体,构建阳性重组t载体,测序鉴定。具体步骤为:将pcr扩增产物按照试剂盒进行凝胶纯化回收,取4μl胶回收产物按照t载体连接试剂盒说明书配制反应体系,16℃连接过夜;取100μl在冰上融化的dh5a 感受态细胞,加入连接产物,轻轻混匀,冰上静置25min;42℃水浴热激45~60s,迅速转移至冰浴中,静置2min;向离心管中加入700μl lb培养液,混匀后37℃,200rpm震荡培养1h;3000rpm离心5min,弃去上清700μl,将剩下的菌液轻轻混匀,吸出涂布到lb琼脂培养板(50μg/mlamp )上,37℃培养箱过夜培养;挑取白色单菌落到 5ml lb液体培养基(50μg/mlamp )中,37℃培养箱过夜培养。取 2μl培养物为模板,进行pcr鉴定;将pcr鉴定阳性的菌落培养物,送生物技术测序公司测序鉴定。
15.(2)将步骤(1)构建的阳性重组载体10倍梯度稀释,以引物 f和引物r进行实时荧光定量pcr扩增,以模板浓度的log值为纵坐标,以扩增得到的ct值作为横坐标,制作标准曲线;
16.(3)提取各类样本的基因组rna,并反转录合成cdna,利用引物f、引物r和探针t进行实时荧光定量pcr扩增,得ct值,然后根据步骤(2)所得标准曲线计算出目标片段的拷贝数。
17.具体的,所述反转录合成cdna的步骤为:
18.反应体系为10μl,在pcr反应管中依次加入下列反应物: 5
×
amv反应缓冲液2μl;反转录引物50μmol/l oligo dt 0.5μl; amv反转录酶0.5μl;随机6核苷酸引物100μmol/l 0.5μl;无核酸酶水4.0μl;rna模板2.5μl;混匀后瞬时离心,随后进入反转录循环37℃15min,65℃5s。
19.具体的,所述pcr扩增采用的荧光rt-pcr反应体系为:
20.18μl荧光rt-pcr反应混合液,组成如下:
[0021][0022]
具体的,所述pcr扩增的步骤为:将18μl荧光rt-pcr反应混合液加入pcr扩增管,将2μl cdna加入pcr扩增管,加入模板后,密封pcr管,瞬时离心,将pcr扩增管放在pcr仪中,扩增程序如下:
[0023]
95℃预变性3min;
[0024]
95℃变性10s;
[0025]
59℃退火10s,
[0026]
72℃延伸25s,45个循环。
[0027]
在采用上述检测方法对兔出血症病毒2型进行鉴定时,方法如下:被检样品ct值≤36且出现特异性扩增曲线,则判定兔出血症病毒2型核酸阳性;当无ct值或ct≥40,则判定兔出血症病毒2型核酸阴性;当36<ct值<40且出现特异性扩增曲线,则判定疑似;对疑似样品进行重复检测,结果仍为疑似,则判定为兔出血症病毒2型核酸阳性。
[0028]
本发明的有益效果如下:
[0029]
本发明提供了一种能够通用且可快速鉴别rhdv与rhdv2的荧光定量rt-pcr检测方法,该方法具有引物特异性强、敏感性高、操作简便、重复性好、易于判定等特点,能够用于快速开展兔病毒性出血症的临床诊断,为该病的流行病学调查与防控提供了有效的技术支持。
附图说明
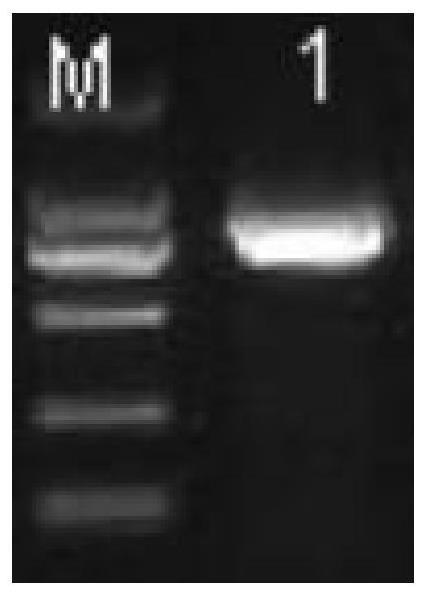
[0030]
图1为荧光定量rt-pcr引物验证图;
[0031]
图2为反应温度优化结果图,退火梯度设置为60℃、59.6℃、58.8℃、 57.5℃、55.8℃、54.4℃、53.5℃、53℃;
[0032]
图3为引物浓度优化结果图,引物量分别为0.25、0.5、0.75和1.0μl;
[0033]
图4为探针浓度优化结果图,探针量分别为0.25、0.5、0.75和1.0μl;
[0034]
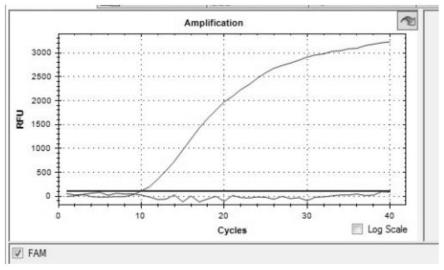
图5为标准曲线图;
[0035]
图6为敏感性试验结果图;
[0036]
图7为特异性试验结果图。
具体实施方式
[0037]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行具体描述,有必要指出的是,以下实施例仅仅用于对本发明进行解释和说明,并不用于限定本发明。本领域技术人员根据上述发明内容所做出的一些非本质的改进和调整,仍属于本发明的保护范围。
[0038]
实施例1
[0039]
1试剂
[0040]
rna提取试剂、无核酸酶水(配置方法见a.1)、荧光pcr预混液(2
×
)。
[0041]
2仪器设备
[0042]
荧光pcr扩增仪、台式低温高速离心机(最大离心力12000g 以上)、微量可调移液器(2.5μl~1000μl等不同规格)、无核酸酶离心管与吸头、pcr扩增管、自动化核酸提取仪。
[0043]
3引物和探针
[0044]
3.1引物和探针设计
[0045]
针对rhdv2 vp60基因保守序列设计引物和探针序列:
[0046]
上游引物f:5
’‑
gagtgttgatggrtacttc-3’,
[0047]
下游引物r:5
’‑
cccaagttgtacacaagc-3’;
[0048]
taqman探针:fam-5
’‑
agccaccctcatygacctgt-3’bhq1。
[0049]
对所设计的引物进行验证,结果如图1,可以看出,该引物对 rhdv2具有特异性。
[0050]
3.2反应温度优化
[0051]
退火温度由高到低设置为:60℃、59.6℃、58.8℃、57.5℃、55.8℃、 54.4℃、53.5℃、53℃,退火反应优化结果如图2所示,最终确定59℃为最佳退火温度。
[0052]
3.3引物浓度优化
[0053]
按上游引物f和下游引物r的浓度均为5μmol/l,分别加0.25、 0.5、0.75和1.0μl,结果见图3,因最终结果cq值差异不大,确定体系中引物量为上游引物f和下游引物r各加1.0μl。
[0054]
3.4探针浓度优化
[0055]
按探针浓度为5μmol/l,分别加入0.5、1.0、1.5、2μl,结果见图4,因结果cq值没明显区别,最终确定反应体系中探针加入量为 1μl。
[0056]
3.5标准曲线的绘制
[0057]
将按照步骤(1)构建的阳性重组t载体,10倍体度稀释,按照确立的反应温度和反应体系构建标准曲线,结果如图5,因rcv病毒属几种病毒核酸同源性相对较高,为增加反应的特异性,确定退火温度时选择为59℃。
[0058]
3.6敏感性试验
[0059]
将构建阳性重组t载体,10倍体度稀释,按照确立的反应温度和反应体系进行试验检测,结果如图6,确定可检测的最低模板拷贝数为43copies。
[0060]
3.7特异性试验
[0061]
通过优化实验条件后,对不同样品进行检测,步骤如下:
[0062]
3.7.1rna提取
[0063]
采用核酸提取试剂提取或用自动化核酸提取仪提取各类样本中的病毒rna。抽取的rna立即进行后续试验或置于-60℃以下保存。
[0064]
3.7.2反转录反应
[0065]
反应体系为10μl,在pcr反应管中依次加入下列反应物:
[0066]5×
amv反应缓冲液2μl;反转录引物50μmol/l oligo dt 0.5 μl;amv反转录酶0.5μl;随机6核苷酸引物100μmol/l 0.5μl;无核酸酶水4.0μl;rna模板2.5μl;
[0067]
混匀后瞬时离心,随后进入反转录循环37℃15min,65℃5s,产物直接用pcr扩增或暂存于-20℃备用。
[0068]
3.7.3扩增体系(20μl)
[0069]
每个样品配置18μl荧光rt-pcr反应混合液,组成如下:
[0070][0071]
将18μl荧光pcr反应混合液加入pcr扩增管;将2μl cdna(反转录产物)加入每个pcr扩增管中。每次进行荧光rt-pcr扩增时均需设立阳性对照(阳性重组质粒为模板)、阴性对照(无核酸酶水为模板)。加入模板后,密封pcr管,瞬时离心。将所有pcr扩增管放在pcr仪中,按照7.4.3条件运行扩增程序。
[0072]
3.7.4扩增条件
[0073]
95℃预变性3min;95℃变性10s,59℃退火10s,72℃延伸 25s,45个循环,在每一循环的72℃延伸时搜集fam荧光信号。
[0074]
特别人工合成了欧洲棕色野兔出血综合症(ebhsv)、rcv的对应基因片段,进行特异性检测。
[0075]
3.7.5结果判定
[0076]
阳性对照的ct值≤30且出现特异性扩增曲线,阴性对照无ct 值或阴性对照ct值≥40且无特异性扩增曲线,试验结果有效;否则应重新进行试验。被检样品ct值≤36且出现特异性扩增曲线,则判定兔出血症病毒2型核酸阳性;当无ct值或ct≥40,则判定兔出血症病毒2型核酸阴性;当36<ct值<40且出现特异性扩增曲线,则判定疑似。对疑似样品应重复检测,结果仍为疑似,则判定兔出血症病毒2型核酸阳性。
[0077]
除阳性对照外,ebhsv、rhdv1、rcv、大肠杆菌、巴氏杆菌 a型、巴氏杆菌f型等检测结果均为阴性,见图7。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。