1.本发明涉及雷特综合征的治疗。
背景技术:
2.雷特综合征(rtt)是一种几乎仅影响女孩的神经发育障碍(10000名女性中约有1例)。其特征在于正常的早期生长和发育,随后发育减慢、丧失对手的有目的的运用、手部运动独特、脑和头部生长减慢、行走问题、癫痫和智力障碍(hagberg等,1985)。
3.雷特综合征的病程,包括发病年龄和症状的严重程度,在患儿与患儿间各不相同。然而,在症状开始之前,通常患儿看起来生长和发育正常,尽管即使在婴儿早期也经常有细微的异常,诸如肌肉张力丧失(张力减退)、进食困难和肢体运动急躁。然后,逐渐出现精神和身体的症状。随着综合征的发展,患儿丧失对其手的有目的的运用以及说话的能力。其他早期症状可能包括爬行或行走问题和眼神接触减少。对手部的功能性运用的丧失后是难以控制的手部运动,诸如绞拧和洗涤(wringing and washing)。有时该消退期的开始很突然(armstrong 1997)。
4.雷特综合征患儿早期常表现出自闭症样行为。其他症状可能包括脚趾行走、睡眠问题、宽基步态、磨牙和咀嚼困难、生长减慢、癫痫、认知障碍和清醒时呼吸困难诸如换气过度、呼吸暂停(屏气)和吞咽空气。雷特综合征是由x-连锁基因甲基-cpg-结合蛋白2(mecp2)中的突变引起的,mecp2是一种广泛表达的转录调节子(amiretal.1999;duncan armstrong 2005)。
5.小鼠模型概括了rtt的许多症状,且它们的研究洞察了疾病的生理学基础。尽管雌性mecp2/ 小鼠部分由于随机x-染色体失活而表现出表型差异,但雄性mecp2/y小鼠具有完全渗透表型。无雄性在出生和断奶时正常而发展成四肢抱握、震颤、昏睡和呼吸异常,症状逐渐加重直至在6-16周龄时死亡(guy等,2001)。
6.在rtt疾病的动物模型中,几项研究已证明mecp2的丧失破坏胆固醇体内平衡。实际上,甲羟戊酸通路中的基因在1个月大的mecp2/y小鼠的脑中,而非肝中轻微上调(轻度影响)。在2月龄时,症状性突变小鼠的脑中总胆固醇浓度增加(nagy和ackerman 2013)。还有报道,在mecp2缺陷的雄性中,cyp46a1表达比野生型的水平增加38%,表明对神经元中胆固醇周转的需求增加(buchovecky等,2013;l
ü
tjohann等2018a)。
7.还尝试了通过施用抑制胆固醇合成中第一限速酶3-羟基-3-甲基戊二酰辅酶a(hmg-coa)还原酶(hmgcr)的他汀类药物的治疗方法。他汀治疗增强了突变雄性小鼠的中值存活时间并改善了运动协调和活动,但没有改善呼吸不规则和听觉惊吓反应异常。为更接近地模拟用rtt对雌性患者的治疗,还用他汀类药物处理了mecp2/ 雌性小鼠,其改善了症状(buchovecky等,2013)。
8.迄今为止,还没有已知的雷特综合征的治疗方法。目前使用的唯一分子仅用于降低与雷特综合征相关的副作用。呼吸不规则和运动困难可能需要药物治疗,并且抗惊厥药物可用于控制癫痫发作。应定期监测脊柱侧凸和可能的心脏异常。然而,实际上正在小鼠疾
病模型中评估几种方法。它们的主要目的是使用基因治疗递送来恢复mecp2表达(garg等,2013)(k.k.gadalla等,2013;k.k.e.gadalla等,2017),从而使得增加存活,而无需显著改善表型协调性能。此外,当以高剂量递送时,肝毒性显现出来。mecp2是一种转录因子,其表达受到强烈调节以维持突触调节和神经元稳态。因此,增加mecp2水平(增加内源性水平的2倍)导致具有mecp2功能丧失的相反表型的rett样病症(na等,2013)。因此,急需开发用于治疗rett患者的新策略。
9.发明概述
10.发明人现提出通过调节胆固醇代谢途径羟化酶,更具体地,通过使用包含编码胆固醇24-羟化酶的核酸的载体来抵抗雷特综合征,所述核酸在靶细胞中表达胆固醇24-羟化酶。
11.因此,本发明的一个目的是提供用于治疗雷特综合征的载体,所述载体包含编码胆固醇24-羟化酶的核酸。
12.在一个实施方案中,所述载体包含编码氨基酸序列seq id no:2的核酸序列。或者,所述载体包含核酸序列seq id no:1。
13.在一个实施方案中,所述载体选自腺病毒、慢病毒、逆转录病毒、疱疹病毒和腺相关病毒(aav)载体,优选aav载体,更优选aav9、aav10(aavrh.10)或aavphp.eb载体,甚至更优选aavphp.eb。
14.在一个实施方案中,将所述载体直接施用于患者的脑,优选施用于脑的所有目标区域(海马体、皮层、纹状体、脑桥和小脑)。在一个实施方案中,通过血管内、静脉内、鼻内、心室内、鞘内或眼眶后注射施用所述载体。在特定的实施方案中,静脉内施用所述载体。在特定的实施方案中,所述载体施用于脑脊液中。
15.本发明的另一个目的是提供用于治疗雷特综合征的药物组合物,其包含含有编码胆固醇24-羟化酶的核酸的载体。
附图说明
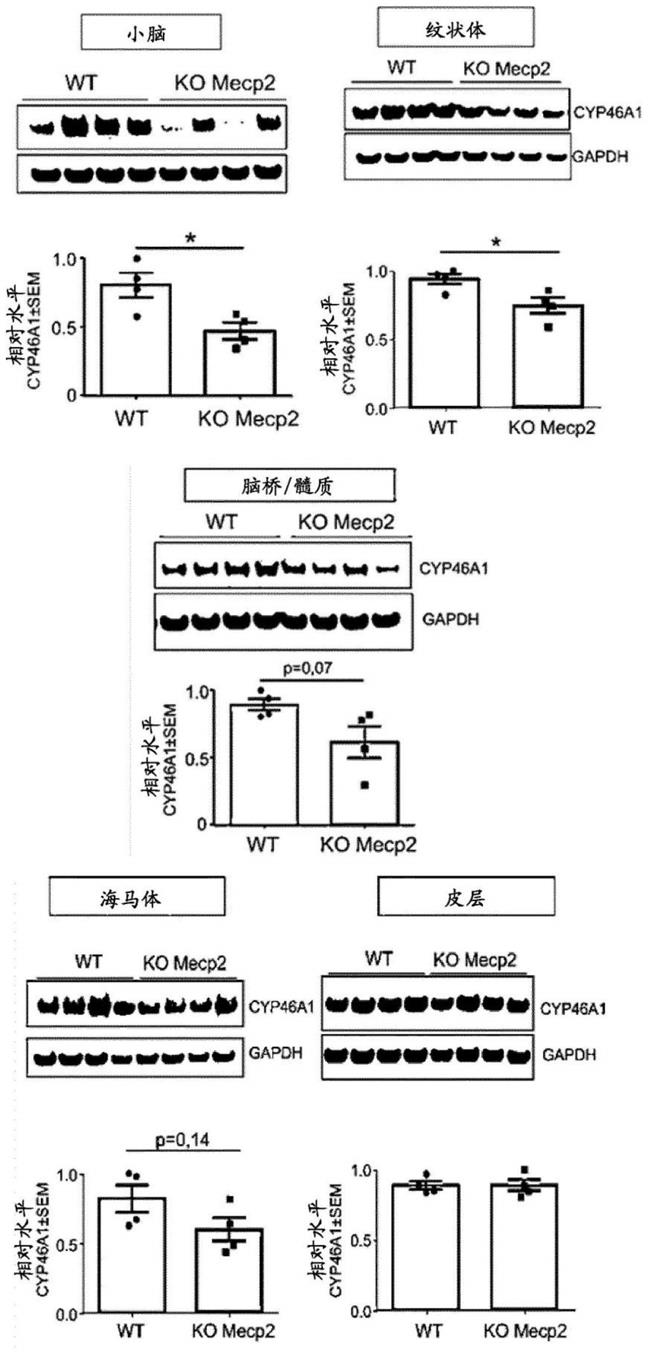
16.图1-与野生型(对照)同窝小鼠(wt)相比,45天时重度mecp2 ko雄性小鼠模型的脑区域(小脑、脑桥、纹状体、海马体和皮层)中cyp46a1的基础水平。
17.图2-与野生型(对照)同窝小鼠(wt)相比,重度mecp2 ko雄性在45天时脑中的脂质异常。
18.图3-与未处理的雄性mecp2 ko小鼠(ko mecp2)和对照(wt)相比,静脉内施用aavphp.eb-cyp46a1(ko mecp2 aav)3周后,轻度mecp2 ko雄性小鼠的行为评价。(a)抱握测试;(b)滚轴;(c)体重随访。结果表示为平均值
±
sem。
19.图4-在轻度雄性ko mecp2的中枢神经系统(a)和外周器官(b)中aavphp.eb-cyp46a1的生物分布。
20.图5-在16周龄时在轻度ko mecp2雄性中通过24oh胆固醇水平定量评价靶接合。通过uplc-hrms评估轻度ko mecp2雄性小鼠的脑24s-羟基胆固醇含量。结果表示为平均值
±
sem。
21.图6-在轻度ko mecp2雄性中静脉内递送aavphp.eb-cyp46a1后16周时浦肯野细胞的评价和组织学分析。(小脑中浦肯野细胞数量的定量。结果表示为平均值
±
sem)。
22.图7-在轻度ko mecp2雄性中静脉内递送aavphp.eb-cyp46a1治疗后16周的星形胶质细胞增生评价和组织学分析。脑不同区域中星形胶质细胞数量的定量。结果表示为平均值
±
sem。
23.图8-在ko mecp2轻度雄性小鼠中静脉内递送aavphp.eb-cyp46a1治疗后16周的小胶质细胞增生评价和组织学分析。脑不同区域中的小胶质细胞数量的定量。结果表示为平均值
±
sem。
24.图9-与未处理的雄性mecp2 ko小鼠(ko mecp2)和对照(wt)相比,静脉内施用aavphp.eb-cyp46a1(ko mecp2aav)3周后重度mecp2 ko雄性小鼠的行为评价。(a)抱握测试;(b)滚轴;(c)体重随访。结果表示为平均值
±
sem。
25.图10-在40天时重度ko mecp2雄性的中枢神经系统(a)和外周器官(b)中的aavphp.eb-cyp46a1生物分布。
26.图11-6周时重度ko mecp2雄性的腰脑中涉及胆固醇代谢的基因的mrna水平。从6周龄小鼠和鼠和人的全脑中提取mrna(a)定量cyp46a1水平和胆固醇通路中涉及的其他基因(b)。将mrna水平标准化为actin管家基因。数据表示为平均值
±
sem(每组n=6)。数据表示为平均值
±
sem(每组n=7-9)。统计分析:student t检验。*p《0.05,**p《0.01。
27.图12-在重度ko mecp2雄性中静脉内递送aavphp.eb-cyp46a1治疗后6周浦肯野细胞的评价和组织学分析。小脑中浦肯野细胞数量的定量。结果表示为平均值
±
sem。
28.图13-在重度ko mecp2雄性中静脉内递送aavphp.eb-cyp46a1治疗后6周时的星形胶质细胞增生评价和组织学分析。脑不同区域中星形胶质细胞数量的定量。结果表示为平均值
±
sem。
29.图14-在重度ko mecp2雄性小鼠中静脉内递送aavphp.eb-cyp46a1治疗后16周的小胶质细胞增生评价和组织学分析。脑不同区域中的小胶质细胞数量的定量。结果表示为平均值
±
sem。
30.图15-与未处理的雄性mecp2 ko小鼠(ko mecp2)和对照(wt)相比,静脉内施用aavphp.eb-cyp46a1(ko mecp2aav)12周后重度mecp2 ko雌性小鼠的行为评价。(a)抱握测试;(b)滚轴;(c)体重随访。结果表示为平均值
±
sem。
31.发明详述
32.发明人证明在rtt小鼠模型中静脉内递送表达cyp46a1基因的载体能够在雄性和雌性小鼠的轻度和重度疾病模型中预防/纠正运动障碍的发展。此外,在雄性中,发明人证明可在轻度ko mecp2模型中预防浦肯野细胞损失和改善星形胶质细胞增生和小胶质细胞增生。
33.在此基础上,发明人提供了用于治疗雷特综合征的病毒载体,其中所述载体在中枢神经系统的细胞中,特别是在皮层、海马体、纹状体和小脑内的神经元中表达cyp46a1。该策略可用于治疗智力障碍或与雷特综合征相关的自闭症谱系障碍的其他病理。
34.雷特综合征
35.本发明具体地涉及雷特综合征的治疗。优选地,本发明涉及由x-连锁的基因甲基-cpg-结合蛋白2(mecp2)(一种普遍表达的转录调节子)中的突变引起的雷特综合征的治疗。在一个实施方案中,本发明涉及与智力障碍相关的雷特综合征的治疗。
36.在本发明的上下文中,术语“治疗(treatment/treat/treating)”在本文中用于表
示治疗方法或过程,其旨在(1)减缓或停止该术语适用的疾病状态或病症的症状的进展、重度或重度治疗方法或过程;(2)减轻或改善该术语适用的疾病状态或病症的症状;和/或(3)逆转或治愈该术语适用的疾病状态或病症。
37.如本文所用,术语“受试者”或“患者”是指动物,优选哺乳动物,甚至更优选人,包括成人和儿童。然而,术语“受试者”也可以指非人动物、哺乳动物诸如小鼠和非人灵长类动物。
38.cyp46a1序列
39.本发明的第一个目的涉及用于治疗雷特综合征的载体,其包含编码胆固醇24-羟化酶的核酸的完整序列。
40.如本文所用,术语“基因”是指含有至少一个在转录或翻译后可编码特定多肽或蛋白质的开放阅读框的多核苷酸。
41.如本文所用,术语“编码序列”或“编码特定蛋白质的序列”表示,当置于适当调节序列的控制下时在体外或体内被转录(dna时)和翻译(mrna时)成多肽的核酸序列。编码序列的边界由5’(氨基)末端的起始密码子和3’(羧基)末端的翻译终止密码子决定。编码序列可包括但不限于来自原核或真核mrna的cdna,来自原核或真核dna的基因组dna序列,甚至合成的dna序列。
42.cyp46a1基因编码胆固醇24-羟化酶。该酶是酶的细胞色素p450超家族的成员。该酶将胆固醇转化为24s-羟基胆固醇(24s-oh-chol),其可以动态地穿过bbb,完成外周循环以从机体排出(i.等,1998),从而维持胆固醇体内平衡。cyp46a1的cdna序列公开于genbank登录号af094480(seq id no:1)。氨基酸序列如seq id no:2所示。
43.本发明利用包含序列seq id no:1或其变体的核酸构建体治疗雷特综合征,以及任选相关的自闭症谱系相关疾病。
44.变体包括,例如,由于个体之间的等位基因变异(例如多态性),可变剪接形式等而天然存在的变体。术语变体还包括来自其他来源或生物体的cyp46a1基因序列。变体优选与seq id no:1基本同源,即表现出与seq id no:1通常至少约75%,优选至少约85%,更优选至少约90%,更优选至少约95%的核苷酸序列同一性。cyp46a1基因的变体还包括在严格杂交条件下与如上定义的序列(或其互补链)杂交的核酸序列。典型的严格杂交条件包括温度高于30℃,优选高于35℃,更优选超过42℃,和/或盐浓度小于约500mm,优选小于200mm。杂交条件可由本领域技术人员通过改变温度、盐浓度和/或其他试剂(诸如sds、ssc等)的浓度来调节。
45.非病毒载体
46.在一个实施方案中,根据本发明的用途的载体是非病毒载体。通常,非病毒载体可以是编码cyp46a1的质粒。所述质粒可以直接施用或通过脂质体、胞外体或纳米颗粒施用。
47.病毒载体
48.可用于实施本发明的基因送递病毒载体可利用分子生物学领域熟知的方法构建。通常,携带转基因的病毒载体由编码转基因的多核苷酸、合适的调节元件和产生介导细胞转导的病毒蛋白所必需的元件组装而成。
49.术语“基因转移”或“基因递送”是指用于将外源dna可靠地插入宿主细胞的方法或系统。这些方法可使得非整合转移的dna的瞬时表达、染色体外复制和转移的复制子的表达
(例如:附加体),或转移的遗传物质整合到宿主细胞的基因组dna中。
50.病毒载体的实例包括腺病毒、慢病毒、逆转录病毒、疱疹病毒和腺相关病毒(aav)载体。
51.这种重组病毒可通过本领域已知的技术产生,诸如通过转染包装细胞或通过用辅助质粒或病毒瞬时转染。病毒包装细胞的典型实例包括pa317细胞、psicrip细胞、gpenv 细胞、293细胞等。生产这种复制缺陷型重组病毒的详细方案可在例如wo95/14785、wo96/22378、us5,882,877、us6,013,516、us4,861,719、us5,278,056和wo94/19478中找到。
52.在优选的实施方案中,使用腺相关病毒(aav)载体。
[0053]“aav载体”是指源自腺相关病毒血清型的载体,包括但不限于aav1、aav2、aav3、aav4、aav5、aav6、aav8、aav9、aav10,诸如aavrh.10、aavphp.eb等。aav载体可具有一个或多个完整或部分缺失的aav野生型基因,优选rep和/或cap基因,但保留功能性侧翼itr序列。功能性itr序列对于aav病毒粒子的拯救、复制和包装是必需的。因此,aav载体在本文中被定义为至少包括病毒的顺式复制和包装所需的那些序列(例如,功能性itr)。itr不必是野生型核苷酸序列,且例如通过核苷酸的插入、缺失或取代可以被改变,只要序列提供功能性拯救、复制和包装。使用已知技术构建aav表达载体,以至少提供作为在转录方向上可操作连接的组分的控制元件,所述控制元件包括转录起始区、目标dna(即cyp46a1基因)和转录终止区。可以包括目标dna的两个拷贝,作为自身互补构建体14。
[0054]
在更优选的实施方案中,aav载体是aav9、aav10(aavrh.10)、aavphp.b或aavphp.eb载体,或源自这些血清型之一的载体。在最优选的实施方案中,aav载体是aavphp.eb载体。aavphp.eb载体是有效转导cns神经元的进化的aav-php.b变体(ken y chan等2017;wo2017100671)。也可以使用其他载体,诸如wo2015038958和wo2015191508中描述的载体。
[0055]
选择在哺乳动物细胞中有功能的控制元件。含有操作性连接的组分的所得构建体与功能性aav itr序列结合(5’和3’)。“腺相关病毒反向末端重复序列”或“aav itr”是指在aav基因组的每个末端发现的本领域公认的区域,它们作为dna复制起点和作为病毒的包装信号一起顺式发挥功能。aav itr与aav rep编码区一起提供了从哺乳动物细胞基因组中有效的切除和拯救,以及插入两个侧翼itr之间的核苷酸序列整合至哺乳动物细胞基因组中。对于aav-2序列,aav itr区域的核苷酸序列是已知的。(参见,例如:kotin,1994;berns,ki“parvoviridae and their replication”in fundamental virology,2
nd edition,(b.n.fields和d.m.knipe,eds.)。如本文所用,“aav itr”不一定包含野生型核苷酸序列,但例如通过核苷酸的插入、删除或取代,可以被改变。另外,aav itr可源自几种aav血清型中的任一种,包括但不限于aav-1、aav-2、aav-3、aav-4、aav-5、aav6等。此外,aav载体中所选核苷酸序列侧翼的5’和3’itr不必相同或源自相同的aav血清型或分离株,只要它们按预期发挥功能即可,即使得从宿主细胞基因组或载体切除和拯救目标序列,且当aav rep基因产物存在于细胞中时使得异源序列整合到受体细胞基因组中。
[0056]
特别优选的是源自aav血清型的载体,其在哺乳动物中枢神经系统(cns)(特别是神经元)的细胞中具有生物向性和高转导效率。davidson等,2000提供了不同血清型的转导效率的综述和比较。在一个优选的实例中,基于aav2的载体已显示引导转基因在cns(优选转导神经元中)的长期表达。在其他非限制性实例中,优选的载体包括源自aav4和aav5血清
型的载体,其也显示转导cns细胞(davidson等,同上)。特别地,载体可以是包含源自aav5的基因组(特别地,itr是aav5 itr)和源自aav5的衣壳的aav载体。
[0057]
在本发明的特定实施方案中,所述载体是假型化aav载体。具体而言,假型化aav载体包含源自第一种aav血清型的aav基因组和源自第二种aav血清型的衣壳。优选地,aav载体的基因组源自aav2。此外,衣壳优选来源于aav5。假型化aav载体的具体非限制性实例包括在源自aav5的衣壳中包含源自aav2的基因组的aav载体,在源自aavrh.10的衣壳中包含源自aav2的基因组的aav载体等。
[0058]
所选的核苷酸序列可操作地连接到引导其在受试者体内转录或表达的控制元件。这些控制元件可包含通常与所选基因相关的控制序列。特别地,这样的控制元件可以包括cyp46a1基因的启动子,特别是人cyp46a1基因的启动子(ohyama y等,2006)。
[0059]
或者,可使用异源控制序列。可用的异源控制序列通常包括源自编码哺乳动物的序列或病毒基因。实例包括但不限于磷酸甘油酸激酶(pgk)启动子、sv40早期启动子、小鼠乳腺肿瘤病毒ltr启动子;腺病毒主要晚期启动子(ad mlp);单纯疱疹病毒(hsv)启动子、巨细胞病毒(cmv)启动子诸如cmv立即早期启动子区(cmvie)、劳氏肉瘤病毒(rsv)启动子、合成启动子、杂合启动子等。此外,源自非病毒基因(诸如鼠金属硫蛋白基因)的序列也可用于本发明。这样的启动子序列可从例如stratagene(san diego,ca)商购。为了本发明的目的,异源启动子和其他控制元件,诸如cns-特异性和诱导型启动子、增强子等,可有特别用途。
[0060]
异源启动子的实例包括cmv启动子。cns特异性启动子的实例包括从来自髓鞘碱性蛋白(mbp)、神经胶质纤维酸性蛋白(gfap)、突触蛋白(例如人突触蛋白1基因启动子)和神经元特异性烯醇化酶(nse)的基因中分离的那些。
[0061]
诱导型启动子的实例包括蜕皮激素、四环素、hypoxia和aufin的dna响应元件。
[0062]
含有由aav itr结合的目标dna分子的aav表达载体可通过将所选的序列直接插入aav基因组中而构建,所述aav基因组具有从中切除的主要aav开放阅读框(“orf”)。aav基因组的其他部分也可以缺失,只要保留足够的itr部分以允许复制和包装功能。这样的构建体可使用本领域熟知的技术来设计。参见,例如:美国专利号5,173,414和5,139,941;国际公开号wo92/01070(1992年1月23日公开)和wo93/03769(1993年3月4日公开);lebkowski等,1988;vincent等,1990;carter,1992;muzyczka,1992;kotin,1994;shelling和smith,1994;和zhou等,1994。或者,可使用标准连接技术将aav itr从病毒基因组或从含有aav itr的aav载体切除,所述aav itr与存在于另一载体中的所选核酸构建体的5’和3’融合。含有itr的aav载体已经在,例如美国专利号5,139,941中描述。特别地,其中还描述了几种aav载体,它们可从美国典型培养物保藏中心(“atcc”)获得,保藏号为53222、53223、53224、53225和53226。另外,可以合成产生嵌合基因以包括排列在一个或多个所选的核酸序列的5’和3’的aav itr序列。可用用于在哺乳动物cns细胞中表达嵌合基因序列的优选密码子。由通过标准方法制备的重叠寡核苷酸组装完整的嵌合序列(参见例如:edge,1981;nambair等,1984;jay等,1984)。为产生raav病毒体,使用已知技术,诸如通过转染将aav表达载体引入合适的宿主细胞。许多转染技术通常是本领域已知的。(参见例如graham等1973;sambrook等(1989)molecular cloning,a laboratory manual,cold spring harbor laboratories,new york,davis等(1986)basic methods in molecular biology,elsevier,和chu等,1981)。特别合适的转染方法包括磷酸钙共沉淀(graham等,1973)、直接
微注射到培养细胞中(capecchi,1980)、电穿孔(shigekawa等,1988)、脂质体介导的基因转移(mannino等,1988)、脂质介导的转导(felgner等,1987)和使用高速微粒的核酸递送(klein等,1987)。
[0063]
例如,优选的病毒载体,诸如aavphp.eb,除了编码胆固醇24-羟化酶的核酸序列之外,还包含具有源自aav-2的itr的aav载体骨架、启动子,诸如小鼠pgk(磷酸甘油酸激酶)基因或巨细胞病毒/β-肌动蛋白杂合启动子(cag),其由来自巨细胞病毒立即基因的增强子、来自鸡β-肌动蛋白基因的启动子、剪接供体和内含子,来自兔β-珠蛋白的剪接受体,或任何神经元启动子,诸如具有或不具有野生型或突变形式的土拨鼠肝炎病毒转录后调控元件(wpre)的多巴胺-1受体或多巴胺-2受体的启动子组成。
[0064]
载体的递送
[0065]
公开了一种治疗雷特综合征的方法,所述方法包括向有需要的患者施用包含编码胆固醇24-羟化酶的核酸的载体。所述载体可以直接递送到受试者的脑和/或脊髓中,或通过血管内、静脉内、眼眶后、鼻内、心室内或鞘内注射递送。
[0066]
在特定的实施方案中,提供了一种用于在受试者中治疗雷特综合征(rtt)的方法,所述方法包括:
[0067]
(a)提供如上定义的载体,其包含编码胆固醇24-羟化酶的核酸;以及
[0068]
(b)将所述载体递送至受试者的脑和/或脊髓,其中所述载体转导脑和/或脊髓中的细胞,且其中胆固醇24-羟化酶以治疗有效水平通过转导细胞表达。
[0069]
有利地,所述载体是病毒载体,更有利地是aav载体,甚至有利地选自下组的aav载体:aav9、aav10或aavphp.eb,优选aavphp.eb。
[0070]
在特定的实施方案中,将载体递送至脑,特别是递送至运动皮层和/或脊髓。在特定的实施方案中,载体只递送到脊髓。
[0071]
将病毒载体递送或施用至神经元和/或星形胶质细胞和/或少突胶质细胞和/或小胶质细胞的方法通常包括适用于将载体直接或通过造血细胞转导递送至所述细胞的任何方法,使得所选突触连接的细胞群的至少一部分细胞被转导。可将载体递送至中枢神经系统的任何细胞,外周神经系统的细胞或二者。优选地,将载体递送至脑和/或脊髓的细胞。通常,将载体递送至脑的细胞,包括例如运动皮层、脊髓或其组合的细胞,或其任何合适的亚群。
[0072]
为了将载体特异性递送至脑或脊髓的特定区域和特定细胞群,可通过立体定位显微注射施用载体。例如,患者将立体定向框架基座固定在适当位置(拧入颅骨)。使用高分辨率mri对具有立体定向框架(与基准标记兼容的mri)的脑部进行成像。然后将mri图像传送到运行立体定向软件的计算机。使用一系列冠状、矢状和轴向图像确定靶点(载体注射部位)和轨迹。软件直接将轨迹转换为适于立体定向框架的三维坐标。在进入部位上方钻出钻孔,并将立体定向装置定位成针植入到给定深度。然后在靶位点注射载体,最后与造影剂混合。由于载体整合到靶细胞中,而非产生病毒颗粒,因此载体随后的扩散是次要的,而从注射部位被动扩散的功能是主要的,且整合之前所需的跨突触转运当然是主要的。可通过调节载体与流体载体的比率来控制扩散程度。
[0073]
其他的施用途径还可包括在直接可视化下局部施用载体,例如:浅表皮层应用、鼻内应用或其他非立体定向应用。
[0074]
本发明载体的靶细胞是患有rtt的受试者的海马体、皮层、纹状体和小脑中的脑细胞(神经元),优选神经细胞。优选地,受试者是人,通常是儿童或婴儿,特别是女性婴儿,但可以是成人。
[0075]
然而,本发明包涵了将载体递送至疾病生物模型。在这种情况下,生物模型可以是在递送时处于发育的任何阶段的任何哺乳动物,例如胚胎、胎儿、婴儿、幼年或成人,优选成人。此外,靶细胞可基本上来自任何来源,尤其是啮齿目(小鼠、大鼠、兔、仓鼠),食肉目(猫、狗)和偶蹄目(牛、猪、绵羊、山羊、马)以及任何其他非人的系统(例如斑马鱼模型系统)的非人的灵长类和哺乳动物。
[0076]
优选地,本发明的方法包括通过立体定位注射的脑内施用。然而,根据本发明也可采用其他已知的递送方法。例如,为了使载体更广泛地分布在脑中,可将其注射到脑脊液中,例如通过腰椎穿刺、小脑延髓池或心室穿刺。为了将载体引导向脑部,可将其注射到脊髓或外周神经节或目标的机体部分肌肉(皮下或肌内)中。在某些情况下,可通过血管内途径施用载体,诸如本文中的aavphp.eb。例如,可在血脑屏障被打破的情况下经动脉内(颈动脉)施用载体。此外,对于更全面的递送,可在通过输注高渗溶液(包括甘露醇)或超声局部递送实现的血脑屏障的“打开”期间施用载体。
[0077]
本文所用的载体可配制在任何合适的用于递送的载体中。例如,可将它们置于药学上可接受的悬浮液、溶液或乳液中。合适的介质包括盐水和脂质体制剂。更具体地,药学上可接受的载体可包括无菌水性或非水性溶液、悬浮液和乳液。非水溶剂的实例是丙二醇、聚乙二醇、植物油诸如橄榄油,和可注射的有机酯诸如油酸乙酯。水性载体包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。静脉内载体包括液体和营养补充剂、电解质补充剂(诸如基于林格氏葡萄糖的电解质补充剂)等。
[0078]
也可以存在防腐剂和其他添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
[0079]
胶体分散系统也可用于靶向基因递送。胶体分散系统包括大分子复合物、纳米胶囊、微球、微珠和基于脂质的系统,包括水包油乳液、胶束、混合胶束和脂质体或胞外体。
[0080]
优选的剂量和方案可以由医师确定,且取决于受试者的年龄、性别、体重和疾病的阶段。例如,为使用病毒表达载体递送胆固醇24-羟化酶,每单位剂量的胆固醇24-羟化酶表达载体可包含2.5-1ml的组合物,该组合物在药学上可接受的流体中包含病毒表达载体,且每ml组合物提供10
10-10
15
个胆固醇24-羟化酶表达病毒颗粒。
[0081]
药物组合物
[0082]
本发明的另一个目的涉及用于治疗雷特综合征的药物组合物,其包含治疗有效量的根据本发明的载体。
[0083]“治疗有效量”是指足以以适用于任何医学治疗的合理益处/风险比治疗雷特综合征的本发明载体的量。
[0084]
应当理解,本发明的化合物和组合物的总日剂量将由主治医师在合理的医学判断范围内决定。对于任何特定患者的具体治疗有效剂量水平将取决于多种因素,包括所治疗的病症和病症的严重程度;所用具体化合物的活性;使用的具体组合物,患者的年龄、体重、一般健康状况、性别和饮食;所用具体化合物的施用时间、施用途径和排泄速率;治疗持续时间;与所用的特定多肽组合或同时使用的药物;以及医学领域公知的类似因素。例如,以
低于达到所需治疗效果要求水平的化合物起始剂量并逐渐增加剂量直到达到所需效果是本领域技术人员熟知的。然而,产品的日剂量可在每个成人每天的宽范围内变化。应当施用的根据本发明的载体的治疗有效量以及用病毒或非病毒颗粒和/或本发明的药物组合物的数量治疗病理状况的剂量将取决于多种因素,包括患者的年龄和状况、紊乱或病症的严重程度、施用的方法和频率以及待用的具体的肽。
[0085]
含有根据本发明的载体的药物组合物适用于肌内、脑内、鼻内、鞘内、心室内或静脉内施用的任何形式。在用于肌内、鼻内、眼眶后、静脉内、脑内、鞘内或心室内施用的本发明的药物组合物中,活性成分单独或与另一种活性成分组合,可作为与常规药物载体的混合物以单位施用的形式施用于动物和人。
[0086]
优选地,药物组合物含有对于待注射的制剂是药学上可接受的媒介物。它们可以特别是等渗的、无菌的盐水溶液(磷酸一钠或二钠、氯化钠、氯化钾、氯化钙或氯化镁等或这些盐的混合物),或干燥的,尤其是冻干的组合物,根据情况加入无菌水或生理盐水后,可以配制无菌可注射溶液。
[0087]
在配制时,溶液将以与剂量制剂相容的方式和以治疗有效的量施用。制剂易于以各种剂型施用,诸如可注射溶液的类型,但也可使用药物释放胶囊等。
[0088]
也可以多剂量施用。
[0089]
也可将治疗方案与能激活cyp46a1的小分子诸如efavirenz(mast,n.等,2017;mast,n.等,2014)或抗真菌药物(mast,n.等,2013;fourgeux,c.等,2014)关联,其相反地可抑制cyp46a1并因此必要时成为停止基因治疗方案的方式。
[0090]
通过以下实施例进一步阐释本发明。然而,该实施例和附图不应以任何方式解释为限制本发明的范围。
具体实施方式
[0091]
在该实验中,已经使用了雷特综合征的严重小鼠模型,且已证明表型的显著拯救。
[0092]
材料和方法
[0093]
动物
[0094]
在本研究中使用了两种品系的小鼠。
[0095]
从jackson实验室获得3只雌性b6.129p2-mecp2
tm1bird
/j纯合子(stock 007177)并与c57bl/6小鼠交配以产生种群,此后命名为轻度mecp2 ko。
[0096]
从jackson实验室获得10只雌性b6.129p2(c)-mecp2
tm.11bird
/j杂合子(stock 003890)并与c57bl/6小鼠交配以产生种群,其后命名为重度mecp2 ko。
[0097]
将小鼠圈养在控温的房间中,并维持12小时光/暗循环。食物和水可随意获得。根据欧洲共同体理事会指引(2010/63/eu)进行实验以照顾和使用实验动物。
[0098]
aav质粒设计和载体生产
[0099]
aav载体通过atlantic基因治疗(inserm u1089,nantes,france)生产和纯化。载体的生产在别处已有描述(hudry等,2010)。aavphp.eb-cyp46a1-ha的病毒构建体含有由人cyp46a1基因组成的表达盒,其由被aav2的反向末端重复序列(itr)序列包围的cmv早期增强子/鸡β-肌动蛋白(cag)合成启动子(cag)驱动。
[0100]
mecp2基因分型
[0101]
根据jackson实验程序(https://www2.jax.org/protocolsdb/f?p=116:5:0::no:5:p5_master_protocol_id,p5_jrs_code:28595,007177)和(https://www.jax.org/protocol?stocknumber=003890&protocolid=24870)根据群体对小鼠基因分型。
[0102]
静脉内注射
[0103]
用4%异氟烷对三周龄mecp2-/y
雄性(轻度和重度)小鼠和12周龄mecp2 /-重度雌性小鼠诱导麻醉,然后用80%空气和20%氧气维持在2%。轻度mecp2-/y
动物(n=14)通过眼眶后注射接受总共5.10e11vg(100μl体积)静脉内注射。wt和未注射的重度mecp2-/y
动物(每组分别n=10-13)接受100μl盐水溶液注射。mecp2-/y
动物(n=11)通过眼眶后注射接受总共5.10e11vg(100μl体积)静脉内注射。wt和未注射的mecp2-/y
动物(每组分别n=17-19)接受100μl盐水溶液的注射。
[0104]
重度mecp2
/-雌性动物(n=8)通过眼眶后注射静脉内注射总共5.10e11vg(100μl体积)。wt和未注射mecp2
/-动物(每组分别n=9-10)接受100μl盐水溶液的注射。
[0105]
行为测试
[0106]
抱握测试
[0107]
抱握测试评估协调性且是rett的经典评估。在注射前对动物进行评分,然后从3周直到32周(对于轻度ko雄性),直到6周(对于重度ko雄性)每周评分。对于重度雌性,在注射后1周,然后每3周进行评分(直到25周,现在正在进行)。从尾部保持动物,如果小鼠抽搐,则评分为“1”,然后对每个后肢抱握的评分加上1分。每个试验的结果表示为每组的平均值
±
sem,并进行双向anova分析。
[0108]
滚轴
[0109]
使用加速滚轴le8200(bioseb,france)测试总的发动机容量,并如前所述进行测量(https://www.mousephenotype.org/)。从3周龄直到最大存活,每周对动物进行评分(重度ko雄性为6周,轻度ko雄性为28周,且重度ko雌性为19周)。
[0110]
组织收集
[0111]
用戊巴比妥(euthasol 180mg/kg)溶液麻醉小鼠并用磷酸盐缓冲盐水(pbs)经心脏灌注。收集脑、脊髓和坐骨神经以及外周器官(肝、心、肺、肾、脾、膈、腓肠肌)并在pfa 4%中后固定,然后加入石蜡用于组织学分析(用切片机切割6-10μm)或立即在液氮中冷冻用于生物分子分析。
[0112]
在液体培养基中研磨/压碎不同的组织并分离以分析rna、dna表达或脂质组学分析。
[0113]
一抗
[0114]
用于免疫组织化学(ihc)分析的抗体列于下表1中。
[0115]
表1:用于免疫组织化学(ihc)分析的抗体
[0116]
一抗来源ihc兔抗钙结合蛋白d-28kswant(cb38a)1:10000兔抗ha细胞转导(#3724)1:500兔抗iba1wako(019-19741)1:500小鼠抗gfapsigma(g-3893)1:500
[0117]
免疫染色
[0118]
石蜡切片上
[0119]
使用abc法进行免疫组织化学标记。简言之,将组织切片用过氧化物处理30分钟以抑制内源性过氧化物酶。在pbs中洗涤后,将切片在95℃下用10mm tris/1mm edta/0.1%吐温ph8.75处理45分钟(仅针对抗ha)或在95℃下用10mm柠檬酸盐ph6处理45分钟(仅针对抗cb)。在pbs中洗涤后,将切片与封闭溶液(10%山羊血清,pbs/0.3%tritonx-100)温育1小时。将一抗在封闭溶液中稀释并在组织切片上在4℃孵育过夜。在pbs中洗涤后,将切片依次和与生物素缀合的山羊抗兔或山羊抗小鼠抗体(vector laboratories)在室温下孵育30分钟,然后与abc复合物(vector laboratories)一起孵育。在pbs中洗涤后,使用二氨基联苯胺作为染色体基因(dako,carpinteria,ca)检测过氧化物酶活性。在一些情况下,用苏木精复染载玻片。载玻片用depex(vwr international)固定。
[0120]
根据标准方案对脑切片进行nissl染色。
[0121]
图像采集
[0122]
对于所有ihc和着色,使用hamamatsu载玻片扫描仪采集切片。
[0123]
dna提取
[0124]
使用氯仿/苯酚法从脑、脊髓和外周器官中提取dna。
[0125]
rna提取
[0126]
使用trizol或trireagent(sigma)从脑的一部分提取总rna。用transcriptor first strand cdna合成试剂盒(roche)根据制造商的说明将1微克总rna转录成cdna。
[0127]
q-pcr
[0128]
用sybergreen(roche)扩增cdna。用于rt-qpcr的引物见上表。所有引物的扩增方案为热启动(95℃ 5min),45个扩增循环(95℃ 15s,60℃ 1min)和熔解曲线分析。用lightcycler 480软件和每个基因的效率因子分析数据并归一化为actine。
[0129]
名称引物5
’‑
》3’actine_126正向tcc tga gcg caa gta ctc tgtactine_127反向ctg atc cac atc tgc tgg aagcyp46a1小鼠正向ggc taa gaa gta tgg tcc tgt tgt aag acyp46a1小鼠反向ggt gga cat cag gaa ctt ctt gac tapoe正向gtc aca ttg ctg aca gga tgc ctaapoe反向ggg ttg gtt gct ttg cca ctchmgcr正向ccc cac att cac tct tga cgc tcthmgcr反向gct ggc gga cgc ctg aca tsrebp1正向ggt cca gca ggt ccc agt tgtsrebp1反向ctg cag tct tca cgg tgg ctcsrebp2正向tgt tga cgc aga cag cca atgcyp46a1人正向cga gtc ctg agt cgg tta aga agt tcyp46a1人反向agt ctg gag cgc acg gta catmbp_正向gcctgtccctcagcagattmbp_反向cttcaaacgaaaagggacgadhcr7正向agacatttgggccaagacac
dhcr7反向aacctggcagaaatctgtggdgat1正向cctcagccttcttccatgagdgat1反向actggggcatcgtagttgagmadck3正向cca cct ctc cta tgg gca gamadck3反向ccg ggc ctt ttc aat gtc t
[0130]
使用light cycler 480 sybr green i master(roche,france)通过qpcr对从脊髓、脑、坐骨神经和外周器官提取的基因组dna测量载体基因组拷贝数。将结果(每个细胞的载体基因组拷贝数)表示为转基因序列拷贝数相对于作为内标(2n基因组的病毒基因组拷贝数)的adck3基因拷贝的n倍差异。
[0131]
胆固醇和氧甾醇测量
[0132]
胆固醇和氧甾醇分析遵循“金标准”方法(dzeletovic等,1995)以最小化自氧化伪影的形成。简言之,将小鼠脑组织样品称重并用tissue lyser ii装置(qiagen)在含有丁基化羟基甲苯(bht,50μg/ml)和edta(0.5m)的500μl溶液中均质。此时,加入内标混合物[表前列醇、2h7-7-谷甾醇、2h6-链甾醇、2h6-羊毛甾醇和2h7-24(r/s)-羟基胆固醇](avanti polar lipids)。在氩气下使用0.35m乙醇koh在室温下进行碱水解2小时。用磷酸中和溶液后,用氯仿萃取甾醇。收集下层相,在氮气流下干燥并将残余物溶于甲苯中。然后在100mg isolute硅胶柱(biotage)上将氧甾醇与胆固醇及其前体分离;将胆固醇在己烷中的0.5%2-丙醇中洗脱,然后将氧甾醇在己烷中的30%2-丙醇中洗脱。如(chevy等,2005)已描述,用 10%tmcs[双(三甲基甲硅烷基)三氟-乙酰胺 10%三甲基氯硅烷](regis technologies)将甾醇和氧甾醇部分各自甲硅烷化。在中等极性毛细管柱rtx-65(65%二苯基35%二甲基聚硅氧烷,长30m,直径0.32mm,膜厚度0.25μm;restesk)中采用采用气相色谱法(hewlett-packard 6890series)分离甾醇和氧甾醇的三甲基甲硅烷醚衍生物。设置与气相色谱串联的质谱仪(agilent 597inert xl)用于检测正离子。在70ev下以电子撞击模式产生离子。通过扫描模式的片段图鉴定,并在用适当的内部和外部标准[表前列醇m/z 370,2h7-7-谷甾醇m/z465,2h6-链甾醇m/z 358,2h6-羊毛甾醇m/z 504,2h7-24(r/s)-羟基胆固醇m/z 553,胆固醇m/z329,7-谷甾醇m/z,7-脱氢胆固醇m/z 325,8-脱氢胆固醇m/z 325,链甾醇m/z 343,羊毛甾醇m/z 393和24(r/s)-羟基胆固醇m/z 413]标准化和校准后,通过选择性监测特定离子来定量。
[0133]
western blot分析
[0134]
从45日龄的mecp2-/y雄性的几个区域提取总蛋白。使用bca试剂盒(pierce)测定总蛋白浓度。在4-12%bis-tris凝胶(novex bis-tris midi凝胶15或26孔,life technologies,carlsbad,usa)中使用sds-page电泳分离等量的总蛋白提取物(30μg)并转移至硝酸纤维素膜。将封闭的膜(tbs-0.1%吐温-20中5%脱脂奶粉)与一抗在4℃下孵育过夜,并用tbs-0.1%吐温-20(t-bst)洗涤三次持续10min。然后用针对每种相应的一抗产生的二抗igg-hrp抗体标记膜。用t-bst洗涤三次后,根据供应商的说明,将膜与ecl化学发光试剂(澄清度western ecl底物;ge healthcare,little chalfont,uk)孵育。用camera system fusion tx7(fisher scientific)检测过氧化物酶活性。用quantity one 1d图像分析软件(version 4.4;biorad,hercules,ca,usa)通过光密度分析进行标准化。光密度相
对于“标准蛋白”(gapdh)标准化。计算分配比并相对于样品标准化,其中最高值定义为1。
[0135]
统计分析
[0136]
使用非配对student t-检验和双向anova进行统计学分析。结果表示为平均值
±
sem。如文中所定义,将显著阈值设定为p<0.05,p<0.01和p<0.001。使用graphpad prism(graphpad software,la jolla,usa)进行所有分析。
[0137]
结果
[0138]
在雷特综合征的c57bl6/mecp2
tm1.1bird
小鼠模型的几个脑区域中cyp46a1蛋白水平降低
[0139]
在45日龄的4只mecp2-/y
动物的冷冻活检中评估cyp46a1的水平。具体而言,分析受影响动物的小脑、脑桥、纹状体、海马体和皮层中的cyp46a1蛋白水平,并与wt同窝小鼠进行比较(图1)。western-blot分析证明相对于对照同窝小鼠,小脑、纹状体中cyp46a1蛋白水平显著降低,在脑桥和海马中观察到降低趋势,且在皮层中没有差异(图1)。
[0140]
总之,这些数据支持cyp46a1(胆固醇代谢途径中的关键酶)作为人雷特综合征的治疗靶标的相关性。
[0141]
雷特综合征的c57bl6/mecp2
tm1.1bird
模型的脑中胆固醇代谢途径失调
[0142]
此前已报道了雷特综合征中胆固醇的改变和总体脂质的改变(l
ü
tjohann等,2018b)。为确定雷特综合征中cyp46a1缺陷的影响,通过气相色谱质谱(gc/ms)对来自45天的4只mecp2-/y
动物和年龄匹配的同窝小鼠的总脑提取物进行甾醇和氧甾醇的定量测量来分析胆固醇代谢。因此,测定了胆固醇代谢途径的第一个固醇羊毛甾醇,以及来自kandutsch-russell(7-谷甾醇)和bloch(链甾醇)途径的胆固醇中间体。首先比较胆固醇和24-羟基胆固醇(24s-ohc)含量,并观察到mecp2 ko小鼠中24s-ohc水平相对于野生型同窝小鼠在统计学上显著降低(图2),并观察到胆固醇显著增加。与wt同窝小鼠相比,在ko mecp2的脑中也测量到羊毛甾醇和7-谷甾醇的显著减少。最后,测量到链甾醇和8dhc的减少趋势但不显著(图2)。未发现氧甾醇25s-ohc和27s-ohc与其余甾醇(7-dhc)的统计学显著差异(图2)。
[0143]
总之,这些结果提示雷特综合征影响区域中胆固醇代谢途径的改变。
[0144]
在雷特综合征的轻度小鼠模型中cyp46a1过表达可减轻与雷特综合征相关的运动障碍并改善与雷特综合征相关的组织学和分子表型
[0145]
发明人研究了胆固醇代谢途径的上调(通过增加cyp46a1水平)是否可以改善雷特综合征的体内模型中的运动改变:轻度ko mecp2模型,特别是受更严重影响的雄性ko。通过在3周龄mecp2-/y
小鼠中静脉内施用aavphp.eb-cyp46a1-ha,cyp46a1的过表达明显减轻小鼠模型中的运动改变。通过抱握测试(图3a)和滚轴(图3b)在注射后29周(研究的最大时间)显著校正运动障碍。
[0146]
与未处理的动物相比,cyp46a1过表达还显著导致小鼠更好的生长并恢复小鼠的正常体重。经处理的动物具有与wt同窝小鼠相似的生长(图3c)。
[0147]
在16周龄时对一组小鼠实施安乐死以评估组织学和分子拯救,且保持队列的其他部分直至32周龄。
[0148]
生物分布研究揭示了脑中约8个载体基因组拷贝(vgc)(图4a),脊髓中约4个vgc和坐骨神经中约1个vgc,以及外周组织的低转导,其中肝中最大0.4个vgc,而其他外周器官中
少于0.2个vgc(图4b)。
[0149]
这种生物分布与cyp46a1-ha在所有脑结构,特别是在皮层、纹状体、海马和小脑中的大量表达完全相关(数据未显示),这也证实了先前在wt动物中获得的结果(未呈现的数据)。
[0150]
通过定量动物腰脊髓中的24-羟基胆固醇来验证靶接合,显示与未治疗动物相比,经处理的动物增加1.9倍(图5)。此外,发明人报道了与未处理的轻度ko mecp2雄性相比,随着7-谷甾醇、羊毛甾醇、25-oh和27-oh胆固醇水平升高,胆固醇途径总体升高(图5)。
[0151]
浦肯野细胞(pc)的部分保存已在小脑中得到证实,总体上具有改善,且在不同小叶中也可观察到,p值《0.0001(对小叶和处理的影响,用anova检验)(图6)。
[0152]
然后发明人研究了治疗对神经炎症的作用。发明人证实,与未处理的动物相比,经处理的动物的星形胶质细胞增生,尤其是海马体中的星形胶质细胞增生得到改善(图7)。此外,与未处理的动物相比,经处理的动物的小胶质增生,特别是纹状体、海马体和小脑中的小胶质增生得到改善(图8)。总之,重要的发现也是aavphp.eb递送未导致脑中的任何长期炎症的事实(图7和8)。
[0153]
cyp46a1过表达减轻了雷特综合征的重度雄性模型的行为改变并改善了与雷特综合征相关的表型。
[0154]
基于对轻度受影响的动物的处理,进行研究以确定通过cyp46a1水平的增加,胆固醇代谢途径的上调能否改善雷特综合征的更严重的体内模型(重度ko mecp2)的运动改变。
[0155]
通过在3周龄小鼠中静脉内施用aavphp.eb-cyp46a1-ha的cyp46a1的过表达明显减轻重度小鼠模型的运动改变。
[0156]
直到4周,aavphp.eb-cyp46a1的施用明显减少了通过抱握测试测量的运动障碍(图9a),并减轻了通过滚轴评估测量的改变(图9b),由于covid19的限制实验没有更长(实验进行中)。ko小鼠生长受损,但是3周的处理没有带来任何改善(图9c)。
[0157]
将小鼠在6周龄(40天)安乐死,用于组织学和分子分析。生物分布研究揭示了在脑中约12个载体基因组拷贝(vgc)(图10a)及在脊髓中约7个vgc(图10a),以及外周组织的低转导,其中在注射后20天在肝中最多2个vgc,在心脏中1个vgc且在其他外周器官中仅少于0.5个vgc(图10b)。这种生物分布与hcyp46a1mrna的大量表达相关(图11a),而不影响内源小鼠水平(图11a)。关于参与胆固醇通路的其他基因,发明人报道了与未处理动物相比,经处理动物中apoe水平正常化的趋势(图11b)。其他基因中没有一个在40日龄时受到影响,但随后需要在小鼠队列中评估其存活。
[0158]
浦肯野细胞(pc)的保存已在小脑中证实,总体具有改善,且也可在不同小叶中观察到,p值《0.0001(对小叶和处理的影响,用anova检验)(图12)。
[0159]
然后发明人研究了处理对神经炎症的作用。发明人证明,除了大脑皮层(图14)和海马体的增加之外,对星形胶质细胞增生没有重要影响。对于星形胶质细胞增生和小胶质细胞增生,在该年龄时在重度ko mecp2雄性中没有观察到明显差异,且需要在后期进行进一步的研究。正在实验另一队列的经处理的动物以评估长期改善和对存活的影响。
[0160]
cyp46a1过表达减轻了雷特综合征的重度雌性模型的行为改变。
[0161]
由于雷特综合征影响人类的女性,发明人想要研究cyp46a1过表达对重度ko mecp2雌性的影响。
[0162]
直到19周,aavphp.eb-cyp46a1的施用明显且显著地减少了通过抱握测试测量的运动障碍(图15a),并减轻了通过滚轴评估的改变(图15b);由于covid19的限制实验没有更长(实验进行中)。
[0163]
ko小鼠生长受损,有肥胖趋势,且在经处理的动物中观察到该表型的明显改进(图15c)。
[0164]
总之,这些数据表明cyp46a1过表达减轻了雷特综合征的轻度和重度模型以及雄性和雌性中的行为改变,且为治疗靶标。
[0165]
参考文献
[0166]
在本技术全文中,多个参考文献描述了本发明有关的现有技术。这些参考文献的公开这里通过引用引入本公开。
[0167]
amir,ruthie e.et al.1999.“rett syndrome is caused by mutations in x-linked mecp2,encoding methyl-cpg-binding protein 2.”nature genetics 23(2):185
–
88.http://www.ncbi.nlm.nih.gov/pubmed/10508514(june 22,2018).
[0168]
armstrong,d d.1997.“review of rett syndrome.”journal of neuropathology and experimental neurology 56(8):843
–
49.http://www.ncbi.nlm.nih.gov/pubmed/9258253(june 22,2018).
[0169]
buchovecky,christie m et al.2013.“a suppressor screen in mecp2 mutant mice implicates cholesterol metabolism in rett syndrome.”nature genetics 45(9):1013
–
20.http://www.ncbi.nlm.nih.gov/pubmed/23892605(march 4,2019).
[0170]
duncan armstrong,dawna.2005.“neuropathology of rett syndrome.”journal of child neurology 20(9):747
–
53.http://www.ncbi.nlm.nih.gov/pubmed/16225830(march 4,2019).
[0171]
gadalla,kamal k.e.et al.2017.“development of a novel aav gene therapy cassette with improved safety features and efficacy in a mouse model of rett syndrome.”molecular therapy-methods&clinical development 5:180
–
90.http://www.ncbi.nlm.nih.gov/pubmed/28497075(june 22,2018).
[0172]
gadalla,kamal ke et al.2013.“improved survival and reduced phenotypic severity following aav9/mecp2 gene transfer to neonatal and juvenile male mecp2 knockout mice.”molecular therapy 21(1):18
–
30.http://www.ncbi.nlm.nih.gov/pubmed/23011033(june 22,2018).
[0173]
garg,s.k.et al.2013.“systemic delivery of mecp2 rescues behavioral and cellular deficits in female mouse models of rett syndrome.”journal of neuroscience 33(34):13612
–
20.http://www.ncbi.nlm.nih.gov/pubmed/23966684(june 22,2018).
[0174]
guy,jacky et al.2001.“a mouse mecp2-null mutation causes neurological symptoms that mimic rett syndrome.”nature genetics 27(3):322
–
26.http://www.ncbi.nlm.nih.gov/pubmed/11242117(june 22,2018).
[0175]
hagberg,b et al.1985.“rett syndrome:criteria for inclusion and exclusion.”brain&development 7(3):372
–
73.http://www.ncbi.nlm.nih.gov/pubmed/
4061772(june 22,2018).
[0176]
l
ü
tjohann,dieter et al.2018a.“identification of correlative shifts in indices of brain cholesterol metabolism in the c57bl6/mecp2 tm1.1bird mouse,a model for rett syndrome.”lipids 53(4):363
–
73.http://www.ncbi.nlm.nih.gov/pubmed/29770459(march 4,2019).
[0177]
l
ü
tjohann,dieter et al.2018b.“identification of correlative shifts in indices of brain cholesterol metabolism in the c57bl6/mecp2 tm1.1bird mouse,a model for rett syndrome.”lipids 53(4):363
–
73.http://www.ncbi.nlm.nih.gov/pubmed/29770459(may 3,2019).
[0178]
na,elisa s,erika d nelson,ege t kavalali,and lisa m monteggia.2013.“the impactof mecp2 loss-or gain-of-function on synaptic plasticity.”neuropsychopharmacology 38(1):212
–
19.http://www.ncbi.nlm.nih.gov/pubmed/22781840(june 22,2018).
[0179]
nagy,gabor,and susan l ackerman.2013.“cholesterol metabolism and rett syndrome pathogenesis.”nature genetics 45(9):965
–
67.http://www.ncbi.nlm.nih.gov/pubmed/23985682(march 4,2019).
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
