1.本发明属于有机合成技术领域,具体涉及一种基于对甲氧基苯甲酸与醋酸铜催化制备[60]富勒烯二氢吡啶-3-酮衍生物的方法及产物。
背景技术:
[0002]
富勒烯特殊的结构以及独特的理化性质,使其一直以来都受到科研工作者的关注。然而,又由于富勒烯本身的全碳笼状结构,导致其基本没有极性,这个特点使富勒烯在水和极性有机溶剂中的溶解度非常差,限制了富勒烯在很多领域的发展和应用。在富勒烯碳骨架上通过化学修饰的方法接上各种官能团,从而实现富勒烯功能化,是研究富勒烯化学的一种重要方法,这种方法可以改变富勒烯的表面结构以及各种理化性质,使其能够更好的应用于其他领域。在之前的报道中,在富勒烯上引入氮杂环结构的例子有很多,例如五元氮杂环富勒烯吡咯烷、富勒烯吡咯啉、富勒烯吲哚啉等,六元氮杂环富勒烯四氢吡啶、富勒烯四氢喹啉等。然而在富勒烯上引入氮氧杂环结构的相关报道却很少。
[0003]
2011年,中国科学技术大学王官武教授课题组研究了钯催化的碳氢活化反应促进的[60]富勒烯与苯甲酰胺的环化反应,得到了富勒烯异喹啉酮衍生物(j.org.chem.2011,76,1599-1604)。(如路线1)
[0004][0005]
2013年,常州大学杨海涛课题组用cui做催化剂,利用空气为氧化剂,使c
60
与脒或酰胺类化合物发生环加成反应,成功制备得到预期产物富勒烯咪唑啉或恶唑啉衍生物(org.lett.2013,15,4650-4653)。(如路线2)
[0006][0007]
2014年,湖北大学李法宝课题组报道了一种利用高氯酸铁金属盐,使c
60
与异氰酸酯/异硫氰酸酯发生反应,简单高效地一步合成出了一系列富勒烯恶唑烷酮/噻唑烷酮衍生
物(rsc adv.2014,4,48085-48094)。(如路线3)
[0008][0009]
到了2019年,王官武教授课题组又实现了c
60
与n-甲氧基-1h-吲哚-1-羧酰胺之间的高效杂环化,合成了c
60
并3,4-二氢嘧啶[1,6-a]吲哚-1(2h)-酮(org.lett.2019,21,8568-8571)。(如路线4)
[0010][0011]
这些合成富勒烯氮氧杂环结构的方法都存在一些局限性,例如反应繁琐,原料不易获得等等,因此进一步探索反应简单,原料便宜易得的富勒烯氮氧杂环结构的合成方法是很有必要的。
技术实现要素:
[0012]
本发明旨在利用[60]富勒烯和芳乙胺衍生物发生反应制备新颖的富勒烯二氢吡啶-3-酮衍生物,提高目标产物的产率,提高产物的选择性。
[0013]
本发明所提供的技术方案如下:
[0014]
一种基于对甲氧基苯甲酸与醋酸铜催化制备[60]富勒烯二氢吡啶-3-酮衍生物的方法,包括以下步骤:
[0015]
以[60]富勒烯和芳乙胺衍生物为原料,以对甲氧基苯甲酸和醋酸铜作为催化剂,以邻二氯苯为溶剂,在空气中油浴加热反应,得到[60]富勒烯二氢吡啶-3-酮衍生物,合成路线为:
[0016][0017]
其中,所述芳乙胺衍生物中的芳香基团为取代或未取代的芳香基团,其取代基选
自以下基团:卤代基、烷氧基、烷基。
[0018]
具体的,芳香基团为苯基,或为噻吩基等具有一个杂原子的五元杂芳环。
[0019]
上述技术方案首次采用芳乙胺衍生物为原料,形成了不同与现有技术的关环的结构。
[0020]
具体的,所述的[60]富勒烯、芳乙胺衍生物、对甲氧基苯甲酸、醋酸铜的投料摩尔比为1:(1~10):(0~10):(0~5)。其中,各物质的用量不为零。
[0021]
具体的,所述的[60]富勒烯、芳乙胺衍生物、对甲氧基苯甲酸、醋酸铜的投料摩尔比为1:5:5:4。
[0022]
具体的,所述溶剂邻二氯苯的用量为6ml。
[0023]
具体的,所述加热反应的反应时间为3~8h。
[0024]
具体的,所述加热反应的加热温度为80~120℃。
[0025]
具体的,对反应后得到的混合产物进行洗脱,得到[60]富勒烯二氢吡啶-3-酮衍生物,所述洗脱剂为二硫化碳或二氯甲烷的一种或者两种的混合。
[0026]
具体的,所述步骤具体为:在反应容器中加入原料[60]富勒烯和芳乙胺衍生物,再加入对甲氧基苯甲酸和醋酸铜作为催化剂,加入溶剂邻二氯苯,并用超声仪超声使反应物和催化剂溶解,将反应物在100℃的恒温下加热并搅拌,反应完成后将反应混合物先通过短硅胶柱粗滤,去除不溶性杂质,溶剂减压蒸出,之后残留物用层析柱层析分离,以二硫化碳为洗脱剂,首先被分离出的是未反应的[60]富勒烯,然后即得[60]富勒烯二氢吡啶-3-酮衍生物。
[0027]
所述反应过程用薄层色谱(tlc)点板跟踪,至反应终点时停止加热,反应终点的判断基于产物不再增加且副产物逐渐增多。
[0028]
本发明还提供了上述制备方法制备得到的[60]富勒烯二氢吡啶-3-酮衍生物。
[0029]
本发明所通过对富勒烯进行化学修饰形成的[60]富勒烯二氢吡啶-3-酮衍生物提高了其在水和极性溶剂中的溶解度;在富勒烯中引入氮氧杂环结构,了增强富勒烯杂环衍生物的得电子能力,可广泛应用于光电材料领域,例如,可作为太阳能电池中提高电导率或光电转化效率的涂层材料。
[0030]
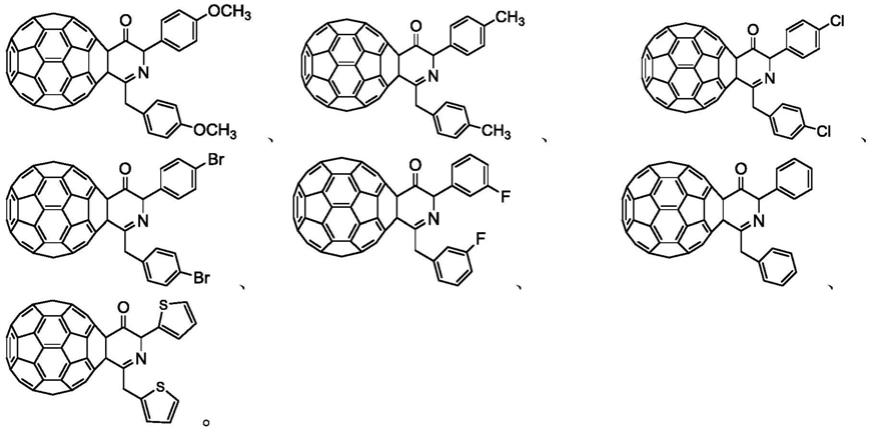
[60]富勒烯二氢吡啶-3-酮衍生物具体包括以下化合物:
[0031]
[0032][0033]
本发明与现有技术中制备富勒烯氮氧杂环的方法相比,具有以下突出优点:
[0034]
1.本发明制备的[60]富勒烯二氢吡啶-3-酮衍生物结构十分新颖,是之前从未报道过的新型富勒烯衍生物;
[0035]
2.反应所使用的原料很简单,且都非常廉价易得;
[0036]
3.反应步骤很简单,只需一步反应就能得到目标产物;
[0037]
4.反应条件温和,节能环保。
附图说明
[0038]
图1是本发明实施例1[60]富勒烯二氢吡啶-3-酮衍生物11h nmr谱;
[0039]
图2是本发明实施例1[60]富勒烯二氢吡啶-3-酮衍生物1
13
c nmr谱;
[0040]
图3是本发明实施例2[60]富勒烯二氢吡啶-3-酮衍生物21h nmr谱;
[0041]
图4是本发明实施例2[60]富勒烯二氢吡啶-3-酮衍生物2
13
c nmr谱;
[0042]
图5是本发明实施例3[60]富勒烯二氢吡啶-3-酮衍生物31h nmr谱;
[0043]
图6是本发明实施例3[60]富勒烯二氢吡啶-3-酮衍生物3
13
c nmr谱;
[0044]
图7是本发明实施例4[60]富勒烯二氢吡啶-3-酮衍生物41h nmr谱;
[0045]
图8是本发明实施例4[60]富勒烯二氢吡啶-3-酮衍生物4
13
c nmr谱;
[0046]
图9是本发明实施例5[60]富勒烯二氢吡啶-3-酮衍生物51h nmr谱;
[0047]
图10是本发明实施例5[60]富勒烯二氢吡啶-3-酮衍生物5
13
c nmr谱;
[0048]
图11是本发明实施例6[60]富勒烯二氢吡啶-3-酮衍生物61h nmr谱;
[0049]
图12是本发明实施例6[60]富勒烯二氢吡啶-3-酮衍生物6
13
c nmr谱;
[0050]
图13是本发明实施例7[60]富勒烯二氢吡啶-3-酮衍生物71h nmr谱;
[0051]
图14是本发明实施例7[60]富勒烯二氢吡啶-3-酮衍生物7
13
c nmr谱;
[0052]
图15是本发明实施例8反应终点时的tlc点板图。
具体实施方式
[0053]
以下对本发明的原理和特征进行描述,所举实施例只用于解释本发明,并非用于限定本发明的范围。
[0054]
实施例1
[0055]
[60]富勒烯二氢吡啶-3-酮衍生物1的制备:
[0056][0057]
具体制备步骤为:
[0058]
将[60]富勒烯(36.0mg,0.05mmol)、4-甲氧基苯乙胺(37μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋酸铜(39.9mg,0.20mmol)加入到圆底烧瓶中。加入6ml的邻二氯苯,用超声仪超声使混合物完全溶解,然后立即将混合液置于温度预设为100℃的油浴中加热搅拌300分钟,反应过程用薄层色谱(tlc)点板跟踪,至点板产物不再增加,原点副产物逐渐增多时停止反应。反应结束后反应混合物通过短硅胶柱粗滤,去除金属盐以及不溶性杂质,溶剂在旋转蒸发仪中减压旋出,残留物用层析柱层析分离,以二硫化碳为洗脱剂,首先被分离出的是未反应的c
60
,然后是[60]富勒烯二氢吡啶-3-酮衍生物1(棕褐色)产率是33%。
[0059]
如图1是[60]富勒烯二氢吡啶-3-酮衍生物1的1h nmr谱图(400mhz,cs2/dmso-d6)δ8.32(d,j=8.7hz,2h),7.40(d,j=8.3hz,2h),7.00(d,j=8.7hz,2h),6.79(d,j=8.3hz,2h),6.37(dd,j=9.9,5.4hz,1h),3.90(s,3h),3.86(dd,j=14.0,5.4hz,1h),3.73(s,3h),3.67(dd,j=13.8,10.2hz,1h);如图2是[60]富勒烯二氢吡啶-3-酮衍生物1的
13
c nmr谱图(125mhz,cs2/dmso-d6)(all 1c unless indicated)δ185.33(c=o),163.32(aryl c),163.15(c=n),157.05(aryl c),152.95,149.58,146.97,146.82,146.23,145.82,145.48,145,35,144.78(2c),144.73,144.70,144.52,144.49,144.41(2c),144.35,144.26,144.22,143.93,143.81(2c),143.78(3c),143.73,143.65,143.55,142.78,142.74,142.71(2c),141.64,141.61,141.22,141.21(2c),141.15,140.91,140.87,140.82,140.77,140.76,140.72,140.49(2c),140.47,140.36,140.34,140.21,138.75,138.47(2c),138.27,134.24,134.17,133.94,132.70,132.04(2c,aryl c),129.45(2c,aryl c),128.74(aryl c),126.78(aryl c),118.08(2c,aryl c),112.84(2c,aryl c),86.25,82.34(sp
3-c of c
60
),73.54(sp
3-c of c
60
),54.90,54.00,41.05.
[0060]
实施例2
[0061]
[60]富勒烯二氢吡啶-3-酮衍生物2的制备:
[0062][0063]
具体制备步骤为:
[0064]
将[60]富勒烯(36.0mg,0.05mmol)、4-甲基苯乙胺(36μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋酸铜(39.9mg,0.20mmol)加入到
indicated)δ186.04(c=o),163.18(c=n),152.90,149.48,146.84,146.63(2c),146.20,145.83,145.71,145.15,145,10,145.07,144.91,144.89,144.84,144.79,144.75,144.70,144.54,144.48,144.33,144.24,144.17(3c),144.12,144.02,143.97,143.89,143.12,143.07,143.03(2c),141.98,141.96,141.58(3c),141.52,141.22,141.16(2c),141.07,141.04,141.00,140.86,140.83,140.73,140.68,140.54,140.08(aryl c),139.12,138.75(3c),135.96,134.72,134.69,134.52,133.07(aryl c),132.70(aryl c),131.75(aryl c),131.52(2c,aryl c),130.27(2c,aryl c),128.09(2c,aryl c),127.69(2c,aryl c),86.02,82.39(sp
3-c of c
60
),73.76(sp
3-c of c
60
),41.32.
[0072]
实施例4
[0073]
[60]富勒烯二氢吡啶-3-酮衍生物4的制备:
[0074][0075]
具体制备步骤为:
[0076]
将[60]富勒烯(36.0mg,0.05mmol)、4-溴苯乙胺(39μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋酸铜(39.9mg,0.20mmol)加入到圆底烧瓶中。加入6ml的邻二氯苯,用超声仪超声使混合物完全溶解,然后立即将混合液置于温度预设为100℃的油浴中加热搅拌320分钟,反应过程用薄层色谱(tlc)点板跟踪,至点板产物不再增加,原点副产物逐渐增多时停止反应。反应结束后反应混合物通过短硅胶柱粗滤,去除金属盐以及不溶性杂质,溶剂在旋转蒸发仪中减压旋出,残留物用层析柱层析分离,以二硫化碳为洗脱剂,首先被分离出的是未反应的c
60
,然后是[60]富勒烯二氢吡啶-3-酮衍生物4(棕褐色)产率是21%。
[0077]
如图7是[60]富勒烯二氢吡啶-3-酮衍生物4的1h nmr谱图(500mhz,cs2/dmso-d6)δ8.27(d,j=8.4hz,2h),7.68(d,j=8.4hz,2h),7.47(d,j=8.3hz,2h),7.43(d,j=8.3hz,2h),6.42(dd,j=10.7,5.1hz,1h),3.92(dd,j=13.8,5.0hz,1h),3.69(dd,j=13.8,11.0hz,1h);如图8是[60]富勒烯二氢吡啶-3-酮衍生物4的
13
c nmr谱图(125mhz,cs2/dmso-d6)(all 1c unless indicated)δ186.33(c=o),163.32(c=n),152.98,149.56,146.93,146.75,146.71,146.32,145.95,145.83,145,27,145.22,145.19,145.01(2c),144.96,144.91,144.87,144.82,144.66,144.59,144.45,144.36,144.30(3c),144.24,144.14,144.07,144.01,143.24,143.19,143.14(2c),142.10,142.08,141.70(3c),141.64,141.34,141.28(2c),141.19,141.16,141.11,140.99,140.96,140.84,140.80,140.65(2c),139.25,138.90,138.87(2c),136.56,134.81(2c),134.64,133.19(2c),131.61(2c,aryl c),131.16(2c,aryl c),130.73(2c,aryl c),130.71(2c,aryl c),129.46(aryl c),120.26(aryl c),86.09,82.49(sp
3-c of c
60
),73.86(sp
3-c of c
60
),41.50.
[0078]
实施例5
[0079]
[60]富勒烯二氢吡啶-3-酮衍生物5的制备:
[0080][0081]
具体制备步骤为:
[0082]
将[60]富勒烯(36.0mg,0.05mmol)、3-氟苯乙胺(33μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋酸铜(39.9mg,0.20mmol)加入到圆底烧瓶中。加入6ml的邻二氯苯,用超声仪超声使混合物完全溶解,然后立即将混合液置于温度预设为100℃的油浴中加热搅拌300分钟,反应过程用薄层色谱(tlc)点板跟踪,至点板产物不再增加,原点副产物逐渐增多时停止反应。反应结束后反应混合物通过短硅胶柱粗滤,去除金属盐以及不溶性杂质,溶剂在旋转蒸发仪中减压旋出,残留物用层析柱层析分离,以二硫化碳为洗脱剂,首先被分离出的是未反应的c
60
,然后是[60]富勒烯二氢吡啶-3-酮衍生物5(棕褐色)产率是18%。
[0083]
如图9是[60]富勒烯二氢吡啶-3-酮衍生物5的1h nmr谱图(500mhz,cs2/dmso-d6)δ8.19-8.17(m,1h),8,12-8.09(m,1h),7.57-7.53(m,1h),7.42-7.38(m,1h),7.36-7.34(m,2h),7.32-7.27(m,1h),6.93-6.89(m,1h),6.48(dd,j=10.8,5.3hz,1h),3.97(dd,j=13.8,5.3hz,1h),3.75(dd,j=13.8,10.8hz,1h);如图10是[60]富勒烯二氢吡啶-3-酮衍生物5的
13
c nmr谱图(125mhz,cs2/dmso-d6)(all 1c unless indicated)δ186.06(c=o),163.00(c=n),161.73(d,jc–f=245.9hz,aryl c),161.40(d,jc–f=245.8hz,aryl c),152.98,149.57,146.83,146.79,146.76,146.31,145.87,145.76,145.20,145.15,145.11,145.00,144.94,144.88,144.83,144.79,144.73,144.63,144.55,144.37,144.30,144.21(3c),144.16,144.12,144.06,143.93,143.19,143.11,143.08(2c),142.02,142.00,141.62(3c),141.55,141.28,141.21(2c),141.13,141.10,141.03,140.90,140.88,140.78,140.74,140.57(2c),140.12(d,jc–f=4.1hz,aryl c),139.12,138.77(2c),138.74,136.40(d,jc–f=2.8hz,aryl c).134.93,134.79,134.62,133.15,129.79(d,jc–f=3.9hz,aryl c),129.20(d,jc–f=7.0hz,aryl c),125.94,124.54,120.53(d,jc–f=21.0hz,aryl c),116.58(d,jc–f=22.4hz,aryl c),115.75(d,jc–f=20.4hz,aryl c),112.80(d,jc–f=21.0hz,aryl c),85.88,82.39(sp
3-c of c
60
),73.84(sp
3-c of c
60
),41.55.
[0084]
实施例6
[0085]
[60]富勒烯二氢吡啶-3-酮衍生物6的制备:
[0086][0087]
具体制备步骤为:
[0088]
将[60]富勒烯(36.0mg,0.05mmol)、苯乙胺(31μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋酸铜(39.9mg,0.20mmol)加入到圆底烧瓶中。加入6ml的邻二氯苯,用超声仪超声使混合物完全溶解,然后立即将混合液置于温度预设为100℃的油浴中加热搅拌300分钟,反应过程用薄层色谱(tlc)点板跟踪,至点板产物不再增加,原点副产物逐渐增多时停止反应。反应结束后反应混合物通过短硅胶柱粗滤,去除金属盐以及不溶性杂质,溶剂在旋转蒸发仪中减压旋出,残留物用层析柱层析分离,以二硫化碳为洗脱剂,首先被分离出的是未反应的c
60
,然后是[60]富勒烯二氢吡啶-3-酮衍生物6(棕褐色)产率是23%。
[0089]
如图11是[60]富勒烯二氢吡啶-3-酮衍生物6的1h nmr谱图(500mhz,cs2/dmso-d6)δ8.34(d,j=7.3hz,2h),7.66(t,j=7.2hz,1h),7.54-7.50(m,4h),7.27(t,j=7.5hz,2h),7.18(t,j=7.4hz,1h),6.44(dd,j=10.2,5.6hz,1h),3.93(dd,j=13.9,5.5hz,1h),3.75(dd,j=13.9,10.3hz,1h);如图12是[60]富勒烯二氢吡啶-3-酮衍生物6的
13
c nmr谱图(125mhz,cs2/dmso-d6)(all 1c unless indicated)δ187.44(c=o),163.42(c=n),153.21,149.81,147.13,147.00,146.72,146.30,145.96,145.83,145,28,145.23,145.19,145.16,145.02,144.97,144.91,144.88,144.83,144.71,144.66,144.45,144.37,144.29(3c),144.26,144.15,144.13,144.02,143.25,143.21,143.17(2c),142.11,142.08,141.70(3c),141.63,141.35(2c),141.29,141.22,141.20(2c),140.97(2c),140.91,140.84,140.76,140.69,139.24,138.96(2c),138.79,137.30(aryl c),134.80,134.74,134.56,134.41,133.56(aryl c),133.20(aryl c),130.04(2c,aryl c),128.89(2c,aryl c),127.89(2c,aryl c),127.76(2c,aryl c),126.06(aryl c),86.39,82.69(sp
3-c of c
60
),74.03(sp
3-c of c
60
),42.29.
[0090]
实施例7
[0091]
[60]富勒烯二氢吡啶-3-酮衍生物7的制备:
[0092][0093]
具体制备步骤为:
[0094]
将[60]富勒烯(36.0mg,0.05mmol)、噻吩-2-乙胺(29μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋酸铜(39.9mg,0.20mmol)加入到圆底烧瓶中。加入6ml的邻二氯苯,用超声仪超声使混合物完全溶解,然后立即将混合液置于温度预设为100℃的油浴中加热搅拌340分钟,反应过程用薄层色谱(tlc)点板跟踪,至点板产物不再增加,原点副产物逐渐增多时停止反应。反应结束后反应混合物通过短硅胶柱粗滤,去除金属盐以及不溶性杂质,溶剂在旋转蒸发仪中减压旋出,残留物用层析柱层析分离,以二硫化碳为洗脱剂,首先被分离出的是未反应的c
60
,然后是[60]富勒烯二氢吡啶-3-酮衍生物7(棕褐色)产率是18%。
[0095]
如图13是[60]富勒烯二氢吡啶-3-酮衍生物7的1h nmr(500mhz,cs2/dmso-d6)δ8.46(d,j=3.6hz,1h),7.93(d,j=5.3hz,1h),7.26-7.22(m,2h),7.17(d,j=2.7hz,1h),6.94(dd,j=5.0,3.5hz,1h),6.44(dd,j=9.9,5.2hz,1h),4.21(dd,j=14.9,5.1hz,1h),3.96(dd,j=14.9,9.9hz,1h);如图14是[60]富勒烯二氢吡啶-3-酮衍生物7的
13
c nmr(125mhz,cs2/dmso-d6)(all 1c unless indicated)δ178.08(c=o),163.31(c=n),152.80,149.10,147.20,146.90,146.86,146.65,145.73,145.61,145,08,145.02,145.00,144.84,144.78,144.73,144.72,144.63,144.60,144.50,144.44,144.29,144.17,144.10,144.08,144.05,144.03,143.94,143.88,143.81,143.05,143.02,142.98,142.93,141.85,141.82,141.49(3c),141.44,141.25,141.19,141.01,141.00,140.95,140.86,140.78(2c),140.61,140.57,140.46(2c),140.03,139.11,139.01,138.64,138.46,138.35,137.10,136.29,134.61,134.52,133.00(aryl c),127.71(aryl c),126.10(aryl c),126.04(aryl c),124.16(aryl c),85.57,81.93(sp
3-c of c
60
),73.61(sp
3-c of c
60
),35.80.
[0096]
实施例8
[0097]
将[60]富勒烯(36.0mg,0.05mmol)、4-甲氧基苯乙胺(37μl,0.25mmol)、对甲氧基苯甲酸(38.0mg,0.25mmol)、一水合醋铜(39.9mg,0.20mmol)加入到圆底烧瓶中。加入6ml的邻二氯苯,用超声仪超声使混合物完全溶解,然后立即将混合液置于温度预设为100℃的油浴中加热搅拌300分钟,反应过程用薄层色谱(tlc)点板跟踪,如图15(tlc板上第一个点为未反应完的c
60
,第二个点为生成的[60]富勒烯二氢吡啶-3-酮衍生物1)。
[0098]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。