1.本发明属于医药化工领域,具体涉及一种脱水淫羊藿素中间体化合物。
背景技术:
2.脱水淫羊藿素(icariin),化学名为3,5,7-三羟基-2-(4-甲氧基苯)-8-(3-甲基丁-2-烯)查尔-4-酮,分子式:c
21h20
o6;分子量:368.13;cas号:118525-40-9,结构式如下:
[0003][0004]
脱水淫羊藿素属于黄酮醇类化合物,普遍存在于植物中,数量众多,结构复杂多样,具有许多重要的生物活性和药理作用。如抗肿瘤、抗癌细胞增殖、抗骨质疏松、调节雌激素、调节神经系统等生物活性。目前主要是通过从植物中提取获取淫羊藿素,但自然界含量较低,且分离纯化较为复杂,限制了在医药领域的发展。脱水淫羊藿素单一化合物的全合成解决了这个问题,为我们下一步计划的临床试验和可能的药物使用提供了保证。
[0005]
现有技术关于全合成淫羊藿素的相关报道较少,中国专利申请cn200610165354.7公开了一种淫羊藿素的合成方法,该路线以山奈酚-4-氧甲醚为起始原料制备得到淫羊藿素,该专利介绍的合成步骤如下:
[0006][0007]
然而在上述方法中,山奈酚-4-氧甲醚的合成需要八步反应,操作较为繁琐。克莱森重排需要微波加热来进行,生产成本高,不利于大规模工业化生产。
[0008]
在2013年3月的《有机化学》中公开了题为“淫羊藿素的合成”的文章,该文章提到
从化合物(3)到化合物(4)的重排过程中,使用三(6,6,7,7,8,8,8,-七氟-2,2-二甲基-3,5-辛二酮)铕做催化剂,收率为42%。上述催化剂价格昂贵且反应收率较低,不利于工业化生产。如何优化或避免克莱森重排成为该合成路线的关键。
[0009]
中国专利申请cn201910220551.1报道了先将异戊烯基通过邻位重排连接到8位碳,随后再进行黄酮骨架的形成系列反应,得到脱水淫羊藿素,该专利介绍的合成步骤如下:
[0010][0011]
该路线虽然反应条件较为温和,但合成路线较长,保护基团的引入和除去较为困难,不利于纯化和工业化生产。
技术实现要素:
[0012]
目前对于淫羊藿类化合物的合成存在很多苦难,如异戊烯基引入困难、保护基难以去除,工艺复杂、催化剂昂贵、副产物多等缺点。本发明以提供了一种新的脱水淫羊藿素中间体化合物及制备方法,该方法在形成黄酮骨架之前,引入异戊烯基,用易除去的苄基做保护基。利用该中间体合成脱水淫羊藿素路线短,收率高,反应条件温和,工艺稳定,适合大量的工业化生产。
[0013]
本发明具体通过如下技术方案实现:
[0014]
本发明第一方面提供了一种新的脱水淫羊藿素中间体化合物,其结构如式iv所示:
[0015][0016]
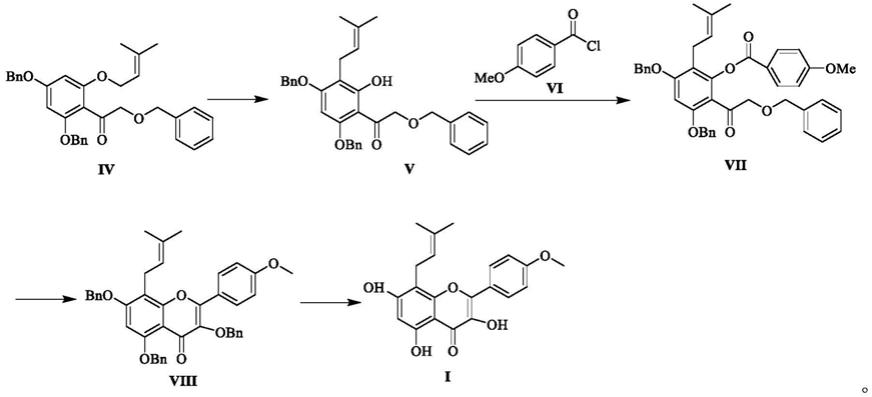
本发明第二方面提供了一种化合物iv的制备方法,包括如下步骤:
[0017]
将化合物ii、化合物iii、碱及有机溶剂a加入反应瓶中,搅拌溶解,控温搅拌反应,检测反应完全后得到化合物iv,合成路线如下:
[0018][0019]
优选地,所述的碱选自碳酸铯、氢氧化钾、氢氧化钠、碳酸钾、叔丁醇钾中的一种,其中特别优选碳酸铯。
[0020]
优选地,所述的化合物ii、化合物iii和碱的投料摩尔比为1:1.0~1.8:1.0~2.0,其中特别优选1:1.2:1.1。
[0021]
优选地,所述的有机溶剂a选自四氢呋喃、丙酮、乙腈、甲苯、二甲苯中的一种或其组合。
[0022]
优选地,所述的反应温度为50~100℃,其中特别优选80℃~85℃。
[0023]
在一优选方案中,反应结束后需进行后处理操作,具体的为:反应液加入纯化水和萃取剂,分液,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得化合物iv;所述萃取剂为乙酸乙酯、二氯甲烷、三氯甲烷中的一种或其组合。
[0024]
本发明第三方面提供一种化合物iv用于制备脱水淫羊藿素的用途。
[0025]
化合物iv用于制备脱水淫羊藿苷素的方法,包括如下方案:中间体iv在催化剂作用下得到中间体v;中间体v与化合物vi在碱性的作用下得到化合物vii;化合物vii在碱性条件下发生合环反应,得到中间体viii;中间体viii发生还原反应,脱掉苄基,得到脱水淫羊藿素,其合成路线如下:
[0026][0027]
优选地,在以下部分进一步详细的描述以上步骤:
[0028]
化合物v的制备
[0029]
化合物v的制备方法如下步骤:将化合物iv、催化剂及有机溶剂b加入到反应瓶中,室温搅拌至反应结束,反应经后处理得化合物v;
[0030]
优选地,所述催化剂选自三氟甲磺酸铋、三氟甲磺酸镱、三氟甲磺酸钪、三氟甲磺酸铕中的一种,其中特别优选三氟甲磺酸铋。
[0031]
优选地,所述的化合物iv、催化剂的投料摩尔比为1:0.05~0.2,其中特别优选1:0.1。
[0032]
优选地,所述的有机溶剂为b四氢呋喃、乙腈、丙酮、甲苯、二氯甲烷中的一种或其组合。
[0033]
在一优选方案中,反应结束后需进行后处理操作,具体的为:反应液加入纯化水中,加入萃取剂,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得中间体
ⅴ
;所述萃取剂为乙酸乙酯、二氯甲烷、三氯甲烷中的一种或其组合。
[0034]
化合物vii的制备
[0035]
将化合物v,化合物vi、碱及有机溶剂加入到反应瓶中,加热回流至反应结束得到中间体化合物vii;
[0036]
优选地,所述的碱选自三乙胺、氢氧化钾、氢氧化钠、碳酸钾、碳酸铯、叔丁醇钾、甲醇钠中的一种,其中特别优选三乙胺。
[0037]
优选地,所述化合物v、化合物vi、碱的投料摩尔比为1:1.0~2.0:1.0~2.0,其中特别优选1:1.3:1.5。
[0038]
优选地,所述的有机溶剂c选自丙酮、四氢呋喃、乙腈、二氯甲烷、环己烷中的一种或其组合。
[0039]
在一优选方案中,反应结束后需进行后处理操作,具体的为:反应液冷却至室温,加入纯化水及萃取剂,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩后所得固体加入乙醇中重结晶得化合物vii;所述萃取剂为乙酸乙酯、二氯甲烷、三氯甲烷中的一种或其组合。
[0040]
化合物viii的制备
[0041]
将化合物vii、碱及有机溶剂d加入到反应瓶中,加热搅拌,检测反应完全后停止加
热,得到化合物viii;
[0042]
优选地,所述的碱选自氢氧化钾、氢氧化钠、碳酸钾、碳酸铯、叔丁醇钾中的一种,其中特别优选氢氧化钾。
[0043]
优选地,所述的化合物vii、碱的投料摩尔比为1:1.0~2.0,其中特别优选1:1.5。
[0044]
优选地,所述的溶剂d选自吡啶、n,n-二乙基苯胺、n-甲基吡咯烷酮中的一种或其组合。
[0045]
优选地,所述的反应温度为60℃~110℃,特别优选80℃~85℃。
[0046]
在一优选方案中,反应结束后需进行后处理操作,具体的为:反应液冷却至室温,加入萃取剂,收集有机相,有机相减压浓缩后经乙酸乙酯/正己烷(体积比1:3)重结晶得化合物viii;所述萃取剂为乙酸乙酯、二氯甲烷、三氯甲烷中的一种或其组合。
[0047]
脱水淫羊藿素的制备
[0048]
将化合物viii,催化剂及有机溶剂e加入到反应瓶中,向瓶中通入氢气,控温搅拌反应,检测反应完全后停止搅拌,得到脱水淫羊藿素。
[0049]
优选地,所述的催化剂选自钯碳、氢氧化钯、醋酸钯中的一种,其中特别优选钯碳。
[0050]
优选地,所述的化合物viii和催化剂的投料摩尔比为1:0.05~0.2,其中特别优选1:0.10
[0051]
优选地,所述的有机溶剂e选自甲醇、乙醇、丙酮、四氢呋喃、乙腈、二氯甲烷、1,4-二氧六环中的一种或其组合。
[0052]
优选地,所述的反应温度为20℃~60℃
[0053]
在一优选方案中,反应结束后需进行后处理操作,具体的为:反应液抽滤,收集有机相,有机相加入纯化水及萃取剂,收集有机相用无水硫酸钠干燥,有机相减压浓缩所得固体经甲醇重结晶后得脱水淫羊藿素;所述萃取剂为乙酸乙酯、二氯甲烷、三氯甲烷中的一种或其组合。
[0054]
本发明取得的有益效果:
[0055]
1、本发明以提供了一种新的脱水淫羊藿素中间体化合物及制备方法,以该新中间体制备脱水淫羊藿素反应路线短、收率高。
[0056]
2、本发明提供的脱水淫羊藿素的制备方法在形成黄酮骨架之前,引入异戊烯基提高了异戊烯基的选择性;化合物vii在碱性条件下发生合环反应,得到中间体viii,避免现有技术需要导向基团及预先活化反应位点等复杂操作。
具体实施方式
[0057]
下面通过实施例来进一步说明本发明。应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属本发明要求保护的范围。
[0058]
对本发明得到的化合物结构确证:
[0059][0060]
化合物iv的高分辨质谱:esi-hrms:m/z=523.6212[m h]
,1h-nmr(400mhz,cdcl3):δ7.30-7.46(m,15h),6.21-6.32(m,2h),5.39(t,j=6.8hz,1h),5.14-5.12(m,4h),4.82(d,j=3.6hz,2h),4.68-4.62(m,4h),1.82(t,j=3.2hz,2h);
13
c-nmr(400mhz,cdcl3)δ198.1,163.2,137.3,136.7,128.1,127.5,100.8,93.6,79.7,95.4,70.2,64.0,24.1,18.2.
[0061][0062]
化合物v的高分辨质谱:esi-hrms:m/z=523.2402[m h]
,1h-nmr(400mhz,cdcl3):δ12.12(s,1h),7.32-7.11(m,15h),6.24(s,1h),5.61(t,j=6.8hz,1h),5.16(s,4h),4.81(d,j=6.2hz,2h),4.61(s,2h),3.33(d,j=4.8hz,2h),1.82-1.73(m,6h);
13
c-nmr(100mhz,cdcl3)δ165.1,162.2,137.2,131.2,128.9,127.1,123.2,70.2,24.6,21.9,18.6.
[0063][0064]
化合物vii的高分辨质谱:esi-hrms:m/z=657.2772[m h]
,1h-nmr(400mhz,cdcl3):δ8.12-8.09(m,2h),7.30-7.50(m,15h),8.89-8.83(m,2h),8.58(s,1h),5.72(t,j=6.8hz,1h),5.18-5.16(m,4h),4.80-4.76(m,4h),3.83(t,j=4.8hz,3h),3.33-3.29(m,2h);1.82-1.73(m,6h);
13
c-nmr(100mhz,cdcl3)δ198.1,165.2,159.2,157.2,138.9,131.1,123.2,128.2,122.6,113.2,104.2,97.3,79.2,71.3,57.2,21.5.
[0065][0066]
化合物viii的高分辨质谱:esi-hrms:m/z=639.6213[m h]
,1h-nmr(400mhz,
cdcl3):δ7.52-7.29(m,17h),6.82-6.71(m,2h),6.32(s,1h),5.72(t,j=6.8hz,1h),5.22-4.96(m,6h),3.81(s,3h),3.34-3.12(m,2h),1.82-1.71(m,6h);
13
c-nmr(100mhz,cdcl3)δ175.1,168.2,159.2,157.2,138.9,132.1,129.1,122.1,115.2,110.2,95.2,72.1,53.2,22.3,11.3.
[0067][0068]
化合物i的高分辨质谱:esi-hrms:m/z=368.1263[m h]
,1h-nmr(400mhz,cdcl3):δ12.36(s,1h),10.86(s,1h),9.49(s,1h,),8.14(d,j=9.0hz,2h),7.13(d,j=9.1hz),6.30(s,1h),5.18(t,j=6.8hz),3.85(s,3h,),3.44(d,j=6.7hz),1.76(s,3h),1.53(s,3h);
13
c-nmr(100mhz,cdcl3):δ176.6,161.4,160.7,158.5,153.9,146.5,136.4,131.5,129.6,124.1,122.9,114.6,106.1,103.6,98.3,55.9,25.3,21.8,18.4.
[0069]
化合物iv的制备
[0070]
实施例1
[0071]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(55.14g,0.37mol),碳酸铯(110.78g,0.34mol)和1000ml甲苯,搅拌溶解,80℃~85℃反应6小时,反应液缓慢降温至室温,加入600ml纯化水和500ml乙酸乙酯,剧烈震荡后静置,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率90.1%,hplc纯度99.78%。
[0072]
实施例2
[0073]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(46.20g,0.31mol),氢氧化钾(19.08g,0.34mol)和500ml甲苯,搅拌溶解,50℃~55℃反应6小时,反应液缓慢降温至室温,加入400ml纯化水和300ml乙酸乙酯,剧烈震荡后静置,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率87.3%,hplc纯度99.36%。
[0074]
实施例3
[0075]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(83.46g,0.56mol),碳酸钾(46.99g,0.34mol)和500ml对二甲苯,搅拌溶解,95℃~100℃反应6小时,反应液缓慢降温至室温,加入400ml纯化水和400ml乙酸乙酯,剧烈震荡后静置,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率86.9%,hplc纯度99.28%。
[0076]
实施例4
[0077]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(92.40g,0.62mol),叔丁醇钾(76.30g,0.68mol)和500ml甲苯,搅拌溶解,100℃~105℃反应4小时,反应液缓慢降温至室温,加入500ml纯化水和600ml乙酸乙酯,剧烈震荡后静置,收集有机相,有机相用无
水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率81.5%,hplc纯度98.82%。
[0078]
实施例5
[0079]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(55.14g,0.37mol),碳酸铯(101.0g,0.31mol)和1000ml四氢呋喃,搅拌溶解,55℃~60℃反应6小时,反应液缓慢降温至室温,加入600ml纯化水和500ml二氯甲烷,剧烈震荡后静置,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率88.7%,hplc纯度99.53%。
[0080]
实施例6
[0081]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(55.14g,0.37mol),碳酸铯(202.0g,0.62mol)和1200ml乙腈,搅拌溶解,75℃~80℃反应6小时,反应液缓慢降温至室温,加入600ml纯化水和600ml三氯甲烷,剧烈震荡后静置,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率86.9%,hplc纯度99.38%。
[0082]
实施例7
[0083]
向三口瓶中加入中间体ii(142.00g,0.31mol),化合物iii(55.14g,0.37mol),碳酸铯(221.56g,0.68mol)和1300ml丙酮,搅拌溶解,45℃~50℃反应6小时,反应液缓慢降温至室温,加入600ml纯化水和600ml三氯甲烷,剧烈震荡后静置,收集有机相,有机相用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得白色固体粉末状化合物iv,收率82.3%,hplc纯度98.64%。
[0084]
化合物v的制备
[0085]
实施例8
[0086]
向三口瓶中加入化合物iv(132.21g,0.25mol),三氟甲磺酸铋(16.40g,0.025mol),500ml二氯甲烷,室温搅拌至反应结束,向其中加入500ml纯化水和500ml乙酸乙酯,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得黄色固体化合物v,收率88.3%,hplc纯度99.61%。
[0087]
实施例8
[0088]
向三口瓶中加入化合物iv(132.21g,0.25mol),三氟甲磺酸铋(8.20g,0.0125mol),400ml四氢呋喃,室温搅拌至反应结束,向其中加入300ml纯化水和300ml二氯甲烷,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得黄色固体化合物v,收率84.6%,hplc纯度99.38%。
[0089]
实施例9
[0090]
向三口瓶中加入化合物iv(132.21g,0.25mol),三氟甲磺酸镱(31.01g,0.05mol),500ml乙腈,室温搅拌至反应结束,向其中加入500ml纯化水和500ml二氯甲烷,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得黄色固体化合物v,收率85.2%,hplc纯度99.32%。
[0091]
实施例10
[0092]
向三口瓶中加入化合物iv(132.21g,0.25mol),三氟甲磺酸钪(3.69g,0.0075mol),300ml丙酮,室温搅拌至反应结束,向其中加入300ml纯化水和300ml三氯甲烷,
剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得黄色固体化合物v,收率79.8%,hplc纯度98.95%。
[0093]
实施例11
[0094]
向三口瓶中加入化合物iv(132.21g,0.25mol),三氟甲磺酸铕(32.95g,0.055mol),500ml丙酮,室温搅拌至反应结束,向其中加入400ml纯化水和400ml三氯甲烷,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩得黄色固体化合物v,收率80.2%,hplc纯度98.99%。
[0095]
化合物vii的制备
[0096]
实施例12
[0097]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(37.53g,0.22mol),三乙胺(26.31g,0.26mol)和500ml四氢呋喃,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入500ml乙酸乙酯和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率92.1%,hplc纯度99.96%。
[0098]
实施例13
[0099]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(29.0g,0.17mol),氢氧化钾(14.59g,0.26mol)和500ml四氢呋喃,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入500ml乙酸乙酯和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率88.6%,hplc纯度99.71%。
[0100]
实施例14
[0101]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(58.0g,0.34mol),碳酸钾(35.93g,0.26mol)和500ml四氢呋喃,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入500ml乙酸乙酯和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率89.2%,hplc纯度99.58%。
[0102]
实施例15
[0103]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(64.82g,0.38mol),叔丁醇钾(42.64g,0.38mol)和500ml四氢呋喃,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入500ml二氯甲烷和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率84.8%,hplc纯度98.88%。
[0104]
实施例16
[0105]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(37.53g,0.22mol),三乙胺(17.20g,0.17mol)和500ml乙腈,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入500ml三氯甲烷和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率88.3%,hplc纯度99.55%。
[0106]
实施例16
[0107]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(37.53g,0.22mol),三乙胺(34.40g,0.34mol)和500ml二氯甲烷,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入200ml二氯甲烷和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率87.8%,hplc纯度99.42%。
[0108]
实施例17
[0109]
向三口瓶中加入中间体v(88.85g,0.17mol),化合物vi(37.53g,0.22mol),甲醇钠(20.53g,0.38mol)和500ml环己烷,搅拌溶解,回流5小时,停止加热,缓慢降温至室温。加入400ml乙酸乙酯和500ml纯化水,剧烈震荡后静置,收集有机相,用无水硫酸钠干燥,过滤除去干燥剂,减压浓缩,所得固体经300ml无水乙醇重结晶得黄色固体化合物vii,收率84.4%,hplc纯度98.82%。
[0110]
化合物viii的制备
[0111]
实施例18
[0112]
向三口瓶中加入中间体vii(98.52g,0.15mol),氢氧化钾(12.90g,0.23mol)和500mln-甲基吡咯烷酮,80℃~85℃反应7小时,停止加热,缓慢降温至室温。加入500ml乙酸乙酯和500ml纯化水,剧烈震荡后静置,收集有机相,有机相减压浓缩,所得固体经乙酸乙酯/正己烷(体积比=1:3,400ml)重结晶得黄色固体化合物viii,收率98.4%,hplc纯度99.62%。
[0113]
实施例19
[0114]
向三口瓶中加入中间体vii(98.52g,0.15mol),碳酸钾(20.73g,0.15mol)和500ml吡啶,60℃~65℃反应7小时,停止加热,缓慢降温至室温。加入500ml乙酸乙酯和500ml纯化水,剧烈震荡后静置,收集有机相,有机相减压浓缩,所得固体经乙酸乙酯/正己烷(体积比=1:3,400ml)重结晶得黄色固体化合物viii,收率94.2%,hplc纯度99.41%。
[0115]
实施例20
[0116]
向三口瓶中加入中间体vii(98.52g,0.15mol),碳酸铯(97.74g,0.30mol)和500ml n,n-二乙基苯胺,105℃~110℃反应7小时,停止加热,缓慢降温至室温。加入500ml二氯甲烷和500ml纯化水,剧烈震荡后静置,收集有机相,有机相减压浓缩,所得固体经乙酸乙酯/正己烷(体积比=1:3,400ml)重结晶得黄色固体化合物viii,收率95.4%,hplc纯度99.35%。
[0117]
实施例21
[0118]
向三口瓶中加入中间体vii(98.52g,0.15mol),叔丁醇钾(37.03g,0.33mol)和400ml n,n-二乙基苯胺,55℃~60℃反应7小时,停止加热,缓慢降温至室温。加入500ml三氯甲烷和500ml纯化水,剧烈震荡后静置,收集有机相,有机相减压浓缩,所得固体经乙酸乙酯/正己烷(体积比=1:3,400ml)重结晶得黄色固体化合物viii,收率91.2%,hplc纯度98.85%。
[0119]
脱水淫羊藿素的制备
[0120]
实施例22
[0121]
向三口瓶中加入化合物viii(70.26g,0.11mol),5%钯碳(21.2g,0.01mol)及200ml甲醇,通入氢气,40℃~45℃反应5小时,抽滤,滤液加入200ml纯化水及200ml乙酸乙
酯,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率94.6%,hplc纯度99.87%。
[0122]
实施例23
[0123]
向三口瓶中加入化合物viii(70.26g,0.11mol),氢氧化钯(1.54g,0.011mol)及200ml乙醇,通入氢气,45℃~50℃反应5小时,抽滤,滤液加入200ml纯化水及200ml乙酸乙酯,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率92.4%,hplc纯度99.72%。
[0124]
实施例24
[0125]
向三口瓶中加入化合物viii(70.26g,0.11mol),醋酸钯(2.47g,0.011mol)及200ml1,4-二氧六环,通入氢气,35℃~40℃反应5小时,抽滤,滤液加入200ml纯化水及200ml二氯甲烷,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率92.9%,hplc纯度99.68%。
[0126]
实施例25
[0127]
向三口瓶中加入化合物viii(70.26g,0.11mol),5%钯碳(11.71g,0.006mol)及200ml丙酮,通入氢气,20℃~25℃反应5小时,抽滤,滤液加入200ml纯化水及200ml乙酸乙酯,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率90.4%,hplc纯度99.66%。
[0128]
实施例26
[0129]
向三口瓶中加入化合物viii(70.26g,0.11mol),5%钯碳(46.82g,0.022mol)及300ml四氢呋喃,通入氢气,55℃~60℃反应5小时,抽滤,滤液加入300ml纯化水及300ml乙酸乙酯,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率91.1%,hplc纯度99.58%。
[0130]
实施例27
[0131]
向三口瓶中加入化合物viii(70.26g,0.11mol),5%钯碳(7.02g,0.0033mol)及200ml乙腈,通入氢气,60℃~65℃反应5小时,抽滤,滤液加入300ml纯化水及300ml乙酸乙酯,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率86.3%,hplc纯度98.92%。
[0132]
实施例28
[0133]
向三口瓶中加入化合物viii(70.26g,0.11mol),5%钯碳(58.53g,0.0275mol)及300ml二氯甲烷,通入氢气,15℃~20℃反应6小时,抽滤,滤液加入300ml纯化水及300ml三氯甲烷,搅拌分层后收集有机层,有机层经无水硫酸钠钠干燥后浓缩至干,加入300ml甲醇重结晶,得到黄色固体脱水淫羊藿素,收率85.6%,hplc纯度99.38%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。