1.本发明属于医药技术领域,具体涉及一种含取代芳基脲亚胺基二芳基嘧啶类衍生物及其制备方法和用途。
背景技术:
2.聚腺苷酸二磷酸核糖聚合酶(poly adp-ribose polymerase,parp)广泛存在于真核细胞。存在至少17种亚型,其中parp-1和parp-2具有dna结合域。parp-1是最早发现而且研究最多的亚型,在parp家族中发挥着约85%的功能。parp-1含有1014个氨基酸,相对分子质量是116kda,包含三个结构域:n端的dna结合域、c端的催化域和中间的自修饰域。parp-1是一种由dna断裂激活的核酶,通过在dna损伤部位催化形成聚合物(poly(adp)核糖基化)来介导dna损伤的ber修复,与多种恶性肿瘤发生发展有密切关系1。研究表明,相比正常细胞,未经治疗患者的肿瘤细胞的parp-1表达明显升高,而经化疗的患者的肿瘤细胞升高趋势更明显。因此,抑制parp-1酶活性则可阻断dna修复,增加化疗药物的敏感性。parp-1抑制剂与细胞毒化疗药物联合应用,为肿瘤治疗提供了新的思路,是抗肿瘤治疗的新靶点。研究表明parp参与hiv对细胞的感染。在hiv-1生命周期中的一个重要环节是病毒dna在整合酶作用下进入宿主细胞基因组。该过程需要dna双链缺口,因此可能导致后来的聚腺苷二磷酸核糖聚合酶(parp)活性激活。parp是抑制hiv-1的潜在靶点。
3.parp-1抑制剂(parpi)的化学结构类型多样,有很多种药物处于临床试验阶段,其中代表性的药物根据基本结构特征包括苯并咪唑甲酰胺类(1)、酞嗪酮类(2)、三环吲哚内酰胺类(3)、吲唑甲酰胺类(4)、咔唑二酰亚胺类(5)和烟酰胺类似物(6)。目前已经有六种parp抑制剂在中国获批上市,分别是奥拉帕利(olaparib azd2281,ku0059436,2)、卢卡帕利(rucaparib,3)、尼拉帕利(niraparib,4)、他拉唑帕尼(talazoparib,7)、氟唑帕利(fluzoparib,8)以及帕米帕利(pamiparib,9)(图1)。奥拉帕利(2)作为2014年底首个被fda批准上市的parp-1抑制剂含有具有酞嗪酮类的基本结构母核和具有一定张力的环丙烷侧链,主要是通过参与dna缺陷修复途径来杀灭肿瘤细胞2。该化合物对parp-1和parp-2的抑制活性(ic
50
)分别为5和1nm,可口服,是一种自噬(autophagy)和线粒体自噬(mitophagy)激活剂,该药结构稳定性差,在体内易被代谢开环。尼拉帕利被(6)美国fda于2017年3月批准用于复发性上皮性卵巢、输卵管或原发性腹膜癌的成年患者的维持治疗,是美国fda批准的首个无需brca突变或其它生物标志物检测就可用于治疗的parp抑制剂,该药通过抑制parp1和parp2导致癌细胞凋亡来发挥作用,是一种口服的高生物利用率和高选择性的parp抑制剂。氟唑帕利(8)是于2020年12月14日由恒瑞医药获国家药品监督管理局批准上市,是首个国产parp抑制剂,该药是通过抑制brca1/2功能异常细胞中的dna修复过程,诱导细胞周期阻滞,进而抑制肿瘤细胞增殖。氟唑帕利的三氟甲基结构封闭了代谢部位,对cyp酶等代谢酶的活性影响较小,与其它药物联用不易产生相互作用,保证了稳定药效和安全性。2021年5月获批的帕米帕利(9)是一种parp-1和parp-2的强效、选择性抑制剂,通过抑制肿
瘤细胞dna单链损伤的修复和同源重组修复缺陷,来诱导肿瘤细胞死亡,尤其对携带brca基因突变的dna修复缺陷型肿瘤细胞敏感度高。
4.一些具有代表性的parp-1抑制剂的结构如下所示:
[0005][0006]
由于parp-1与parp-2催化域的结构相似,目前研发都是parp-1抑制剂,且其选择性差,对parp-1和parp-2均有抑制作用。另一方面,对于正常细胞来说dna正常修复功能还需保持,才能保持生命的活力,因此在使用抗肿瘤药物parpi来使肿瘤细胞合成致死的同时,也需要对正常生命的细胞的活性的进行保持和激活。因此,设计和研发具有高选择性的parp-1抑制剂(parp-1inhibitors)和激动剂(parp-1agonists)都具有重要的研究意义和临床应用价值。
技术实现要素:
[0007]
本发明的目的在于提出一种含取代芳基脲亚胺基二芳基嘧啶类衍生物及其制备方法和用途。
[0008]
为达上述目的,本发明将传统parpi结构中的常见吡啶甲酰胺或苯甲酰胺的基本结构母核部分保留,并将酰胺基本结构单元反转其取代基的排列方向,设计为尿素结构的类似物,并使用嘧啶环替代原来大多数分子结构中的含氮杂环,以保证分子结构中具有一定数量的氮原子,以便分子和靶标蛋白活性口袋内壁的氨基酸残基之间形成氢键相互作用,并利用苯环上的取代基的种类和取代位点来调节化合物对目标蛋白的亲和能力,设计目标化合物分子结构的基本思想如下:
[0009][0010]
本发明提供的含取代芳基脲亚胺基二芳基嘧啶类衍生物,记为zfi,具有如下结构式:
[0011][0012]
其中,r独立选自氢、甲基、氰基、硝基、甲氧基、乙氧基、羟基、卤素,取代位置可以是邻位、对位或者间位;x为卤素等。
[0013]
本发明还包括所述含取代芳基脲亚胺基二芳基嘧啶类衍生物的药用盐,其水合物和溶剂化物,其多晶和共晶,其同样生物功能的前体和衍生物。
[0014]
本发明中,所述含取代芳基脲亚胺基二芳基嘧啶类衍生物的药用盐,包括盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、醋酸盐、甲磺酸盐、对甲苯磺酸盐、酒石酸盐、柠檬酸盐、富马酸盐或苹果酸盐。
[0015]
本发明还提出含取代芳基脲亚胺基二芳基嘧啶类衍生物的制备方法,具体合成路线如下
[0016][0017]
合成的具体步骤如下:
[0018]
(1)2-(4-氰基苯胺基)-4-氯-嘧啶(10,1.0~1.1equiv.)与2-卤代苯乙腈(11,1.0~1.1equiv)在氢化钠(60%)的作用下,于n,n-二甲基甲酰胺中进行亲核取代反应,将控制温度为-10℃至室温,在无水无氧条件下得到中间体cyan-ch
2-dapys(12);
[0019]
(2)上述中间体cyan-ch
2-dapys(12)不稳定,将其置于空气中,室温条件下,反应大40~48h之后,即可缓慢氧化得到关键中间体氧代亚甲基取代双芳基嘧啶类化合物(13);
[0020]
(3)在制备中间体13的同时,从各种取代苯胺出发制备中间体18;具体步骤如下:取代苯胺(14a-14t,1.0~1.1equiv.)溶于四氢呋喃中,同时将nahco3(1.2~1.4equiv.)溶
于水中,将nahco3水溶液与取代苯胺的四氢呋喃溶液混合并置于冰浴中,温度稳定为0℃后加入氯甲酸苯酯(15,1.2~1.4equiv.),反应很快即可完成,用乙酸乙酯萃取旋蒸,即得各种在室温下稳定存在的取代氨基甲酸苯酯中间体(16a-16t)3;将取代的氨基甲酸苯酯中间体(16a-16t,1.0~1.1equiv.)溶于乙腈中,加入80%水合肼(17,2.5~3.0equiv.),超声室温反应1~3h,得相应的取代氨基脲(18a-18t);
[0021]
(4)最后将等当量的氧代亚甲基取代双芳基嘧啶类化合物中间体(13,1.0~1.1equiv.)与取代氨基脲中间体(18a-18t,1.0~1.1equiv.)在盐酸作催化剂条件下,于乙醇中加热回流脱水,即可得到相应的目标化合物(zfia-zfiv),共22种。
[0022]
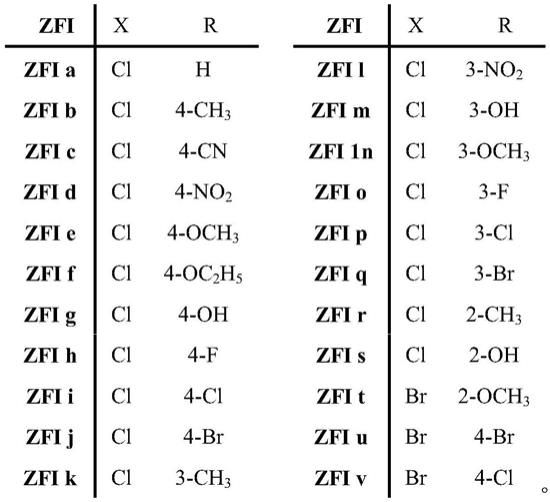
步骤(3)中的取代苯胺(14a-14t)、取代氨基甲酸苯酯(16a-16t)、取代氨基脲(18a-18t),以及步骤(4)中的目标化合物(zfia-zfiv),对应的r、x,具体如下:
[0023][0024][0025]
其中,取代基对映的编号(a~v)分别对映着各个系列中间体(14,16,18)和相应系列目标化合物(zfia~zfiv),中间体编号和取代基类型编号相互组合,分别代表相应的化合物各种编号,如中间体(14a~v,16a~v,18a~v)和目标化合物(zfia~zfiv)。
[0026]
本发明的目标化合物可以作为parp-1表达异常的选择性调节剂,具有较为精细的可调节活性,通过改变化合物结构中的部分取代基的种类和取代位置,可以对parp-1的生物酶活性进行细微调节,可抑制,也可适当激活;细胞水平评价其细胞毒性较小。具体情况分析如下,在芳香环上用闲位-羟基取代可以抑制parp-1的活性,而采用邻位-甲氧基取代则可以适当激活parp-1的活性。其它取代基的调节情况可以参见图1所示(当
△
tm为正值时可用作抑制调节,而当
△
tm为负值时则可用作激活调节)。
[0027]
本发明还涉及一种药物组合物,该组合物含有有效剂量的上述化合物和相关的药用载体,以及所述化合物或组合物在制备预防和治疗艾滋病药物中的应用。
附图说明
[0028]
图1为parp-1与目标化合物相互作用的
△
tm变化图。
[0029]
图2为化合物zfim与化合物zfit的化学结构对比。
[0030]
图3为化合物zfim(左)和化合物zfit(右)与parp-1(3goy)结合口袋氨基酸残基的相互作用模式:其中,(a)是zfim与parp-1结合口袋氨基酸残基的相互作用模式的化合物侧
视图,(b)是化合物zfit与parp-1结合口袋氨基酸残基的相互作用模式的化合物侧视图,(c)是化合物zfim与parp-1结合口袋氨基酸残基的相互作用模式的化合物平视图,(d)是化合物zfit与parp-1结合口袋氨基酸残基的相互作用模式的化合物平视图。
具体实施方式
[0031]
通过下述实施实例可以更好地理解本发明内容,但是不能限制本发明的内容。
[0032]
实施例1:2-卤代苯基2-(4-氰基苯氨基)-嘧啶酮(13)的制备
[0033]
2-(4-氰基苯胺基)-4-氯尿嘧啶(10,2.77g,12.0mmol)与邻卤代苯乙腈(11a,11b,2.73g/3.53g,18.0mmol)在nah(0.96g,24.0mmol,60%)存在下无水dmf(30ml)作溶剂发生芳香亲核取代反应,得2-(对氰基苯氨基)-4-(2-卤代苯基氰基)亚甲基嘧啶中间体(12a,12b)。该反应对空气敏感,需要氮气保护,并且无水条件要求较高,dmf需用活化分子筛干燥过夜后使用。2-(对氰基苯氨基)-4-(2-氯苯基氰基)亚甲基嘧啶(12a,12b)不稳定,去除氮气保护,在空气中氧化即得2-(对氰基苯氨基)-4-芳酰基嘧啶(13a,13b)。该步反应为整个合成中的限速反应,耗时较长,且副反应较多,反应不易控制。反应48-72h后,tlc显示反应完全。将反应液倒入水中,用稀盐酸中和至中性,后以乙酸乙酯萃取,将乙酸乙酯层合并并且用无水硫酸钠干燥并旋蒸除去,得到的粗品经快速减压柱层析(pe:ea=5:1),得纯品2-卤代苯基2-(4-氰基苯氨基)-嘧啶酮(13a,13b)。
[0034]
各种取代的氨基脲的合成
[0035]
本文采用以各种取代的苯胺为起始原料,经过两步得到取代氨基脲。该路线简单易行,条件温和,而且经济高效,产率高,纯度高。
[0036]
将各种取代苯胺(14a-14t,1.86~3.44g,20.0mmol)溶于四氢呋喃中,同时将nahco3(2.0g,24.0mmol)溶于水中,将nahco3水溶液与取代苯胺的四氢呋喃溶液混合并置于冰浴中,温度稳定为0℃后加入氯甲酸苯酯(15,3.8g,24.0mmol)。反应速度极快,反应物加入后即可完成。由于取代的氨基甲酸苯酯中间体在反应液中不稳定,反应过程中温度要控制在0℃,以防中间体分解,影响产率和纯度。后处理过程简单,用乙酸乙酯萃取后旋蒸即得各种取代的氨基甲酸苯酯中间体,该中间体在室温下稳定3。
[0037]
将取代的氨基甲酸苯酯中间体(16a-16t,2.13~2.92g,10.0mmol)溶于乙腈中,加入80%水合肼(17,1.6g,25.0mmol),超声室温反应1~3h,得相应的取代氨基脲(18a-18t),具体的实验数如表1所示。
[0038]
表1.各种中间体取代氨基脲18a-18t的物理性质和产率
[0039][0040][0041]
实施例2:paari目标物zfia-zfiv的合成
[0042]
将取代氨基脲(18a-t,0.23~0.35g,1.5mmol)与2-氯苯基2-(4-氰基苯氨基)-嘧啶酮(13a,13b,0.50g/0.57g,1.5mmol)溶于无水乙醇(10.0ml)中,加入浓盐酸(2~3滴)为催化剂,升温回流4~5.5h。反应过程中有淡黄色固体析出,薄层色谱显示反应完全,过滤。产物溶解度不佳,乙酸乙酯洗可得到纯度较高的目标化合物zfi。各目标化合物zfia~zfiv的反应时间、产率和物理性质總結在表2之中。
[0043]
表2.目标化合物zfia~zfiv制备的反应时间,产率和物理性质
[0044][0045][0046]
1、目标化合物的波谱数据表征如下:
[0047]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-苯基缩氨基脲(zfia).1h nmr(400mhz,dmso-d6)δ:10.15(s,1h,ph-nh-嘧啶环),9.83(s,1h,=n-nh-co),9.24(s,1h,co-nh-ph”),8.61(d,j=5.2hz,1h,嘧啶环ch6),7.87(d,j=5.1hz,1h,嘧啶环ch5),7.78
–
7.67(m,2h,ph’h),7.59(dd,j=10.4,4.2hz,1h,ph’h),7.54(d,j=7.9hz,2h,ph”h
2,6
),7.44(t,j=7.0hz,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
),7.31(t,j=7.9hz,2h,ph”h
3,5
),7.03(t,j=7.4hz,1h,ph”h4)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.74,159.48,159.04,152.02,145.26,143.96,139.15,133.15,132.95,131.81,131.57,130.27,129.20,128.45,123.35,120.10,119.99,118.29,109.27,102.48ppm;ms(esi ):m/z=490(m na)
;hplc:tr=17.60min,98.5%。
[0048]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-甲基苯基)缩氨基脲(zfib).1h nmr(400mhz,dmso-d6)δ:10.15(s,1h,ph-nh-嘧啶环),9.78(s,1h,=n-nh-co),9.16(s,1h,co-nh-ph”),8.61(d,j=5.2hz,1h,嘧啶环ch6),7.88(d,j=5.1hz,1h,嘧啶环ch5),7.74
–
7.68(m,2h,ph’h),7.59(t,j=7.3hz,1h,ph’h),7.43(t,j=9.0hz,5h,phh
3,5
ph’h ph”h
2,6
),7.37(d,j=8.8hz,2h,phh
2,6
),7.11(d,j=8.3hz,2h,ph”h
3,5
),1.98(s,3h,ch3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.76,159.47,159.03,152.06,145.27,143.57,136.55,133.15,132.95,132.29,131.79,131.59,130.27,129.59,128.44,120.22,120.00,118.29,109.27,102.46,20.88ppm;ms(esi )504(m na)
;hrms(esi ):m/z=482.1495,484.1470[m h]
;calcd.482.1496,484.1467for c
26h21
cln7o h;hplc:tr=18.60min,99.2%。
[0049]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-氰基苯基)缩氨基脲(zfic).1h nmr(400mhz,dmso-d6)δ:10.17(s,1h,ph-nh-嘧啶环),10.08(s,1h,=n-nh-co),9.67(s,1h,co-nh-ph”),8.63(d,j=5.2hz,1h,嘧啶环ch6),7.86(d,j=4.6hz,1h,嘧啶环ch5),7.74
–
7.68(m,6h,ph’h,ph”h
2,3,5,6
),7.60(t,j=6.7hz,1h,ph’h),7.43(t,j=7.0hz,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.55,159.48,159.18,151.85,145.21,145.05,143.72,133.68,132.96,131.90,131.55,131.47,130.28,128.44,119.98,119.73,119.65,118.30,109.38,104.83,102.53ppm。
[0050]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-硝基苯基)缩氨基脲(zfid).1h nmr(400mhz,dmso-d6)δ:10.23(s,1h,ph-nh-嘧啶环),10.20(s,1h,=n-nh-co),10.13(s,1h,co-nh-ph”),8.63(d,j=5.2hz,1h,嘧啶环ch6),8.21(d,j=9.1hz,2h,ph”h
2,6
),7.82(d,j=8.9hz,3h,嘧啶环ch5,ph”h
3,5
),7.71(q,j=7.9hz,2h,ph’h),7.59(t,j=7.3hz,1h,ph’h),7.44(t,j=8.6hz,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.64,159.38,159.06,151.80,145.93,145.32,145.16,142.19,133.04,132.96,131.92,131.54,131.40,130.29,128.45,125.45,119.97,119.06,118.34,109.36,102.57,56.49,19.03ppm;hrms(esi ):m/z=513.1191,515.1165[m h]
;calcd.513.1190,515.1161for c
25h18
cln8o3 h。
[0051]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-甲氧基苯基)缩氨基脲(zfie).1h nmr(400mhz,dmso-d6)δ:10.14(s,1h,ph-nh-嘧啶环),9.78(s,1h,=n-nh-co),9.12(s,1h,co-nh-ph”),8.60(d,j=5.2hz,1h,嘧啶环ch6),7.91(d,j=5.0hz,1h,嘧啶环ch5),7.77
–
7.64(m,2h,ph’h),7.59(t,j=7.4hz,1h,ph’h),7.43(dt,j=7.6,5.1hz,5h,phh
3,5
ph’h ph”h
2,6
),7.37(d,j=8.9hz,2h,phh
2,6
),6.89(d,j=8.9hz,2h,ph”h
3,5
),3.35(s,3h,ch3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.77,159.47,158.98,155.71,152.32,145.28,143.56,133.17,132.95,132.03,131.76,131.61,130.26,128.42,122.23,120.01,118.29,114.34,109.29,102.45,55.66ppm;ms(esi ):m/z=520.5(m na)
;hplc:tr=17.35min,99.1%。
[0052]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-乙氧基苯基)缩氨基脲(zfif).1h nmr(400mhz,dmso-d6)δ:10.14(s,1h,ph-nh-嘧啶环),9.76(s,1h,=n-nh-co),9.11(s,1h,co-nh-ph”),8.60(d,j=5.2hz,1h,嘧啶环ch6),7.91(d,j=5.1hz,1h,嘧啶环ch5),7.77
–
7.65(m,2h,ph’h),7.59(t,j=7.3hz,1h,ph’h),7.43(t,j=9.8hz,5h,phh
3,5
,ph’h ph”h
2,6
),7.37(d,j=8.8hz,2h,phh
2,6
),6.88(d,j=8.9hz,2h,ph”h
3,5
),3.98(q,j=7.0hz,2h,ch2),1.30(t,j=7.0hz,3h,ch3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.78,159.47,158.98,154.98,152.31,145.28,143.53,133.17,132.95,131.93,131.76,131.61,130.26,128.48,122.23,120.00,118.28,114.87,109.29,102.45,63.58,15.19ppm;ms(esi )534.5
(m na)
;hrms(esi )m/z:=512.1602,514.1572[m h]
;calcd.512.1602,514.1572for c
27h23
cln7o2 h;hplc:tr=18.15min,98.5%。
[0053]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-羟基苯基)缩氨基脲(zfig).1h nmr(400mhz,dmso-d6)δ:10.13(s,1h,ph-nh-嘧啶环),9.69(s,1h,=n-nh-co),9.19(s,1h,oh),9.02(s,1h,co-nh-ph”),8.60(d,j=5.2hz,1h,嘧啶环ch6),7.91(d,j=5.2hz,1h,嘧啶环ch5),7.76
–
7.64(m,2h,ph’h),7.58(t,j=7.3hz,1h,ph’h),7.42(dd,j=12.1,8.3hz,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
),7.28(d,j=8.8hz,2h,ph”h
2,6
),6.72(d,j=8.8hz,2h,ph”h
3,5
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.81,159.46,158.95,153.89,152.36,145.28,143.33,133.17,132.95,131.61,131.58,130.41,130.25,128.48,122.65,120.00,118.28,115.58,109.27,102.43,56.51,19.03ppm;ms(esi )506(m na)
;hrms(esi )m/z:=484.1283,486.1256[m h]
;calcd.484.1289,486.1259for c
25h19
cln7o2 h;hplc:tr=15.25min,98.1%。
[0054]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-氟苯基)缩氨基脲(zfih).1h nmr(400mhz,dmso-d6)δ:10.15(s,1h,ph-nh-嘧啶环),9.87(s,1h,=n-nh-co),9.29(s,1h,co-nh-ph”),8.62(d,j=5.2hz,1h,嘧啶环ch6),7.91(d,j=4.8hz,1h,嘧啶环ch5),7.71(dt,j=15.3,7.8hz,2h,ph’h),7.57(dt,j=8.9,6.3hz,3h,ph’h ph”h
2,6
),7.43(t,j=8.3hz,3h,phh
3,5
ph’h),7.37(d,j=8.6hz,2h,phh
2,6
),7.15(d,j=8.8hz,2h,ph”h
3,5
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.70,159.47,159.04,157.30,145.26,143.99,135.45,133.15,132.95,131.79,131.58,130.26,128.41,122.27,120.00,118.29,115.82,115.60 109.33,102.47ppm;ms(esi ):m/z=486.5(m na)
;hplc:tr=17.52min,98.5%。
[0055]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-氯苯基)缩氨基脲(zfii).1h nmr(400mhz,dmso-d6)δ:10.16(s,1h,ph-nh-嘧啶环),9.93(s,1h,=n-nh-co),9.43(s,1h,co-nh-ph”),8.62(d,j=5.2hz,1h,嘧啶环ch6),7.88(d,j=4.8hz,1h,嘧啶环ch5),7.76-7.65(m,2h,ph’h),7.58(d,j=8.9hz,3h,ph’h ph”h
2,6
),7.42(t,j=9.1hz,3h,phh
3,5
ph’h),7.36(dd,j=8.8,3.8hz,4h,phh
2,6
ph”h
3,5
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.69,159.42,159.03,152.09,145.22,144.29,138.19,133.11,132.95,131.52,130.26,129.05,128.43,126.96,121.63,119.99,118.31,109.33,102.50ppm;ms(esi )502.5(m na)
;hrms(esi )m/z:=502.0957,504.0933[m h]
;calcd.502.0950,504.0920for c
25h18
cl2n7o2 h;hplc:tr=14.84min,98.2%。
[0056]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-溴苯基)缩氨基脲(zfij).1h nmr(400mhz,dmso-d6)δ:10.16(s,1h,ph-nh-嘧啶环),9.93(s,1h,=n-nh-co),9.36(s,1h,co-nh-ph”),8.62(d,j=5.1hz,1h,嘧啶环ch6),7.89(d,j=4.2hz,1h,嘧啶环ch5),7.71(q,j=7.8hz,2h,ph’h),7.63-7.52(m,3h,ph’h ph”h
2,6
),7.49(d,j=8.6hz,2h,ph”h
3,5
),7.43(t,j=7.4hz,3h,phh
3,5
ph’h),7.37(d,j=8.5hz,2h,phh
2,6
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.65,159.48,159.09,152.06,145.25,144.30,138.62,133.13,132.95,131.95,131.83,131.55,130.26,128.43,122.04,119.99,118.29,114.95,109.35,102.49ppm;ms(esi ):m/z=568.5(m na)
;hrms(esi )m/z:=546.0439,548.0419[m h] ;calcd.546.0445,548.0424for c
25h18
brcln7o2 h;hplc:tr=19.58min,99.2%。
[0057]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-甲基苯基)缩氨基脲(zfik)
.yield:48.2%;light黄色solid;mp:258.4-259.1℃;1h nmr(400mhz,dmso-d6)δ:10.16(s,1h,ph-nh-嘧啶环),9.83(s,1h,=n-nh-co),9.21(s,1h,co-nh-ph”),8.61(d,j=5.2hz,1h,嘧啶环ch6),7.86(d,j=5.0hz,1h,嘧啶环ch5),7.77
–
7.66(m,2h,ph’h),7.59(t,j=7.3hz,1h,ph’h),7.43(t,j=7.9hz,3h,phh
3,5
ph’h),7.36(t,j=11hz,4h,phh
2,6
ph”h
2,6
),7.18(t,j=7.7hz,1h,ph”h5),6.85(d,j=7.4hz,1h,ph”h4),2.28(s,3h,ch3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.76,159.44,159.02,151.99,145.25,143.88,139.06,138.40,132.96,131.81,131.56,130.27,129.05,128.45,124.07,120.56,120.00,118.30,117.22,109.25,102.47,21.66ppm;ms(esi ):m/z=582(m na)
;hrms(esi )m/z:=482.1493,484.1474[m h]
;calcd.482.1496,484.1467for c
26h21
cln7o h;hplc:tr=14.55min,99.1%。
[0058]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-硝基苯基)缩氨基脲(zfil).1h nmr(400mhz,dmso-d6)δ:10.17(s,1h,ph-nh-嘧啶环),10.13(s,1h,=n-nh-co),9.78(s,1h,co-nh-ph”),8.62(s,1h,ph”h2),8.65(d,j=5.2hz,1h,嘧啶环ch6),7.94(s,2h,ph”h
4,6
),7.89(d,j=9.8hz,1h,嘧啶环ch5),7.73(d,j=7.4hz,2h,ph’h),7.60(t,j=8.3hz,2h,ph’h ph”h5),7.44(t,j=8.8hz,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.57,159.48,159.14,152.34,148.49,145.23,144.84,140.59,133.12,132.94,131.84,131.54,130.47,130.26,128.40,119.98,118.30,117.75,114.13,109.46,102.50ppm;ms(esi )513.5(m h)
;hrms(esi )m/z:=513.1191,515.1165[m h] ;calcd.513.1191,515.1164for c
25h18
cln8o3 h;hplc:tr=14.05min,98.1%。
[0059]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-羟基苯基)缩氨基脲(zfim).1h nmr(400mhz,dmso-d6)δ:10.19(s,1h,ph-nh-嘧啶环),9.82(s,1h,=n-nh-co),9.24(s,1h,co-nh-ph”),8.60(d,j=5.3hz,1h,嘧啶环ch6),7.81(d,j=5.1hz,1h,嘧啶环ch5),7.77
–
7.63(m,2h,ph’h),7.59(t,j=7.3hz,1h,ph’h),7.43(t,j=8.8hz,3h,phh
3,5
ph’h),7.37(t,j=8.8hz,2h,phh
2,6
),7.15-6.99(m,2h,ph”h
2,5
),6.89(d,j=8.3hz,1h,ph”h2),6.44(d,j=9.5hz,1h,ph”h4)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.92,159.29,158.81,158.19,151.73,145.18,143.82,140.22,133.11,132.96,131.83,131.60,131.50,130.28,129.85,128.47,119.98,118.35,110.43,106.87,102.55,56.50,19.03ppm。
[0060]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-甲氧基苯基)缩氨基脲(zfin).1h nmr(400mhz,dmso-d6)δ:10.19(s,1h,ph-nh-嘧啶环),9.86(s,1h,=n-nh-co),9.36(s,1h,co-nh-ph”),8.61(d,j=5.3hz,1h,嘧啶环ch6),7.82(d,j=5.0hz,1h,嘧啶环ch5),7.78
–
7.65(m,2h,ph’h),7.59(t,j=7.4hz,1h,ph’h),7.43(t,j=9.0hz,3h,phh
3,5
ph’h),7.38(t,j=9.5hz,2h,phh
2,6
),7.20(dd,j=11.2,4.9hz,2h,ph”h
2,5
),7.07(d,j=8.0hz,1h,ph”h6),6.61(d,j=8.2hz,1h,ph”h4),2.49(s,3h,ch3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.87,160.07,159.31,158.86,151.86,145.18,144.02,133.10,132.96,131.84,131.58,131.49,130.28,129.99,128.47,119.97,118.36,112.13,109.21,108.67,105.68,102.56,55.47ppm。
[0061]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-氟苯基)缩氨基脲(zfio).1h nmr(400mhz,dmso-d6)δ:10.16(s,1h,ph-nh-嘧啶环),9.95(s,1h,=n-nh-co),9.42(s,1h,co-nh-ph”),8.63(d,j=5.2hz,1h,嘧啶环ch6),7.88(d,j=4.9hz,1h,嘧啶环ch5),7.72
(dt,j=15.4,8.1hz,2h,ph’h),7.62-7.51(m,2h,ph’h ph”h2),7.47-7.40(m,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
),7.34-7.28(m,2h,ph”h
4,6
),6.85(t,j=7.7hz,1h,ph”h5)ppm;
13
c nmr(100mhz,dmso-d6)δ:163.19,162.62,161.52,159.48,159.12,152.01,145.24,144.48,141.10,140.98,133.12,132.96,131.85,131.53,130.71,130.27,128.44,119.99,118.29,115.71,109.34,106.55,102.49ppm;ms(esi ):m/z=508(m h)
;hplc:tr=16.05min,98.2%。
[0062]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-氯苯基)缩氨基脲(zfip).1h nmr(400mhz,dmso-d6)δ:10.16(s,1h,ph-nh-嘧啶环),9.97(s,1h,=n-nh-co),9.40(s,1h,co-nh-ph”),8.63(d,j=5.2hz,1h,嘧啶环ch6),7.90(d,j=5.0hz,1h,嘧啶环ch5),7.77
–
7.68(m,3h,ph’h ph”h2),7.70-7.41(m,4h,phh
3,5
ph’h ph”h2),7.59(t,j=7.3hz,1h,ph’h),7.38-7.31(m,3h,phh
2,6
ph”h
5,6
),7.09(d,j=7.8hz,1h,ph”h4)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.61,159.48,159.12,152.10,145.24,144.48,140.74,133.53,133.13,132.96,131.84,131.55,130.81,130.26,128.42,122.99,119.99,119.50,118.52,118.29,102.49ppm;ms(esi )524.5(m na)
;hrms(esi ):m/z=502.0939,504.0914[m h] ;calcd.502.0950,504.0920for c
25h18
cl2n7o2 h;hplc:tr=19.20min,97.9%。
[0063]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(3-溴苯基)缩氨基脲(zfiq).1h nmr(400mhz,dmso-d6)δ:10.15(s,1h,ph-nh-嘧啶环),9.98(s,1h,=n-nh-co),9.41(s,1h,co-nh-ph”),8.63(d,j=5.2hz,1h,嘧啶环ch6),7.91(d,j=5.0hz,2h,嘧啶环ch5 ph”h2),7.78
–
7.66(m,2h,ph’h),7.59(t,j=7.3hz,1h,ph’h),7.50(d,j=8.0hz,1h,ph”h6),7.43(t,j=4.6hz,3h,phh
3,5
ph’h),7.37(d,j=8.7hz,2h,phh
2,6
),7.27(t,j=8.0hz,1h,ph”h5),7.21(d,j=8.0hz,1h,ph”h4)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.61,159.47,159.11,152.10,145.24,144.48,140.48,133.13,132.95,131.83,131.54,131.11,130.26,128.42,125.89,122.34,122.01,119.99,118.90,118.30,109.39,102.50ppm;ms(esi )568.5(m na)
;hrms(esi )m/z:=546.0434,548.0412[m h] ;calcd.546.0445,548.0424for c
25h18
brcln7o2 h;hplc:tr=16.18min,98.3%。
[0064]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(2-甲基苯基)缩氨基(zfir).1h nmr(400mhz,dmso-d6)δ:10.17(s,1h,ph-nh-嘧啶环),9.85(s,1h,=n-nh-co),9.27(s,1h,co-nh-ph”),8.61(d,j=5.2hz,1h,嘧啶环ch6),7.85(d,j=5.1hz,1h,嘧啶环ch5),7.77
–
7.66(m,2h,ph’h),7.59(t,j=7.2hz,1h,ph’h),7.43(t,j=9.5hz,3h,phh
3,5
ph’h),7.38-7.33(m,4h,phh
2,6
ph”h
5,6
),7.18(t,j=7.7hz,1h,ph”h4),6.84(d,j=7.4hz,1h,ph”h3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.85,159.49,159.35,158.89,151.98,145.21,143.84,139.09,138.38,133.13,132.95,131.81,131.59,131.54,130.27,129.04,128.45,124.04,120.53,119.98,118.34,117.18,109.24,102.52,21.66ppm;ms(esi ):m/z=482(m h)
;hplc:tr=14.56min,98.6%。
[0065]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(2-羟基苯基)缩氨基脲(zfis).1h nmr(400mhz,dmso-d6)δ:10.35(s,1h,ph-nh-嘧啶环),10.21(s,1h,=n-nh-co),8.94(s,1h,co-nh-ph”),8.60(d,j=5.2hz,1h,嘧啶环ch6),8.00(d,j=7.9hz,1h,嘧啶环ch5),7.74
–
7.67(m,2h,ph’h),7.59(dd,j=13.7,6.3hz,2h,ph’h ph”h6),7.43(t,j=7.6hz,3h,phh
3,5
ph’h),7.37(d,j=8.8hz,2h,phh
2,6
),6.90(d,j=7.8hz,1h,ph”h3),6.84(t,j=
7.5hz,1h,ph”h4),6.76(t,j=7.6hz,1h,ph”h5)ppm;
13
c nmr(100mhz,dmso-d6)δ:163.10,159.34,158.80,151.87,146.97,145.15,143.52,133.14,132.97,131.78,131.72,130.18,128.36,127.16,123.32,119.98,119.87,119.58,118.38,115.16,108.57,102.59ppm。
[0066]
2-氯苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(2-甲氧基苯基)缩氨基脲(zfit).δ:10.35(s,1h,ph-nh-嘧啶环),10.21(s,1h,=n-nh-co),8.94(s,1h,co-nh-ph”),8.61(d,j=5.2hz,1h,嘧啶环ch6),7.83(d,j=4.9hz,1h,嘧啶环ch5),7.75
–
7.68(m,2h,ph’h),7.59(t,j=7.2hz,1h,ph’h),7.43(t,j=9.2hz,3h,phh
3,5
ph’h),7.37(d,j=8.6hz,2h,phh
2,6
),7.21-7.18(m,2h,ph”h
4,5
),7.07(d,j=8.0hz,1h,ph”h6),6.60(d,j=8.0hz,1h,ph”h3),2.49(s,3h,ch3)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.88,160.06,159.30,158.83,151.85,145.17,144.00,140.42,133.11,132.96,131.84,131.59,131.50,130.28,129.99,128.47,119.98,118.36,112.13,109.20,108.66,105.67,102.56,55.47ppm。
[0067]
2-溴苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-溴苯基)缩氨基脲(zfiu).1h nmr(400mhz,dmso-d6)δ:10.17(s,1h,ph-nh-嘧啶环),9.96(s,1h,=n-nh-co),9.51(s,1h,co-nh-ph”),8.64(d,j=4.8hz,1h,嘧啶环ch6),7.91(d,j=4.2hz,3h,嘧啶环ch5 ph”h
2,6
),7.63(s,2h,ph’h),7.51(d,j=7.3hz,1h,ph’h),7.45(d,j=8.0hz,3h,phh
3,5
ph’h),7.38(d,j=7.9hz,2h,phh
2,6
),7.28(d,j=7.8hz,2h,ph”h
3,5
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.53,159.41,159.06,145.67,145.23,145.23,140.89,133.68,133.46,133.26,132.92,131.92,131.62,131.10,128.84,123.08,122.00,119.97,119.05,118.30,109.42,102.46ppm。
[0068]
2-溴苯基-2-(4-氰基苯氨基)-嘧啶-4-基酮-n-(4-氯苯基)缩氨基脲(zfiv).1h nmr(400mhz,dmso-d6)δ:10.18(s,1h,ph-nh-嘧啶环),9.93(s,1h,=n-nh-co),9.52(s,1h,co-nh-ph”),8.62(d,j=5.2hz,1h,嘧啶环ch6),7.88(d,j=4.8hz,1h,嘧啶环ch5),7.76-7.65(m,2h,ph’h),7.58(d,j=8.9hz,3h,ph’h ph”h
2,6
),7.42(t,j=9.1hz,3h,phh
3,5
ph’h),7.36(dd,j=8.8,3.8hz,4h,phh
2,6
ph”h
3,5
)ppm;
13
c nmr(100mhz,dmso-d6)δ:162.59,159.32,158.95,152.02,145.41,145.21,138.21,133.68,133.32,132.92,131.90,131.63,129.03,128.91,126.85,123.02,121.45,119.85,118.32,102.49ppm。
[0069]
2、目标化合物的parp-1活性测试
[0070]
以经典热漂移试验分析(thermal shift analysis,tsa)方法对22个缩氨基脲取代的双芳基嘧啶目标化合物,针对靶点聚腺苷二磷酸核糖聚合酶-1(parp-1)进行了parp-1酶水平的结合测试,初步评鉴了其潜在的生物活性,tsa的具体测试方法是描述在下文之中,初步评价结果总结在表3和图1之中。
[0071]
2.1实验材料
[0072]
(1)空白(control)样品:荧光染料 dmso 缓冲液,对照(reference)样品:蛋白 荧光染料 dmso 缓冲液,实验(sample)样品:蛋白 荧光染料 抑制剂 缓冲液;
[0073]
(2)仪器:实时定量荧光pcr;
[0074]
(3)数据分析软件:蛋白热熔软件。
[0075]
2.2测试原理和方法
[0076]
蛋白质对外界温度敏感,加热会引起蛋白质变性。蛋白质的热稳定性是指在温度升高和其它因素的影响下保持生物活性的能力,是衡量蛋白稳定性的重要指标。tsa是检测
蛋白热稳定性的一种方法。在tsa中,蛋白质随外界温度升高而渐渐升温,当温度大于临界温度时,蛋白质变性,结构发生伸展、去折叠,发生变性的温度即变性温度(tm)或熔化温度。tm值越高,热稳定性越好。变性后的蛋白质结构伸展,暴露出疏水区域,与溶液中的荧光染料结合。由于采用的荧光染料在接触水时荧光很弱,而在接触疏水环境时会被激发产生荧光信号,荧光染料的荧光强度的变化反应了蛋白质的变性情况。化合物与蛋白质的结合后使蛋白质更加稳定,使tm值升高。以tm2(加入化合物)减去tm1(未加入化合物),得到
△
tm值,
△
tm值越高,蛋白与化合物结合越强。该方法利用荧光实时定量pcr仪运行熔解曲线,对小分子配体进行筛选。每个目的蛋白在一定条件下(缓冲液、ph、盐离子强度)有一个相对恒定的熔解温度(tm)。
[0077]
2.3实验过程
[0078]
蛋白质加缓冲液溶解,小分子配体用dmso溶解。蛋白质分别与小分子配体、荧光染料混合作为实验样品,并设置空白及对照样品,4个重复。蛋白质与小分子配体的摩尔数之比为1:3~1:5。样品分别加入96孔板,升温策略为25~95℃,升温1℃/min,测定tm与
△
tm值。
[0079]
2.4实验结果与讨论
[0080]
△
tm值如表3所示。值得注意的是部分化合物如zfit,与parp-1的相互作用与蛋白的稳定性呈正相关,部分化合物如zfim,与parp-1的相互作用与蛋白的稳定性呈负相关。
[0081]
表3.parp-1与目标化合物(zfia~zfiv)相互作用的
△
tm变化图
[0082][0083][0084]
为了探讨部分化合物加入后parp-1的tm值升高,而部分化合物的tm值降低的现象。选择pdb代码为3goy的复合晶体4,用sybyl软件包的surflex-dock分子模拟软件对dapy-sc与parp-1进行了分子对接研究。dock打分值如表1所示。分别以zfim和zfit为例进行比较分析,如图3-a,b,c,d所示,zfim与zfit与parp-1相互作用时采取的构象和空间取向不同,zfim采取与一种展开的蝴蝶双翅构象,而zfit的二芳基嘧啶三个环被无规则地张开。
这可能是造成两者对parp-1稳定性调节有相反作用的原因。作用位点包含多个芳香性氨基酸,如tyr1633,tyr1640和tyr1646,与zfim与zfit均能形成π-π堆积作用和疏水相互作用。zfi同时分别与两种氨基酸残基(tyr1633和tyr1640)之间存在氢键相互作用。zfit仅仅与一种氨基酸残基(gly1602)之间发生氢键相互作用(图3)。
[0085]
分析上述两种化合物的结构特征与区别发现:将zfim缩氨基脲相连苯环上的间位3-羟基替换为zfit邻位2-甲氧基的细微改变,就可以改变化合物与靶标parp-1分子之间结合力度的方向,表明在类似结构类型的化合物上通过取代基的细微调节有可能改变对parp-1抑制活性或激动活性。这本身就是很有意思的现象,其分子对接的结合情况也有所不同(图3)。
[0086]
总之,通过parp-1酶水平的实验结果均表明,化学通式中所包含的化合物普遍具有对parp-1多变的调节功能,有望成为parpi和与肿瘤细胞增生的相关性疾病的辅助治疗药物。
[0087]
本发明不限于上述实例。
[0088]
参考文献:
[0089]
1.gilliams-francis,k.l.;quaye,a.a.;naegele,j.r.,parp cleavage,dna fragmentation,and pyknosis during excitotoxin-induced neuronal death.exp.neurol.2003,184(1),359-372.
[0090]
2.curtin,n.,parp inhibitors for anticancer therapy.biochem.soc.trans.2014,42(1),82-88.
[0091]
3.r.hron,b.s.j.,preparation of substituted semicarbazides from corresponding amines and hydrazines via phenyl carbamates.tetrahedron letters 2014,55(9),1540-1543.
[0092]
4.wahlberg,e.;karlberg,t.;kouznetsova,e.;markova,n.;macchiarulo,a.;thorsell,a.-g.;pol,e.;frostell,ekblad,t.;oncu,d.;kull,b.;robertson,g.m.;pellicciari,r.;schuler,h.;weigelt,j.,family-wide chemical profiling and structural analysis of parp and tankyrase inhibitors.nat biotechnol 2012,30(3),283-388。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
