1.本发明属于生物工程技术领域,尤其涉及一种人源化降糖多肽、其制备方法 和应用。
背景技术:
2.随着全球肥胖、身体久坐与高热量饮食潮流的盛行,糖尿病已成为继心血管 疾病/肿瘤之后威胁人类健康的全球性卫生问题,其患病率显著升高,截止到2018 年,全世界大约有4.15亿的糖尿病患者,预测2040年会超过6.25亿,对患者及 家属造成了深刻的身心痛苦,并对卫生保健系统造成巨大负担。90%以上的糖尿 病患者为ii型糖尿病(t2d),其主要是由于肥胖引发的靶器官胰岛素抵抗或胰 腺β细胞功能障碍导致的相对胰岛素缺陷,最终导致血糖过高引起的。目前临床 上治疗糖尿病的药物主要有以下几类:胰岛素,降糖效果明显,然而会造成低血 糖以及体重增加;二甲双胍类,主要用于减少糖异生和肝脏葡萄糖生成,然而长 期使用会造成胃肠道和乳酸中毒;磺酰脲类药物(和胰岛素促分泌剂),可以增 加胰岛细胞分泌胰岛素,长期使用会造成低血糖,增加心血管疾病风险;钠-葡 萄糖协同转运蛋白(sglt2)抑制剂,阻断肾近端小管对葡萄糖的重吸收,长期 使用会造成酮酸中毒、生殖器霉菌病以及骨折;肠促胰岛素类似物,促进胰岛素 分泌,延迟胃排空,抑制食欲,长期使用会造成恶心、呕吐以及胰腺炎;过氧化 物酶体增殖物激活受体γ(pparγ)拮抗剂(噻唑烷二酮类),增强脂肪组织对脂 质的贮积能力,减少肝脏和肌肉组织对脂质的异常贮积,改善肝脏和肌肉对胰岛 素的敏感性,长期使用会造成体重增加、膀胱癌以及骨折,增加心血管疾病风险; α-葡糖苷酶抑制剂,干扰肠道葡萄糖吸收,减少葡萄糖生成,增加葡萄糖的利用 率,长期使用会造成腹泻、腹痛、恶心、呕吐。总之,这些药物由于功效低、耐 受性差、副作用明显的特点,并不能全面地改善ii型糖尿病的内分泌代谢异常 问题,因此,这就需要对ii型糖尿病的发病机理有深入的研究,开发出针对病 症根源的安全有效的药物。
3.分泌蛋白、激素和细胞因子是由胰岛β细胞和胰岛素响应组织如肌肉、肝脏、 脂肪组织分泌出来的一类因子,在机体的食物摄取、胰岛素敏感性以及能量代谢 上发挥着重要的作用,血清中这些分泌因子的水平变化对维持机体葡萄糖代谢和 能量稳态至关重要。胰岛素是由胰岛β细胞分泌出来的激素,能促进骨骼肌及脂 肪组织对葡萄糖的摄取以及减少肝脏中葡萄糖的产生,胰岛素分泌减少造成高血 糖症。瘦素是由脂肪组织分泌出来的,它能通过抑制糖原合成,抑制糖原反应和 抑制下丘脑-垂体-肾上腺轴起到抗糖尿病的作用。肠促胰岛素葡萄糖依赖的胰岛 素释放多肽(gip)和糖原类似多肽-1(glp-1)在摄取食物和吸收葡萄糖时被 释放出来,极大的促进了胰岛素的分泌。除此以外,glp-1在抑制糖原分泌和促 进胰岛素合成上也有重要的作用。血清里高浓度的视黄醇结合蛋白-4(rbp4) 通过减少骨骼肌里glut4的水平引起胰岛素的拮抗。激素irisen能作用于白色 脂肪组织细胞来促进ucp1的表达和棕色脂肪化的转变,在肥胖病人血清中增 多。脂肪因子apelin作为g蛋白偶联受体,在维持心血管功能、体液稳态、血 管生成、食物摄入以及细胞增殖上发挥重要作用,在ii型糖尿病病人中分泌增 加。fgf21作为内分泌激素调节肝酮生成、糖异生和脂肪分
解,能有效抵抗饮食 造成的肥胖和增强葡萄糖耐受,血清中fgf21水平与肥胖和胰岛素抵抗成正相 关,注射fgf21可以有效改善糖尿病小鼠的代谢紊乱。因此,研究分泌蛋白与 血糖血脂的关系对糖尿病治疗有极其重要的作用。分泌蛋白是自身组织器官分泌 的,几乎不存在毒副作用,对机体极为安全,因此研究分泌蛋白将为糖尿病多肽 治疗治疗提供理论依据。
4.腺苷酸环化酶相关蛋白家族是一类与细胞骨架运动密切相关的蛋白,包括两 个成员cap1和cap2,其中,cap1分布较广,在很多组织内都能检测到,而 cap2分布相对比较狭隘,仅在脑、心脏骨骼肌和皮肤中的表达较为明显。cap 蛋白对肌动蛋白的多聚化具有负调控作用,维持肌动蛋白处于单体肌动蛋白的状 态,抑制单体肌动蛋白和多聚肌动蛋白之间的转化,从而抑制细胞骨架的运动。 cap1在细胞信号转导过程中具有重要角色。cap1蛋白参与胰岛素通路,在胰 岛素刺激的葡萄糖转运吸收的过程中,cap1蛋白起到调节葡萄糖吸收的作用。 细胞吸收葡萄糖依赖葡萄糖转运蛋白家族glucose transporter proteins的参与,在 基础状态时,glut1/4分布于细胞内的储存囊泡中,在受到胰岛素刺激时, glut1/4就会从细胞质的囊泡内移位到细胞膜上,葡萄糖转运蛋白转移到细胞 膜上以后才能发挥转运葡萄糖的作用。这个过程主要有两条途径来完成的, cap1蛋白参与其中的一条通路,胰岛素首先和细胞膜上的胰岛素受体相互作用, 然后胰岛素受体的β亚基发生自身磷酸化,胰岛素受体的β亚基位于细胞膜的内 侧,磷酸化的β亚基能激活其下游的cbl蛋白,然而cbl蛋白不能直接跟胰岛 素受体ir发生直接的相互作用,cbl需要首先和cap1的sh3功能域相互结合, 然后由cap1将cbl蛋白招募到胰岛素受体附近,进而激活cbl磷酸化,随后 cbl-cap1复合体从胰岛素受体ir上解离,转运到富含磷脂的脂筏上,磷酸化 的cbl能招募crkii-c3g复合体,使该复合体也向“脂筏”转移,在“脂筏
”ꢀ
区域c3g蛋白能特异的激活tc10,从而促进细胞骨架的运动,将葡萄糖转运蛋 白glut从细胞基质的囊泡中转运到细胞膜上开始对葡萄糖进行转运。在这条途径 中,最终tc10蛋白跟随c3g蛋白转移到“脂筏”,在脂筏区域内激活小gtp 结合蛋白tc10,然后促进细胞骨架运动带动葡萄糖转运蛋白glut的上膜是关 键步骤,而以cbl、cap1、c3g以及tc10为核心的“脂筏”微环境是tc10 蛋白激活所必需的。cap1蛋白是这个过程中的重要调节者,在这个过程中cap1 的作用是将cbl蛋白招募到胰岛素受体ir附近进行磷酸化,依赖的是cap1的 sh3结构域可以跟cbl发生相互作用,cap1蛋白的丰度以及cap1蛋白的相 关修饰都会影响到cbl蛋白在胰岛素受体作用下的磷酸化,从而影响下游的信 号通路。所以cap1在insulin通路中发挥作用,是细胞对葡萄糖吸收过程中的 重要调控者。
5.然而对于cap1如何调控葡萄糖吸收,目前文献中并无关于深入研究和相关 的论述,cap1是否能应用于降糖领域仍存在技术壁垒。
技术实现要素:
6.本发明的主要目的在于提供一种人源化、安全性好、具有较好降糖效果的降 糖多肽,其氨基酸序列如序列表seq id no:1所示,具体为,
7.glawsktgpvakelsglpsgpsagscppppppcpppppvstiscsyesasrss lfaqinqgesithalkhvsddmkthknpalkaqsgpvrsgpkpfsapkpqtsp spkratkkepavlelegkkwr。
8.优选的,所述降糖多肽为人源性,为分泌蛋白cap1第204-330位的氨基酸, 记为
204-330氨基酸序列促进细胞内葡萄糖吸收。本发 明提供了新的治疗和或/预防高血糖的方法,有利于开发针对治疗和/或预防糖尿 病的药物和保健品。
附图说明
27.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明 的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
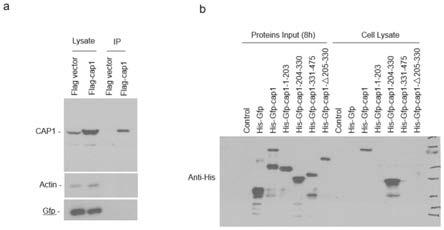
28.图1.实施例1中检测cap1的分泌以及穿膜情况;图a为瞬时过表达cap1 的293t细胞在血清饥饿下cap1的分泌情况;图b为体外纯化的cap1及突变体 蛋白进入细胞所依赖的氨基酸序列。
29.图2.实施例2中体外纯化的cap1-204-330aa蛋白促进glut1及glut4的 上膜。
30.图3.实施例3中体外纯化的cap1-204-330aa蛋白促进细胞内葡萄糖吸收; 图为cap1-204-330aa蛋白促进hela细胞及hepg2细胞的葡萄糖吸收。
31.图4.实施例1中pcr扩增目的基因反应条件。
32.图5.实施例2中检测所纯化his-cap1-204-330aa蛋白的质量。
具体实施方式
33.下面结合说明书附图和具体实施例进一步详细说明本发明。除非特别说明, 本发明采用的试剂、设备为本技术领域常规试剂和设备。当然实施例中仪器和材 料的采用并不局限于本实例的列举,而是以能够解决本发明的技术问题,并实现 相应的技术效果为依据。另外,实施例中未详细说明的分子生物学方法均为本领 域常规的方法,具体操作可参看分子生物指南或产品说明书。
34.实施例1:证实cap1蛋白是分泌蛋白试验:
35.1、实验材料
36.1.1细胞及培养耗材
37.人肾胚细胞293t,人宫颈癌细胞hela、细胞培养皿、培养板,细胞培养基:
38.dmem 10%胎牛血清
39.1.2试剂
40.flag-m2-beads(sigma)、protein a/g beads(abmart)
41.配制的试剂
[0042][0043]
调节ph值至7.4,定容至1l,高压蒸汽灭菌40min后备用。
[0044]
ip lysis buffer
[0045][0046]
ripa buffer
[0047][0048][0049]
加水定容到100ml,抽滤,分装,用前加蛋白酶抑制剂。
[0050]
lysis buffer(用5n naoh调节ph至8.0)
[0051][0052]
wash buffer(用5n naoh调节ph至8.0)
[0053][0054]
elution buffer(用5n naoh调节ph至8.0)
[0055][0056]
10
×
running buffer(电泳缓冲液)
[0057][0058]
10
×
transfer buffer(转膜缓冲液)
[0059]
tris
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
165g
[0060]
glycine
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
720g
[0061]
ddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
至5l
[0062]
磷酸钙转染基本试剂配制:
[0063][0064]
调节ph值至7.05,微调至最合适的ph值,定容至1l,0.22μm的滤膜过滤。
[0065]
2.5m cacl2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
100ml
[0066]
cacl2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3.874g
[0067]
h2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
50ml
[0068]
用0.22μm的滤膜过滤,分装保存。
[0069]
2、实验方法
[0070]
2.1western blot的具体实验步骤如下所述:
[0071]
(1)配制变性聚丙烯酰胺凝胶:将胶板清洗干净,按正确的顺序安置在制胶 架上;检漏;配制分离胶,ddh2o密封;待分离胶凝固,配制浓缩胶,然后插上 梳子,待浓缩胶完全凝固后就可以使用了。
[0072]
(2)电泳:将配好的胶与电泳槽安置好;将running buffer加入电泳槽中; 上样;将电泳仪的电压调到80v开始电泳,当loading完全进入分离胶时,将电 压调高到120v,直至loading到达分离胶的底部,结束电泳。
[0073]
(3)转膜:将pvdf膜在甲醇中浸泡30s后也放入transfer buffer中备用; 将transfer buffer加入到转膜槽中,并提前用冰水混合物冷却;按正确的顺序 将海绵、滤纸、胶和pvdf膜放置好,然后都放在转膜槽的卡槽中;启动电泳仪, 使用80v电压进行转膜,一般所需的时间是90min。
[0074]
(4)封阻:将转好膜的pvdf膜放入pbst配制的5%的脱脂牛奶,室温摇床 孵育1-1.5小时。
[0075]
(5)加一抗:用5%脱脂牛奶将特异性的一抗稀释到适当的浓度,室温摇床 上孵育2小时或4℃摇床过夜。然后用pbst室温洗涤3-4遍,每次10min。
[0076]
(6)加二抗:用5%脱脂牛奶将对应的二抗(偶联有hrp)稀释到所需要的浓 度,室温下孵育2-2.5小时,然后用pbst室温洗涤4-5遍,每次10分钟。
[0077]
(7)显影及定影:在暗房中,吸掉pvdf膜上面的液体,将混合好的发光试 剂a、b液
滴在膜上;将pvdf膜放在避光盒子中,覆盖上x光片;将x光片依次 显影和定影;冲洗干净x光片,于烘箱中烘干,即可分析结果。
[0078]
2.2磷酸钙颗粒转染
[0079]
(1)配制a液(16ulcaci 目的质粒 无菌水共300ul),配制b液(300ul 2
×
hepes),将两种试剂各自混匀之后,用电动移液枪向b液均匀吹泡,同时用 移液枪吸取a液往b液里滴加,速度要均匀。
[0080]
(2)吹完后,轻轻混匀a、b液,将600ul混合物轻轻的均匀的滴加进入待转 染的6cm皿(提前铺好293t细胞)中,轻摇混匀。
[0081]
(3)将转染后的293t细胞放进培养箱中继续培养,约1小时左右即可在显微 镜下观察形成的钙颗粒的大小。
[0082]
(4)大约4-6小时,将转染的细胞换成新鲜的培养基,具体时间可根据钙颗 粒大小的情况决定。
[0083]
(5)12小时后,可以在荧光显微镜下观察gfp荧光蛋白的表达情况,16小时 左右根据荧光的表达可以判断转染效率的高低,24小时左右目的蛋白表达。
[0084]
(6)根据实验需求,在目的蛋白表达以后可收细胞做后续实验。
[0085]
2.3cap1缺失体的构建,具体操作如下:
[0086]
(1)引物设计
[0087]
通过浏览ncbi网站,下载cap1基因的序列,使用相关软件查找出基因序 列中所包含的酶切位点,研究所用载体的图谱,选择合适的限制性内切酶,将 cap1分成如图2所示的五段,通过primer-5等软件辅助设计所需的上、下游引 物。
[0088]
(2)pcr扩增目的基因
[0089]
pcr体系如下:
[0090][0091]
将配好的pcr反应液,混匀,瞬离,放入pcr仪中反应。反应条件如图4所 示:先94℃3min;然后94℃1min,55℃1min,72℃1min,此步35个循环;最后 72℃10min。
[0092]
(3)扩增的目的片段的割胶回收、酶切
[0093]
pcr结束后,取适量产物进行琼脂糖凝胶电泳检测,观察胶上是否有预计 分子量的主要产物带,并将目的条带进行割胶回收。
[0094]
a.根据回收dna片段的大小配制合适浓度的琼脂糖凝胶(加适量的eb)。
[0095]
b.向pcr产物,加入6
×
dna loading稀释到1
×
,开始点样。
[0096]
c.加样后立即通电进行电泳,电压为120v,20分钟以后停止电泳。
[0097]
d.取出凝胶,在紫外灯下观察条带所在位置,然后用凝胶成像系统拍照保 存,切下目的条带,用天根琼脂胶回收试剂盒回收目的基因。
[0098]
e.选用pcdna3.0 flag载体,将载体和pcr产物用同样的酶分别同时进行 酶切,以产生相同的酶切位点。酶切条件为37℃下3-4小时。用琼脂糖凝 胶电泳分离载体和pcr产物的酶切产物,然后用胶回收试剂盒(试剂盒 购自天根生化科技有限公司)回收需要的产物。具体步骤见试剂盒说明书。
[0099]
(4)连接
[0100]
实验原理:在一定的条件下,t4 dna连接酶可以催化两个双链dna片段 相邻的5’端磷酸和3’端羟基之间形成磷酸二酯键,从而将两个片段连接起来。 向体系中加入1μl载体,1μl t4连接酶,1μl buffer,7μl目的基因片段,混合均 匀后,放到16℃水浴锅中8-12小时。
[0101]
(5)转化
[0102]
利用热激法原理进行转化,将50微升刚融化的感受态加入到连接产物中, 冰上放置30分钟,然后放入42℃水浴锅中热激60秒,然后放到冰上5分钟, 再加入700微升的无抗性的lb,37度摇床复苏45分钟,低速离心后,涂板到 相应抗性的平板上,倒置放到37度培养箱培养12小时。
[0103]
(6)小摇并提取质粒
[0104]
在超净工作台中,挑取转化所得的克隆,接种到相应抗性的lb培养基中, 37℃,200rpm/min振荡培养12-16小时,然后保菌,将剩余的菌液使用天根质粒 小提试剂盒提取质粒,详细步骤可查阅说明书。
[0105]
(7)酶切鉴定、测序分析及验证表达
[0106]
取1ug质粒,选择对应的酶和buffer进行酶切鉴定。37℃酶切处理3h,然 后用琼脂糖凝胶电泳检测。将酶切验证正确的质粒挑取一个克隆送去测序公司测 序,将反馈的结果进行分析,检测是否构建成功。将构建成功的质粒瞬转到293t 细胞中,通过免疫印迹实验验证表达。
[0107]
2.4his蛋白纯化
[0108]
(1)构建蛋白纯化所需要的质粒his-cap1-204-330aa,首先pcr出 cap1-204-330aa片段,方法同上,然后将这段序列连接到pet28a-his载体上, 构建成his-cap1-204-330aa。测序正确以后将其转化到transetta菌株中,挑取 单克隆,做小诱,设置不同的诱导温度和不同的od,探索蛋白诱导的最佳条件。
[0109]
(2)按照对蛋白就行小量诱导时摸索的诱导条件,扩大培养进行大诱。将活 化的菌液加入到lb培养基中,在37℃中220rpm摇至小诱时摸索的od值0.6, 加入iptg,然后将摇床温度调至摸索的温度25℃,8小时后收取菌液。
[0110]
(3)将菌液离心后,加入lysis buffer、溶菌酶、pmsf、dtt,冰上静止15 分钟后,用超声仪进行超声,超声程序为超声3秒、停7秒,重复超声90次。
[0111]
(4)将超声完成的裂解液高速离心,转速10000rpm,离心30分钟,收集上 清于新的100ml离心管中,加入偶联镍的beads,放到4度冰箱中,用静音混匀 器摇2-4小时。
[0112]
(5)将溶液过柱,然后用wash buffer冲洗3遍。
[0113]
(6)用elution buffer将蛋白质洗脱下来,用pbs在4度冰箱进行透析,测 浓度,检
475aa,1-330aa,331-475aa,delta204-330aa),然后转染到293t细胞中,24 小时以后对细胞进行血清饥饿处理4小时,分别收集培养基和细胞,用ripa裂 解细胞,用flag-m2-beads富集细胞外的flag标签的蛋白,wb检测到cap1全 长、204-475aa、1-330aa都可以明显的分泌到细胞外,而1-203aa,331-475aa以 及δ204-330aa都不可以分泌出去,说明cap1的分泌依赖于204-330aa。结果如 图2所示,表明204-330氨基酸序列介导cap1蛋白的分泌。
[0140]
实施例3体外纯化的cap1-204-330aa蛋白可促进细胞对葡萄糖的吸收验 证试验:
[0141]
1、实验材料
[0142]
1.1细胞与培养基
[0143]
人宫颈癌细胞hela,人肝癌细胞hepg2,培养基:dmem 10%fbs
[0144]
1.2试剂
[0145]
葡萄糖酶标检测试剂盒(采购自南京建成生物公司)
[0146]
2、实验方法
[0147]
根据试剂盒说明书检测,具体检测过程如下所述:
[0148]
1.在生长培养基中以50,000-80,000细胞/孔/100μl/96孔或12,500-20,000细胞/ 孔/25μl/384-孔黑壁/透明底细胞培养poly-d赖氨酸平板培养4-6小时。
[0149]
2.从培养箱中取出细胞板,从孔中吸出培养基,用100μl/孔(96孔板)或25μl/ 孔(384孔板)无血清培养基除去细胞。将细胞在37℃,5%co2培养箱中孵育6 小时至过夜。
[0150]
3.从培养箱中取出细胞板,从孔中吸出培养基,用100μl/孔1
×
krph缓冲液 轻轻洗涤细胞两次。
[0151]
4.加入90μl/孔葡萄糖摄取缓冲液(组分b)并在37℃,5%co2培养箱中孵育 细胞1小时。
[0152]
5.用或不用胰岛素或试验化合物刺激20分钟。加入10μl/孔的10
×
胰岛素溶液 至终浓度为1μm或10
×
化合物测试溶液。并且还向未处理的孔中加入10μl胰岛素 载体缓冲液或复合载体缓冲液作为对照,并在37℃,5%co2培养箱中孵育20分钟。
[0153]
6.向每个孔中加入10μl/孔2-dg溶液(组分a),并在37℃,5%co2培养箱 中孵育20-40分钟。对于阴性对照,留下一些未经胰岛素,抑制剂和2-dg处理的 孔。
[0154]
7.处理后,取出每孔中的溶液,用krph缓冲液轻轻洗涤细胞3次,100μl/ 孔,从溶液中除去额外的2-dg。从孔中移除krph缓冲液。
[0155]
8.向每个孔中加入25μl/孔酸性裂解缓冲液(组分c),并在37℃下孵育20分 钟以裂解细胞。并且可以同时制备2dg摄取测定混合物。
[0156]
9.向每个孔中加入25μl/孔中和缓冲液(组分d),充分混合,在室温下放置 5-10分钟以中和细胞裂解物。
[0157]
10.向2dg6p标准品或细胞裂解液的每个孔中加入50μl2dguptake assay工 作溶液。
[0158]
11.在室温下孵育反应30分钟至2小时,避光。
[0159]
12.使用吸光度板读数器监测570/610nm处的吸光度比增加。
[0160]
3、实验结果
[0161]
检测葡萄糖吸收的实验分组,包括如下过程:使用六孔板培养细胞,分别使 用四个孔,第一个孔中只加培养基,不培养细胞,从第二个孔开始培养细胞,且 每个孔中细胞的
数目相同,第二个孔中只加培养基不加蛋白,第三个孔中加培养 基以及纯化的his-gfp蛋白,第四个孔中加入培养基以及纯化的 his-cap1-204-330aa蛋白,各个处理组的培养基中所含蛋白浓度为0.05mg/ml,培 养24h后开始测量细胞培养基中葡萄糖的含量。
[0162]
采用酶标仪比色法测定葡萄糖含量(glu),计算公式为:
[0163][0164]
在hela和hepg2两种细胞株进行上述检测葡萄糖吸收的分组实验,实验结果 如图3所示,可见,cap1-204-330aa蛋白促进细胞对葡萄糖的吸收。
[0165]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域 的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内, 所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。