mir-7在制备/筛选前列腺癌诊治产品中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及mir-7在制备/筛选前列腺癌诊治产品中的应用。
背景技术:
2.世界范围内,前列腺癌发病率已上升至男性恶性肿瘤第一位。据美国肿瘤协会的估计,到2021年,美国将有近248,530例新确诊病例,占男性确诊病例的26%,其中发病率占男性所有癌症中第一位,死亡率占第二位,仅次于肺癌。亚洲国家前列腺癌发病率相对较低,但近年来前列腺癌不论是发病率还是死亡率上升趋势都很明显,且增长比欧美发达国家更为迅速。在我国,随着步入老年化社会,前列腺癌发病位居泌尿系肿瘤首位,2009年前列腺癌的发病率达到9.92/10万,死亡率达到4.19/10万,而到了2015年,前列腺癌发病率与死亡率分别达到了60.3/1000和26.6/1000。每年大约有100万新病例被诊断出患有前列腺癌,这占全世界男性癌症新发病例的近10%,因此,对于前列腺癌的研究越来越得到世界范围内各国学者的关注。前列腺癌的好发人群为老年男性,前列腺癌早期无明显特异性症状,临床上与良性前列腺增生鉴别有一定困难。患者往往因为肿瘤压迫尿道或侵犯膀胱颈,产生尿频、尿急、排尿困难等下尿路症状或者侵犯直肠,产生里急后重感,甚至压迫直肠导致排便困难时才就诊发现;更有忽略了下尿路原发症状,发生了骨转移疼痛或病理性骨折、脊髓压迫等症状时才就诊,此时已是肿瘤晚期,错过了最佳的治疗时间。前列腺癌的发生发展可能涉及到许多方面如基因、蛋白、代谢等多个方面的改变,因此在不同层次、不同阶段寻求肿瘤标志物成为众多研究的共同方向。如前列腺癌在早期被诊断,患者可获得较好的10年无进展率。众多的研究者也将提高前列腺癌的早期诊断率、早期治疗从而降低患者死亡率作为目标。因此,临床上迫切需要用于前列腺癌早期诊断和监测的生物标志物,研究前列腺癌的转移和进展的生物机制,早期识别前列腺癌转移机制有助于更准确地预测临床结果和研发靶向药物。
3.随着对rna研究的不断深入,人们对微小rna(microrna)了解越来越深,而微小rna是一种长度约为22nt的非编码rna,它们通过mirna介导的特异性的基因沉默导致靶mrna降解及抑制蛋白质的合成调控转录后基因表达水平。已证明,mirna能够调控多种生理学和病理学的过程,如细胞分化、细胞增殖和肿瘤形成。某些mirna可直接参与人类肿瘤(如肺癌、乳腺癌、颅脑肿瘤、肝癌、结直肠癌及淋巴瘤等)的形成。mirna既可作为癌基因又可作为抑癌基因,参与人类肿瘤形成的多条信号通路。目前随着对mirna研究的深入,发现它们具有调节细胞增殖、分化和凋亡的功能,这些效应通过调控信号分子(如细胞因子、生长因子、转录因子、促凋亡和抗凋亡基因)的表达而实现。据计算机推测人类基因组可能存在1000多个mirna基因,单个mirna可调控200多个靶基因,约三分之一的蛋白编码基因受mirna调控。目前,越来越多的研究报道mirna参与肿瘤的发生发展过程,其生物学特性使其可以作为肿瘤诊断和预后的生物标志物及精准治疗的靶点。
技术实现要素:
4.针对前列腺癌诊断、预后和治疗效果不佳的问题,本发明提供了mir-7在制备前列腺癌诊断和治疗产品中的应用。
5.本发明通过基因芯片筛查与前列腺癌细胞相关的微小rna生物标志物,选择差异表达明显的mirna,在前列腺癌芯片组织和正常组织中检测其表达差异,检测该mirna的表达水平,判断其是否与前列腺癌的预后相关,为临床上判断前列腺癌是否发生转移提供支持。
6.具体地:1、通过数据库获得mir-7的序列,其序列如下:ttggatgttggcctagttctgtgtggaagactagtgattttgttgtttttagataactaaaacgacaacaaatcacagtctgccatatggcacaggccacctctacag (seq id no.1)。
7.通过ocr(氧气消耗率)、ecar(细胞外酸化率)检测mir-7对前列腺癌细胞的糖酵解能力影响,此外,cck8、细胞克隆检测mir-7对前列腺癌细胞的增殖及克隆能力作用,并通过流式细胞检测mir-7能够促进细胞凋亡,证明mir-7在前列腺癌中起着抑癌作用。
8.2、构建了mirna在前列腺癌细胞株和前列腺癌组织中相对表达的检测试剂试剂包含:用于检测前列腺癌组织中mir-7表达的引物对:上游引物为:5
’‑
tggtgtcgtggagtcg-3
’ꢀ
(seq id no.2)下游引物为:5
’‑
ctcaactggtgtcgtggagtcggcaattcagttgagaacaacaa-3
’ꢀ
(seq id no.3)内参基因u6的引物对:上游引物为:5
’‑
ctcgcttcggcagcaca-3
’ꢀ
(seq id no.4)下游引物为:5
’‑
aacgcttcacgaatttgcgt-3
’ꢀ
(seq id no.5)。
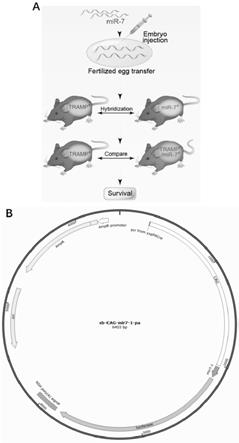
9.3、构建了mir-7转基因鼠并以tramp鼠(自发性前列腺癌小鼠)作为背景,通过crispr-cas9基因编辑技术构建mir-7 tramp双转基因鼠。
10.有益效果:1、本发明发现mir-7在前列腺癌组织芯片中相较于癌旁组织特异性表达下调,前列腺癌合并pet-ct检查的患者中发现,高表达mir-7患者可以明显降低suvmax的数值,而mir-7表达量相对较低的患者,其suvmax值反而较大,二者关系明显成负相关,以上结果表明可以作为前列腺癌的诊断及治疗标志物;同时,低表达mir-7与前列腺癌患者预后不良相关,与高表达mir-7组患者相比,低表达组患者表现出更差的生存期,可以作为前列腺癌患者的预后标志物。经过体外实验证实mir-7能够明显抑制前列腺细胞及原代细胞的恶性生物学功能,包括抑制前列腺癌细胞对葡萄糖的摄取、乳酸产生、atp的产生、糖酵解功能,并且能够抑制前列腺癌的增殖、克隆,流式细胞检测发现mir-7能够改变细胞的周期,促进细胞凋亡;体内实验证实,mir-7能够抑制裸鼠的皮下瘤生长以及抑制小鼠的前列腺部位的原位成瘤;此外,通过皮下瘤模型和尾静脉肺转移模型,发现脂质体包裹mir-7后进行皮下瘤和尾静脉注射发现,mir-7能够抑制小鼠皮下移植瘤的生长且能够抑制小鼠尾静脉肺转移。
11.2、本发明成功构建了mir-7转基因鼠,发现mir-7转基因鼠能够明显抑制皮下瘤模型小鼠的瘤组织生长;并以tramp鼠为背景,构建出mir-7 tramp双转基因鼠,进一步探究
mir-7的作用,在排除外界人为因为干扰情况下,与单纯的tramp鼠相比,评估mir-7 tramp鼠双转基因小鼠的前列腺组织进展,发现包括在前列腺的体积、pin占比、前列腺肿瘤生长方面均受到明显抑制,mir-7 tramp小鼠的总生存期明显延长,能够进一步深入了解mir-7在前列腺癌中的抑制作用,为临床的诊断、治疗提供依据;最后,构建的mir-7转基因鼠可以作为泌尿系肿瘤包括膀胱癌、肾癌以及前列腺癌的研究模型,以及肿瘤内环境的研究模型。
附图说明
12.图1为实施例1中的实验结果。
13.图2-4为实施例2中的实验结果。
14.图5-7为实施例3中的实验结果。
具体实施方式
15.越来越多的研究报道mir-7富含在多种正常组织和参与多个器官的发展和生物功能,此外mir-7在癌症中扮演重要作用,包括能够抑制乳腺癌、神经胶质瘤、肝癌等多种癌症,但是mir-7在前列腺癌中的作用并不明确,为了探究其在前列腺癌中的作用,也为了更好的模拟前列腺癌的进展过程,特别是以观察微小rna mir-7转入后对前列腺癌进展的影响,本发明先构建了mir-7转基因鼠并以tramp鼠(转基因前列腺癌小鼠模型)作为背景,通过crispr-cas9基因编辑技术构建以tramp鼠为背景的mir-7 tramp双转基因鼠,进一步探究mir-7的功能。
16.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
17.实施例11、mir-7在前列腺癌细胞及癌组织中表达情况1.1、rna提取:采用天根rna提取试剂盒1)前列腺癌三种细胞pc3、du145、lncap以及前列腺上皮细胞pbs清洗2遍,加入适量胰酶消化;2)消化1min,加入培养基终止消化1000rpm,离心5分钟;3)每个离心管加入全量150-200
µ
l细胞裂解液重悬细胞;4)冰上孵育15分钟,涡旋振荡器混合均匀;5)溶液加入过滤柱cs中,12000rpm离心2min,收集滤液;6)加入滤液等体积70%乙醇,混匀后加入吸附柱cr2中,12000rpm离心1min,弃去废液,吸附柱放回收集管;7)吸附柱中加入350
µ
l去蛋白液rw1,12000rpm离心1min,弃去废液,吸附柱放回收集管;8)吸附柱中加入80
µ
l rnase-free dnaseⅰ工作液,室温静置15min;9)吸附柱中加入500
µ
l漂洗液rw2,室温静置2min,12000rpm离心1min,弃去废液,吸附柱放回收集管;
10)重复步骤11;11)12000rpm离心2min,弃去废液,吸附柱放回收集管,室温静置3-5min,以晾干残余漂洗液;12)吸附柱放入一个新的rnase-free离心管中,加入30-50
µ
l rnase-free ddh2o,室温放置2min,12000rpm离心2min,得到rna溶液,置于-70℃备用。
18.1.2、逆转录:使用vazyme公司的hisq select rt super mix for qpcr kit进行目的基因和u6的逆转录反应,主要步骤如下:(1)rna预变性:microtube管中加入以下反应液体,如表1所示:表1反应条件:65℃孵育5min,后将混合物置于冰上2min。
19.(2)rna逆转录:microtube管中加入以下反应液体,如表2所示:表2反应条件:25℃,5min;42℃,60min;70℃,15min;4℃保持冷却,产物即cdna。
20.1.3、qrt-pcr:采用诺唯赞公司的sybr-green染料法(real-time qpcr master mix)进行实时荧光定量pcr,以检测前列腺上皮细胞及前列腺癌细胞株中mir-7的表达水平。具体操作如下:(1)microtube管中加入以下反应液体,如表3所示:表3
反应条件:95℃,预变性30s;95℃,5s;60℃,20s;72℃,10s;40个反应循环。
21.(2)mir-7和内参引物微小rna mir-7的qrt-pcr引物,上下游引物序列如下:上游引物为:5
’‑
tggtgtcgtggagtcg-3’下游引物为:5
’‑
ctcaactggtgtcgtggagtcggcaattcagttgagaacaacaa-3’内参基因u6的pcr引物,上下游引物序列如下:上游引物为:5
’‑
ctcgcttcggcagcaca-3’下游引物为:5
’‑
aacgcttcacgaatttgcgt-3’。
22.(3)pcr扩增循环参数:95℃预变性30秒,接着进入循环,首先95℃变性5秒60℃火34秒接着95℃延伸15秒循环40次,60℃延伸1分钟。接着95℃延伸15秒,绘制扩增曲线。以u6作为内参,通过2
‑△△
ct
法计算实验组与对照组的相对含量(ct代表基本循环数,即反应的实时荧光强度达到设定阈值时所经过的扩增循环数;
△
ct表示基本循环与内参循环数差值;
△△
ct*=最低样本
△
ct值-其它各样本
△
ct值)。(*相对定量以含量最低的样本为标准,其余各样本的含量均为相对该样本的倍数)。
23.2、原位杂交检测mir-7的表达前列腺癌患者术后标本石蜡包埋后,病理科医生病理切片,制备成4μm厚度切片后进行原位杂交检测。
24.地高辛标记的mir-7原位杂交探针由武汉博士德有限公司合成,其序列如下所示:5
’‑
aacaacaaaatcactagtcttcca-3
’ꢀ
(seq id no.6)。
25.1)将常规石蜡切片(4μm)放入二甲苯中浸润10分钟并重复一次,随后室温下经100%乙醇、90%乙醇、75%乙醇、50%乙醇及蒸馏水各浸泡5分钟脱蜡;2)30% h2o
2 1份 纯甲醇50份混合,室温处理30分钟,蒸馏水洗涤3次以灭活内源性过氧化物酶;3)切片上滴加3%柠檬酸新鲜稀释的胃蛋白酶,室温下消化120秒以暴露mrna核酸片断,用pbs清洗3次,每次5分钟,蒸馏水洗1次;4)使用1%多聚甲醛/0.1mpbs(ph 7.4,含有1/1000 depc)室温固定20分钟,蒸馏水充分洗涤;5)在一干燥的杂交盒底部加20%甘油保持湿润;6)每张切片滴加20μl预杂交染液,40℃静置2小时,甩去多余液体;7)每张切片滴加20μl杂交液,盖玻片盖在切片上,恒温箱40℃杂交过夜;8)洗涤:移去盖玻片,37℃预热的2
×
ssc洗2次每次5分钟,37℃、0.5
×
ssc洗涤1次
15分钟;37℃、0.2
×
ssc洗涤1次15分钟;9)滴加封闭液后37℃、30分钟静置,随后甩去多余液体;10)滴加鼠抗地高辛后室温孵育120分钟,随后用pbs洗涤4次每次5分钟;11)滴加sabc,37℃孵育30分钟,pbs洗涤4次每次5分钟;12)滴加生物素化过氧化物酶,37℃孵育30分钟,pbs洗涤4次每次5分钟;13)显色:显色剂a、b、c各一滴加入1ml蒸馏水中混匀后滴加于标本上,37℃显色30分钟后(若无背景出现则可继续显色)充分水洗;14)使用苏木素复染5分钟,随后自来水水洗;15)玻片置于酒精中脱水后浸入二甲苯中透明,最后中性树胶封片;16)光镜下观察并评价显色结果。阳性细胞百分比评分:阳性细胞数《5%记为0;6%《阳性细胞数《30%记为1;31%《阳性细胞数《70%记为2;阳性细胞数》71%记为3。显色程度评分:0代表无显色,1代表显色较弱,2代表中度显色中度,3代表较深显色较深。最终显色结果评价得分=阳性细胞百分比评分 显色程度评分:-(0-1); (2-3); (4-5); (6)。
26.3、前列腺癌患者mirna表达芯片数据的获得与二次分析研究所用的mirna表达谱数据下载自癌症基因组图谱(the cancer genome atlas,tcga)包括前列腺癌、非前列腺癌组织和前列腺癌细胞的非编码rna表达数据。患者的生存资料由美国纪念斯隆-凯瑟琳癌症研究中心(memorial sloan kettering cancer center,mskcc)数据库下载。我们从下载的数据中提取mir-7在前列腺癌组织、生存时间等临床数据进行二次分析,通过kaplan
–
meier生存曲线分析mir-7的表达水平与患者术后生存时间的关系。
27.4、原位杂交检测组织芯片中mir-7的表达差异组织芯片构建:从2018年4月至2021年4月在东南大学泌尿外科研究所行根治性前列腺切除术获取福尔马林固定石蜡包埋前列腺癌组织样本,至少有两名病理学家证实病理诊断。从肿瘤中心、肿瘤旁正常组织等块中构建直径为0.6mm的穿孔组织芯片,具体染色步骤同上述原位杂交。
28.以上实验过程的结果如图1所示。图1中,a为qrt-qpcr检测mir-7在人正常前列腺上皮细胞株rwpe-1和多种前列腺癌细胞株(lncap、pc3、du145)中的表达水平;b为数据库显示mir-7在前列腺肿瘤组织和癌旁之间的表达差异;c为mir-7与前列腺癌患者总生存期的关系;d为组织芯片检测mir-7在人正常前列腺组织中和前列腺癌组织中表达水平;e为前列腺癌患者pet-ct检测发现高表达mir-7能够明显抑制suvmax,而低表达mir-7患者suvmax则明显升高;f为fish检测mir-7在前列腺癌和癌旁组织中表达差异。
29.从以上结果可知,mir-7在前列腺癌中低表达,并且是一个抑癌基因。
30.实施例2mir-7抑制前列腺癌细胞及原代细胞的糖代谢以及增殖、克隆等能力1、细胞糖酵解代谢水平检测1)选择处于对数生长期的细胞进行实验,将mir-7(过表达mir-7),mir-nc(空白对照)转染入lncap和前列腺癌原代细胞中36-48小时后加入胰酶消化液消化细胞,并进行计数。每孔细胞密度以5
×
103个/80
µ
l接种于seahorse xf96分析仪专用的96孔检测板中,置于37℃、5% co2培养箱中培养过夜,使细胞适应贴壁生长;
2)更换细胞培养基变为不含葡萄糖的专用糖酵解压力测试培养基,按步骤设置ecar检测程序,上seahorsexf96分析仪进行检测。这时ecar数值是非糖酵解途径产生的酸化速率。细胞经过三羧酸循环产生co2,而co2可以变成碳酸或者碳酸氢盐,造成细胞外的酸化;3)接着给予饱和溶度的葡萄糖进行刺激,此时前列腺癌细胞会摄取葡萄糖主要进行糖酵解,产生氢离子被释放到细胞外,因此ecar数值上升,此段反应的是基础糖酵解水平;4)然后给予抑制剂寡霉素,抑制线粒体氧化磷酸化途径产生atp,细胞受此反馈会增强糖酵解途径来产生atp,ecar数值进一步上升,此段反应的是最大糖酵解水平,最大糖酵解水平减去基础糖酵解水平,结果即为糖酵解储备能力。
31.5)然后加入葡萄糖模拟物(2-dg),其可以竞争性结合到己糖激酶(己糖激酶是糖酵解反应的第一个关键的限速酶),糖酵解反应即受到抑制,ecar迅速下降,由此证明步骤3中测得升高的ecar值确实反应了细胞的糖酵解能力。
32.6)最后,细胞的相对糖酵解能力=加入atp合酶抑制剂后第三次ecar值-加入不含葡萄糖的第三次ecar测定值。
33.2、细胞培养液中葡萄糖的检测1)选择处于对数生长期的细胞进行实验,将mir-7(过表达mir-7)、mir-nc(过表达组空白对照)、anti-mir-7(敲低mir-7)、anti-mir-7(敲低组空白对照)转染入lncap和前列腺癌患者来源原代细胞,孵育48小时后进行后续操作;2)吸取细胞培养上清液,以4℃,12000rpm离心10分钟后取上清液,同时将葡萄糖标准品用缓冲液稀释到lnmol/
µ
l。按照0、2、4、6、8、10
µ
l加入到96孔板中,并用缓冲液定容50
µ
l,按顺序加入96孔板中加入待测样品离心后的上清液2
µ
l,并用缓冲液定容至50
µ
l;3)按照葡萄糖检测试剂盒说明书,向每孔中加入50
ꢀµ
l的检测工作液,以37℃环境孵育30分钟后,以570nm波长检测各孔的吸光值。再利用标准孔吸光值绘制出葡萄糖浓度标准曲线,将待测样品的吸光值读数带入曲线,算得样品中葡萄糖浓度值。
34.3、细胞培养基中乳酸含量检测1)选择处于对数生长期的细胞进行实验,将mir-7(过表达mir-7)、mir-nc(过表达组空白对照)、anti-mir-7(敲低mir-7)、anti-mir-7(敲低组空白对照)转染入lncap和前列腺癌患者来源原代细胞中72小时后进行后步操作;2)吸取24孔内细胞培养液,以4℃,12000rpm离心10分钟后取上清液,同时将乳酸标准品用缓冲液按照0、2、4、6、8、10nmol/
µ
l配制,并以50
µ
l每孔按顺序加入96孔板中,同法加入待测样品离心后的上清液50
µ
l;3)每孔中加入509l的检测工作液,以37℃环境孵育30分钟后,以570nm波长检测各孔的吸光值。再利用标准孔吸光值绘制出乳酸浓度标准曲线,将待测样品的吸光值读数带入曲线,算得样品中乳酸浓度值。
35.4、细胞内atp水平检测1)选择处于对数生长期的细胞进行实验,将mir-7(过表达mir-7)、mir-nc(过表达组空白对照)、anti-mir-7(敲低mir-7)、anti-mir-7(敲低组空白对照)转染入lncap和前列腺癌患者来源原代细胞中72小时后进行后步操作;
2)pbs缓冲盐溶液清洗细胞后,在24孔板的每孔内加入50
µ
l细胞裂解液,样品裂解需在4℃或冰上操作,移液器反复吹吸1分钟充分裂解,裂解后以4℃,12000rpm离心10分钟,取上清4℃保存,用于后续测定;3)弱光线环境下,取适量的atp检测试剂,按照1:9的比例用atp检测试剂稀释液稀释atp检测试剂,加100微升atp检测工作液到检测孔或检测管内。室温放置3-5分钟,以使本底性的atp全部被消耗掉,从而降低本底数值。在检测孔或检测管内加上5
µ
l样品或标准品,迅速用移液器混匀,间隔5秒后,用荧光素酶报告基因检测仪测定曝光值并记录(样品预先用bca蛋白定量法定量)。
36.5、cck8实验将转染mir-7(过表达mir-7)、mir-nc(过表达组空白对照)、anti-mir-7(敲低mir-7)、anti-mir-7(敲低组空白对照) 48小的lncap和前列腺癌患者来源原代细胞接种于96孔板中,密度为2000个/孔。将cck8与培养基原液以1:10的比例配制,pbs洗涤细胞,加入含cck8的培养基100
µ
l。96孔板在37℃黑暗中孵育2h后,测od值。细胞贴壁培养后连续监测0h、12h、24h、48h、72h和96h各时间位点,绘制增殖曲线。
37.6、细胞低密度平板克隆形成实验将转染mir-7(过表达mir-7)、mir-nc(过表达组空白对照)、anti-mir-7(敲低mir-7)、anti-mir-7(敲低组空白对照)48小的lncap和前列腺癌患者来源原代细胞接种于96孔板中,密度为1000个/孔,每周更换两次培养基;观察克隆集落形成,待细胞克隆集落形成且集落中细胞个数>50个,吸除培养基,pbs洗涤细胞3次后,4%中性甲醛固定15分钟,0.1%结晶紫染液染色15分钟,pbs冲洗3次后拍照获得克隆集落图像;imagej软件计数克隆团块细胞个数超过50个的克隆团块数量,每组重复三次。
38.7、细胞周期检测1)将mir-7(过表达mir-7),mir-nc(过表达组空白对照)转染进lncap细胞后,待细胞密度达到70%以上,即用于功能实验;2)选取对数生长期且生长密度大于70%的细胞进行实验。pbs清洗细胞后,无edta胰蛋白酶消化,1000rpm离心5分钟,调整细胞浓度为1
×
106/ml;3)制备的细胞悬液经1000rpm离心5分钟弃上清后,弃上清。在细胞沉淀中加入体积分数为70%的预冷乙醇500
µ
l固定3小时;4)固定3小时后,加入100
µ
l rnase a,37℃水浴30分钟;5)加入400
µ
l pi后混匀;流式细胞仪进行检测(实验重复三次)。
39.8、细胞凋亡检测1)对细胞进行转染后,待细胞密度达到70%以上,即用于功能实验;2)选取对数生长期且生长密度大于70%的细胞进行实验,pbs清洗细胞后,胰蛋白酶消化,2000rpm离心5分钟后弃上清;3)pbs再次清洗细胞,随后制备成细胞悬液(3
×
105/ml);4)离心弃上清后加入500
µ
l binding buffer悬浮细胞;5)加入5
µ
l annexin v-fitc/annexin v-apc混匀后,加入5
µ
l pi,混匀并避光置于室温下反应5分钟;6)流式细胞仪检测细胞凋亡率。
40.以上实验过程的结果如图2-4所示。图2中,a和b表明ocr和ecar检测mir-7对前列腺癌lncap细胞的糖酵解的抑制;c、d、e表明lncap转染完mir-7后检测上清中葡萄糖的消耗、乳酸和atp的产生均受到明显抑制。图3中,a、b为lncap细胞转染mir-7、control后进行细胞cck8和克隆实验;c、d为lncap细胞转染mir-7、control后细胞周期和凋亡实验。图4中,a、b、c、d为前列腺癌患者来源原代细胞中转染mir-7后检测对其葡萄糖消耗乳酸产生以及增值克隆的影响;e表明原代细胞中过表达mir-7能够抑制前列腺癌类器官的生长。
41.实施例3mir-7转基因鼠的构建1、载体构建:根据mir-7序列,挑选合适载体,构建cag-mir-7-luc-pa质粒。pcag-gene-intron-bghpa转基因dna片段的序列:tattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggactatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatgcatgggtcgaggtgagccccacgttctgcttcactctccccatctcccccccctccccacccccaattttgtatttatttattttttaattattttgtgcagcgatgggggcggggggggggggggcgcgcgccaggcggggcggggcggggcgaggggcggggcggggcgaggcggagaggtgcggcggcagccaatcagagcggcgcgctccgaaagtttccttttatggcgaggcggcggcggcggcggccctataaaaagcgaagcgcgcggcgggcgggagtcgctgcgttgccttcgccccgtgccccgctccgcgccgcctcgcgccgcccgccccggctctgactgaccgcgttactcccacaggtgagcgggcgggacggcccttctcctccgggctgtaattagcgcttggtttaatgacggctcgtttcttttctgtggctgcgtgaaagccttaaagggctccgggagggccctttgtgcgggggggagcggctcggggggtgcgtgcgtgtgtgtgtgcgtggggagcgccgcgtgcggcccgcgctgcccggcggctgtgagcgctgcgggcgcggcgcggggctttgtgcgctccgcgtgtgcgcgaggggagcgcggccgggggcggtgccccgcggtgcgggggggctgcgaggggaacaaaggctgcgtgcggggtgtgtgcgtgggggggtgagcagggggtgtgggcgcggcggtcgggctgtaacccccccctgcacccccctccccgagttgctgagcacggcccggcttcgggtgcggggctccgtgcggggcgtggcgcggggctcgccgtgccgggcggggggtggcggcaggtgggggtgccgggcggggcggggccgcctcgggccggggagggctcgggggaggggcgcggcggccccggagcgccggcggctgtcgaggcgcggcgagccgcagccattgccttttatggtaatcgtgcgagagggcgcagggacttcctttgtcccaaatctggcggagccgaaatctgggaggcgccgccgcaccccctctagcgggcgcgggcgaagcggtgcggcgccggcaggaaggaaatgggcggggagggccttcgtgcgtcgccgcgccgccgtccccttctccatctccagcctcggggctgccgcagggggacggctgccttcgggggggacggggcagggcggggttcggcttctggcgtgtgaccggcggctctagagcctctgctaaccatgttcatgccttcttctttttcctacagctcctgggcaacgtgctggttattgtgctgtctcatcattttggcaaagagctagaactcgagacaagttcggtaccttggatgttggcctagttctgtgtggaagactagtgattt (seq id no.7)。
42.2、小鼠准备:1)胚胎供体小鼠的准备:向成熟雌鼠腹腔内注射5.0iu的孕马血清促性腺激素(pmsg),一般是在下午13~14点注射pmsg,约在48 h后再注射5.0iu的人绒毛膜促性腺激素(hcg),并立即与雄鼠合笼。翌日清晨,检查雌鼠的阴道栓,交配成功的雌鼠将用于回收胚胎。为了获得较好的超排效果,一般多选用3~6周龄的雌鼠。而雄鼠大约在8周龄以上达到
性成熟,并且可以一直使用到其繁殖性能下降时(6~8月龄)将其淘汰。
43.2)胚胎移植受体小鼠的准备:为了获得用作胚胎移植受体的假孕母鼠,一般会在进行胚胎移植的前一天,将结扎输精管的公鼠与自然发情的母鼠合笼。然后在胚胎移植当天的清晨,将见栓的雌鼠取出备用。假孕鼠一般用价格便宜,母性好的icr或km小鼠。
44.3、胚胎收集:将见栓的小鼠处死后,打开腹腔,小心地分离输卵管。接着将输卵管放进含有透明质酸酶的m2培养基中,刚排出的合子由于卵丘细胞包围,会在壶腹部形成一个“云雾团”,用钟表镊子撕开壶腹部,“云雾团”由于受到输卵管内部压力而被挤出。在透明质酸酶的作用下,合子逐渐脱去卵丘细胞,然后将合子在m2培养基中移洗一次,转入事先平衡好的ksom微滴中培养待注射。
45.4、显微注射:显微注射的时间一般选择在中午至下午16点左右,此时小鼠合子的原核处于逐渐膨胀的阶段,比较容易识别和注射。显微注射用的持定针可直接装载于操作仪上,注意不要产生气泡。向注射针中装载注射用样品的方法可采用尾部虹吸法或者用microloader tip直接注入。
46.1)用m2在载玻片上做一长形液滴,并用石蜡油覆于其上即可做成显微操作滴。用移卵管将一组合子转移到操作滴中。
47.2)于镜下观察,确定注射针针尖未堵塞,dna液流顺畅。
48.3)在高倍镜下观察合子,选择双原核并且形态良好的合子。将持定针调整到邻近合子的位置,并调节压力以负压固定。要求原核应尽可能处于持定针的中轴线上。
49.4)持定针再稍加负压以确保将合子固定牢靠,微调焦距,使原核的边缘最清晰。然后再移动注射针,使针尖完全清晰。
50.5)推动注射针穿过透明带,进入卵胞质并慢慢接近原核。如果原核膨胀则表明注射成功。此时应立即将注射针撤出。
51.6)操作滴中所有合子注射完毕后,应置于ksom中在37℃培养一段时间,用于下一步的胚胎移植。注意观察并做好记录。
52.5、胚胎移植:1)将小鼠称重并经腹腔注射麻醉剂。麻醉后,将小鼠置于垫板或纸上,以便于在显微镜下操作。按常规手术方法拉出卵巢、输卵管和部分子宫角。将注射后的合子吸入移植管。在吸入胚胎前可先吸2~3个小气泡,这样能够很好的控制液体的进出,并且对移植的成功有指示作用。
53.2)用钝头镊子夹住卵巢的脂肪垫将其拉出,并用小的血管夹夹住固定,将卵巢、输卵管和一部分子宫暴露于体外。在显微镜下找到输卵管的开口(输卵管伞)或膨大的输卵管壶腹部,一般选择这两个部位作为移植的入口。调整好小鼠和输卵管的位置,将移植针插入输卵管伞,轻轻将胚胎吹入,若在输卵管内看到气泡就说明移植成功。松开血管夹,将卵巢、输卵管和子宫还原回体内,缝合体壁。
54.3)术后将小鼠置于干净的鼠笼内,盖住眼睛。可放在37℃的热台上,直到其苏醒。
55.6、founder鼠鉴定:1)待小鼠成长至7天左右,剪取小鼠脚趾(或尾巴、耳廓等组织),放入1.5ml洁净离心管中;2)待小鼠成长至7天左右,剪取小鼠脚趾(或尾巴、耳廓等组织),放入1.5ml洁净离
心管中;3)按500μl裂解液 5μl蛋白酶k的比例,配制组织消化液;4)加500μl消化液至离心管中,同时离心使小鼠脚趾沉淀至管底;5)55℃放置5 hours,使之充分消化,然后取出短暂离心;6)加入等体积酚氯仿,混合均匀,12,000rpm离心5min;7)吸出上清并丢弃,加入等体积三氯甲烷,轻轻混合均匀,并于4℃,12,000rpm离心10min;8)吸尽上清,加2.5倍体积的无水乙醇和0.1倍体积的naac(3m,ph=5.2),-20℃放置30min;9)取出后在4℃,12,000rpm离心5min,此时应观察到管底有白色沉淀产生;10)同时除去液体(注意不要吸到白色沉淀),室温静置使乙醇充分干燥挥发,最后用灭菌纯水进行溶解,测定溶度;11)基因组短期于4℃保存,长期保存于-20℃。
56.7、双小鼠杂交:将mir-7转基因鼠与tramp鼠进行杂交,pcr鉴定获得mir-7 tramp双阳转基因鼠。
57.8、he和免疫组化鉴定:分别在15和20周龄获取双转基因小鼠前列腺组织,通过he染色及免疫组化染色确定两种不同类型小鼠在前列腺大小、体积、病理学分期分级方面有何差异。
58.以上实验过程的结果如图5-7所示。图5中,a为mir-7转基因小鼠及双转基因小鼠构建模式图;b为构建cag-mir-7-luc-pa质粒模式图。图6中,a为pcr样品检测结果,b琼脂糖凝胶电泳结果;结果证实;小鼠组织来源rna携带所转目的基因。图7中,a为15周双转基因鼠与tramp小鼠的前列腺he和免疫组化结果比较;b为20周双转基因鼠与tramp小鼠的前列腺he和免疫组化结果比较,结果显示:携带mir-7基因小鼠能够明显延长生存期,并且抑制原位前列腺癌的进展。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
