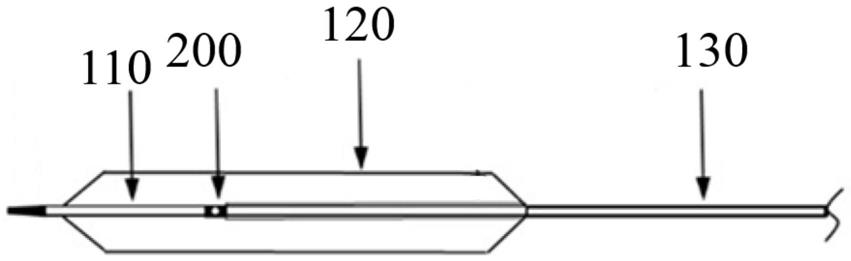
1.本发明属于医药技术领域,具体涉及一种钠钾镁钙葡萄糖注射液药物组合物及其制备方法。
背景技术:
2.在人体组成成分中,水分约占人体体重的60%。体液平衡对人体具有重要作用,它可以维持人体内环境的稳态。临床上各种创伤、手术及多种疾病都会引起机体体液平衡失调,而严重体液平衡失调会导致机体组织器官、系统功能障碍,甚至休克死亡。因此,晶体溶液应运而生。
3.目前临床上用于细胞外液补充液有:生理盐水、林格液、乳酸林格液(含糖和不含糖两种)、醋酸林格液(含糖和不含糖两种)、碳酸氢钠林格液等。在生理盐水和林格液中,由于氯离子浓度较高,此类电解质在大量快速输液时会导致酸中毒。目前临床使用较为广泛的为乳酸林格液,但此类电解质注射液含有较多的乳酸(乳酸根的浓度可高达28meq/l),大量输液时会使血液中乳酸值上升,由于乳酸主要在肝脏中代谢,当肝脏机能低下时可导致乳酸代谢障碍,引起高乳酸血症。用醋酸钠代替乳酸钠作为碱化剂的醋酸林格液已出现。醋酸不仅在肝脏中代谢,且醋酸自骨骼肌开始几乎在机体的所有组织中分布。最新一代的林格液为碳酸氢钠林格注射液,是以碳酸氢钠代替醋酸钠和乳酸钠作为碳酸氢根的来源。但是乳酸林格液、醋酸林格液和碳酸氢钠林格液中的钠离子浓度(130meq/l)均低于血浆中的钠离子浓度,因此,这类电解质在输液时容易引起低钠血症。
4.与常规补液相比,钠钾镁钙葡萄糖注射液具有明显的临床治疗优势,其所含各种离子的摩尔浓度(na 140meq/l,mg2 2meq/l)、渗透压及ph值与人体血浆电解质组成相接近,不增加肝肾代谢的负担,可用于治疗因循环血液量减少所致的休克及手术、外伤、烫伤、大出血等因素所致的组织液减少,用以补充、调整细胞外液。在人体血浆中由于氯离子浓度低于钠离子,与等渗的生理盐水相比,钠钾镁钙葡萄糖注射液中的na /cl-更接近生理比值,可以避免大量补液时发生高氯性代谢性酸中毒及低钠血症。本品中含有镁离子,可避免大量、急速给药时可能出现的低镁血症。此外,加入1%的葡萄糖可以抑制体内低血糖及脂肪代谢分解,有利于血糖和脂肪的代谢平衡,而不会引起高血糖和尿糖排泄。
5.常用的钠钾镁钙葡萄糖注射液的参比制剂是日本大冢制药株式会社的“physio140injection”,该产品的专利“zl200710059911.1复方醋酸钠电解质注射液及其制备方法”公开了一种复方醋酸钠电解质注射液的制备方法。该产品的ph值为6.0-6.1,灭菌条件为110℃40min。经计算,110℃40min灭菌的f0值仅为3.18,不符合我国注射液需采取终端灭菌工艺的要求,无菌保证效果差,不能有效灭杀微生物、热源等,存在非常高的安全隐患。。此外,该专利中亦未描述该制备方法对产品中葡萄糖降解的影响。专利“cn201510042510.x一种钠钾镁钙葡萄糖注射液的制备方法”对照例3中公开了一种钠钾镁钙葡萄糖注射液的制备方法,其中产品的ph值为6.0,灭菌工艺为121℃灭菌12min,得到的产品中葡萄糖的含量为89.1%,杂质5-羟甲基糠醛含量高达0.162%。可见,当产品ph值为
6.0,采用符合我国注射剂灭菌要求的121℃高温灭菌12min后,葡萄糖降解杂质却大大增加,提高了产品的使用风险。
6.因此,本领域普遍认可,为获得符合我国灭菌要求的钠钾镁钙注射液,经终端灭菌工艺的钠钾镁钙葡萄糖注射液的ph值只有在4.0~5.5时,才能保证注射液中葡萄糖的稳定性,因此市面上的同类产品的ph值均在此列。
技术实现要素:
7.本发明提供了一种钠钾镁钙葡萄糖注射液组合物及其制备方法,该注射液含有氯化钠、氯化钾、葡萄糖酸钙、氯化镁、醋酸钠、枸橼酸钠、葡萄糖,所述注射液采取终端灭菌制得,所得钠钾镁钙葡萄糖注射液无菌保障水平高,同时注射液所含各种离子的摩尔浓度、渗透压及ph值与人体血浆电解质组成相接近,可用于循环血量及组织间液减少时的细胞外液补充,代谢性酸中毒的纠正。
8.在实施方案中,所述注射液采取终端灭菌制得,其f0值范围选自8<f0≤27,优选10≤f0≤27,更优选12≤f0≤25。
9.在实施方案中,所述注射液的ph值为5.5~7.0,优选ph值为5.9~6.2,更优选ph值为6.0。
10.本发明中f0值是以嗜热脂肪芽孢杆菌为微生物指示剂,将不同灭菌温度和时间折算到相同灭菌效力的121℃湿热灭菌所相当的时间(分),当f0值大于8时,即可确认达到可靠的灭菌效果。计算公式如下:
[0011][0012]
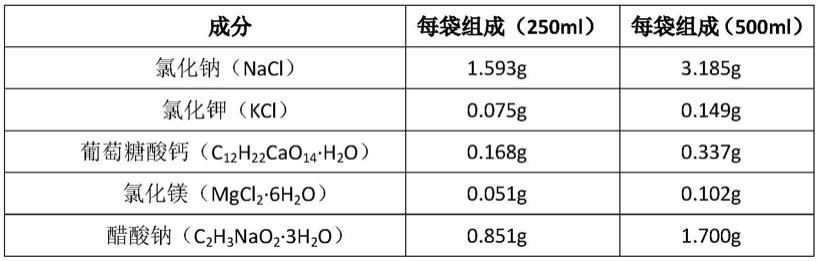
本发明提供的钠钾镁钙葡萄糖注射液组合物,250ml、500ml规格的注射液按以下述重量配比的物质制成:
[0013][0014][0015]
本发明提供的钠钾镁钙葡萄糖注射液组合物及其制备方法,采用终端灭菌工艺,可以进一步提高灭菌效果,确保钠钾镁钙葡萄糖注射液的无菌性。
[0016]
在实施方案中,终端灭菌工艺为过度杀灭法或残存概率法。
[0017]
在实施方案中,终端灭菌工艺采用的灭菌温度为121℃,灭菌时间为6~8分钟,优选灭菌时间为8分钟。
[0018]
经申请人研究发现,葡萄糖溶液的稳定性与溶液温度和ph值均有关,在弱酸或碱性条件下,葡萄糖容易降解,产生5-羟甲基糠醛和果糖。而当灭菌工艺采用的灭菌温度过高或灭菌时间过长时,也会导致溶液中葡萄糖的降解。本发明所述注射液及其制备方法,克服了现有技术中的技术偏见,当产品的ph值为5.5~7.0时,仍采用121℃高温灭菌6~8分钟,得到的终产品无菌保障水平高,溶液中葡萄糖的稳定性好,降解杂质5-羟甲基糠醛含量极低,仅产生少量对人体无害的果糖,符合我国注射液相关的工艺和质量要求,适于工业大规模生产和运用。
[0019]
本发明所述注射液及其制备方法,可同时兼顾葡萄糖的稳定性和注射液的无菌保障水平,还能使得注射液的ph值与人体血浆ph值更接近,从而降低对血管的刺激性,减少过敏反应的发生。
[0020]
本发明所述的药物组合物及其制备方法,在该ph值和终端灭菌条件下,葡萄糖含量在灭菌后有下降趋势,且所述葡萄糖在灭菌后会降解为果糖,但果糖仍处于较低水平,远小于果糖的使用限度。
[0021]
本发明提供的钠钾镁钙葡萄糖注射液的制备方法,包括:1)将葡萄糖酸钙、氯化钠、氯化钾、氯化镁、枸橼酸钠、醋酸钠、无水葡萄糖溶于注射用水中;2)用盐酸调节药液ph值;3)过滤后灌装于复合膜袋中;4)终端灭菌。
[0022]
进一步地,本发明所述制备方法,包括:
[0023]
1)采用带搅拌桨的不锈钢配制罐配制,先加入约25%总重量的注射用水,投入处方量的葡萄糖酸钙,搅拌使其溶解;
[0024]
2)向配制罐补加注射用水至约90%总重量,冷却至50~60℃,投入其他原料药(氯化钠、氯化钾、氯化镁、枸橼酸钠、醋酸钠、无水葡萄糖),搅拌溶解;
[0025]
3)向配制罐补加注射用水至约99%总重量,用2mol/l盐酸调节药液ph值,边加酸边调节,搅拌混合均匀。最后加入注射用水至全量,搅拌混匀;
[0026]
4)药液冷却至40℃后进行过滤,使药液通过5根并联的0.45μm聚醚砜过滤器预过滤,再通过5根并联的0.2μm聚醚砜除菌过滤器在管道内循环15min后进行中间体药液的过滤;
[0027]
5)药液灌装于250ml或500ml复合膜袋中,于水浴灭菌柜灭菌,即得钠钾镁钙葡萄糖注射液。
具体实施方式
[0028]
以下结合实施例进一步描述本公开中,但这些实施例并非限制本公开中的范围。
[0029]
实施例1:制备钠钾镁钙葡萄糖注射液(250ml/袋,21000袋)
[0030]
表1钠钾镁钙葡萄糖注射液的处方组成及用量(250ml/袋,21000袋)
[0031]
物料名称每袋组成21000袋批处方量氯化钠1.593g33.453kg氯化钾0.075g1.575kg
氯化镁0.051g1.071kg葡萄糖酸钙0.168g3.528kg枸橼酸钠0.147g3.087kg醋酸钠0.851g17.871kg无水葡萄糖2.500g52.500kg盐酸适量适量注射用水加至250ml加至5250l
[0032]
制备方法:
[0033]
1)采用带搅拌桨的不锈钢配制罐配制,先加入约25%总重量的注射用水,投入处方量的葡萄糖酸钙,搅拌使其溶解;
[0034]
2)向配制罐补加注射用水至约90%总重量,冷却至50~60℃,投入其他原料药(氯化钠、氯化钾、氯化镁、枸橼酸钠、醋酸钠、无水葡萄糖),搅拌溶解;
[0035]
3)向配制罐补加注射用水至约99%总重量,用2mol/l盐酸调节药液ph值,边加酸边调节,搅拌混合均匀。最后加入注射用水至全量,搅拌混匀;
[0036]
4)药液冷却至40℃后进行过滤,使药液通过5根并联的0.45μm聚醚砜过滤器预过滤,再通过5根并联的0.2μm聚醚砜除菌过滤器在管道内循环15min后进行中间体药液的过滤;
[0037]
5)药液灌装于250ml或500ml复合膜袋中,于水浴灭菌柜灭菌,即得钠钾镁钙葡萄糖注射液。
[0038]
实施例2:制备钠钾镁钙葡萄糖注射液(500ml/袋,15000袋)
[0039]
表2钠钾镁钙葡萄糖注射液的处方组成及用量(500ml/袋,15000袋)
[0040][0041][0042]
采用与实施例1相同的方法制备钠钾镁钙葡萄糖注射液,不同的是:两个规格的处方量存在因四舍五入进位导致的末位数字不同。
[0043]
实施例3:钠钾镁钙葡萄糖注射液ph值研究
[0044]
表3 ph值筛选结果
[0045][0046]
注:“*”表示吸光度检测值。
[0047]
由表3结果可知,采用121℃灭菌15min和121℃灭菌12min作为灭菌条件,ph值为5.0和5.5时,灭菌后药液中的葡萄糖含量基本不变。当ph值超过5.5时,随着ph值的升高,灭菌后药液中葡萄糖含量逐渐下降,降解杂质果糖的产生量逐渐增多。
[0048]
采用121℃灭菌8min的灭菌条件进行灭菌的药液结果如表4。
[0049]
表4 ph值进一步研究的结果
[0050][0051]
注:1)“*”表示吸光度检测值;2)本批药液采用121℃8min灭菌。
[0052]
由表4结果可知:
[0053]
1)在ph值5.9~6.2范围内,随着ph值的升高,灭菌后药液中的葡萄糖降解程度逐渐增大。
[0054]
2)在ph值5.9~6.2范围内,随着ph值的升高,灭菌后药液中的葡萄糖含量逐渐下降,5-羟甲基糠醛产生量也逐渐增加。
[0055]
3)在ph值5.9~6.2范围内,灭菌前均未检测出果糖,而灭菌后的果糖产生量随着样品ph值上升而增大。
[0056]
实施例4:钠钾镁钙葡萄糖注射液灭菌工艺研究
[0057]
表5灭菌条件筛选结果
[0058][0059]
注:“*”表示吸光度检测值。
[0060]
由表5结果可知,自制制剂采用灭菌温度为121℃下的不同时间进行灭菌,随着灭菌时间的延长,灭菌后药液中的葡萄糖降解程度逐渐增大,同时果糖产生量增加。对比121℃和115℃下的灭菌效果,可以看出达到相同的f0值时,采用121℃进行灭菌时葡萄糖的含量下降量小于115℃,说明高温、短时间的灭菌工艺更有利于维持葡萄糖的稳定。
[0061]
经查阅资料,果糖在fda非活性成分数据库(fda iig限度)的用量上限为5%(w/v),而ph值为6.0的药液中葡萄糖的含量约在93~95%范围内,降解产物果糖约为0.05~0.06%(w/v),远小于果糖的使用限度。
[0062]
生产验证期间,我们统计了多批次产品121℃灭菌8min的灭菌f0值,结果见表6。
[0063]
表6产品的灭菌f0值
[0064][0065]
上表结果显示,在实际生产过程中,121℃灭菌8min的f0值大于12,达到过度杀灭的要求,能保证无菌,保证注射液的安全性。
[0066]
实施例5:钠钾镁钙葡萄糖注射液灭菌f0值的确定
[0067]
为了考察产品能耐受的f0值,我们按照处方配制药液,考察不同灭菌工艺前后相
关指标的变化。(115℃灭菌32min、121℃灭菌8min、121℃灭菌15min、121℃灭菌20min、121℃灭菌25min、121℃灭菌30min)考察结果见表7。
[0068]
表7 f0值筛选结果
[0069][0070]
注:“*”表示吸光度检测值。
[0071]
由表7结果可知,
[0072]
1)ph约为6.0的药液采用灭菌温度为121℃下的不同时间进行灭菌,随着灭菌时间的延长,f0值逐渐增加,同时灭菌后药液中的葡萄糖降解程度逐渐增大,果糖产生量增加。
[0073]
2)对比121℃和115℃下的灭菌效果,可以看出达到相同的f0值时,采用121℃进行灭菌时葡萄糖的含量下降量小于115℃。
[0074]
为了更好的保证产品质量,降低各项指标灭菌后的变化幅度,需将产品的f0值范围控制在8~27(8<f0≤27)。
[0075]
实施例6:特殊安全性研究
[0076]
1、兔溶血性、血管刺激性试验
[0077]
选择新西兰兔的红细胞进行溶血试验。结果表明,在实验条件下,供试品对兔血红细胞均无明显的体外溶血及致凝作用。
[0078]
用肉眼形态学、组织病理学方法观察供试品耳缘静脉滴注对新西兰兔耳缘静脉及其周围组织是否有刺激作用。结果显示,给药体积为10ml/kg,给药速度为1050ml/h,每天给药1次,连续给药7天,在末次给药后72h及恢复期结束未发现供试品对新西兰兔耳缘静脉及其周围组织的刺激作用。
[0079]
2、豚鼠主动全身过敏试验
[0080]
hartley豚鼠连续3次隔日腹腔注射给予钠钾镁钙葡萄糖注射液供试品,致敏体积均为0.5ml/只;末次致敏后第14天和21天分别静脉注射2倍致敏剂量进行激发,激发体积均为1.0ml/只。结果显示,在本试验条件下,供试品豚鼠主动全身过敏反应为阴性。
[0081]
3、大鼠被动皮肤过敏试验
[0082]
sd大鼠连续3次隔日皮下分别注射钠钾镁钙葡萄糖注射液供试品0.5ml与佐剂0.5ml混合乳液1.0ml/只致敏,末次致敏后第10天取血制备抗血清。致敏血清按原液、1:2、1:4、1:8倍比稀释,大鼠背部皮肤皮内注射0.1ml各浓度致敏血清被动致敏,24h后静脉分别注射与致敏剂量相同抗原激发。结果显示,在本试验条件下,供试品过敏反应未见阳性结果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。