1.本发明涉及色谱层析技术领域,具体涉及一种复合型阴离子层析介质及其制备方法,及在抗体蛋白纯化中的应用。
背景技术:
2.随着生物医药市场的飞速发展,抗体类药物对疾病具有优异的疗效和安全性,已经在肿瘤类、心血管类,特别是自身免疫性疾病的治疗过程中逐步凸显重要作用,是目前生物类药物中增长率最高的一类药物。其中,单克隆抗体(mab)凭借其优异的特性,已经成为研究热点。由于mab大规模高效培养技术的不断创新,抗体蛋白(也称免疫球蛋白)的表达浓度大幅提高,这给抗体蛋白纯化带来了巨大的压力。为了以更加简单高效的方式获得高度纯化的抗体蛋白,已有大量研究人员对抗体分离纯化方法进行研究。
3.传统的抗体蛋白的分离方法是基于选择性可逆沉淀含抗体蛋白的片段,同时去除溶液中其他蛋白。所用的试剂通常为乙醇、聚乙二醇、硫酸铵、磷酸钾或辛酸等。传统分离方法制备的产品纯度较低并且耗时耗力,另外用到的试剂会造成严重的环境问题。因此,目前常用的抗体蛋白纯化方法通常为色谱层析法。它是利用两个互不混溶的相(固定相和流动相),在分离体系中,流动相内需要纯化的样品与固定相进行一系列相互作用,利用样品物理或化学性质的差异,达到分离的目的。为了提高分离纯化的效率,研究人员正努力开发最优异的层析介质(固定相)。层析介质一般由含官能团的配体以及固相载体构成,根据每种层析介质不同的相互作用原理来进行分离纯化。一般采用经典的三步纯化策略:粗纯-中间纯化-精细纯化。粗纯的主要目的是捕获、浓缩和稳定样品,为了去除各种潜在的杂质以满足药品安全的要求,因此在粗纯之后还需要进行中间纯化和精细纯化,去除宿主细胞蛋白(hcp)、宿主dna、抗体聚集体和变体等,常用的层析技术可分为亲和纯化介质、离子交换介质、疏水介质、凝胶过滤介质等。
4.离子交换介质常用于分离免疫球蛋白,主要分为阴离子交换介质和阳离子交换介质两类。在阴离子交换色谱法中,免疫球蛋白负电荷氨基酸端链将与层析介质的正电荷配体相互作用。相反,阳离子交换色谱即免疫球蛋白的正电荷氨基酸端链将与层析介质的负电荷配体相互作用。为了拓宽离子交换介质的应用范围,早在1997年,专利wo9729825(amersham pharmacia biotech ab)公开一种混合型阴离子交换介质,可以提供正电荷和氢键双重相互作用。另外,专利wo9965607(amersham pharmacia biotech ab)公开了一种混合型阳离子交换介质,可以提供负电荷和氢键双重相互作用。但是上述两个专利中提到的层析介质结合物质较为牢固,在洗脱被结合物质时均要求较高的洗脱离子强度,可能会引起大分子物质的变性。
5.为了解决上述问题,专利wo0138228(belew等人)公开了一种混合型的高盐配体,每个配体包括一个正电荷氮和一个距所述正电荷氮1-7个原子距离的硫醚键,可以通过该阴离子交换介质去除样品中的负电荷物质。并且其可以在高盐浓度下(如0.25m nacl)下吸附目标物质。由于其耐高盐浓度的性质,在分离纯化的过程中不需要稀释样品,这就大大减
小了所需样品的总体积,可以降低成本简化工作。但是,这种混合型阴离子层析介质的制备过程中不可控,会造成不同的配体产物,严重影响分离纯化的效果,可能会导致比普通介质更低的分离纯化效率。
6.而专利us6702943(johansson等人)公开了含阴离子交换基团和疏水性结构配体的混合型阴离子层析介质。此外,已有的一些商品化混合阴离子层析介质,如cytiva公司的capto adhere也是一种含阴离子交换基团和疏水性结构配体的混合型阴离子层析介质。这些混合型阴离子层析介质在制备过程中的配体组成比较容易控制,具有较好的分离纯化效果。但是上述层析介质的制备过程往往比较复杂,涉及到各种毒性较强的化学试剂,例如各类含有苯环结构的物质。同时,在制备过程中涉及到水相和有机溶剂的各种调换以及混合问题,更加费时费力,同时废弃有机溶剂的处理也是一大难题。
技术实现要素:
7.在一方面,本发明提供了一种复合型阴离子层析介质及其在抗体蛋白分离纯化中的应用,该层析介质具备高选择性与高效能的分离作用,较高的动态结合载量,及较低的洗脱离子强度,所采用的技术方案为:一种复合型阴离子层析介质,包括基质与功能配基,所述功能配基为交联活化剂共价结合的环氧类胺盐与聚乙烯吡咯烷酮,所述环氧类胺盐键合至基质表面。
8.在一些实施方案中,所述基质为选自葡聚糖、琼脂糖和纤维素的多糖类。
9.在一些实施方案中,所述基质为选自聚苯乙烯、聚乙烯和二氧化硅的合成高分子。
10.在一些实施方案中,所述环氧类胺盐为包含伯胺基、仲胺基、叔胺基或季胺基的胺或胺盐,并且具有取代或未取代的c
1-20
直链或支链的烷烃或烯烃。
11.在一些实施方案中,所述环氧类胺盐碳链上的取代基选自氨基、羟基和卤素。
12.在一些实施方案中,所述交联活化剂为包含烯丙基的双官能团或多官能团取代的化合物,所述官能团选自卤素、环氧基和羧基。
13.在一些实施方案中,所述交联活化剂为烯丙基缩水甘油醚。
14.另一方面,本发明提供一种制备上述复合型阴离子层析介质的方法,其制备过程简便,所用化学试剂毒性低且仅用到水相,构成一种环境友好的制备方法,所采用的技术方案为:包括步骤:将适量配比的环氧类胺盐在开环温度下加入到碱性基质中充分反应,以使环氧类胺盐接枝到基质上;在上述反应产物中加入适量的交联活化剂与环氧类胺盐开环后的羟基反应,以活化胺盐配体;在活化后的胺盐配体中加入乙烯基吡咯烷酮,且使乙烯基吡咯烷酮在引发剂作用下聚合并接枝到交联活化剂上,从而获得复合型阴离子层析介质。
15.在一些实施方案中,所述交联活化剂为烯丙基缩水甘油醚,其所含环氧基在开环温度下与环氧类胺盐开环后的羟基反应,且其所含烯丙基与聚乙烯吡咯烷酮反应。
16.本发明采用以上技术方案至少具有如下的有益效果:
17.1.n-乙烯吡咯烷酮(nvp)是聚乙烯吡咯烷酮(pvp)的前体,pvp是一种具有溶解性、低毒性、生物相容性、化学稳定性、生物惰性优异的均聚物,广泛应用于医疗卫生、日用化工、食品、饮料、酿酒、纺织印染等领域,n-乙烯基吡咯烷酮上存在酰胺键,能与多肽上的酰胺键形成氢键,达到纯化的目的;环氧类胺盐可与带负电荷的多肽结合,起到分离纯化的效用;本技术采用环氧类胺盐与聚乙烯吡咯烷酮复配的层析介质,除具备高选择性与高效能
的分离作用之外,还具有较高的动态结合载量,及较低的洗脱离子强度。
18.2.本技术提供的复合型阴离子层析介质用于填充至层析柱中,所获得的层析柱可用于纯化蛋白,具体为抗体、抗体片段或含抗体的融合蛋白。
19.3.本技术提出的复合型阴离子层析介质的制备方法,其制备过程简便,所用化学试剂毒性低且仅用到水相,构成一种环境友好的制备方法。
附图说明
20.为了更清楚的说明本发明实施例中的技术方案,下面将对实施例中所需要使用的附图作简单的介绍,显而易见地,下面描述的附图仅仅是本发明的一些实施例,对于本领域的普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
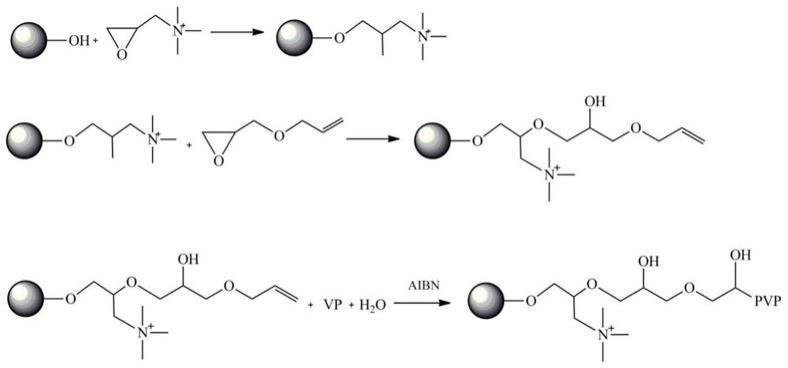
21.图1为本发明实施例2所述的复合型阴离子层析介质的合成路线图;
22.图2为本发明实施例3所述的复合型阴离子层析介质的功能谱图;
23.图3为本发明实施例3所述的q beatarose ff层析介质的功能谱图;
24.图4为本发明实施例4所述的复合型阴离子层析介质10%动态载量测定的谱图;
25.图5为本发明实施例5所述的q beatarose ff层析介质10%动态载量测定的谱图。
具体实施方式
26.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。实施例中所用到的各种常用试剂,均为市售产品。
27.实施例1
28.基于乙烯基吡咯烷酮上存在的能与多肽键合的酰胺键及环氧类胺盐携带的能与抗体蛋白负电荷氨基酸端链相互作用的正电荷,发明人设计了一种复合型阴离子层析介质,包括基质与功能配基,功能配基为交联活化剂共价结合的环氧类胺盐与聚乙烯吡咯烷酮,环氧类胺盐键合至基质表面。
29.在一些较佳的实施方式中,基质为天然高分子或合成高分子,其中,天然高分子为多糖类,选自葡聚糖、琼脂糖和纤维素;合成高分子选自聚苯乙烯、聚乙烯和二氧化硅。
30.在另一些较佳的实施方式中,环氧类胺盐为包含伯胺基、仲胺基、叔胺基或季胺基的胺或胺盐,并且具有取代或未取代的c
1-20
直链或支链的烷烃或烯烃,其中,环氧类胺盐碳链上的取代基选自氨基、羟基和卤素。
31.在又一较佳实施方式中,交联活化剂为包含烯丙基的双官能团或多官能团取代的化合物,该官能团选自卤素、环氧基和羧基,优选为烯丙基缩水甘油醚。
32.实施例2:参阅图2,复合型阴离子层析介质的制备
33.1)高刚性琼脂糖基质上引入2,3-环氧丙基三甲基氯化铵(gta)
34.取100g高刚性琼脂糖(bestarose 6ff)加入到圆底烧瓶,加入1kg纯净水,充分搅拌使其溶胀,加入110g na2so4,在30℃搅拌1小时后,将15ml 1m氢氧化钠溶液加入到圆底烧瓶中,搅拌溶解后,升温至55℃,加入50g gta反应8小时。产物用无水乙醇洗涤3次,纯化水
洗涤一次,抽滤得到琼脂糖-gta凝胶。
35.2)烯丙基甘油醚活化
36.取100g步骤(1)中制备的琼脂糖-gta加入圆底烧瓶中,加入1kg纯净水,加入70g氢氧化钠,搅拌溶解后加入烯丙基甘油醚,在55℃反应12小时。12小时后,依次用10倍体积的纯化水、乙醇、纯化水洗涤得到的活化凝胶。
37.3)接枝乙烯基吡咯烷酮(vp)
38.将100ml上述凝胶过滤,用5l纯化水多次洗涤后,用3
×
150ml 1.0m硫酸钠洗涤,每次洗涤后过滤抽干。将上述凝胶和1.0m硫酸钠溶液(总重244.7g)加入至圆底烧瓶中,再加入26.3g乙烯基吡咯烷酮和0.25g自由基引发剂偶氮二异丁氰(aibn)。在200rpm下通氮气25分钟,将圆底烧瓶置于甘油浴(45℃),反应至形成聚合物悬浮液(直径约为2mm)。继续反应过夜后,加入200g纯化水以稀释反应溶液。过滤后,依次用20l纯化水和1l 20%乙醇洗涤。
39.实施例3:复合型阴离子配体层析介质和q beatarose ff层析介质功能测定
40.用β-lactoglobulin(β-lactoglobulin a和β-lactoglobulin b)和katg来检测层析介质的功能,用线性升高的盐浓度梯度来洗脱蛋白,根据蛋白的保留体积来评估介质的功能是否合格。
41.(1)实验样品及试剂
42.缓冲液a:20mm六水哌嗪(ph 6.20
±
0.05);缓冲液b:20mm六水哌嗪,0.3m nacl(ph 6.20
±
0.05);1%丙酮;β-lactoglobulin;kat g。
43.(2)实验方法
44.a)装柱:称取6g湿胶介质,加入等量水制成50%悬液,将悬液倒入ezsscreen 4.4ml柱管中,用1.5ml/min流速装柱10min。
45.b)柱效测定:将装好的层析柱连接到exploer 100系统上,用纯化水以0.4ml/min的流速平衡层析柱直至电导平稳。在load状态下将1%丙酮注入到100μl上样环中。在inject状态下,以0.4ml/min的流速测定层析柱柱效,紫外峰完全出来且与平衡相同时结束程序。通过unicorn软件对紫外峰进行积分,用软件计算出理论塔板数n及不对称因子as(n≥3000,as应在0.8-1.5范围内)。
46.c)层析柱平衡:将层析柱连接到exploer 100系统上,用平衡缓冲液以1ml/min的流速平衡柱子,直至基线平稳。
47.d)上样:称取22mgβ-lactoglobulin,用1ml kat g溶解,然后用0.45μm滤膜过滤。将上述样品注入1000μl上样环,并运行exploer100系统程序。
48.(3)结果分析:根据样品的出峰时间,计算样品的保留体积。
49.图2和图3分别为混合型阴离子配体层析介质和q beatarose ff层析介质功能测定结果。由图2和图3对比,明显可以看出图2所得三个峰之间无明显拖尾现象且峰形对称,与常规q beatarose ff层析介质相比,本发明混合型阴离子配体层析介质具有更高选择性和更高效能的分离作用。
50.实施例4:复合型阴离子配体层析介质10%动态载量测定
51.用浓度为4.0mg/ml的牛血清白蛋白(bsa)做蛋白样品,在高ph条件下与混合型阴离子配体层析介质结合,当有10%蛋白流穿时,计算介质结合载量。
52.(1)实验样品及试剂
53.装柱溶液:20%乙醇,0.2m nacl;缓冲液a:50mm tris(ph 8.0
±
0.05);缓冲液b:50mm tris 1m nacl(ph 8.0
±
0.05);1%丙酮。
54.样品:取0.64g bsa于烧杯中加入适量的缓冲液a,用分光光度计测定280nm下的吸光值,使样品最终浓度为4.0
±
0.1mg/ml。
55.(2)实验方法
56.a)装柱:称取10ml介质,用装柱溶液清洗3次后,抽干。将7g介质转移至烧杯中,加入10ml装柱溶液混匀。取5ml胶悬液倒入装好装柱器的bhr5/100柱管中,装柱器上层用装柱溶液填满。先用25ml/min的流速压柱4min,卸下装柱器,调整胶面高度为10cm
±
0.2cm。装上上柱头,继续压柱2min,胶面处划线,停止流速,旋下上柱头,使柱头压至划线处。
57.b)柱效测定:将装好的层析装柱连接到akta上,用20%的乙醇以0.33ml/min的流速平衡层析柱直至电导平衡。确保在load状态下将1%丙酮,20%乙醇溶液注入到20μl上样环中,将上样阀改为inject状态,以0.2ml/min的流速测定层析柱柱效,紫外峰完全出来后结束程序。通过unicorn软件对紫外峰进行积分,计算出理论塔板数n及不对称因子as。(as应在0.8-1.4范围内)
58.c)层析柱平衡:用缓冲液a清洗泵后,将层析柱连接到akta系统上,用缓冲液a以2.0ml/min的流速平衡层析柱直至基线平稳。
59.d)样品uv测定:将紫外归零,样品以2.0ml/min流速经bypass经过紫外检测器,稳定后记录样品的紫外吸收值。停止进样,并用缓冲液a冲洗掉系统管路中的样品。
60.e)上样:以2.0ml/min的流速将样品泵入层析柱,同时收集流穿,当uv值为基础流穿与10%样品uv值的总和时停止上样,记录收集的流穿体积v
ft
。
61.f)清洗和洗脱:用缓冲液a以2.0ml/min的流速清洗层析柱直至基线平稳,再用缓冲液b以2.0ml/min的流速洗脱层析柱,收集洗脱峰。
62.(3)结果分析
[0063][0064]cbsa
为bsa样品的浓度;v
ft
为收集的流穿体积;vc为层析柱体积。
[0065]
结果取两个层析柱检测结果的平均值。
[0066]
实施例5:q beatarose ff层析介质10%动态载量测定
[0067]
用浓度为4.0mg/ml的牛血清白蛋白(bsa)做蛋白样品,在ph为8.0的tris缓冲液的条件下与q beatarose ff结合,当有10%蛋白流穿时,计算介质结合载量。
[0068]
(1)实验样品及试剂
[0069]
缓冲液a:50mm tris(ph 8.0
±
0.05);缓冲液b:0.1m醋酸ph3.0
±
0.05;4m naoh;5m hcl;1%丙酮;
[0070]
样品:称取0.4g bsa放入烧杯中,加入100ml缓冲液a,用分光光度计测定280nm下的吸光值,使样品最终浓度为4.0
±
0.1mg/ml。
[0071]
(2)实验方法
[0072]
a)装柱:称取约10g介质加入20ml水,搅拌均匀后沉降1-2min后抽干,重复4次。使用20%乙醇溶液重复上述清洗步骤,取3g介质加3ml20%乙醇搅拌均匀制备成50%悬浮液,将悬浮液倒入hr 5/100柱管中,用1ml/min的流速压柱至界面清晰平稳,卸下hr 5/100装柱
器,装上上柱头,再用13ml/min的流速装柱5min,压柱结束后堵住下端,调节柱头使其刚好与胶面接触,柱高10.2
±
0.2cm。
[0073]
b)柱效测定:将装好的层析柱连接到akta系统上,用纯化水以1.0ml/min的流速平衡层析柱直至基线平稳,在load状态下将1%丙酮注入到20μl上样环中。在inject状态下,以0.1ml/min的流速测定层析柱柱效,盐峰完全出来且电导平衡时结束程序。通过unicorn软件对盐峰进行积分,用软件计算出理论塔板数n及不对称因子as(n≥3000,as应在0.8-1.5范围内)。
[0074]
c)层析柱平衡:在23
±
2℃下,用注射器直接将bsa样品打入检测器,记录uv值。将层析柱连接到akta系统上,用缓冲液a以1.0ml/min的流速平衡层析柱直至基线平稳。
[0075]
d)上样:以2.0ml/min的流速将样品泵入层析柱,同时收集流穿,当uv值为基础流穿与10%样品uv值的总和时停止上样,记录收集的流穿体积v
ft
。
[0076]
e)清洗和洗脱:用缓冲液a以2.0ml/min的流速清洗层析柱直至基线平稳。再用缓冲液b以2.0ml/min的流速洗脱层析柱,收集洗脱峰。
[0077]
(3)结果分析
[0078][0079]
其中,a
280
为bsa样品稀释4倍后的吸光度;4为稀释倍数;v
ft
为流穿体积;0.67为消光系数;v为柱床体积。
[0080]
结果取两个层析柱检测结果的平均值。
[0081]
图4和图5分别为混合型阴离子配体层析介质和q beatarose ff层析介质10%动态载量测定结果。由图4和图5对比,明显可以看出图4的动态载量更高,是q beatarose ff层析介质的5-6倍,一般情况下蛋白结合量越高,后期洗脱越困难,对比图4和图5洗脱峰高度、峰形基本一致,使用洗脱剂体积也相差不多,因此混合型阴离子配体层析介质拥有高动态载量的同时不存在洗脱困难的问题,说明该本发明层析介质较容易洗脱,有利于重复使用,节约成本。
[0082]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。