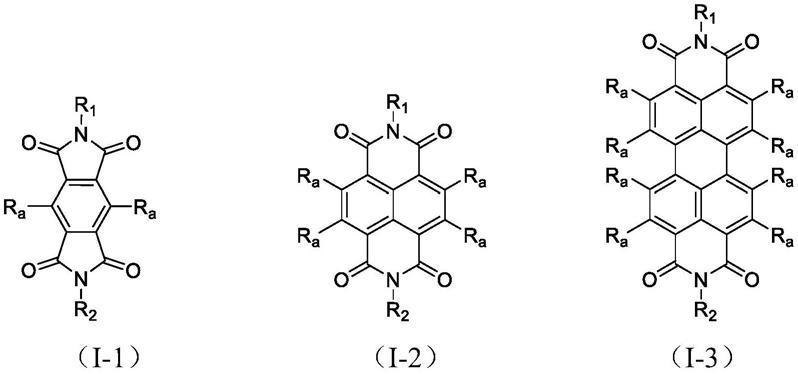
一种包含第三信号受体的嵌合抗原受体及其应用
1.本技术是申请日为2019年03月13日、申请号为201980041282.0、发明名称为“一种包含第三信号受体的嵌合抗原受体及其应用”的中国专利申请的分案申请。
技术领域
2.本发明涉及细胞免疫治疗技术领域,尤其涉及一种包含第三信号受体的嵌合抗原受体及其应用。
背景技术:
3.利用免疫学治疗手段来攻克肿瘤,一直是免疫学在转化医学方面应用的重要方向。随着各种组学(基因组学,蛋白组学等)的发展,肿瘤细胞由于突变产生的免疫原性得到了广泛的认可,这为肿瘤免疫治疗奠定了理论的基础。同时,随着肿瘤免疫学研究自身的积累,肿瘤免疫治疗近期取得了巨大的进步,一系列新的免疫治疗手段逐步进入临床。当前的肿瘤免疫学研究,奠定了t细胞杀伤在肿瘤免疫治疗中的中心地位,而嵌和抗原受体t细胞(car-t细胞)就是结合了抗体的靶向识别和t细胞的肿瘤杀伤功能,人工修饰生成的肿瘤杀伤细胞。
4.嵌和抗原受体t细胞的概念最早在1989年被gross,waks和eshhar提出,他们将识别tnp的抗体表达在t细胞上,实现了抗原特异性的、非mhc限制的t细胞的活化和效应的增强,并提出了car-t技术在肿瘤治疗中的应用的概念。根据这一原理,将具有肿瘤特异性的抗体嵌入t细胞,将赋予t细胞新的杀瘤能力。之后,car-t技术被引入到抗肿瘤临床试验中,但早期的car-t细胞由于其胞内信号传递域仅含有第一信号,而且选择的肿瘤类型为实体瘤,最终的临床结果都不太理想。在2008年,fred hutchison肿瘤研究所等机构使用car-t对b细胞淋巴瘤来进行治疗,虽然治疗结果不太理想,但这一临床实验的关键在于证实了以表达cd20的b细胞作为靶点的car-t治疗是相对安全的。随后,在2010年nci报道了一例b细胞淋巴瘤治疗成功的病例,利用针对cd19的car-t,病人的淋巴瘤得到控制,正常b细胞也被清除,血清ig显著降低,为car-t治疗b细胞来源的淋巴瘤的有效性提供了理论和实际的支持。在2011年,美国宾夕法尼亚大学的的carl june博士领导的团队将特异性识别cd19的car-t用于b细胞来源的慢性淋巴细胞白血病的治疗,显示了“治愈”的疗效,随后在复发难治性急性淋巴细胞白血病展开临床实验,也取得了良好的疗效。由于这一突破性的进展以及其他免疫调控手段的发展,science杂志将肿瘤免疫治疗评为了2013年科技突破进展的第一名。这一成功在世界各国引起了广泛的影响,各国开始大量开展基于car-t的科学研究和肿瘤治疗的临床试验。
5.car的结构由胞外抗原识别结构域,胞外铰链区,跨膜区和胞内的信号传导结构域组成。胞外的抗原识别域通常是由单链抗体组成,特异性识别肿瘤细胞膜表面分子,也可以是某些肿瘤特异抗原的配体或受体等。胞外铰链区是一段用于隔开抗原识别域和跨膜区的空间结构,其目的是为了提供合适的空间位置,使得胞外抗原识别域能够在识别抗原前后维持正确的结构并传导胞内信号。跨膜区是为了保证car分子在膜表面定位的结构域。胞内
信号传导结构域是介导car信号传导的关键部分,通常是一个或几个第一信号(tcr和mhc-i-peptide复合物识别),第二信号(共刺激受体和共刺激配体识别)的组合。第一代car只含有第一信号,第二代car有一个第一信号和一个第二信号,第三代car有一个第一信号和两个第二信号结构域。虽然car-t在针对b细胞来源的白血病治疗中获得了巨大的成功,但是其相对较高的复发率以及对实体瘤的低有效率是当前的重要挑战。因此发展新一代的高效car-t是目前临床所急需的。除了第三代car-t,目前还有其他新的car-t设计策略,即在第二代car-t的基础上引入了新的独立于car的调节分子,以进一步增强car-t的功能。
6.利用病人自体血液细胞制备的针对b细胞表面靶向分子cd19、cd20的car-t在b细胞白血病治疗中的应用已相对成熟,但虽然响应率高,但是存在大量的复发现象,此外对实体淋巴瘤的治疗效率相对较低,这与实体肿瘤中的免疫抑制微环境有关。
7.在实体肿瘤中,存在多种免疫细胞、肿瘤细胞和基质细胞,共同组成肿瘤微环境。肿瘤微环境通常是免疫抑制的,能够对内源的抗肿瘤t细胞反应或过继性的t细胞(譬如car-t)在多种层次进行抑制,譬如,导致t细胞发生耗竭,失去杀伤肿瘤的功能,最终t细胞被清除。如何增强car-t在实体瘤中的活化能力,使其能够对抗肿瘤微环境中的免疫抑制,是扩增car-t到实体瘤治疗的重要思路和方向。
8.而当前临床使用的car-t结构域,在肿瘤杀伤能力和扩增能力上还存在不足,在控制实体肿瘤/转移肿瘤上疗效较差,部分car-t采用新型调控分子如il-12,4-1bbl等,这些分子除了影响car-t,也会对其他非car-t细胞产生非特异的活化作用,有造成免疫副作用的潜在可能。
技术实现要素:
9.本发明的目的在于克服现有技术中的缺陷,提供一种第三信号受体的嵌合抗原受体及其应用,并提供一种由如该嵌合抗原受体的重组表达载体构建的car-t细胞,在该car-t细胞中t细胞的活化受到第1信号(tcr和mhc-i-peptide复合物识别),第2信号(共刺激受体和共刺激配体识别)和第3信号(细胞因子受体和细胞因子识别)的调控,这三者协同作用达到t细胞大量扩增,发挥效应功能,清除感染或肿瘤。
10.为实现上述目的,本发明采用如下技术方案:
11.本发明的第一个目的是提供一种包含第三信号受体的嵌合抗原受体,所述嵌合抗原受体的结构为scfv(x)-(y)cd3zeta-mn;
12.其中,x包括肿瘤靶向抗体或能与肿瘤特异结合的配体、受体;y为共刺激受体的胞内区,所述共刺激受体选自icos、cd28、cd27、hvem、light、cd40l、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、cd226;m为gamma chain家族细胞因子受体的胞内区,所述细胞因子受体选自il2ra、il2rb、il4ra、il7ra、il9ra、il15ra、il21ra;n为il2rg胞内区。
13.为了进一步优化上述嵌合抗原受体,本发明采取的技术措施还包括:
14.进一步地,所述x选自anti-cd19抗体、anti-cd20抗体、egfr抗体、her2抗体、egfrviii抗体、anti-psma抗体、anti-bcma抗体、anti-cd22抗体,anti-cd30抗体。可理解的是,x还可为能与肿瘤特异结合的其他蛋白。
15.进一步地,所述x为anti-cd20抗体,所述y为4-1bb胞内区,所述m选自il2rb胞内区、il4ra胞内区、il7ra胞内区、il9ra胞内区、il21ra胞内区中的一种。
16.进一步地,所述scfv(x)-(y)cd3zeta为scfv-antihcd20-20bbz,其序列如seq id no.1所示;所述il7ra胞内区的序列如seq id no.2所示;所述il2rb胞内区的序列如seq id no.3所示;所述il4ra胞内区的序列如seq id no.4所示;所述il9ra胞内区的序列如seq id no.5所示;所述il21ra胞内区的序列如seq id no.6所示;所述il2rg胞内区的序列如seq id no.7所示。
17.其中上述各序列具体如下:
18.seq id no.1:
19.qivlsqspailsaspgekvtmtcrasssvsyihwfqqkpgsspkpwiyatsnlasgvpvrfsgsgsgtsysltisrveaedaatyycqqwtsnpptfgggtkleikggggsggggsggggsqvqlqqpgaelvkpgasvkmsckasgytftsynmhwvkqtpgrglewigaiypgngdtsynqkfkgkatltadkssstaymqlssltsedsavyycarstyyggdwyfnvwgagttvtvsaaaatttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr;seq id no.2:
20.kkrikpivwpslpdhkktlehlckkprknlnvsfnpesfldcqihrvddiqardevegflqdtfpqqleesekqrlggdvqspncpsedvvitpesfgrdssltclagnvsacdapilsssrsldcresgkngphvyqdlllslgttnstlpppfslqsgiltlnpvaqgqpiltslgsnqeeayvtmssfyqnq;
21.seq id no.3
22.ncrntgpwlkkvlkcntpdpskffsqlssehggdvqkwlsspfpsssfspgglapeisplevlerdkvtqlllqqdkvpepaslssnhsltscftnqgyfffhlpdaleieacqvyftydpyseedpdegvagaptgsspqplqplsgeddayctfpsrddlllfspsllggpsppstapggsgageermppslqervprdwdpqplgpptpgvpdlvdfqpppelvlreageevpdagpregvsfpwsrppgqgefralnarlplntdaylslqelqgqdpthlv;
23.seq id no.4:
24.kikkewwdqipnparsrlvaiiiqdaqgsqwekrsrgqepakcphwkncltkllpcflehnmkrdedphkaakempfqgsgksawcpveisktvlwpesisvvrcvelfeapveceeeeeveeekgsfcaspessrddfqegregivarlteslfldllgeenggfcqqdmgescllppsgstsahmpwdefpsagpkeappwgkeqplhlepsppasptqspdnltctetplviagnpayrsfsnslsqspcprelgpdpllarhleevepempcvpqlsepttvpqpepetweqilrrnvlqhgaaaapvsaptsgyqefvhaveqggtqasavvglgppgeagykafssllassavspekcgfgassgeegykpfqdlipgcpgdpapvpvplftfgldrepprspqsshlpssspehlglepgekvedmpkpplpqeqatdplvdslgsgivysaltchlcghlkqchgqedggqtpvmaspccgcccgdrssppttplrapdpspggvpleaslcpaslapsgisekskssssfhpapgnaqsssqtpkivnfvsvgptymrvs;
25.seq id no.5:
26.klsprvkrifyqnvpspamffqplysvhngnfqtwmgahgagvllsqdcagtpqgalepcvqeatalltcgparpwksvaleeeqegpgtrlpgnlssedvlpagctewrvqtlaylpqedwaptsltrpappdsegsrssssssssnnnnycalgcyggwhlsalpgntqssgpipalacglscdhqgletqqgvawvlaghcqrpglhedlqgmllpsvlskarswtf;
27.seq id no.6:
28.slkthplwrlwkkiwavpsperffmplykgcsgdfkkwvgapftgsslelgpwspevpstlevyschpprspakrlqltelqepaelvesdgvpkpsfwptaqnsggsayseerdrpyglvsidtvtvldaegpctwpcscedd
gypaldldaglepspgledplldagttvlscgcvsagspglggplgslldrlkppladgedwagglpwggrspggvseseagsplagldmdtfdsgfvgsdcsspvecdftspgdegpprsylrqwvvippplsspgpqas;
29.seq id no.7:
30.ertmpriptlknledlvteyhgnfsawsgvskglaeslqpdyserlclvseippkggalgegpgaspcnqhspywappcytlkpet
31.进一步地,所述嵌合抗原受体的胞外铰链区选自cd8a或igg的一段区域;所述嵌合抗原受体的跨膜区选自cd8a、cd28、cd137或cd3中的一个。
32.本发明的第二个目的是提供一种任一上述的嵌合抗原受体的重组表达载体。
33.本发明的第三个目的是提供一种由任一上述的嵌合抗原受体的重组表达载体构建的car-t细胞。
34.本发明的第四个目的是提供一种上述car-t细胞的制备方法,其包括以下步骤:
35.步骤一、慢病毒载体的构建及病毒生产;
36.将scfv(x)-(y)cd3zeta,m和n形成融合蛋白,两端加入慢病毒载体,并和慢病毒包装质粒共同转染,获得scfv(x)-(y)cd3zeta-mn病毒;
37.步骤二、scfv(x)-(y)cd3zeta-mn car-t细胞的制备;
38.分离纯化后的人pbmc经过培养后,感染步骤一获得的scfv(x)-(y)cd3zeta-mn病毒,在合适的条件下进行细胞扩增,制备scfv(x)-(y)cd3zeta-mn car-t细胞;
39.其中,其中,x为肿瘤靶向抗体或其他蛋白;y为共刺激受体的胞内区,所述共刺激受体选自icos、cd28、cd27、hvem、light、cd40l、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、cd226;m为gamma chain家族细胞因子受体的胞内区,所述细胞因子受体选自il2ra、il2rb、il4ra、il7ra、il9ra、il15ra、il21ra;n为il2rg胞内区。
40.为了进一步优化上述car-t细胞的制备方法,本发明采取的技术措施还包括:
41.进一步地,所述慢病毒载体的构建及病毒生产的具体步骤包括:将scfv(x)-(y)cd3zeta,m和n通过overlap pcr形成融合蛋白,两端加入酶切位点克隆慢病毒载体;将测序正确的克隆无内毒素大提,和慢病毒包装质粒共同转染,预定时间收取上清,过滤、离心浓缩病毒,获得scfv(x)-(y)cd3zeta-mn病毒。
42.更进一步地,所述慢病毒载体的构建及病毒生产的具体步骤为:将scfv(x)-(y)cd3zeta,m和n通过overlap pcr形成融合蛋白,两端加入ecori和bamhi酶切位点克隆pcdh-mscvef载体;将测序正确的克隆无内毒素大提,和慢病毒包装质粒共同转染293x,48和72小时后收取上清,0.45um过滤后25000rpm离心2小时浓缩病毒,获得scfv(x)-(y)cd3zeta-mn病毒。
43.进一步地,所述scfv(x)-(y)cd3zeta-mn car-t细胞的制备的具体步骤包括:将人pbmc经过分离纯化后,接种到具有合适刺激条件的培养板,培养预定时间后,感染步骤一生产的scfv(x)-(y)cd3zeta-mn病毒,按照合适的刺激条件进行细胞扩增,经过2轮刺激扩增后,获得的细胞即为scfv(x)-(y)cd3zeta-mn car-t细胞。
44.进一步地,培养分离纯化后的人pbmc的刺激条件为anti-hcd3和anti-hcd28,扩增细胞的刺激条件为每6天使用人工抗原呈递细胞或anti-hcd3/28刺激。
45.更进一步地,所述scfv(x)-(y)cd3zeta-mn car-t细胞的制备的具体步骤为:将人pbmc经过stemcell t细胞分离试剂盒纯化后,接种到anti-hcd3和anti-hcd28包被的96孔
培养板,2天后,按照moi=10-20感染步骤一生产的scfv(x)-(y)cd3zeta-mn病毒,1天后换液继续细胞培养,按照每6天使用人工抗原呈递细胞或anti-hcd3/28刺激,经过2轮刺激后,所得细胞即为scfv(x)-(y)cd3zeta-mn car-t。
46.进一步地,所述x选自anti-cd19抗体、anti-cd20抗体、egfr抗体、her2抗体、egfrviii抗体。
47.进一步地,所述x为anti-cd20抗体,所述y为4-1bb,所述m选自il2rb、il4ra、il7ra、il9ra、il21ra中的一种。
48.进一步地,所述scfv(x)-(y)cd3zeta为scfv-antihcd20-20bbz,其序列如seq id no.1所示;所述il7ra胞内区的序列如seq id no.2所示;所述il2rb胞内区的序列如seq id no.3所示;所述il4ra胞内区的序列如seq id no.4所示;所述il9ra胞内区的序列如seq id no.5所示;所述il21ra胞内区的序列如seq id no.6所示;所述il2rg胞内区的序列如seq id no.7所示。
49.进一步地,所述步骤一中慢病毒包装质粒包括vsv-g,pmd gag/pol,rsv-rev,离心使用贝克曼超速离心机和sw28转头。
50.本发明的第五个目的是提供一种含有上述car-t细胞或含有由上述制备方法制得的的car-t细胞的制剂;进一步地,所述制剂还包括药用的稀释剂或赋形剂。
51.本发明的第六个目的是提供一种上述嵌合抗原受体、上述car-t细胞或由上述制备方法制得的的car-t细胞在制备治疗或预防肿瘤药物中的应用。
52.进一步地,所述肿瘤为实体肿瘤,该实体肿瘤的例子包括但不限于,淋巴瘤、肾脏肿瘤、神经母细胞瘤、生殖细胞瘤、骨肉瘤、软骨肉瘤、软组织肉瘤、肝脏肿瘤、胸腺瘤、肺母细胞瘤、胰母细胞瘤、血管瘤等。
53.与现有技术相比,本发明具有以下有益效果:
54.本发明所述的car-t细胞显著提高了肿瘤杀伤能力和扩增能力,显著提高的实体肿瘤/转移肿瘤的杀伤能力;本发明所述的car-t细胞,包含第三信号受体(il2ra、il2rb、il4ra、il7ra、il9ra、il15ra、il21ra等),其不是常规所用的配体或分泌因子,例如第三信号的受体il7ra,主要表达在记忆性的cd4和cd8 t细胞,对t细胞的长期存活和记忆性t细胞的形成有着重要作用,将第三信号受体信号整合在car-t中,具有潜在的增强效应的功能,且只对car-t细胞有作用,降低了造成免疫副作用的风险。
55.本发明通过构建新型含第三信号受体的car-t细胞,相对目前临床使用的car-t技术,其提高car-t细胞在肿瘤中的活化能力和存活能力,活化能力和扩增能力显著增强,从而提高car-t细胞疗效,以具有更优异的抗肿瘤疗效。
附图说明
56.图1为本发明各实施例中含有第三信号受体的嵌合抗原受体(car)分子结构的说明示意图;
57.图2为本发明一实施例中bbzil2rbil2rg病毒感染293细胞后测得的病毒滴度的示意图;
58.图3为本发明一实施例中bbzil4rail2rg病毒感染293细胞后测得的病毒滴度的示意图;
59.图4为本发明一实施例中bbzil7rail2rg病毒感染293细胞后测得的病毒滴度的示意图;
60.图5为本发明一实施例中bbzil9rail2rg病毒感染293细胞后测得的病毒滴度的示意图;
61.图6为本发明一实施例中bbzil21rail2rg病毒感染293细胞后测得的病毒滴度的示意图;
62.图7为本发明一实施例中bbz car-t细胞和bbzil2rbil2rg car-t细胞表型分析的结果示意图;
63.图8为本发明一实施例中bbz car-t细胞和bbzil4rail2rg car-t细胞表型分析的结果示意图;
64.图9为本发明一实施例中bbz car-t细胞和bbzil7rail2rg car-t细胞表型分析的结果示意图;
65.图10为本发明一实施例中bbz car-t细胞和bbzil9rail2rg car-t细胞表型分析的结果示意图;
66.图11为本发明一实施例中bbz car-t细胞和bbzil21rail2rg car-t细胞表型分析的结果示意图;
67.图12为本发明一实施例中bbz car-t细胞和bbzil7rail2rg car-t细胞的扩增能力的示意图;
68.图13为本发明一实施例中bbz car-t细胞和bbzil7rail2rg car-t细胞的肿瘤杀伤能力的示意图;
69.图14为本发明一实施例中bbz car-t细胞和bbzil7rail2rg car-t细胞的抗肿瘤能力的示意图;
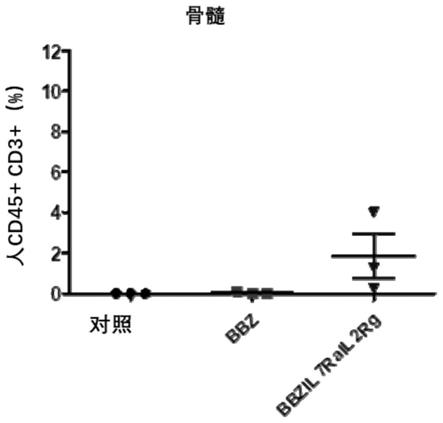
70.图15为本发明一实施例中bbz car-t细胞和bbzil7rail2rg car-t细胞的体内存活能力的示意图;
具体实施方式
71.本发明提供一种包含第三信号受体的嵌合抗原受体,该嵌合抗原受体的结构为scfv(x)-(y)cd3zeta-mn;其中,x为肿瘤靶向抗体或其他蛋白;y为共刺激受体的胞内区,所述共刺激受体选自icos、cd28、cd27、hvem、light、cd40l、4-1bb、ox40、dr3、gitr、cd30、tim1、slam、cd2、cd226;m为gamma chain家族细胞因子受体的胞内区,所述细胞因子受体选自il2ra、il2rb、il4ra、il7ra、il9ra、il15ra、il21ra;n为il2rg胞内区。本发明还涉及一种由任一上述的嵌合抗原受体的重组表达载体构建的car-t细胞及其制备方法,含有该car-t细胞的制剂以及该car-t细胞的应用。
72.下面结合附图和实施例,对本发明的具体实施方式作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
73.本发明下述实施例所涉及的含有第三信号受体的嵌合抗原受体(car)分子分别为bbzil2rbil2rg、bbzil4rail2rg、bbzil7rail2rg、bbzil9rail2rg、bbzil21rail2rg,其结构如图1所示。
74.实施例1-20bbzil2rbil2rg car-t细胞的制备
75.本实施例所述的20bbzil2rbil2rg car-t细胞的制备包括以下步骤:
76.1.慢病毒载体pcdh-mscvef-20bbzil2rbil2rg的构建及病毒生产
77.将scfv-antihcd20-20bbz(seq id no.1),il2rb胞内区(seq id no.3)和il2rg胞内区(seq id no.7)通过overlap pcr形成融合蛋白,两端加入ecori和bamhi酶切位点克隆pcdh-mscvef载体。将测序正确的克隆无内毒素大提,和慢病毒包装质粒(vsv-g,pmd gag/pol,rsv-rev)共同转染293x,48和72小时后收取上清,0.45um过滤后,使用贝克曼超速离心机和sw28转头,25000rpm离心2小时浓缩病毒,即为pcdh-mscvef-20bbzil2rbil2rg病毒(简称为20bbzil2rbil2rg病毒),用于后续car-t细胞生产。同时生产对照pcdh-mscvef-20bbz病毒(简称20bbz病毒),将所得20bbzil2rbil2rg病毒感染293细胞,测得病毒滴度,如图2所示。
78.2.20bbzil2rbil2rg car-t细胞和20bbz car-t细胞的制备
79.将人pbmc经过stemcell t细胞分离试剂盒纯化后,接种到anti-hcd3和anti-hcd28包被的96孔培养板,2天后,按照moi=10-20感染20bbz病毒和20bbzil2rbil2rg病毒,1天后换液继续细胞培养,按照每6天使用人工抗原呈递细胞或anti-hcd3/28刺激,经过2轮刺激后,所得细胞即为20bbz car-t细胞和20bbzil2rbil2rg car-t细胞,用于后续实验和表型分析。如图7所示,所得细胞为car阳性。
80.实施例2-20bbzil4rail2rg car-t细胞的制备
81.本实施例所述的20bbzil4rail2rg car-t细胞的制备包括以下步骤:
82.1.慢病毒载体pcdh-mscvef-20bbzil4rail2rg的构建及病毒生产
83.将scfv-antihcd20-20bbz(seq id no.1),il4ra胞内区(seq id no.4)和il2rg胞内区(seq id no.7)通过overlap pcr形成融合蛋白,两端加入ecori和bamhi酶切位点克隆pcdh-mscvef载体。将测序正确的克隆无内毒素大提,和慢病毒包装质粒(vsv-g,pmd gag/pol,rsv-rev)共同转染293x,48和72小时后收取上清,0.45um过滤后,使用贝克曼超速离心机和sw28转头,25000rpm离心2小时浓缩病毒,即为pcdh-mscvef-20bbzil4rail2rg病毒(简称为20bbzil4rail2rg病毒),用于后续car-t细胞生产。同时生产对照pcdh-mscvef-20bbz病毒(简称20bbz病毒),将所得20bbzil4rail2rg病毒感染293细胞,测得病毒滴度,如图3所示。
84.2.20bbzil4rail2rg car-t细胞和20bbz car-t细胞的制备
85.将人pbmc经过stemcell t细胞分离试剂盒纯化后,接种到anti-hcd3和anti-hcd28包被的96孔培养板,2天后,按照moi=10-20感染20bbz病毒和20bbzil4rail2rg病毒,1天后换液继续细胞培养,按照每6天使用人工抗原呈递细胞或anti-hcd3/28刺激,经过2轮刺激后,所得细胞即为20bbz car-t细胞和20bbzil4rail2rg car-t细胞,用于后续实验和表型分析。如图8所示,所得细胞为car阳性。
86.实施例3-20bbzil7rail2rg car-t细胞的制备
87.本实施例所述的20bbzil7rail2rg car-t细胞的制备包括以下步骤:
88.1.慢病毒载体pcdh-mscvef-20bbzil7rail2rg的构建及病毒生产
89.将scfv-antihcd20-20bbz(seq id no.1),il7ra胞内区(seq id no.2)和il2rg胞内区(seq id no.7)通过overlap pcr形成融合蛋白,两端加入ecori和bamhi酶切位点克隆pcdh-mscvef载体。将测序正确的克隆无内毒素大提,和慢病毒包装质粒(vsv-g,pmd gag/
pol,rsv-rev)共同转染293x,48和72小时后收取上清,0.45um过滤后,使用贝克曼超速离心机和sw28转头,25000rpm离心2小时浓缩病毒,即为pcdh-mscvef-20bbzil7rail2rg病毒(简称为20bbzil7rail2rg病毒),用于后续car-t细胞生产。同时生产对照pcdh-mscvef-20bbz病毒(简称20bbz病毒),将所得20bbzil7rail2rg病毒感染293细胞,测得病毒滴度,如图4所示。
90.2.20bbzil7rail2rg car-t细胞和20bbz car-t细胞的制备
91.将人pbmc经过stemcell t细胞分离试剂盒纯化后,接种到anti-hcd3和anti-hcd28包被的96孔培养板,2天后,按照moi=10-20感染20bbz病毒和20bbzil7rail2rg病毒,1天后换液继续细胞培养,按照每6天使用人工抗原呈递细胞或anti-hcd3/28刺激,经过2轮刺激后,所得细胞即为20bbz car-t细胞和20bbzil7rail2rg car-t细胞,用于后续实验和表型分析。如图9所示,所得细胞为car阳性。
92.实施例4-20bbzil9rail2rg car-t细胞的制备
93.本实施例所述的20bbzil9rail2rg car-t细胞的制备包括以下步骤:
94.1.慢病毒载体pcdh-mscvef-20bbzil9rail2rg的构建及病毒生产
95.将scfv-antihcd20-20bbz(seq id no.1),il9ra胞内区(seq id no.5)和il2rg胞内区(seq id no.7)通过overlap pcr形成融合蛋白,两端加入ecori和bamhi酶切位点克隆pcdh-mscvef载体。将测序正确的克隆无内毒素大提,和慢病毒包装质粒(vsv-g,pmd gag/pol,rsv-rev)共同转染293x,48和72小时后收取上清,0.45um过滤后,使用贝克曼超速离心机和sw28转头,25000rpm离心2小时浓缩病毒,即为pcdh-mscvef-20bbzil9rail2rg病毒(简称为20bbzil9rail2rg病毒),用于后续car-t细胞生产。同时生产对照pcdh-mscvef-20bbz病毒(简称20bbz病毒),将所得20bbzil9rail2rg病毒感染293细胞,测得病毒滴度,如图5所示。
96.2.20bbzil9rail2rg car-t细胞和20bbz car-t细胞的制备
97.将人pbmc经过stemcell t细胞分离试剂盒纯化后,接种到anti-hcd3和anti-hcd28包被的96孔培养板,2天后,按照moi=10-20感染20bbz病毒和20bbzil9rail2rg病毒,1天后换液继续细胞培养,按照每6天使用人工抗原呈递细胞或anti-hcd3/28刺激,经过2轮刺激后,所得细胞即为20bbz car-t细胞和20bbzil9rail2rg car-t细胞,用于后续实验和表型分析。如图10所示,所得细胞为car阳性。
98.实施例5-20bbzil21rail2rg car-t细胞的制备
99.本实施例所述的20bbzil21rail2rg car-t细胞的制备包括以下步骤:
100.1.慢病毒载体pcdh-mscvef-20bbzil21rail2rg的构建及病毒生产
101.将scfv-antihcd20-20bbz(seq id no.1),il21ra胞内区(seq id no.6)和il2rg胞内区(seq id no.7)通过overlap pcr形成融合蛋白,两端加入ecori和bamhi酶切位点克隆pcdh-mscvef载体。将测序正确的克隆无内毒素大提,和慢病毒包装质粒(vsv-g,pmd gag/pol,rsv-rev)共同转染293x,48和72小时后收取上清,0.45um过滤后,使用贝克曼超速离心机和sw28转头,25000rpm离心2小时浓缩病毒,即为pcdh-mscvef-20bbzil21rail2rg病毒(简称为20bbzil21rail2rg病毒),用于后续car-t细胞生产。同时生产对照pcdh-mscvef-20bbz病毒(简称20bbz病毒),将所得20bbzil21rail2rg病毒感染293细胞,测得病毒滴度,如图6所示。
102.2.20bbzil21rail2rg car-t细胞和20bbz car-t细胞的制备
103.将人pbmc经过stemcell t细胞分离试剂盒纯化后,接种到anti-hcd3和anti-hcd28包被的96孔培养板,2天后,按照moi=10-20感染20bbz病毒和20bbzil21rail2rg病毒,1天后换液继续细胞培养,按照每6天使用人工抗原呈递细胞或anti-hcd3/28刺激,经过2轮刺激后,所得细胞即为20bbz car-t细胞和20bbzil21rail2rg car-t细胞,用于后续实验和表型分析。如图11所示,所得细胞为car阳性。
104.实施例6-比较20bbz car-t细胞和20bbzil7rail2rg car-t细胞的扩增能力
105.将实施例3中步骤2制备所得的20bbz car-t细胞和20bbzil7rail2rg car-t细胞,连续培养14天,每隔6天用人工抗原呈递细胞刺激一次,细胞计数,其结果如图12所示。由图可知,20bbzil7rail2rg car-t细胞相对20bbzcar-t细胞有更强的增殖能力。
106.实施例7-比较20bbz car-t细胞和20bbzil7rail2rg car-t细胞的肿瘤杀伤能力
107.将实施例3中步骤2制备所得的20bbz car-t细胞和20bbzil7rail2rg car-t细胞,接种到96孔板,按照car-t:肿瘤细胞比例1:1、1:2、1:4加入raji肿瘤细胞,24、48小时后比较肿瘤细胞的存活比例,其结果如图13所示。由图可知,20bbzil7rail2rg car-t细胞相对20bbz car-t细胞有相似的肿瘤杀伤能力。
108.实施例8-比较20bbz car-t细胞和20bbzil7rail2rg car-t细胞的抗肿瘤能力和体内存活能力
109.将106nalm-6肿瘤细胞通过静脉接种到b-ndg小鼠,6天后给予10
7 20bbz car-t细胞和20bbzil7rail2rg car-t细胞治疗,观察小鼠的存活率,部分小鼠在第7天检测其骨髓中的肿瘤细胞和car-t细胞的含量,其结果分别如图14和图15所示。由图可知,20bbzil7rail2rg car-t细胞相对20bbz car-t细胞显著延长了小鼠的生存,并在体内扩增更多。
110.由上述实施例可知,本发明通过构建新型含第三信号受体的car-t细胞,相对目前临床使用的car-t技术,其使car-t细胞在肿瘤中的活化能力、存活能力、扩增能力显著增强,具有更优异的抗肿瘤疗效。
111.以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。