1.本发明涉及医药领域,具体涉及荷叶碱衍生物及其制备方法和应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息已经成为本领域一般技术人员所公知的现有技术。
3.糖尿病是内分泌代谢紊乱引起的一种常见慢性疾病,表现为高血糖,脂肪、蛋白质等的代谢紊乱,并伴随有胰岛素分泌不足或胰岛素抵抗等症状。临床表现为:三多一少(即:多饮、多食、多尿和疲乏、消瘦)。久病可引起系统的损伤,导致肾脏、末端神经、视网膜、心血管等组织和器官的慢性进行性疾病(并发症),进而引起功能性缺陷或衰竭。据国际糖尿病联盟数据,全球约4.25亿成人患糖尿病,中国占1.14亿,意味着全世界超过1/4的糖友都在中国,糖尿病人数占全球第一。糖尿病已经成为一个日趋严峻的全球问题,近年来全球糖尿病患病率持续增长,预测到2045年将达到6.29亿人。众所周知,糖尿病最可怕的地方在于它的并发症,糖尿病导致的并发症不仅无法治愈,还会给患者带来巨大的痛苦,给健康和社会经济带来严重影响。
4.现今,临床上使用的降糖药物除胰岛素外,主要还有(1)传统降糖药物磺酰脲类,第一代主要有氯磺丙脲、甲苯磺丁脲等,随之产生了第二代、第三代,第三代是以格列美脲为代表的;(2)胰高血糖素样肽类,这是一类多肽类激素药,此类药需要经皮下注射,然后被吸收。在此种药物中有一种叫exendin-4是amylin公司和礼来公司合作开发的,是一种从畸形蜥蜴及墨西哥珠状蜥蜴唾液中分泌的多肽类降糖药物。此外,amily公司还研制出一种人胰岛类似物—普兰林肽,可用来治疗ⅰ型糖尿病。依帕司他可以阻止神经传导速度的下降,改善末梢神经障碍、振动感觉异常等症,因此可以用来治疗糖尿病神经失常等症;(3)双胍类药物,如二甲双胍、丁福明,是肥胖的糖尿病病人有效的一线用药,在有些国家还被推荐为非肥胖的糖尿病患者的一线用药。双胍类药物是口服降糖药中的元老,单用不会引起低血糖;(4)α-葡萄糖苷酶抑制剂类,α-淀粉酶抑制剂是国外近年来开发的一类新型口服抗糖尿病药物,它能有效地抑制消化道内唾液及胰淀粉酶的活性,阻碍食物中碳水化合物的水解和消化,减少糖分的摄取,降低血糖和血脂水平,临床上用于防治糖尿病、高血糖、高血脂等疾病。1990年,德国拜耳公司成功开发了一淀粉酶抑制剂类的抗糖尿病药物拜糖平即阿卡波糖。
5.目前糖尿病治疗药物存在这样或那样的一些副作用或不便,如有些药物必须皮下注射方能被吸收,有些药物胃酸分泌增加、恶心、腹痛、腹泻,还偶见粒细胞减少及胆汁淤积性黄疸,引起低血糖反应的危险、严重者可低血糖昏迷甚至死亡等。
6.明朝李时珍―荷叶服之,令人瘦劣”,可见,自古以来就发现荷叶具有降脂作用,因而受到人们的广泛关注,荷叶在我国的分布十分广泛,资源丰富。荷叶中的鹅掌楸碱和2-羟基-1-甲氧基阿朴啡和lysicamine对α-糖苷酶有抑制活性(袁谱龙等,荷叶生物碱分离及相关活性研究,中成药,2014,36(11):2330-2333),荷叶总生物碱、荷叶碱、o-去甲基荷叶碱和
巴婆碱都具有对胰脂酶活性的抑制活性(范婷婷,荷叶生物碱类物质降脂减肥活性研究,2013年,浙江大学,硕士论文),参照文献(yang z,song z,xue w,et al.synthesis and structure
–
activity relationship of nuciferine derivatives as potential acetylcholinesterase inhibitors[j].medicinal chemistry research,2014,23(6):3178-3186)方法,可以制备1-o-去甲基荷叶碱。现有的荷叶碱及其衍生物本身的降脂活性并不强,所以荷叶碱及其衍生物并没有被直接用于临床上。因此,开发荷叶碱及其衍生物用于降糖降脂是非常有意义的。
技术实现要素:
[0007]
本发明的目的是克服上述不足而提供一种荷叶碱衍生物及其制备方法。本发明的另一目的是提供该新型荷叶碱衍生物在降糖和降脂中的应用。
[0008]
具体地,本发明的技术方案如下:
[0009]
在本发明的第一方面,本发明提供了一种荷叶碱衍生物及其药学上可接受的盐,所述荷叶碱衍生物具有式i所示结构:
[0010][0011]
其中,r为取代苄基或取代吡啶基;
[0012]
其中,所述取代苄基是被选自卤素、烷基、烷氧基、卤代烷基、硝基、氰基中的一种或多种取代基所取代的;
[0013]
所述取代吡啶基是被选自烷基所取代的。
[0014]
在本发明的一个或多个实施方式中,所述卤素选自f、cl、br、i。
[0015]
在本发明的一个或多个实施方式中,所述烷基选自c1-c3烷基,优选为甲基。
[0016]
在本发明的一个或多个实施方式中,所述烷氧基选自c1-c3烷氧基,优选为甲氧基。
[0017]
在本发明的一个或多个实施方式中,所述卤代烷基选自被f、cl、br、i中的一个或多个所取代的c1-c3烷。
[0018]
在本发明的一个或多个实施方式中,取代苄基为被选自卤素、甲氧基、三氟甲基、硝基、氰基中的一种或二种取代基所取代的。
[0019]
在本发明的一个或多个实施方式中,所述取代吡啶基为甲基取代的吡啶基,在一些实施方式中,所述甲基取代的吡啶基选自:
[0020]
在本发明的一个或多个实施方式中,所述取代苄基为单取代的,其结构如式ii所示
[0021][0022]
其中,r1选自卤素、烷氧基、卤代烷基、氰基和硝基。
[0023]
在本发明的一个或多个实施方式中,r1的取代位置为邻位、间位或对位,更为优选的取代位置为间位或对位。
[0024]
在本发明的一个或多个实施方式中,r1为f、cl、br、i、甲氧基、三氟甲基、氰基或硝基。
[0025]
在本发明的一个或多个实施方式中,所述取代苄基为二取代的,其结构如式iii所示:
[0026][0027]
其中,r2、r3可以相同或不同;
[0028]
r2、r3各自独立地选自卤素、烷基、烷氧基和卤代烷基。
[0029]
在本发明的一个或多个实施方式中,r2、r3各自独立地选自f、cl、br、i、甲氧基和三氟甲基。
[0030]
在本发明的一个或多个实施方式中,较为优选的r2、r3的取代位置选自以下组合:c-3位和c-4位、c-2位和c-4位、c-2位和c-5位、c-3位和c-5。
[0031]
在本发明的一个或多个实施方式中,r2、r3不同时,较优选的基团组合其选自以下:卤素和甲基、卤素和甲氧基、卤素和三氟甲基、甲氧基和三氟甲基。
[0032]
在本发明的一个或多个实施方式中,r2、r3不同时,其选自以下组合:卤素和甲基、卤素和甲氧基、卤素和三氟甲基、甲氧基和三氟甲基。
[0033]
在本发明的一个或多个实施方式中,r2、r3相同时,其为卤素或三氟甲基,所述卤素选自f、cl和br。
[0034]
在本发明的一个或多个实施方式中,所述药学上可接受的盐为式i化合物的有机酸盐或无机酸盐,其具有式i’所示结构:
[0035][0036]
其中,y为有机酸或无机酸,r同上文中所定义。
[0037]
在本发明的一个或多个实施方式中,所述无机酸为盐酸、氢溴酸或氢碘酸。
[0038]
在本发明的一个或多个实施方式中,所述有机酸为甲酸、乙酸、丙酸、丙二酸、1,4-丁二酸、苯甲酸、烟酸、富马酸、苹果酸、马来酸、葡萄糖酸或柠檬酸。
[0039]
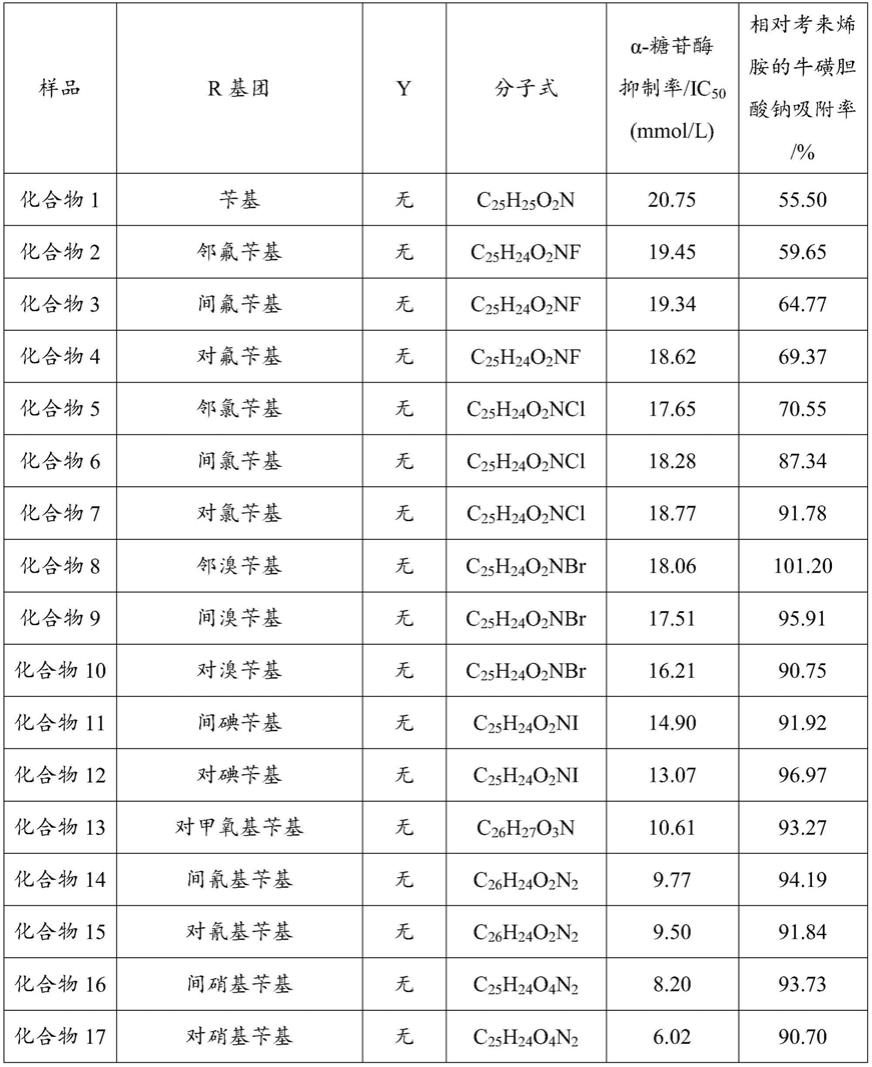
进一步地,本发明提供了多个化合物的示例,所述化合物如表1中所示,具体包括
以下化合物:
[0040]
化合物1:1-o-苄基荷叶碱;
[0041]
化合物2:1-o-邻氟苄基荷叶碱;
[0042]
化合物3:1-o-间氟苄基荷叶碱;
[0043]
化合物4:1-o-对氟苄基荷叶碱;
[0044]
化合物5:1-o-邻氯苄基荷叶碱;
[0045]
化合物6:1-o-间氯苄基荷叶碱;
[0046]
化合物7:1-o-对氯苄基荷叶碱;
[0047]
化合物8:1-o-邻溴苄基荷叶碱;
[0048]
化合物9:1-o-间溴苄基荷叶碱;
[0049]
化合物10:1-o-对溴苄基荷叶碱;
[0050]
化合物11:1-o-间碘苄基荷叶碱;
[0051]
化合物12:1-o-对碘苄基荷叶碱;
[0052]
化合物13:1-o-对甲氧基苄基荷叶碱;
[0053]
化合物14:1-o-间氰基苄基荷叶碱;
[0054]
化合物15:1-o-对氰基苄基荷叶碱;
[0055]
化合物16:1-o-间硝基苄基荷叶碱;
[0056]
化合物17:1-o-对硝基苄基荷叶碱;
[0057]
化合物18:1-o-(3
′
,4
′‑
二氟苄基)荷叶碱;
[0058]
化合物19:1-o-(2
′
,4
′‑
二氟苄基)荷叶碱;
[0059]
化合物20:1-o-(2
′
,5
′‑
二氟苄基)荷叶碱;
[0060]
化合物21:1-o-(3
′
,5
′‑
二氟苄基)荷叶碱;
[0061]
化合物22:1-o-(3',4'-二氯苄基)荷叶碱;
[0062]
化合物23:1-o-(2',4'-二氯苄基)荷叶碱;
[0063]
化合物24:1-o-(3',4'-二溴苄基)荷叶碱;
[0064]
化合物25:1-o-(2',4'-二溴苄基)荷叶碱;
[0065]
化合物26:1-o-(2'-氟-4'-甲基苄基)荷叶碱;
[0066]
化合物27:1-o-(3'-氟-4'-甲基苄基)荷叶碱;
[0067]
化合物28:1-o-邻三氟甲基苄基荷叶碱;
[0068]
化合物29:1-o-间三氟甲基苄基荷叶碱;
[0069]
化合物30:1-o-对三氟甲基苄基荷叶碱;
[0070]
化合物31:1-o-(2',3'-二(三氟甲基)苄基)荷叶碱;
[0071]
化合物32:1-o-(3',4'-二(三氟甲基)苄基)荷叶碱;
[0072]
化合物33:1-o-(2',4'-二(三氟甲基)苄基)荷叶碱;
[0073]
化合物34:1-o-(2',5'-二(三氟甲基)苄基)荷叶碱;
[0074]
化合物35:1-o-(3',5'-二(三氟甲基)苄基)荷叶碱;
[0075]
化合物36:1-o-(2'-氯-3'-三氟甲基苄基)荷叶碱;
[0076]
化合物37:1-o-(2'-溴-3'-三氟甲基苄基)荷叶碱;
[0077]
化合物38:1-o-(2'-氟-3'-三氟甲基苄基)荷叶碱;
[0078]
化合物39:1-o-(2'-碘-3'-三氟甲基苄基)荷叶碱;
[0079]
化合物40:1-o-(4'-氯-3'-三氟甲基苄基)荷叶碱;
[0080]
化合物41:1-o-(4'-溴-3'-三氟甲基苄基)荷叶碱;
[0081]
化合物42:1-o-(4'-氟-3'-三氟甲基苄基)荷叶碱;
[0082]
化合物43:1-o-(4'-碘-3'-三氟甲基苄基)荷叶碱;
[0083]
化合物44:1-o-(2'-氯-5'-三氟甲基苄基)荷叶碱;
[0084]
化合物45:1-o-(2'-溴-5'-三氟甲基苄基)荷叶碱;
[0085]
化合物46:1-o-(2'-氟-5'-三氟甲基苄基)荷叶碱;
[0086]
化合物47:1-o-(2'-碘-5'-三氟甲基苄基)荷叶碱;
[0087]
化合物48:1-o-(3'-氯-5'-三氟甲基苄基)荷叶碱;
[0088]
化合物49:1-o-(3'-溴-5'-三氟甲基苄基)荷叶碱;
[0089]
化合物50:1-o-(3'-氟-5'-三氟甲基苄基)荷叶碱;
[0090]
化合物51:1-o-(3'-碘-5'-三氟甲基苄基)荷叶碱;
[0091]
化合物52:1-o-(2'-氯-4'-三氟甲基苄基)荷叶碱;
[0092]
化合物53:1-o-(2'-溴-4'-三氟甲基苄基)荷叶碱;
[0093]
化合物54:1-o-(2'-氟-4'-三氟甲基苄基)荷叶碱;
[0094]
化合物55:1-o-(2'-碘-4'-三氟甲基苄基)荷叶碱;
[0095]
化合物56:1-o-(3'-氯-4'-三氟甲基苄基)荷叶碱;
[0096]
化合物57:1-o-(3'-溴-4'-三氟甲基苄基)荷叶碱;
[0097]
化合物58:1-o-(3'-氟-4'-三氟甲基苄基)荷叶碱;
[0098]
化合物59:1-o-(3'-碘-4'-三氟甲基苄基)荷叶碱;
[0099]
化合物60:1-o-(2'-氟-4'-甲氧基苄基)荷叶碱;
[0100]
化合物61:1-o-(2'-氯-4'-甲氧基苄基)荷叶碱;
[0101]
化合物62:1-o-(2'-溴-4'-甲氧基苄基)荷叶碱;
[0102]
化合物63:1-o-(2'-氟-5'-甲氧基苄基)荷叶碱;
[0103]
化合物64:1-o-(2'-氯-5'-甲氧基苄基)荷叶碱;
[0104]
化合物65:1-o-(2
′‑
溴-5
′‑
甲氧基苄基)荷叶碱;
[0105]
化合物66:1-o-(3'-氟-5'-甲氧基苄基)荷叶碱;
[0106]
化合物67:1-o-(3'-氯-5'-甲氧基苄基)荷叶碱;
[0107]
化合物68:1-o-(3'-溴-5'-甲氧基苄基)荷叶碱;
[0108]
化合物69:1-o-(2'-甲氧基-3'-三氟甲基苄基)荷叶碱;
[0109]
化合物70:1-o-(2'-甲氧基-4'-三氟甲基苄基)荷叶碱;
[0110]
化合物71:1-o-(2'-甲氧基-5'-三氟甲基苄基)荷叶碱;
[0111]
化合物72:1-o-(5'-三氟甲基-3'-甲氧基苄基)荷叶碱;
[0112]
化合物73:1-o-(3'-甲氧基-2'-三氟甲基苄基)荷叶碱;
[0113]
化合物74:1-o-(3'-甲氧基-4'-三氟甲基苄基)荷叶碱;
[0114]
化合物75:1-o-(2'-三氟甲基-4'-甲氧基苄基)荷叶碱;
[0115]
化合物76:1-o-(3-三氟甲基-4-甲氧基苄基)荷叶碱;
[0116]
化合物77:1-o-(2'-吡啶甲基)荷叶碱;
[0117]
化合物78:1-o-(3'-吡啶甲基)荷叶碱;
[0118]
化合物79:1-o-(4'-吡啶甲基)荷叶碱;
[0119]
化合物80:1-o-苄基荷叶碱盐酸盐;
[0120]
化合物81:1-o-邻氟苄基荷叶碱盐酸盐;
[0121]
化合物82:1-o-间氟苄基荷叶碱乙酸盐;
[0122]
化合物83:1-o-对氟苄基荷叶碱盐酸盐;
[0123]
化合物84:1-o-邻氯苄基荷叶碱乙酸盐;
[0124]
化合物85:1-o-间氯苄基荷叶碱盐酸盐;
[0125]
化合物86:1-o-对氯苄基荷叶碱氢溴酸盐;
[0126]
化合物87:1-o-邻溴苄基荷叶碱盐酸盐;
[0127]
化合物88:1-o-间溴苄基荷叶碱富马酸盐;
[0128]
化合物89:1-o-对溴苄基荷叶碱丙酸盐;
[0129]
化合物90:1-o-间碘苄基荷叶碱乙酸盐;
[0130]
化合物91:1-o-对碘苄基荷叶碱盐酸盐;
[0131]
化合物92:1-o-对甲氧基苄基荷叶碱氢溴酸盐;
[0132]
化合物93:1-o-间氰基苄基荷叶碱马来酸盐;
[0133]
化合物94:1-o-对氰基苄基荷叶碱盐酸盐;
[0134]
化合物95:1-o-间硝基苄基荷叶碱盐酸盐;
[0135]
化合物96:1-o-对硝基苄基荷叶碱乙酸盐;
[0136]
化合物97:1-o-(3
′
,4
′‑
二氟苄基)荷叶碱丙酸盐;
[0137]
化合物98:1-o-(2',4'-二氟苄基)荷叶碱乙酸盐;
[0138]
化合物99:1-o-(2',5'-二氟苄基)荷叶碱苯甲酸盐;
[0139]
化合物100:1-o-(3',5'-二氟苄基)荷叶碱盐酸盐;
[0140]
化合物101:1-o-(3',4'-二氯苄基)荷叶碱盐酸盐;
[0141]
化合物102:1-o-(2',4'-二氯苄基)荷叶碱盐酸盐;
[0142]
化合物103:1-o-(3',4'-二溴苄基)荷叶碱氢溴酸盐;
[0143]
化合物104:1-o-(2',4'-二溴苄基)荷叶碱氢溴酸盐;
[0144]
化合物105:1-o-(2'-氟-3'-甲基苄基)荷叶碱氢溴酸盐;
[0145]
化合物106:1-o-(3'-氟-2'-甲基苄基)荷叶碱盐酸盐;
[0146]
化合物107:1-o-邻三氟甲基苄基荷叶碱盐酸盐;
[0147]
化合物108:1-o-间三氟甲基苄基荷叶碱盐酸盐;
[0148]
化合物109:1-o-对三氟甲基苄基荷叶碱盐酸盐;
[0149]
化合物110:1-o-(2',3'-二(三氟甲基)苄基)荷叶碱盐酸盐;
[0150]
化合物111:1-o-(3',4'-二(三氟甲基)苄基)荷叶碱氢溴酸盐;
[0151]
化合物112:1-o-(2',4'-二(三氟甲基)苄基)荷叶碱氢碘酸盐;
[0152]
化合物113:1-o-(2',5'-二(三氟甲基)苄基)荷叶碱丙二酸盐;
[0153]
化合物114:1-o-(3',5'-二(三氟甲基)苄基)荷叶碱盐酸盐;
[0154]
化合物115:1-o-(2'-氯-3'-三氟甲基苄基)荷叶碱盐酸盐;
[0155]
化合物116:1-o-(2'-溴-3'-三氟甲基苄基)荷叶碱氢溴酸盐;
[0156]
化合物117:1-o-(2'-氟-3'-三氟甲基苄基)荷叶碱盐酸盐;
[0157]
化合物118:1-o-(2'-碘-3'-三氟甲基苄基)荷叶碱盐酸盐;
[0158]
化合物119:1-o-(4'-氯-3'-三氟甲基苄基)荷叶碱盐酸盐;
[0159]
化合物120:1-o-(4'-溴-3'-三氟甲基苄基)荷叶碱氢溴酸盐;
[0160]
化合物121:1-o-(4'-氟-3'-三氟甲基苄基)荷叶碱盐酸盐;
[0161]
化合物122:1-o-(4'-碘-3'-三氟甲基苄基)荷叶碱盐酸盐;
[0162]
化合物123:1-o-(2'-氯-5'-三氟甲基苄基)荷叶碱盐酸盐;
[0163]
化合物124:1-o-(2'-溴-5'-三氟甲基苄基)荷叶碱氢溴酸盐;
[0164]
化合物125:1-o-(2'-氟-5'-三氟甲基苄基)荷叶碱盐酸盐;
[0165]
化合物126:1-o-(2'-碘-5'-三氟甲基苄基)荷叶碱盐酸盐;
[0166]
化合物127:1-o-(3'-氯-5'-三氟甲基苄基)荷叶碱盐酸盐;
[0167]
化合物128:1-o-(3'-溴-5'-三氟甲基苄基)荷叶碱氢溴酸盐;
[0168]
化合物129:1-o-(3'-氟-5'-三氟甲基苄基)荷叶碱盐酸盐;
[0169]
化合物130:1-o-(3'-碘-5'-三氟甲基苄基)荷叶碱盐酸盐;
[0170]
化合物131:1-o-(2'-氯-4'-三氟甲基苄基)荷叶碱盐酸盐;
[0171]
化合物132:1-o-(2'-溴-4'-三氟甲基苄基)荷叶碱氢溴酸盐;
[0172]
化合物133:1-o-(2'-氟-4'-三氟甲基苄基)荷叶碱盐酸盐;
[0173]
化合物134:1-o-(2'-碘-4'-三氟甲基苄基)荷叶碱烟酸盐;
[0174]
化合物135:1-o-(3'-氯-4'-三氟甲基苄基)荷叶碱盐酸盐;
[0175]
化合物136:1-o-(3'-溴-4'-三氟甲基苄基)荷叶碱氢溴酸盐;
[0176]
化合物137:1-o-(3'-氟-4'-三氟甲基苄基)荷叶碱盐酸盐;
[0177]
化合物138:1-o-(3'-碘-4'-三氟甲基苄基)荷叶碱盐酸盐;
[0178]
化合物139:1-o-(2'-氟-4'-甲氧基苄基)荷叶碱氢溴酸盐;
[0179]
化合物140:1-o-(2'-氯-4'-甲氧基苄基)荷叶碱盐酸盐;
[0180]
化合物141:1-o-(2'-溴-4'-甲氧基苄基)荷叶碱盐酸盐;
[0181]
化合物142:1-o-(2'-氟-5'-甲氧基苄基)荷叶碱盐酸盐;
[0182]
化合物143:1-o-(2'-氯-5'-甲氧基苄基)荷叶碱乙酸盐;
[0183]
化合物144:1-o-(2'-溴-5'-甲氧基苄基)荷叶碱乙酸盐;
[0184]
化合物145:1-o-(3'-氟-5'-甲氧基苄基)荷叶碱丙酸盐;
[0185]
化合物146:1-o-(3'-氯-5'-甲氧基苄基)荷叶碱丙酸盐;
[0186]
化合物147:1-o-(3
′‑
溴-5
′‑
甲氧基苄基)荷叶碱氢溴酸盐;
[0187]
化合物148:1-o-(2'-甲氧基-3'-三氟甲基苄基)荷叶碱乙酸盐;
[0188]
化合物149:1-o-(2'-甲氧基-4'-三氟甲基苄基)荷叶碱烟酸盐;
[0189]
化合物150:1-o-(2
′‑
甲氧基-5
′‑
三氟甲基苄基)荷叶碱乙酸盐;
[0190]
化合物151:1-o-(5'-三氟甲基-3'-甲氧基苄基)荷叶碱乙酸盐;
[0191]
化合物152:1-o-(3'-甲氧基-2'-三氟甲基苄基)荷叶碱柠檬酸盐;
[0192]
化合物153:1-o-(3'-甲氧基-4'-三氟甲基苄基)荷叶碱1,4-丁二酸盐;
[0193]
化合物154:1-o-(2'-三氟甲基-4'-甲氧基苄基)荷叶碱葡萄糖酸盐;
[0194]
化合物155:1-o-(3'-三氟甲基-4'-甲氧基苄基)荷叶碱乙酸盐;
[0195]
化合物156:1-o-(2'-吡啶甲基)荷叶碱盐酸盐;
[0196]
化合物157:1-o-(3'-吡啶甲基)荷叶碱氢溴酸盐;
[0197]
化合物158:1-o-(4'-吡啶甲基)荷叶碱乙酸盐。
[0198]
在本发明的第二方面,本发明提供了一种制备上述第一方面中所述的荷叶碱衍生物或其药学上所接受的盐的方法,其包括:以o-去甲基荷叶碱为起始反应物与rx反应后制备式i化合物;
[0199]
或者,得到式i化合物加y制备式i’化合物;
[0200]
其中,x为卤素,选自f、cl、br、i,r如上文中所定义,y如如上文中所定义。
[0201]
在本发明的一个或多个实施方式中,所述制备方法包括:将o-去甲基荷叶碱溶解溶剂中,在惰性气氛中,加入碱性物质混合均匀,在-20~100℃下加入rx,反应0.1~12h,反应过程中保持溶液呈碱性,色谱法检测反应至终点后放置至室温,经分离纯化制备式i化合物,或进一步加y中和至中性,分离纯化制备式i’化合物。
[0202]
在本发明的一个或多个实施方式中,所述溶剂选自二氯甲烷、三氯甲烷、四氯化碳、苯、甲苯、二甲苯、1,4-二氧六环、1,2-二氯乙烷、四氢呋喃、n,n-二甲基甲酰胺、乙酸乙酯和二甲基亚砜中的一种或多种。
[0203]
在本发明的一个或多个实施方式中,所述溶剂的用量为每摩尔o-去甲基荷叶碱溶解于5-100l溶剂中。
[0204]
在本发明的一个或多个实施方式中,所述碱性物质选自γ-al2o
3-na、γ-al2o
3-k、γ-al2o
3-naoh-na、γ-al2o
3-naoh-k、γ-al2o
3-koh-na、γ-al2o
3-koh-k、甲醇钠、乙醇钠、丙醇钠、丁醇钠、氨基钠、金属钠、氢化钠、氢氧化钠、氢氧化钾、氢氧化钙、氧化钠、氧化钾、氧化钙、碳酸钾、碳酸钠、氨水、乙胺、二乙胺、三乙胺、甲胺、二甲胺、三甲胺、吡啶和哌啶中的一种或多种。
[0205]
在本发明的一个或多个实施方式中,所述o-去甲基荷叶碱、rx、碱性物质的摩尔比为1:(0.1~10):(0.1~20),优选为1︰(1.0~1.5)︰(1~3)。
[0206]
在本发明的一个或多个实施方式中,所述1-o-去甲基荷叶碱与rx反应温度为-20~100℃下,优选-20~50℃,更优选0-50℃。
[0207]
在本发明的一个或多个实施方式中,所述分离纯化方法选自过滤、树脂处理、水洗、蒸馏、结晶、萃取、活性炭处理、分子筛处理和层析中的一种或多种的结合。
[0208]
本发明所述的分离纯化的方法可以为:比如,在tlc检测1-o-去甲基荷叶碱全部反应,升温至室温后,加水,用二氯甲烷、三氯甲烷、丙酮或乙酸乙酯萃取1至多次,比如3次(比如50-300ml
×
3),tlc追踪反应与产物的分离纯化过程,萃取液回收,得固体物在干燥比如在60℃下干燥4h,得到目标产物。
[0209]
比如,所述分离纯化方法可以为:hplc检测1-o-去甲基荷叶碱全部反应,蒸出溶剂至液体体积减少至1/4,冷却结晶过夜,比如冷却至5℃结晶过夜,过滤,hplc追踪反应与产物的分离纯化过程,固体物干燥,比如在60℃下干燥4h,得到目标产物。
[0210]
比如,所述分离纯化方法可以为:hplc检测1-o-去甲基荷叶碱全部反应,减压出溶剂,进行层析,比如采用三氧化二铝柱层析,用乙酸乙酯-乙醇(比如200:1)或二氯甲烷-甲醇(100:1)洗脱,hplc追踪反应与产物的分离纯化过程,收集并合并产品流分,用旋转蒸发仪(比如在60℃下)蒸出溶剂,得到目标产物。
[0211]
比如,所述分离纯化方法可以为:tlc检测1-o-去甲基荷叶碱全部反应,减压蒸出溶剂,降温至室温,加y酸,比如加10%盐酸中和至中性,使用分子筛吸附树脂比如用500g 5a分子筛吸附树脂处理,水洗后再用无水乙醇洗脱,tlc追踪反应与产物的分离纯化过程,收集乙醇流分,减压蒸出乙醇得固体物,固体物干燥比如60℃下干燥4h,得到目标产物。
[0212]
比如,所述分离纯化方法可以为:tlc检测1-o-去甲基荷叶碱全部反应,加y酸比如加10%盐酸中和至中性,加适当溶剂比如丙酮100ml溶解后加入活性炭,过滤除去氧化铝固体碱比如γ-al2o3和活性炭,滤液蒸至50ml后常温结晶过夜,tlc追踪反应与产物的分离纯化过程,过滤,固体物干燥比如在60℃下干燥4h,得到目标产物。
[0213]
比如,所述分离纯化方法可以为:tlc检测1-o-去甲基荷叶碱全部反应,减压蒸出溶剂,降温至室温,加y酸比如加30%富马酸中和至ph=7.1,减压蒸出溶剂,固体物加水溶解后,使用大孔吸附树脂比如用500g的d-101型大孔吸附树脂处理,水洗后在用适宜溶剂比如95%乙醇洗脱,tlc追踪反应与产物的分离纯化过程,收集乙醇部分,减压蒸出乙醇后制得固体物,固体物干燥比如在60℃下干燥6h,得到目标产物。
[0214]
比如,所述分离纯化方法可以为:tlc检测1-o-去甲基荷叶碱全部反应,冷至常温,加y酸比如加20%乙酸中和至中性,40℃保温静置4h析晶,过滤,固体物加适宜溶剂比如丙酮100ml重结晶,过滤,tlc追踪反应与产物的分离纯化过程,固体物干燥比如在60℃下干燥2h,得到目标产物。
[0215]
在本发明的第三方面,本发明提供了一种药物组合物或药物制剂,其包括上述第一方面中所述的荷叶碱衍生物或其药学上可接受的盐;
[0216]
或者,还可以进一步包含药学上可接受的辅料和/或载体。
[0217]“药学上可接受的辅料”是指药物组合物或药物制剂中除有效成分之外的成分,其对受试者无毒。药学上可接受的辅料,包括但不限于赋形剂、缓冲剂、稳定剂或防腐剂。
[0218]“药物载体”是指药学上可接受的溶剂,悬浮剂或载体(比如蛋白质、脂质体等),用于将活性成分递送至动物或人体内。载体可以是液体或固体,可按照计划的给药方式进行选择。
[0219]
本发明的一些实施方式中包括生产药物组合物或药物制剂的方法,所述方法包括将根据本文所述的化合物中的至少一种与药用辅料混合。也可以通过任意合适的方法制备制剂,比如,通常通过以所需比例均匀混合活性化合物与液体和/或微细粉碎的固体辅料制备,然后如果需要,使所得混合物形成所需的形状。本领域技术人员可使用本领域公知的技术将本发明的化合物配制成药物组合物或制剂。比如可根据由沈阳药科大学主编的现代药物制剂丛书进行药物制剂的制备。合适的药用辅料可根据需要选择本领域已知的,例如参见药用辅料手册,作者(英)r.c.罗(raymondcrowe)(美)p.j.舍斯基(pauljsheskey),目前该书已初版至第八版。
[0220]
在本发明的第四方面,本发明提供了上述第一方面中所述荷叶碱衍生物或其药学上可接受的盐、或上述第三方面中所述的药物组合物或药物制剂在制备用于降糖和/或降脂的药物或食品或保健品中的应用,或者在制备治疗高血糖和/或高血脂症药物中的应用;或者在制备α-糖苷酶抑制剂和/或胆汁酸螯合剂中的应用。
[0221]
在本发明的第五方面,本发明提供了一种降糖和/或降脂的方法,其包括向受试者施用治疗有效量的本发明上述第一方面中所述的荷叶碱衍生物或其药学上可接受的盐、或
上述第三方面中所述的药物组合物或药物制剂。所述降糖为降血糖,比如用于高血糖症的治疗,所述降脂为降血脂,比如用于高血脂症的治疗。
[0222]
其中,“受试者”是指已经是治疗、观察或实验的对象的动物,优选指哺乳动物,最优选指人。“治疗有效量”是指包括本发明化合物在内的活性化合物或药剂的量,该量可引起研究者、兽医、医生或其他医疗人员所追求的组织系统、动物或人的生物学或医学响应,这包括减轻或部分减轻受治疗的疾病、综合征、病症或障碍的症状
[0223]
相较于现有技术,本发明的有益效果是:
[0224]
本发明的荷叶碱衍生物或其药学上可接受的盐具有良好的降糖和降脂活性,尤其是,当本发明的结构中含有含卤素的芳基时,降糖和降脂活性增加显著,比如对α-糖苷酶的抑制率显著增强,比如,所述含卤素的芳基为三氟甲基苄基时,这类化合物对α-糖苷酶抑制率基本上都小于0.5(ic
50
,mmol/l),显著低于阿卡波糖(ic
50
=5.35mmol/l),其中1-o-(4
′‑
氯-3
′‑
三氟甲基苄基)荷叶碱对α-糖苷酶的抑制率是阳性药阿卡波糖的35.7倍;比如对牛磺胆酸钠吸附能力显著增强,其中,所述含卤素的芳基为三氟甲基苄基时,这类化合物对牛磺胆酸钠吸附能力是阳性药考来烯胺的3倍以上,其中,1-o-间三氟甲基苄基荷叶碱对牛磺胆酸钠吸附能力是阳性药考来烯胺的4.5倍。
具体实施方式
[0225]
下面结合具体实施例,进一步阐述本技术。应理解,这些实施例仅用于说明本技术而不用于限制本技术的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
[0226]
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本技术所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本技术所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本技术方法中。文中所述的较佳实施方法与材料仅作示范之用。
[0227]
实施例1 1-o-苄基荷叶碱的合成
[0228]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于50ml二氯甲烷溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.29g(约12mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入1.27g(约10mmol)溶于30ml二氯甲烷的苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后加入60ml去离子冰水,分出有机相,水相用二氯甲烷3次(比如50ml
×
3),合并有机相,蒸出有机相即得淡黄色粉末状产物2.21g,tlc追踪反应与产物的分离纯化过程,产物的熔点为103.5-105.2℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-苄基荷叶碱,即表1中的化合物1,收率59.5%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ:8.02(d,j=7.8hz,1h),7.29(dd,j=6.8,3.1hz,2h),7.26
–
7.22(m,3h),7.20(dd,j=11.0,3.4hz,2h),7.16(dd,j=5.0,3.7hz,1h),6.64(s,1h),4.32
–
4.21(m,2h),3.84(s,3h),3.15
–
3.04(m,1h),3.03
–
2.98(m,1h),2.97
–
2.87(m,2h),2.64(dd,j=16.5,3.2hz,1h),2.56(t,j=13.4hz,1h),2.45(s,3h),2.44
–
2.38(m,1h);
13
c nmr(101mhz,cdcl3)δ:151.28,137.01,134.65,132.88,130.83,129.06,128.35,128.72,127.36,127.00,111.67,111.29,62.34,60.27,58.68,56.14,55.88,53.51,53.31,53.03,45.79,43.97,35.13,
34.88,29.29;hrms(esi):calcd for c
25h25
no
2 m/z:371.1979,found:372.1998[m h]
。
[0229]
实施例2 1-o-邻氟苄基荷叶碱的合成
[0230]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢氧化钾0.56g(约10mmol),室温下机械搅拌混合2.0h,加入2.89g(约20mmol)溶于50ml dmf的邻氟苄基氯、30~40℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡绿色粉末状产物2.44g,产物的熔点为101.4-103.3℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-邻氟苄基荷叶碱,即表1中的化合物2,收率62.7%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.25(d,j=7.6hz,1h),7.23
–
7.19(m,1h),7.16(dt,j=6.1,2.3hz,1h),7.13
–
7.08(m,3h),6.92(td,j=7.5,1.0hz,1h),6.86
–
6.78(m,1h),6.56(s,1h),4.88
–
4.69(m,2h),3.79(s,3h),3.15
–
3.04(m,1h),2.97(dd,j=7.0,3.4hz,1h),2.96
–
2.88(m,2h),2.62(dd,j=16.3,3.5hz,1h),2.47(s,3h),2.46
–
2.38(m,2h);
13
c nmr(101mhz,cdcl3)δ159.64,152.12,143.07,136.29,132.11,131.08,129.61,129.03,127.88,127.59,127.24,126.77,124.35,123.60,115.01,114.80,111.22,67.73,62.36,55.89,53.30,44.00,35.07,29.25;hrms(esi):calcd for c
25h24
o2nf m/z:389.1879,found:390.1824[m h]
。
[0231]
实施例3 1-o-间氟苄基荷叶碱的合成
[0232]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入哌啶3.41g(约40mmol),室温下机械搅拌混合2.0h,加入2.17g(约15mmol)溶于50ml dmf的间氟苄基氯、90~100℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,室温下结晶4-6h,抽滤,固体物在60℃下干燥4-6h即产物,tlc追踪反应与产物的分离纯化过程,制得淡绿色粉末状产物2.03g,产物的熔点为102.7-104.5℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-间氟苄基荷叶碱,即表1中的化合物3,收率52.3%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.26(t,j=5.6hz,1h),7.19(dt,j=5.9,1.8hz,2h),7.17
–
7.15(m,2h),7.15
–
7.11(m,1h),7.04
–
6.94(m,2h),6.90
–
6.82(m,1h),6.57(s,1h),4.66(dd,j=59.1,10.9hz,2h),3.80(s,3h),3.15
–
3.04(m,1h),3.00(dd,j=12.8,3.1hz,1h),2.98
–
2.88(m,2h),2.62(dd,j=16.3,3.4hz,1h),2.47(s,3h),2.46
–
2.39(m,1h);
13
c nmr(101mhz,cdcl3)δ163.89,161.45,151.99,143.26,139.85,136.42,132.07,129.53,129.09,128.83,127.52,126.82,123.99,115.52,115.31,114.75,114.54,111.27,73.73,62.34,55.90,53.36,43.99,35.07,29.22;hrms(esi):calcd for c
25h24
o2nf m/z:389.1879,found:390.1886[m h]
。
[0233]
实施例4 1-o-对氟苄基荷叶碱的合成
[0234]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于50ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入γ-al2o
3-na 3.65g,室温下机械搅拌混合2.0h,置于冷阱中,加入2.17g(约15mmol)溶于35ml dmf的对氟苄基氯、在-5~0℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂
得产物,tlc追踪反应与产物的分离纯化过程,制得淡绿色粉末状产物1.73g,产物的熔点为102.7-104.6℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-对氟苄基荷叶碱,即表1中的化合物4,收率44.3%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ:8.25(d,j=7.1hz,1h),7.18(s,1h),7.14(s,3h),7.12(t,j=3.7hz,1h),6.83(t,j=8.7hz,2h),6.56(s,1h),4.63(dd,j=60.4,10.6hz,2h),3.81(d,j=9.2hz,3h),3.14
–
3.03(m,1h),2.98(dd,j=13.5,4.1hz,1h),2.92(t,j=10.7hz,2h),2.61(dd,j=16.1,3.3hz,1h),2.46(s,3h),2.42(dt,j=12.0,5.1hz,2h);
13
c nmr(101mhz,cdcl3)δ:163.7,161.26,152.06,143.12,136.42,132.98,132.19,130.63,129.01,127.95,127.74,127.37,126.72,115.43,115.21,114.94,114.73,111.23,73.81,62.33,55.89,53.38,44.00,35.07,31.94,29.77,29.35;hrms(esi):calcd for c
25h24
o2nf m/z:389.1779,found:390.1886[m h]
。
[0235]
实施例5 1-o-间氯苄基荷叶碱的合成
[0236]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入γ-al2o
3-koh-k 4.20g,室温下机械搅拌混合2.0h,置于冷阱,加入3.22g(约20mmol)溶于60ml dmf的间氯苄基氯、在-5~0℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物1.81g,产物的熔点为101.9-103.5℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-间氯苄基荷叶碱,即表1中的化合物6,收率44.8%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.25(t,j=6.1hz,1h),7.26(s,1h),7.19(d,j=3.8hz,2h),7.17(s,1h),7.16
–
7.13(m,2h),7.10(d,j=5.8hz,1h),7.09
–
7.05(m,1h),6.56(d,j=11.3hz,1h),4.65(dd,j=62.2,10.9hz,2h),3.81(s,3h),3.16
–
3.04(m,1h),3.00(dd,j=13.6,3.7hz,1h),2.98
–
2.89(m,2h),2.62(dd,j=16.2,3.4hz,1h),2.47(s,4h),2.42(dd,j=11.8,3.6hz,1h);
13
c nmr(101mhz,cdcl3)δ151.97,143.19,139.28,136.45,133.96,132.04,129.22,128.83,127.93,126.72,111.25,73.74,62.34,55.90,53.28,44.01,35.08,29.73,29.24;hrms(esi):calcd for c
25h24
clno
2 m/z:405.1579,found:406.9279[m h]
。
[0237]
实施例6 1-o-间溴苄基荷叶碱的合成
[0238]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.24g(约10mmol),室温机械搅拌混合2.0h,置于冷阱中,加入3.29g(约16mmol)溶于60ml dmf的间溴苄基氯、控温-20~-10℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,室温下结晶4-6h,抽滤,固体物在60℃下干燥4-6h即产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物2.87g,产物的熔点为104.4-106.2℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-间溴苄基荷叶碱,即表1中的化合物9,收率59.9%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.25(d,j=7.5hz,1h),7.42(s,1h),7.32
–
7.27(m,1h),7.22
–
7.18(m,2h),7.18
–
7.14(m,2h),7.13
–
7.09(m,1h),7.05(t,j=7.7hz,1h),6.57(s,1h),4.62(dt,j=21.1,10.5hz,2h),3.81(s,3h),3.14
–
3.04(m,1h),3.00(dd,j=13.4,3.4hz,1h),2.98
–
2.89(m,2h),2.62(dd,j=16.3,3.4hz,1h),2.47(d,j=4.2hz,3h),2.42(dd,j=11.8,3.7hz,1h);
13
c nmr(101mhz,cdcl3)δ151.96,143.18,139.54,136.45,132.03,
131.72,130.86,129.60,129.13,128.89,127.74,127.10,126.82,122.18,111.25,73.70,62.34,55.90,53.27,44.00,35.08,29.73,29.23;hrms(esi):calcd for c
25h24
brno2m/z:479.1879,found:450.2022[m h]
。
[0239]
实施例7 1-o-间碘苄基荷叶碱的合成
[0240]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入乙醇钠0.82g(约12mmol),室温机械搅拌混合2.0h,置于冷阱中,加入3.82g(约15mmol)溶于60ml dmf的间碘苄基氯、控温0~10℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物2.64g,产物的熔点为105.4-107.3℃,经1hnmr、
13
c nmr和hr-ms分析,确定为1-o-间碘苄基荷叶碱,即表1中的化合物11,收率53.2%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.23(t,j=7.6hz,1h),7.61(d,j=1.5hz,1h),7.48(t,j=8.0hz,1h),7.22
–
7.18(m,1h),7.18(s,1h),7.14(dd,j=7.8,6.6hz,2h),6.90(t,j=7.7hz,1h),6.56(s,1h),4.59(dt,j=32.6,9.2hz,2h),3.80(s,3h),3.14
–
3.03(m,1h),3.00(dd,j=13.5,3.8hz,1h),2.92(dd,j=15.5,4.2hz,2h),2.61(dd,j=16.3,3.3hz,1h),2.46(s,3h),2.45
–
2.38(m,1h);
13
c nmr(101mhz,cdcl3)δ151.97,143.18,139.57,137.72,136.81,136.45,132.03,129.76,129.13,128.92,127.78,126.83,111.24,94.04,73.63,62.34,55.91,53.28,44.02,35.11,29.73,29.25;hrms(esi):calcd for c
25h24
ino
2 m/z:497.08,found:498.0893[m h]
。
[0241]
实施例8 1-o-间氰基苄基荷叶碱的合成
[0242]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于60ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.24g(约10mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入1.97g(约13mmol)溶于50ml dmf的间氰基苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用90ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物1.70g,产物的熔点为107.5-109.4℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-间氰基苄基荷叶碱,即表1中的化合物14,收率42.8%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.16(dt,j=6.2,2.3hz,1h),7.52(d,j=5.7hz,1h),7.41(dt,j=7.7,1.3hz,1h),7.35(d,j=7.8hz,1h),7.24(t,j=7.7hz,1h),7.19
–
7.16(m,1h),7.16
–
7.14(m,2h),6.57(s,1h),4.69(dd,j=67.4,11.3hz,2h),3.79(s,3h),3.12
–
3.02(m,1h),2.98(dd,j=12.4,2.9hz,1h),2.96
–
2.86(m,2h),2.60(dd,j=16.4,3.4hz,1h),2.45(s,3h),2.44
–
2.36(m,2h);
13
c nmr(101mhz,cdcl3)δ151.84,142.82,138.72,136.45,132.23,131.77,131.38,129.29,129.04,129.36,128.76,127.90,125.74,118.77,112.14,111.30,73.26,62.31,56.62,56.12,55.89,53.21,43.93,35.01,29.17;hrms(esi):calcd for c
26h24
o2n
2 m/z:396.1879,found:397.1913[m h]
。
[0243]
实施例9 1-o-间硝基苄基荷叶碱的合成
[0244]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢氧化钠0.40g(约10mmol),机械搅拌混合2.0h,加入2.06g(约
12mmol)溶于40ml dmf的间硝基苄基氯、60~70℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物1.74g,产物的熔点为97.7-99.5℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-间硝基苄基荷叶碱,即表1中的化合物16,收率41.9%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ:8.17(d,j=7.6hz,1h),8.12(t,j=1.8hz,1h),7.97(ddd,j=8.2,2.2,0.9hz,1h),7.42(d,j=7.6hz,1h),7.28(dd,j=10.0,5.7hz,1h),7.16(dd,j=7.6,5.6hz,1h),7.13
–
7.07(m,2h),6.57(s,1h),4.76(dd,j=70.0,11.4hz,2h),3.81(s,3h),3.12
–
3.01(m,1h),2.99
–
2.93(m,2h),2.92
–
2.83(m,1h),2.64
–
2.56(m,1h),2.45
–
2.42(m,3h),2.37(dd,j=18.3,8.6hz,2h);
13
c nmr(101mhz,cdcl3)δ:151.80,147.97,142.72,139.18,136.44,134.47,131.89,129.44,128.86,128.38,127.86,127.56,123.76,122.76,111.27,73.28,62.32,58.12,56.10,55.88,53.52,53.22,43.97,35.01,29.10;hrms(esi):calcd for c
25h24
n2o
4 m/z:416.1779,found:417.1865[m h]
。
[0245]
实施例10 1-o-(3
′
,4
′‑
二氟苄基)荷叶碱的合成
[0246]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入叔丁醇钠1.06g(约11mmol),室温机械搅拌混合2.0h,置于冷阱中,加入3.24g(约20mmol)溶于60ml dmf的3,4-二氟苄基氯、0~10℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物2.12g,产物的熔点为106.1-107.9℃,经1hnmr、
13
c nmr和hr-ms分析,确定为1-o-(3
′
,4
′‑
二氟苄基)荷叶碱,即表1中的化合物18,收率52.1%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.23
–
8.16(m,1h),7.40(t,j=8.0hz,2h),7.16
–
7.10(m,3h),6.56(d,j=9.9hz,1h),4.84
–
4.62(m,3h),3.80(s,3h),3.08(dd,j=19.0,8.0hz,1h),3.00
–
2.96(m,1h),2.94
–
2.85(m,2h),2.62(d,j=16.2hz,1h),2.46(s,3h),2.43
–
2.34(m,2h);
13
c nmr(101mhz,cdcl3)δ151.93,142.94,141.07,136.40,132.03,129.98,129.65,129.22,128.90,128.68,128.33,127.86,127.38,126.75,125.67,124.88,111.27,73.68,64.31,62.32,55.87,53.36,43.98,35.00,29.21;hrms(esi):calcd for c
25h23
o2nf
2 m/z:407.4679,found:408.1778[m h]
。
[0247]
实施例11 1-o-邻三氟甲基苄基荷叶碱的合成
[0248]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入三乙胺5.06g(约50mmol),室温下机械搅拌混合2.0h,加入2.34g(约12mmol)溶于60ml dmf的邻三氟甲基苄基氯、50~60℃下反应至1-o-去甲基荷叶碱反应完全,反应结束后使用120ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物2.58g,产物的熔点为112.2-113.9℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-邻三氟甲基苄基荷叶碱,即表1中的化合物28,收率58.8%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.24
–
8.18(m,
1h),7.17(dd,j=6.4,4.5hz,2h),7.16
–
7.11(m,2h),7.09
–
7.02(m,1h),6.93(dt,j=10.1,8.1hz,1h),6.88
–
6.82(m,1h),6.57(s,1h),4.61(dd,j=64.0,10.9hz,2h),3.81(d,j=9.4hz,3h),3.14
–
3.03(m,1h),2.99(dd,j=13.6,3.6hz,1h),2.93(dd,j=16.6,10.2hz,2h),2.61(dd,j=16.2,3.3hz,1h),2.46(d,j=4.8hz,3h),2.44
–
2.38(m,2h);
13
c nmr(101mhz,cdcl3)δ151.91,151.22,148.76,142.94,136.46,134.29,132.04,129.24,128.85,127.84,127.50,126.75,124.67,117.74,116.66,111.24,73.33,62.31,55.88,53.26,44.00,35.05,29.68,29.29,27.24;hrms(esi):calcd for c
26h24
o2nf
3 m/z:439.4879,found:440.1843[m h]
。
[0249]
实施例12 1-o-(2
′‑
溴-5
′‑
甲氧基苄基)荷叶碱的合成
[0250]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml二氯甲烷溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.29g(约12mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入3.77g(约16mmol)溶于80ml二氯甲烷的2-溴-5-甲氧基苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用100ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约10ml,过中性氧化铝柱分离纯化(洗脱剂v/v:二氯甲烷/甲醇=200/1-100/1),收集产物馏分、减压蒸出溶剂得产物,tlc追踪反应与产物的分离纯化过程,制得淡黄色粉末状产物2.29g,产物的熔点为103.9-105.7℃,经1h nmr、
13
c nmr和hr-ms分析,确定为1-o-(2
′‑
溴-5
′‑
甲氧基苄基)荷叶碱,即表1中的化合物65,收率47.9%。产物化学结构波谱分析:1h nmr(400mhz,cdcl3)δ8.24(dd,j=7.8,1.5hz,1h),7.27
–
7.22(m,1h),7.16
–
7.12(m,2h),7.11
–
7.07(m,2h),6.59(dd,j=8.2,3.7hz,2h),4.91
–
4.66(m,2h),3.79(s,3h),3.68(s,3h),3.65
–
3.59(m,1h),3.19
–
3.06(m,1h),3.02(t,j=4.3hz,1h),2.98(d,j=8.1hz,2h),2.63(dd,j=16.3,3.3hz,1h),2.49(s,3h),2.48
–
2.38(m,1h);
13
c nmr(101mhz,cdcl3)δ158.89,152.10,143.39,138.03,136.28,132.76,132.01,128.93,127.74,126.86,115.24,114.86,112.95,111.37,73.65,62.38,58.36,55.90,55.46,53.22,43.80,34.98,29.05,18.45;hrms(esi):calcd for c
26h26
o3nbr m/z:479.1079,found:480.1173[m h]
。
[0251]
实施例13 1-o-苄基荷叶碱盐酸盐的合成
[0252]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于50ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.29g(约12mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入1.33g(约10.5mmol)溶于20ml dmf的苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,10%盐酸中和至中性,减压蒸出溶剂至约20ml,冷却结晶4-8h,抽滤制得固体物,固体物在60℃下干燥6-8h,tlc追踪反应与产物的分离纯化过程,即得无色粉末状的产物3.08g,目的产物的熔点为185.2-187.0℃,hrms(esi):calcd for c
25h26
o2ncl m/z:407.9322,found:408.9294[m h]
,即表1中的化合物80,收率75.5%。
[0253]
实施例14 1-o-间氟苄基荷叶碱醋酸盐的合成
[0254]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢氧化钠0.80g(约20mmol),室温下机械搅拌混合2.0h,加入2.17g(约15mmol)溶于50ml dmf的间氟苄基氯、控温50~60℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,50%醋酸中和至中性,用d101大孔树脂处理,水洗后再用无水乙醇洗脱,tlc追踪反应与产
物的分离纯化过程,收集乙醇馏分,减压蒸出乙醇得固体物,固体物在60℃下干燥6-8h,即得无色粉末状的产物3.13g,目的产物的熔点为158.4-159.9℃,hrms(esi):calcd for c
27h28
o4nf m/z:449.5140,found:450.5117[m h]
,即表1中的化合物82,收率69.6%。
[0255]
实施例15 1-o-间溴苄基荷叶碱富马酸盐的合成
[0256]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于50ml氯仿溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.24g(约10mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入3.29g(约16mmol)溶于60ml氯仿的间溴苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,30%富马酸中和至中性,减压蒸出溶剂至约30ml,冷却结晶4-8h,抽滤制得固体物,固体物在60℃下干燥6-8h,tlc追踪反应与产物的分离纯化过程,即得无色粉末状的产物3.07g,目的产物的熔点为175.7-177.3℃,hrms(esi):calcd for c
29h28
o6nbr m/z:566.4398,found:567.4362[m h]
,即表1中的化合物88,收率54.2%。
[0257]
实施例16 1-o-间氰基苄基荷叶碱马来酸盐的合成
[0258]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入三乙胺4.04g(约40mmol),室温下机械搅拌混合2.0h,加入1.97g(约13mmol)溶于60ml dmf的间氰基苄基氯、控温80~90℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用100ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,30%马来酸中和至中性,减压蒸出溶剂至约30ml,冷却结晶4-8h,抽滤制得固体物,固体物在60℃下干燥6-8h,tlc追踪反应与产物的分离纯化过程,即得无色粉末状的产物2.28g,目的产物的熔点为178.7-180.5℃,hrms(esi):calcd for c
30h28
o6n
2 m/z:512.5532,found:513.5501[m h]
,即表1中的化合物93,收率44.5%。
[0259]
实施例17 1-o-间硝基苄基荷叶碱盐酸盐的合成
[0260]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.24g(约10mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入2.06g(约12mmol)溶于40ml dmf的间硝基苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,10%盐酸中和至中性,减压蒸出溶剂至约20ml,冷却结晶4-8h,抽滤制得固体物,固体物在60℃下干燥6-8h,tlc追踪反应与产物的分离纯化过程,即得无色粉末状的产物3.17g,目的产物的熔点为181.7-183.5℃,hrms(esi):calcd for c
25h25
o4n2cl m/z:452.9298,found:453.9257[m h]
,即表1中的化合物95,收率70.2%。
[0261]
实施例18 1-o-(3
′
,4
′‑
二氟苄基)荷叶碱丙酸盐的合成
[0262]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢氧化钾0.84g(约15mmol),室温下机械搅拌混合2.0h,加入3.24g(约20mmol)溶于60ml dmf的3,4-二氟苄基氯、控温30~50℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,30%丙酸中和至中性,用d101大孔树脂处理,水洗后再用无水乙醇洗脱,tlc追踪反应与产物的分离纯化过程,收集乙醇馏分,减压蒸出乙醇得固体物,固体物在60℃下干燥6-8h,即得无色粉末状的产物3.04g,目的产物的熔点为153.5-155.2℃,hrms(esi):calcd for c
28h29
o4nf
2 m/z:481.5310,found:482.5286[m h]
,即表1中的化合物97,收率63.2%。
[0263]
实施例19 1-o-邻三氟甲基苄基荷叶碱盐酸盐的合成
[0264]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢化钠0.36g(约15mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入2.34g(约12mmol)溶于60ml dmf的邻三氟甲基苄基氯、控温-20~-10℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用100ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,10%盐酸中和至中性,旋蒸浓缩至约20ml,室温下结晶4-6h,抽滤,固体物在60℃下干燥6-8h,即得无色粉末状的产物2.93g,目的产物的熔点为167.2-169.0℃,hrms(esi):calcd for c
26h25
o2nf3cl m/z:475.9301,found:476.9286[m h]
,即表1中的化合物107,收率61.5%。
[0265]
实施例20 1-o-(3
′‑
氯-5
′‑
三氟甲基苄基)荷叶碱盐酸盐的合成
[0266]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmf溶剂并置于充满氮气的250ml三颈烧瓶中,加入氢氧化钾0.84g(约15mmol),室温下机械搅拌混合2.0h,加入3.44g(约15mmol)溶于60ml dmf的3-氯-5-三氟甲基苄基氯、控温30~50℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用100ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,10%盐酸中和至中性,用d101大孔树脂处理,水洗后再用无水乙醇洗脱,tlc追踪反应与产物的分离纯化过程,收集乙醇馏分,减压蒸出乙醇得固体物,固体物在60℃下干燥6-8h,即得无色粉末状的产物3.43g,目的产物的熔点为166.4-168.3℃,hrms(esi):calcd for c
26h24
o2nf3cl
2 m/z:510.3749,found:511.3717[m h]
,即表1中的化合物127,收率67.2%。
[0267]
实施例21 1-o-(3
′‑
溴-5
′‑
甲氧基苄基)荷叶碱氢溴酸盐的合成
[0268]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml二氯甲烷溶剂并置于充满氮气的250ml三颈烧瓶中,加入丁醇钠1.44g(约15mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入3.77g(约16mmol)溶于80ml二氯甲烷的3-溴-5-甲氧基苄基氯、控温-10~0℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用60ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,20%氢溴酸中和至中性,用d101大孔树脂处理,水洗后再用无水乙醇洗脱,tlc追踪反应与产物的分离纯化过程,收集乙醇馏分,减压蒸出乙醇得固体物,固体物在60℃下干燥6-8h,即得无色粉末状的产物3.29g,目的产物的熔点为175.7-177.5℃,hrms(esi):calcd for c
26h27
o3nbr
2 m/z:561.3055,found:562.3028[m h]
,即表1中的化合物147,收率58.6%。
[0269]
实施例22 1-o-(2
′‑
甲氧基-5
′‑
三氟甲基苄基)荷叶碱乙酸盐的合成
[0270]
准确称取1-o-去甲基荷叶碱2.81g(10mmol)溶于30ml dmso溶剂并置于充满氮气的250ml三颈烧瓶中,加入乙醇钠1.76g(约20mmol),室温下机械搅拌混合2.0h,置于冷阱中,加入3.37g(约15mmol)溶于80ml dmso的2-甲氧基-5-三氟甲基苄基氯、控温-5~5℃反应至1-o-去甲基荷叶碱反应完全,反应结束后使用100ml去离子冰水洗3-5次,将有机相旋蒸浓缩至约20ml,降温至室温,50%乙酸中和至中性,用d101大孔树脂处理,水洗后再用无水乙醇洗脱,tlc追踪反应与产物的分离纯化过程,收集乙醇馏分,减压蒸出乙醇得固体物,固体物在60℃下干燥6-8h,即得无色粉末状的产物3.47g,目的产物的熔点为177.4-179.2℃,hrms(esi):calcd for c
29h30
o5nf
3 m/z:529.5474,found:530.5435[m h]
,即表1中的化合物150,收率65.6%。
[0271]
其他化合物可根据上述实施例的方法、通过选择加入对应基团的卤代物制备得到。
[0272]
实施例23α-糖苷酶抑制活性测定
[0273]
α-pnpg溶液5.3mmol/ml(20
×
10-3
ml),α-葡萄糖苷酶溶液10u/ml(10
×
10-3
ml),加入不同剂量待测样品(表1样品)溶液(10mg/ml)和磷酸盐缓冲液溶液,反应体系总体积为130
×
10-3
ml,空白对,空白对照为磷酸盐缓冲液、α-pnpg溶液以及α-葡萄糖苷酶溶液的混合液,阳性对照为阿卡波糖。取酶液10
×
10-3
ml加入缓冲液和不同体积待测样品溶液,混匀,37℃下恒温10min,再加入α-pnpg 20
×
10-3
ml,37℃保温10min,加入终止剂na2co3(1mol/l)50
×
10-3
ml,混匀,取混合液110
×
10-3
ml,溶于2ml缓冲溶液,紫外-可见分光光度仪(shimadzu uv-2600)于405nm处测定溶液吸光度,计算抑制率(in%),每一组重复3次,并通过spss计算其ic
50
。结果见表1。
[0274][0275]
实施例24牛磺胆酸钠吸附能力的测定
[0276]
模拟胃液:用0.01mol/l的盐酸溶液配制成10mg/ml的胃蛋白酶溶液。模拟肠液:用0.1mol/l ph 6.3的磷酸缓冲液配制成10mg/ml的胰蛋白酶溶液。牛磺胆酸钠:浓度为0.3mmol/l,采用0.1mol/l ph 6.3的磷酸缓冲液配制。
[0277]
各取1ml样品(表1样品,1.0mg)和考来烯胺1.0mg(南京厚生药业、阳性对照药)于各具塞试管中,加入1ml的模拟胃液,在37℃水浴中消化1h,用0.1mol/l的naoh溶液调节ph至6.3,随后加入4ml模拟肠液,继续在37℃水浴中消化1h。每个样品中分别加入4ml牛磺胆酸钠溶液,在37℃水浴中反应1h。反应结束后将混合物离心,4000r/min离心20min,测定上清液中的牛磺胆酸钠含量,取2.5ml的上述上清液,加入60%的硫酸溶液7.5m l,70℃水浴20min,取出后立即冰浴5min,于紫外-可见分光光度仪(shimadzu uv-2600)386nm处测定吸光值。
[0278]
牛磺胆酸钠的吸附实验以考来烯胺作为阳性对照,样品对牛磺胆酸钠的吸附率由相对于1.0mg的考来烯胺的百分比来表示。结果见表1。
[0279]
表1α-糖苷酶抑制活性与牛磺胆酸钠吸附能力测定结果
[0280]
[0281]
[0282]
[0283]
[0284]
[0285]
[0286]
[0287]
[0288][0289]
注:
“‑”
表示没有活性。
[0290]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,尽管参照前述实施例对本技术进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。