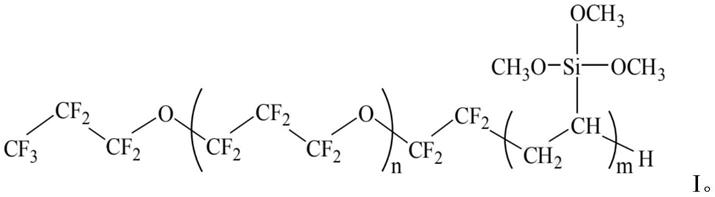
1.本发明属于生物技术领域,更具体的,涉及果糖-1,6-二磷酸钙盐在提高根际促生菌在植物根际定殖的应用。
背景技术:
2.由于农业生产中化学肥料的过度施用,导致了生态安全、食品安全、环境污染等一系列问题。微生物肥料因其绿色环保、安全有效等特点而受到广泛关注,已成为绿色生态农业发展的新型驱动力。20年来,我国微生物肥料产业经历了高速发展阶段。目前已进入到最为需要创新的时期,研发新产品、新菌种、新工艺、新功效等已成为新时期产业的发展目标。
3.植物根际促生菌(plant growth promoting rhizobacteria,pgpr)是指生活在根际土壤或依附于植物根系的有益细菌,它不仅能给植物提供营养、降低病虫害发生,增加作物产量,同时还能改善土壤质量,防止其二次污染。目前,pgpr已成为微生物肥料研究的热点之一。根际促生菌促进植物生长和改善土壤健康的作用依赖于其在植物根际的定殖、诱导植物系统抗性、分泌特定生防活性物质等过程。
4.生物膜在植物根际促生菌适应环境逆境胁迫、改善农药等的敏感性、有效促进作物生长等过程中具有重要功能。有研究发现,在初级代谢中,拟南芥根系分泌的糖类可吸引枯草芽孢杆菌,其根系分泌的苹果酸可募集枯草芽孢杆菌到根系并刺激其形成生物膜。多种l-氨基酸对荧光假单胞菌有趋化作用。在次级代谢中,小麦根系分泌物类黄酮刺激毛萼田菁茎瘤菌产生趋化反应。有研究表明,植物对不同植物的根系分泌物的趋化性存在差异,不同亚种菌株对植物的趋化性和研究效果也存在差异。因此为高效固氮菌找到根际定殖的信号分子是制约其推广应用的瓶颈。
5.而现有技术中,利用高能磷酸化合物果糖-1,6-二磷酸钙盐(fb),化学式c6h
12
cao
12
p2,cas登录号103213-33-8,在医学上被用于心肌缺血的辅助治疗。作为信号分子提高促生菌在植物根际定殖的研究未见报道。
技术实现要素:
6.本发明提出了高能磷酸化合物果糖-1,6-二磷酸钙盐作为信号分子提高促生菌在植物根际定殖上的应用。
7.其中,果糖-1,6-二磷酸钙盐提高促生菌的生物膜形成量和泳动直径。
8.具体地,所述促生菌为植物根际促生菌,包括但不限于枯草芽孢杆菌(bacillus subtilis)nrcb002、解淀粉芽孢杆菌(bacillus amyloliquefaciens)nrcb005和施氏假单胞菌(pseudomonas stutzeri)nrcb010、白色芽孢杆菌(bacillus albus)lv5a、反硝化无色杆菌(achromobacter denitrificans)ysq030中的任意一种。
9.其中,枯草芽孢杆菌(bacillus subtilis)nrcb002已于2019年1月18日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.17213,保藏地址
为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,其详细信息披露于专利cn201910191640.8中。解淀粉芽孢杆菌(bacillus amyloliquefaciens)nrcb005已于2019年1月18日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.17214,其详细信息披露于cn201910191639.5中。施氏假单胞菌(pseudomonas stutzeri)nrcb010已于2019年12月02日保藏在中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.19067,其详细信息披露于cn202010071098.5中。白色芽孢杆菌(bacillus albus)lv5a已于2021年1月13日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.21616,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,其详细信息披露于专利cn113046261a中。反硝化无色杆菌(achromobacter denitrificans)ysq030已于2021年7月8日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.22850,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
10.在一些具体的实施例中,本技术证明了,果糖-1,6-二磷酸钙盐可以提高根际促生菌在番茄、生菜或水稻的根际定殖。
11.本发明同时提出了果糖-1,6-二磷酸钙盐在制备用于提高根际促生菌在植物根际定殖的制剂上的应用。
12.另外,本发明提出了一种提高根际促生菌在植物根际定殖的方法,向植物根际促生菌发酵液中添加果糖-1,6-二磷酸钙盐。
13.优选地,向植物根际促生菌发酵液添加果糖-1,6-二磷酸钙盐的浓度为0.01%-10%。更优选地,向植物根际促生菌发酵液添加果糖-1,6-二磷酸钙盐的浓度为0.1%-1%。
14.本发明还提出了另外的一种提高根际促生菌在植物根际定殖的方法,通过直接向植物根际处添加果糖-1,6-二磷酸钙盐,添加果糖-1,6-二磷酸钙盐的浓度为0.01%-10%。优选地,向植物根际添加果糖-1,6-二磷酸钙盐的最优浓度为0.05%-0.2%。即可以通过向植物根际或促生菌制品中添加果糖-1,6-二磷酸钙盐来达到提高根际促生菌在植物根际定殖的目的。
15.有益效果:本发明提供了高能磷酸化合物果糖-1,6-二磷酸钙盐(fb)在提高促生菌在根际定殖以及在制备促生菌在植物根际定殖的制剂方面的应用。本发明从植物根际筛选出一种促进促生菌在根际定殖的信号分子fb,研究发现fb对促生菌有显著的趋化作用和群游作用,能够显著诱导促生菌在植物根际定殖。根际分泌物中含fb的植物根部的促生菌数量显著增加,且fb可以有效促进促生菌生物膜的形成。因此,fb在促进促生菌在根际定殖方面具有广泛的应用前景。
附图说明
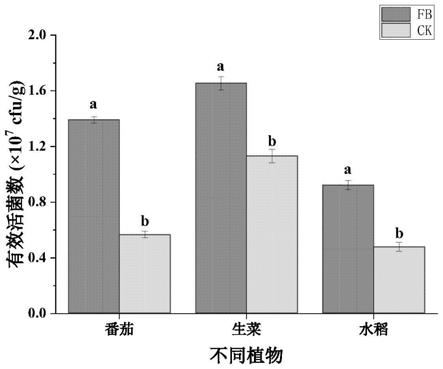
16.图1为不同浓度fb对于nrcb002生物膜的形成的影响;
17.图2为不同浓度fb对于nrcb005生物膜的形成的影响;
18.图3为不同浓度fb对于nrcb010生物膜的形成的影响;
19.图4为不同浓度fb对于lv5a生物膜的形成的影响;
20.图5为fb对不同菌涌动性影响;
21.图6为fb对根际促生菌nrcb002在番茄根际定殖的影响,(a)fb处理下的番茄根部
定殖的nrcb002活菌数(
×
107);(b)不加fb处理的番茄根部定殖的nrcb002活菌数(
×
107);
22.图7为不同浓度fb处理下的番茄根部定殖的nrcb002活菌数(
×
107);
23.图8为fb处理下的不同植物根部定殖的nrcb002活菌数(
×
107)。
具体实施方式
24.下面结合具体实施例对本发明做进一步详细说明。给出了详细的实施方式和具体的操作过程,实施例将有助于理解本发明,但是本发明的保护范围不限于下述的实施例。
25.除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,以下实施例所用试剂和材料均为市购。
26.实施例1果糖-1,6-二磷酸钙盐(fb)对根际促生菌nrcb002、nrcb005、nrcb010和lv5a生物膜的形成的影响。
27.(一)实验方法
28.从平板上接各个菌至50ml离心管中,30℃,200rpm培养12小时,吸取1%接种量至装有50ml lb培养液的250锥形瓶中,过夜培养。
29.将菌悬液吸取20ml在5000rpm离心5min(50ml离心管)。利用生理盐水洗涤两次收集菌体,再用k氏培养基定容至od值为1.2左右。向96孔塑料培养板依次加入菌液37.5μl,不同fb浓度(0、0.1、0.5、1g/l)的k氏培养基112.5μl,每个处理设置8个平行,以等量的无菌培养基作为空白对照组,于28℃静置培养48h。
30.培养48h,先用酶标仪测定溶液在od600nm处的吸光值,再用移液枪轻轻吸取培养板中的液体,并加入160μl蒸馏水清洗浮游细菌。向培养孔加入160μl 2%结晶紫,在室温下染色10min,吸取染色液,用蒸馏水清除未结合的结晶紫,晾干后,向培养孔中加入160μl 30%的乙酸,用酶标仪测定溶液在od560nm处的吸光值。生物膜形成量用od560nm处的吸光值表示。
31.(二)实验结果
32.不同浓度的fb对根际促生菌生物膜形成量的影响结果如图1-4和表1、表2所示,可以看出,fb能够促进根际促生菌nrcb002、nrcb005、nrcb010和lv5a生物膜的形成;其中,根际促生菌nrcb010生物膜形成量最高,不同浓度下(0、0.1、0.5、1g/l)相比对照组生物膜形成量增加了256.0%、262.2%和449.8%;nrcb002生物膜的形成量分别相比对照组增加了185.2%、192.9%和213.2%;nrcb005生物膜的形成量分别相比对照组增加了22.2%、24.4%和67.6%;lv5a生物膜的形成量分别相比对照组增加了33.06%、85.83%和265.96%。以上结果表明,fb可以有效促进根际促生菌生物膜的形成,有助于提高根际促生菌在植物根际定殖。
33.表1
[0034][0035]
表2
[0036][0037]
实施例2果糖-1,6-二磷酸钙盐(fb)对根际促生菌nrcb002、nrcb005、nrcb010泳动直径的影响。
[0038]
(一)实验方法
[0039]
swimming培养基:每1l中含胰蛋白胨10g、氯化钠10g、酵母粉5g和琼脂粉5g。
[0040]
使用nbns液体培养基接种过夜活化的菌株nrcb002、nrcb005、nrcb010种子液。30℃,200rpm条件下培养至对数中期(od600=1.0)。向swimming平板中加入100μl 0.1g/l fb溶液并均匀涂布。在平板中央放置一直径为0.5cm的圆形无菌纸片,用枪头吸取5μl菌液缓慢滴至纸片中央,在无菌环境下静置十分钟,将培养基轻柔移至30℃生化培养箱培养,分别在12h、8h和24h时间点测定nrcb002、nrcb005、nrcb010所形成的菌环的直径。每组平行3份。
[0041]
如图5所示,经fb处理后,nrcb002在泳动性平板表面培养12h后,相比于对照组,扩
散直径提高了40.4%;nrcb005在泳动性平板表面培养8h后,相比于对照组,扩散直径提高了30.1%;nrcb010在泳动性平板表面培养24h后,相比于对照组,扩散直径显著提高了70.5%。
[0042]
实施例3 fb对根际促生菌在植物根际定殖的作用。
[0043]
本实验选择一种根际促生菌nrcb002,研究fb对根际促生菌nrcb002在植物根际定殖中的作用,实验方法如下:
[0044]
番茄种子处理:用2.5%的84消毒液处理10min(剧烈晃动),用无菌水冲洗7-10次,再用无菌水浸泡5min,浸泡2次,去除水分后,将种子均匀撒在配置好的琼脂平板上,并放置在光照培养箱中催芽。
[0045]
菌种处理:将上述菌接于含10ml lb培养基的50ml离心管中,200rpm,30℃过夜培养,并调节od600至1.0,记录稀释倍数。将菌液5000rpm离心10min,去除上清,在无菌条件下用无菌水等量重悬2次后,用无菌水稀释100倍。作为微生物肥料或农药时,可混匀直接浇灌于植物根部。
[0046]
植物培养:
①
无菌环境下,将催芽3天的番茄幼苗在菌液中浸泡30min、60min、90min。随后,取出处理好的幼苗,用无菌滤纸吸干表面的水分,移至fb浓度为0.05g/l、0.1g/l的1/10ms固体培养基中。在平板约1/3处平行摆放幼苗,每个培养基七个,保证幼苗方向、幼苗间间隔一致。以没有加fb的1/10ms培养基为空白对照,重复3次。转至光照培养箱培养7天后取出。
[0047]
②
无菌环境下,将催芽3天的番茄幼苗在菌液中浸泡30min。随后,取出处理好的幼苗,用无菌滤纸吸干表面的水分,移至fb浓度分别为0.05g/l、0.1g/l、0.2g/l的1/10ms固体培养基中。在平板约1/3处平行摆放幼苗,每个培养基7株,保证幼苗方向、幼苗间间隔一致。以没有加fb的1/10ms培养基为空白对照,重复3次。转至光照培养箱培养7天后取出。
[0048]
③
无菌环境下,将催芽3天的番茄幼苗在菌液中浸泡30min。随后,取出处理好的幼苗,用无菌滤纸吸干表面的水分,移至1/10ms固体培养基中。在平板约1/3处平行摆放番茄、生菜、水稻幼苗,每个培养基7株,保证幼苗方向、幼苗间间隔一致。以没有加fb的1/10ms培养基为空白对照,重复3次。转至光照培养箱培养7天后取出。
[0049]
计数:将番茄种子光照培养培养7天后,在无菌的环境下将番茄根部剪下并用无菌水反复清洗表面未定殖的菌体和残留的培养基。然后,将根称重并加入无菌水研磨,最后将获得的根浊液用生理盐水依次稀释至10-3
、10-4
、10-5
,吸取100μl涂布于lb培养基上,每个处理重复3次,置于30℃培养箱中培养12h。采用平板计数法测定定殖到番茄根部的活细菌数量。以生理盐水和最后一次冲洗苜蓿根部的无菌水作为阴性对照。通过根重对计数结果进行标准化。定殖到番茄根部的质量有效活菌数用以下公式进行计算:
[0050]
n(个/g)=x
×k×
v1/m
×
v2
[0051]
其中,x为活菌落个数(个);k为稀释倍数;v1为根浊液总体积(ml);v2为根浊液加入量(ml);m为根质量(g)。为了更加直观地体现有效活菌数的数量多少,可以用log
10
cfu g-1
来表述最终的测定结果。
[0052]
如图6所示,番茄幼苗在菌液中浸泡30min、60min、90min后放置于fb浓度为0.1g/l的1/10ms固体培养基,浸泡不同时间根际定殖的有效活菌数分别为1.58
×
107cfu/g、1.71
×
107cfu/g和1.65
×
107cfu/g,而未施加fb处理的空白对照组根际定殖的活菌数为5.47
×
106cfu/g、5.76
×
106cfu/g和5.68
×
106cfu/g,定殖数量分别增加了188.4%、196.9%、190.5%。结果表明:
①
浸泡30min、60min、90min的番茄幼苗在施加fb和blk培养基中有效活菌数均无显著性差异,即浸泡时间在30-90min内菌株根际定殖能力变化不大;
②
而菌株nrcb002在施加fb后的根际定殖能力存在显著提升。如图7所示,番茄幼苗在菌液中浸泡30min并均匀放置于fb浓度分别为0.05g/l、0.1g/l、0.2g/l的1/10ms固体培养基中。fb浓度为0.1g/l的定殖效果最好,其有效活菌数达到1.63
×
107cfu/g,而0.05g/l和0.2g/l的fb也能增强菌的定殖效果,其定殖的有效活菌数分别为7.3
×
106cfu/g和1.18
×
107cfu/g,未施加fb处理的空白对照组根际定殖的活菌数为4.93
×
106cfu/g。结果表明:不同浓度的fb均能增强菌的根际定殖效果,而在0.1g/l时其效果最好。
[0053]
如图8所示,菌株nrcb002经fb处理后,在菌液中浸泡30min的番茄、生菜、水稻幼苗根际定殖的有效活菌数分别为1.39
×
107cfu/g、1.65
×
107cfu/g、9.2
×
106cfu/g,未施加fb处理的空白对照组根际定殖的活菌数为5.65
×
106cfu/g、1.13
×
107cfu/g、4.77
×
106cfu/g。即经过fb处理后,菌株nrcb002对不同植物的定殖效果均增强,定殖的有效活菌数分别增加了146.0%、46.0%、92.9%。结果表明添加fb后,对菌株在番茄根际定殖效果的促进更为明显。
[0054]
本发明提供了一种促进根际促生菌在植物根际定殖的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。