1.本发明涉及基因治疗领域,尤其涉及用于治疗法布里病的腺相关病毒载体及其用途。
背景技术:
2.法布里病(fabry disease)是一种由于溶酶体缺乏α-半乳糖苷酶a(α-gala,gla)导致的溶酶体贮积症,能够导致中性鞘糖脂在全身系统性堆积,其中以酰基鞘氨醇三己(gb3)堆积为主,主要堆积于溶酶体内皮细胞、血管平滑肌细胞、肾脏细胞、心肌细胞和背根神经节细胞中。首先表现出的临床症状为与外周神经系统及自主神经系统的小神经纤维相关的神经痛,少汗及震颤,从而影响生活质量。随着年龄的增长,致命性并发症主要出现在肾脏、心脏和脑部。由于法布里病为x染色体相关的疾病,因此只有男性半合子及女性杂合子发病,法布里病在男性中的发病率约为1/40000到1/117000。目前治疗方法主要是酶替代疗法,利用cho细胞表达完整全长的α-半乳糖苷酶。目前有两个上市蛋白药物,一个是健赞公司的fabrazyme,给药剂量为1mg/kg,给药方式为静脉给药,两周一次;另外一种蛋白药物是shire公司的replagal,给药剂量为0.2mg/kg,给药方式为静脉给药,两周一次。蛋白类药物的主要缺点是体内半衰期短,给药频率频繁,易造成患者依从性差,而且长时间治疗给患者家庭造成沉重的经济负担。
3.近年来,基因治疗已经在罕见遗传病、癌症和传染性疾病染领域显出引人注目的疗效。spark therapeutics公司以aav2为载体的基因治疗药物luxturna获批上市,为rpe65基因缺陷引起的视网膜病患者带来了福音。就法布里病而言,通过基因治疗将正常的α-半乳糖苷酶a基因转移到受影响的患者体内后,通过持续的内源性产生α-半乳糖苷酶a来提供治疗的潜力,这一基因治疗方案能够很好地解决病人的依从性问题,从而取得更好的治疗效果。
4.目前,病毒载体是基因治疗领域最通用递送方法之一,以血清型命名的aav亚型分为aav1-aav12,主要以人类和灵长类动物为宿主,其中aav1-6是从人类组织中分离获得,并且具有明确的抗体反应性,因而较为经典并得以公认。aav7和aav8是高光平等通过基因工程手段从猕猴心脏组织拯救得到的,疑为在进化中已经绝迹的aav亚型,而aav9-12是利用同类技术路线分别于人和短尾猴的组织中制备的。尽管不同aav血清型的病毒都具有正二十面体的结构,但其衣壳蛋白在序列与空间构象上的多样性,使得其细胞表面的结合受体以及对细胞的感染嗜性(tropism)存在显著差异,例如,在感染嗜性方面,aav2的感染谱较广,尤对神经细胞效果最好;aav1和aav7在骨骼肌中的转导效率较高;aav3易于转导巨核细胞;aav5和aav6感染呼吸道上皮细胞的优势显著等。
5.然而,天然aav靶向性是有限的,尤其是在使用aav载体进行系统给药时,根据血清型选择的不同,能够有效感染靶细胞组织的比例差异很大,其他非靶向组织细胞都有被感染的潜在风险。又因为天然aav自然感染过人和其他灵长类,人和其他灵长类体内会产生针对天然aav的中和抗体,会大大降低aav的半衰期,不能使aav载体的利用最大化。
6.根据aav亚型对组织感染的相对特异性和人体或灵长类体内已存在或产生中和抗体多寡的程度,对特定疾病的治疗具有重大意义。因此,针对不同靶向组织的基因治疗中寻求最佳的载体类型,成为治疗相关疾病成功的关键。
7.aav8是目前公认的对肝脏靶向性最优的血清型。aavx是利用dna shuffling技术获得的新型aav载体。本发明通过对aavx载体体内外靶向性研究及灵长类体内外已存在或可能产生中和抗体的研究,一系列研究表明,aavx在治疗肝疾病的研究中比aav8可能更具有优势。
8.现有技术中已有利用aav8携带gla治疗fabry疾病的相关研究(专利cn107980063a),但本发明的进一步研究表明,利用aavx载体携带gla治疗fabry疾病取得了更好的治疗效果。
技术实现要素:
9.本公开还通过使用腺相关病毒载体aavx介导α-半乳糖苷酶a基因的转移和表达,使患者体内持续产生正常的α-半乳糖苷酶a,降低糖鞘脂的积累,达到治疗法布里病的目的,且已证明aavx载体携带α-半乳糖苷酶a比现在已知的肝靶向性最好的aav8载体携带α-半乳糖苷酶a在治疗法布里疾病方面具有更好的治疗效果。
10.在一方面,本公开提供一种重组腺相关病毒(aav)载体,其包含aavx衣壳和载体基因组,其中,所述载体基因组包含编码功能性α-半乳糖苷酶a的核酸序列和引导α-半乳糖苷酶a序列在宿主细胞中表达的表达控制序列。
11.在另一方面,本公开提供一种分离的宿主细胞,其包含前述的重组腺相关病毒(aav)载体。
12.在另一方面,本公开提供一种药物组合物,其包含前述的重组腺相关病毒(aav)载体和/或宿主细胞以及药学上可接受的载体。
13.在另一方面,本公开提供一种前述的重组腺相关病毒(aav)载体、宿主细胞和/或药物组合物在制备用于预防或治疗法布里病的药物中的用途。
14.在另一方面,本公开提供一种提供了在受试者中治疗法布里病的方法。该方法包括向需要其的受试者施用前述的重组腺相关病毒(aav)载体、宿主细胞和/或药物组合物。
附图说明
15.图1示出了载体构建过程中相关的质粒图谱。
16.图2示出了aav2/x和aav2/8重组病毒在不同人肝细胞系中感染效率的比较。其中,左右图为重复实验。
17.图3示出了aav2/x和aav2/8重组病毒在不同人肝癌原代细胞中感染效率的比较。其中,左侧为荧光百分比,右侧为荧光强度。
18.图4示出了aav2/x-cmv-egfp重组病毒给药组动物不同组织的荧光照片。其中,a.心脏,b.肺脏,c.肝脏1,d.肝脏2,e.肝脏3,f.肝脏4,g.肝脏5,h.大脑,i.睾丸,j.股二头肌,k.胃,l.空肠,m.肾脏,n.脾脏。
19.图5示出了aav2/8-cmv-egfp重组病毒给药组动物不同组织的荧光照片。其中,a.心脏,b.肺脏,c.肝脏1,d.肝脏2,e.肝脏3,f.肝脏4,g.肝脏5,h.大脑,i.睾丸,j.股二头肌,
k.胃,l.空肠,m.肾脏,n.脾脏。
20.图6示出了20份人血清中aav2/x和aav2/8中和抗体的比较统计结果。
21.图7示出了含有不同启动子元件的结构图。
22.图8a示出了含有不同启动子元件的携带荧光素酶的重组病毒分别注射正常小鼠后,荧光素酶活性的检测结果。
23.图8b示出了含有不同启动子元件的携带gla的重组病毒分别注射正常小鼠后,gla酶活性的检测结果。
24.图9示出了含有wpre表达调控元件的结构图。
25.图10示出了含有lp1启动子-gla及含有lp1启动子-wpre表达调控元件-gla的重组病毒分别注射正常小鼠后,gla酶活性检测结果。
26.图11示出了候选药物ssaav2/x-lp1-gla感染模型鼠原代肝细胞后,gla酶活性检测结果。
27.图12a示出了ssaav2/x-lp1-gla和ssaav2/8-lp1-gla重组病毒分别注射模型鼠后,不同组织中gla酶活性检测结果。
28.图12b示出了候选药物ssaav2/x-lp1-gla分别以不同剂量注射模型鼠后,不同组织中gla酶活性检测结果。
具体实施方式
29.i.定义
30.除非另外指出,本发明的实践将采用本领域技术中的常规化学、生物化学、重组dna技术和免疫学的方法。这样的技术在文献中有充分解释(参见例如fundamentalvirology,第二版,vol.i&ii(b.n.fields和d.m.knipe编);handbook of experimentalimmunology,vois.i-fv(d.m.weir和cc.blackwell编,blackwell scientificpublications);t.e.creighton,proteins:structures and molecular properties(w.h.freeman和company,1993);a.l.lehninger,biochemistry(worth publishers,inc.,current addition);sambrook,等,molecular cloning:a laboratory manual(第2版,1989);methods in enzymology(s.colowick和n.kaplan编,academic press,inc.)。
31.为了便于理解本公开内容的各个实施方案,提供了特定术语的以下解释:
32.腺相关病毒(aav):感染人和其他一些灵长类物种的小的复制缺陷性无包膜病毒。已知aav不造成疾病并且引起非常轻微的免疫应答。使用aav的基因疗法载体可以感染分裂细胞和静止期细胞,并且可以保持染色体外状态而不整合到宿主细胞的基因组中。这些特征使得aav成为用于基因疗法的有吸引力的病毒载体。
33.给药/给予:通过有效的途径向受试者提供或给予药剂,例如治疗剂(例如,重组aav)。示例性给药途径包括但不限于注射(例如,皮下、肌内、真皮内、腹膜内和静脉内)、口服、导管内、舌下、直肠、经皮、鼻内、阴道和吸入途径。
34.密码子优化的:“密码子优化的”核酸是指已经被改变以使得密码子最适于特定系统(例如,特定物种或物种的组)中的表达的核酸序列。例如,核酸序列可以优化用于在哺乳动物细胞或特定哺乳动物物种(例如人细胞)中表达。密码子优化不改变所编码蛋白质的氨
基酸序列。
35.增强子:通过提高启动子的活性来提高转录速率的核酸序列。
36.内含子:基因中不包含蛋白质的编码信息的一段dna。内含子在信使rna翻译之前被移除。杂合内含子(hybrid intron):是一种组合内含子,其包括来自一个以上天然内含子的序列。
37.反向末端重复(itr):有效复制所需的腺相关病毒基因组中的对称核酸序列。itr序列位于aav dna基因组的每一端。itr充当病毒dna合成的复制起点,并且是产生aav整合型载体的必要的顺式元件。
38.分离的:“分离的”生物组分(例如,核酸分子、蛋白质、病毒或细胞)已经被从其中所述组分天然存在的生物体的细胞或组织中或者生物体本身中的其他生物组分(例如其他染色体和染色体外dna和rna、蛋白质和细胞)中基本上分离或纯化。已经“分离”的核酸分子和蛋白质包括通过标准纯化方法纯化的那些。该术语还包括通过在宿主细胞中重组表达制备的核酸分子和蛋白质,以及化学合成的核酸分子和蛋白质。
39.可操作地连接:当第一核酸序列与第二核酸序列被放置为具有功能关系时,第一核酸序列与第二核酸序列可操作地连接。例如,如果启动子影响编码序列的转录或表达,则启动子与编码序列可操作地连接。通常,可操作地连接的dna序列是连续的,并且当有必要连接两个蛋白质编码区时,其在相同阅读框中。
40.可药用载体:本公开内容中可以使用的可药用载体(溶剂(vehicle))是常规的。remington’s pharmaceutical sciences,by e.w.martin,mackpublishing co.,easton,pa,15th edition(1975)描述了适合一种或更多种治疗性化合物、分子或试剂的药物递送的组合物和制剂。
41.通常,载体的性质取决于所使用的特定给药方式。例如,胃肠外制剂通常包含可注射流体,其包括药学和生理学上可接受的流体,例如水、生理盐水、平衡盐溶液、水性右旋糖、甘油等作为溶剂。对于固体组合物(例如,粉末剂、丸剂、片剂或胶囊剂形式),可以包含常规无毒固体载体,例如药物级甘露醇、乳糖、淀粉或硬脂酸镁。除了生物学中性载体外,待给予的药物组合物还可以包含少量无毒辅助物质,例如润湿剂或乳化剂、防腐剂和ph缓冲剂等,例如醋酸钠或脱水山梨糖醇单月桂酸酯.
42.预防、治疗或改善疾病:“预防”疾病(例如gsd-ia)是指抑制疾病的全面发生。“治疗”是指在疾病开始发生后改善疾病或病理病症的体征或症状的治疗性介入。“改善”是指降低疾病的体征或症状的数目或严重性。
43.启动子:指导/引起核酸(例如,基因)的转录的dna区域。启动子包括转录起始位点附近的必要核酸序列。通常,启动子位于其转录的基因附近。启动子区域还任选地包括远端增强子或阻遏物元件,其可以位于距转录起始位点数千个碱基对远。
44.重组:重组核酸分子是指这样的核酸分子,其具有非天然存在的序列,或者具有通过两个序列片段的人为组合(否则地话,其将是分开的)制备的序列。这种人为组合可以通过化学合成或者通过分离的核酸分子片段的人为操作(如通过基因工程技术)实现。
45.同样地,重组病毒是包含非天然存在的序列或通过至少两个不同来源的序列的人为组合制备的序列的病毒。术语“重组”还包括仅通过天然核酸分子、蛋白质或病毒的一部分的添加、置换或缺失改变的核酸、蛋白质和病毒。本文使用的“重组aav”是指其中包装有
重组核酸分子(例如,编码g6pase-α的重组核酸分子)的aav颗粒。
46.血清型:通过抗原的特征组区分的一类密切相关的微生物(例如,病毒)。
47.受试者:活的多细胞脊椎动物生物体,包括人和非人哺乳动物的类别。
48.合成:通过人工手段在实验室产生,例如合成核酸可以在实验室化学合成。
49.治疗有效量:足以在用试剂治疗的受试者或者细胞中取得所需效果的特定药物或治疗试剂(例如重组aav)的量。试剂的有效量取决于多种因素,包括但不限于被治疗的受试者或细胞,以及治疗性组合物的给药方式。
50.载体:载体是允许插入外源核酸而不破坏载体在宿主细胞中复制和/或整合的能力的核酸分子。载体可以包含允许其在宿主细胞中复制的核酸序列,例如复制起点。载体还可以包含一种或更多种选择性标记基因和其他遗传元件。表达载体是包含必要的调控序列以允许插入的基因转录和翻译的载体。在本文的一些实施方案中,载体是aav载体。
51.序列同一性:两个或更多个核酸序列之间或者两个或更多个氨基酸序列之间的同一性或相似性是根据序列之间的同一性或相似性表示。序列同一性可以根据百分比同一性测量;百分比越高,序列越相同。序列相似性可以根据百分比相似性测量(考虑保守性氨基酸置换);百分比越高,序列越相似。当使用标准方法比对时,核酸或氨基酸序列的同源物或直系同源物具有相对高的序列同一性/相似性程度。与来自相关性更远的物种(例如,人和线虫(c.elegans)序列)相比,当直系同源蛋白质或cdna来自更紧密相关的物种(例如,人和小鼠序列)时,这种同源性更显著。
52.序列同一性比较的长度可在基因组的全长上,基因编码序列的全长,或至少大约500至5000个核苷酸的片段是期望的。但是,在较小片段(例如具有至少大约9个核苷酸,通常至少大约20至24个核苷酸、至少大约28至32个核苷酸、至少大约36或更多个核苷酸)中的同一性也可以是期望的。
53.可在全长的蛋白、多肽、大约32个氨基酸、大约330个氨基酸或其肽片段或相应的核酸序列编码序列上容易地测定氨基酸序列的百分比同一性。合适的氨基酸片段的长度可以为至少大约8个氨基酸,并可以为至最多大约700个氨基酸。通常,当提到两种不同序列之间的“同一性”、“同源性”或“相似性”时,参照“比对”序列确定“同一性”、“同源性”或“相似性”。“比对”序列或“比对”是指多个核酸序列或蛋白(氨基酸)序列,其通常含有与参考序列相比缺失或额外的碱基或氨基酸的校正。
54.使用任何公共或市售可得的多序列比对程序来进行比对。序列比对程序可用于氨基酸序列,例如“clustal x”、“map”、“pima”、“msa”、“blockmaker”、“meme”和“match-box”程序。通常,这些程序中的任一种以默认设置使用,尽管本领域技术人员可以按需改变这些设置。或者,本领域技术人员可以采用至少提供如参考算法或程序所提供的同一性或比对水平的另一算法或计算机程序。参见例如j.d.thomson等人,nucl.acids.res.,“acomprehensive comparison of multiple sequence alignments”,27(13):2682-2690(1999)。
55.多序列比对程序还可用于核酸序列。此类程序的实例包括“clustal w”、“capsequence assembly”、“blast”、“map”和“meme”,其可以通过互联网上的web服务器来访问。此类程序的其它来源是本领域技术人员已知的。或者,还使用vector nti应用程序。还存在许多可用于测量核苷酸序列同一性的本领域已知的算法,包括在上述程序中包含的
那些。作为另一实例,可以使用(gcg version 6.1中的一个程序)来比较多核苷酸序列。提供了询问与搜索序列之间最佳重叠区域的比对和百分比序列同一性。例如,可以使用以其在gcg version 6.1(经此引用并入本文)中提供的默认参数(字长为6,和用于打分矩阵的nopam因子)来确定核酸序列之间的百分比序列同一性。
56.在一个实施方案中,修饰的hgla编码序列是密码子优化的序列,针对受试物种中的表达而进行了优化。本文中所用的“受试者”是哺乳动物,例如人、小鼠、大鼠、豚鼠、狗、猫、马、牛、猪或非人灵长类,如猴子、黑猩猩、狒狒或大猩猩。在一个优选实施方案中,该受试者是人。在一个实施方案中,该序列经密码子优化用于在人内表达。
57.密码子优化的编码区可以通过各种不同的方法来设计。可以使用可在线获得的方法(例如geneart)、公开的方法、或提供密码子优化服务的公司,例如dna2.0(menlo park,ca)来进行这种优化。例如,在美国国际专利公开号wo 2015/012924中描述了一种密码子优化方法,其经此引用全文并入本文。还参见例如美国专利公开号2014/0032186和美国专利公开号2006/0136184。适当地,修改该产品的开放阅读框(orf)的整个长度。但是,在一些实施方案中,可以仅改变orf的片段。通过使用这些方法中的一种,可以对任意给定的多肽序列施加所述频率,并生产编码该多肽的密码子优化的编码区的核酸片段。
58.许多选择可用于对密码子进行实际改变或用于合成如本文中所述设计的密码子优化的编码区。可以使用本领域普通技术人员熟知的标准和常规的分子生物学操作来进行此类修饰或合成。在一种方法中,通过标准方法合成了各自长度为80-90个核苷酸并跨越所需序列长度的一系列互补寡核苷酸对。合成这些寡核苷酸对,使得它们在退火时形成含有粘性末端的80-90个碱基对的双链片段,例如合成该对中的各寡核苷酸以超出与该对中另一寡核苷酸互补的区域延伸3、4、5、6、7、8、9、10或更多个碱基。各寡核苷酸对的单链末端被设计为与另一寡核苷酸对的单链末端退火。使该寡核苷酸对退火,并随后使这些双链片段中的大约五至六个经由粘性单链末端一起退火,和随后它们连接在一起并克隆到标准细菌克隆载体中,例如可获自invitrogen corporation,carlsbad,calif的载体。随后通过标准方法对该构建体进行测序。制备数个由连接在一起的5至6个80至90个碱基对的片段(即大约500个碱基对的片段)组成的这些构建体,以使整个所需序列显示为一系列的质粒构建体。随后用适当的限制酶切割这些质粒的插入物,并连接在一起以形成最终构建体。最终构建体随后克隆到标准细菌克隆载体中,并进行测序。另外的方法对本领域技术人员会是显而易见的。此外,基因合成容易购得。
59.在一个实施方案中,将本文中描述的修饰的hgla基因工程化为可用于生成病毒载体和/或递送至宿主细胞的合适的遗传元件(载体),例如裸dna、噬菌体、转座子、粘粒、游离基因等等,其传送在其上携带的hgla序列。所选载体可以通过任何合适的方法来递送,包括转染、电穿孔、脂质体递送、膜融合技术、高速dna包覆小球、病毒感染和原生质体融合。用于制造此类构建体的方法是核酸操作领域技术人员已知的,并包括基因工程、重组工程和合成技术。参见例如sambrook等人,molecular cloning:a laboratory manual,coldspring harbor press,cold spring harbor,ny。
60.在一方面,提供了包含该hgla核酸序列的表达盒。本文中所用的“表达盒”是指包含启动子hgla序列的核酸分子,并为此可以包括其它调节序列,该盒可以包装到病毒载体(例如病毒粒子)的衣壳中。通常,用于生成病毒载体的此类表达盒含有本文中描述的hgla
序列,其侧接病毒基因组的包装信号,以及其它表达控制序列,如本文中描述的那些。例如,对于aav病毒载体而言,包装信号是5’反向末端重复(itr)和3’itr。当包装到aav衣壳中时,该表达盒及其两侧的itrs在本文中被称为“重组aav(raav)基因组”或“载体基因组”。
61.由此,在一方面,提供了腺相关病毒载体,其包含aav衣壳和至少一种表达盒,其中所述至少一种表达盒包含编码gla的核酸序列和引导gla序列在宿主细胞中表达的表达控制序列。该aav载体还包含aav itr序列。在一个实施方案中,该itrs来自于与提供衣壳的不同的aav。在一个优选实施方案中,该itr序列来自aav9,或其缺失版本(δitr),其可能因方便起见而使用并加速调节许可(regulatory approval)。但是,可以选择来自其它aav源的itr。当itr的源是来自aav9且aav衣壳来自另一aav源时,所得载体可以被称为是假型的。通常,aav载体基因组包含aav 5’itr(hgla编码序列和任何调节序列)以及aav 3’itr。但是,这些元件的其它构造可能是合适的。已经描述了其中缺失d-序列和末端解析位点(trs)的5’itr的缩短版本(称为δitr)。在其它实施方案中,使用全长aav 5’和3’itrs。
62.使用本文中所述的其它合成hgla编码序列和本文中所述的其它表达控制元件可以生成其它表达盒。
63.该表达盒通常含有启动子序列作为表达控制序列的一部分,例如位于所选5’itr序列与该hgla编码序列之间。本文中描述的说明性质粒和载体使用含有dc172启动子、dc190启动子或lp1启动子。
64.其它启动子如组成型启动子、可调型启动子[参见例如wo 2011/126808和wo2013/04943],或响应生理信号(cues)的启动子可以用在本文中所述的载体中。该启动子可以选自不同的源,例如人巨细胞病毒(cmv)即时早期增强子/启动子、sv40早期增强子/启动子、jc polymovirus启动子、髓鞘碱性蛋白(mbp)或胶质细胞原纤维酸性蛋白(gfap)启动子、单纯疱疹病毒(hsv-1)潜伏相关启动子(lap)、劳斯肉瘤病毒(rsv)长末端重复(ltr)启动子、神经元特异性启动子(nse)、血小板衍生生长因子(pdgf)启动子、hsyn、黑色素浓集激素(mch)启动子、cba、基质金属蛋白酶启动子(mpp)与鸡β肌动蛋白启动子。
[0065]
除了启动子之外,表达盒和/或载体可以含有一种或多种其它合适的转录起始、终止、增强子序列、有效rna加工信号如剪接和聚腺苷酸化(polya)信号;稳定细胞质mrna的序列,例如wpre;增强翻译效率的序列(即kozak共有序列);增强蛋白稳定性的序列;以及在需要时,增强编码产物分泌的序列。合适的polya序列的实例包括例如sv40、sv50、牛生长激素(bgh)、人生长激素和合成polya。合适的增强子的一个实例是cmv增强子。其它合适的增强子包括适于肝脏特异性的那些。在一个实施方案中,该表达盒包含一种或多种表达增强子。在一个实施方案中,该表达盒含有两种或更多种表达增强子。这些增强子可以是相同的,或可以彼此不同。例如,增强子可以包括cmv即时早期增强子。这种增强子可以存在于彼此相邻定位的两个拷贝中。或者,该增强子的双拷贝可以通过一个或多个序列分隔。在又一实施方案中,该表达盒进一步含有内含子,例如鸡β肌动蛋白内含子。其它合适的内含子包括本领域中已知的那些,例如描述在wo 2011/126808中。任选地,可以选择一种或多种序列以稳定mrna。此类序列的一个实例是修饰的wpre序列,其可以在该polya序列的上游和该编码序列的下游工程化[参见例如ma zanta-boussif等人,gene therapy(2009)16:605-619]。
[0066]
这些控制序列“可操作地连接”到hgla基因序列上。本文中所用的术语“可操作地连接”是指与相关基因邻接的表达控制序列和以反式或在一定距离上起作用以控制相关基
therapy(2001年8月),第8卷,第16期,第1248-1254页。自身互补型aav描述在例如美国专利号6,596,535;7,125,717和7,456,683中,其各自经此引用全文并入本文。
[0070]
生成和分离适于递送至受试者的aav病毒载体的方法在本领域中是已知的。参见例如美国公开专利申请号2007/0036760(2007年2月15日);美国专利7790449;美国专利7282199;wo 2003/042397;wo 2005/033321;wo 2006/110689和us 7588772 b2。在一种系统中,用编码侧接itr的转基因的构建体和编码rep与cap的构建体瞬时转染生产细胞系。在第二系统中,用编码侧接itr的转基因的构建体瞬时转染稳定提供rep和cap的包装细胞系。在各自这些系统中,aav病毒体响应于感染辅助腺病毒或疱疹病毒而产生,其中需要从污染病毒中分离raav。近来,开发了不需要用辅助病毒感染以回收aav的系统,由该系统以反式还提供了所需辅助功能(即腺病毒e1、e2a、va和e4或疱疹病毒ul5、ul8、ul52和ul29以及疱疹病毒聚合酶)。在这些较新的系统中,辅助功能可以通过用编码所需辅助功能的构建体瞬时转染该细胞来提供,或者该细胞可以被工程化以稳定含有编码该辅助功能的基因,其表达可以以转录水平或转录后水平来控制。在又一种系统中,通过用基于杆状病毒的载体感染将侧接itr的转基因和rep/cap基因引入到昆虫细胞中。对于这些生产系统的概述,通常参见例如zhang等人,2009,“adenovirus-adeno-associated virus hybrid for large-scale recombinant adeno-associated virus production”,human gene therapy 20:922-929,其各自的内容经此引用全文并入本文。制造和使用这些和其它aav生产系统的方法还描述在下列美国专利中,其各自的内容经此引用全文并入本文:5,139,941;5,741,683;6,057,152;6,204,059;6,268,213;6,491,907;6,660,514;6,951,753;7,094,604;7,172,893;7,201,898;7,229,823和7,439,065。
[0071]“复制缺陷型病毒”或“病毒载体”是指合成或人工病毒粒子,其中含有相关基因的表达盒包装在病毒衣壳或包膜中,其中也包装在该病毒衣壳或包膜中的任何病毒基因组序列是复制缺陷的;即它们不能产生子代病毒体,但是保留了感染靶细胞的能力。在一个实施方案中,该病毒载体的基因组不包括编码复制所需的酶的基因(该基因组可以被工程化为“无内容”——仅含有侧接扩增和包装人工基因组所需信号的相关转基因),但是这些基因可以在生产过程中提供。因此,其被认为对用于基因疗法是安全的,因为除了在复制所需病毒酶的存在下,复制和被子代病毒体感染不会发生。此类复制缺陷型病毒可以是腺相关病毒(aav)、腺病毒、慢病毒(整合或非整合)或另一合适的病毒源。
[0072]
通常,这些递送方法被设计为避免直接全身递送含有本文中所述的aav组合物的悬浮液。合适地,这可以具有与全身施用相比减少剂量、降低毒性和/或减少对aav和/或转基因产物的不期望的免疫反应的益处。
[0073]
或者,可以选择其它施用途径(例如口服、吸入、鼻内、气管内、动脉内、眼内、静脉内、肌内和其它肠胃外(parental)途径)。
[0074]
本文中描述的hgla递送构建体可以以单一组合物或多种组合物递送。任选地,可以递送两种或多种不同的aav[参见例如wo 2011/126808和wo 2013/049493]。在另一实施方案中,此类多种病毒可以含有不同的复制缺陷型病毒(例如aav、腺病毒和/或慢病毒)。或者,可以通过非病毒构建体,例如“裸dna”、“裸质粒dna”、rna和mrna来介导递送;与各种递送组合物和纳米粒子结合,包括例如胶束、脂质体、阳离子脂质-核酸组合物、聚多糖(poly-glycan)组合物和其它聚合物、基于脂质和/或胆固醇-核酸缀合物,以及如本文中所述的其
它构建体。参见例如x.su等人,mol.pharmaceutics,2011,8(3),第774-787页;网络出版:2011年3月21日;wo2013/182683、wo 2010/053572和wo 2012/170930,其均经此引用并入本文,此类非病毒hgla递送构建体可以通过前述途径施用。
[0075]
该病毒载体,或非病毒dna或rna转移部分,可以用生理可接受载体配制以用于基因转移和基因疗法应用。可以选择多种合适的纯化方法。描述适于从载体粒子中分离空衣壳的纯化方法的实例,例如2016年12月9日提交的国际专利申请号pct/us16/65976及其优先权文件,2016年4月13日提交的美国专利申请号62/322,098和2015年12月11日提交的且题为“scalable purification method for aav8”的美国专利申请号62/266,341中描述的方法,其经此引用并入本文。还参见以下文献中描述的纯化方法:2016年12月9日提交的国际专利申请号pct/us16/65974,及其优先权文件,2016年4月13日提交的美国专利申请号62/322,083,和2015年12月11日提交的62/266,351(aav1);2016年12月9日提交的国际专利申请号pct/us16/66013,及其优先权文件,2016年4月13日提交的美国临时申请号62/322,055和2015年12月11日提交的62/266,347(aavrh10);和2016年12月9日提交的国际专利申请号pct/us16/65970,及其优先权申请美国临时申请号62/266,357和62/266,357(aav9),其经此引用并入本文。简而言之,描述了两步骤纯化方案,其从raav生产细胞培养物的澄清浓缩上清液中选择性捕获并分离含有基因组的raav载体粒子。该方法利用了在高盐浓度下进行的亲和捕获方法,随后是在高ph下进行的阴离子交换树脂方法,以提供基本不含raav中间体的raav载体粒子。
[0076]
在aav病毒载体的情况下,病毒基因组(vg)的定量可以用作制剂中所含剂量的量度。以本文公开的方法施用的raav的剂量将根据例如特定的raav、施用方式、治疗目标、个体和靶向的细胞类型而变化,并且可以通过本领域标准方法确定。剂量可以以病毒基因组(vg)为单位表示(即,分别为1
×
107vg、1
×
108vg、1
×
109vg、1
×
10
10
vg、1
×
10
11
vg、1
×
10
12
vg、1
×
10
13
vg、1
×
l0
14
vg、1
×
10
15
vg)。剂量也可以以每千克(kg)体重的病毒基因组(vg)为单位表示(即,分别为1
×
10
10
vg/kg、1
×
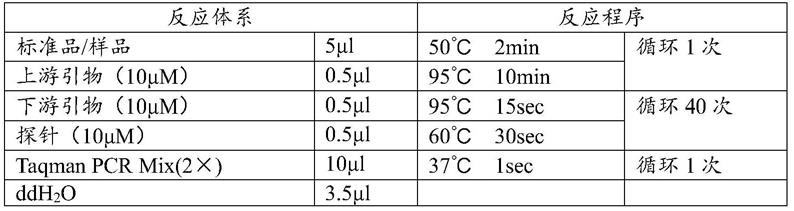
10
11
vg/kg、1
×
10
12
vg/kg、1
×
10
13
vg/kg、1
×
10
14
vg/kg、1
×
10
15
vg/kg)。滴定aav的方法描述于clark等人《人类基因治疗(hum.genether.)》1999年;10:1031-1039。
[0077]
这些上述剂量可以在各种体积的载体、赋形剂或缓冲剂制剂中施用,所述体积在大约25至大约1000微升的范围内,包括该范围内的所有数字,取决于待处理的区域的尺寸、所用病毒滴度、施用途径和该方法的预期效果。在一个实施方案中,载体、赋形剂或缓冲剂的体积为至少大约25μl。在一个实施方案中,该体积为大约50μl。在另一实施方案中,该体积为大约75μl。在另一实施方案中,该体积为大约100μl。在另一实施方案中,该体积为大约125μl。在另一实施方案中,该体积为大约150μl。在另一实施方案中,该体积为大约175μl。在又一实施方案中,该体积为大约200μl。在另一实施方案中,该体积为大约225μl。在又一实施方案中,该体积为大约250μl。在又一实施方案中,该体积为大约275μl。在又一实施方案中,该体积为大约300μl。在又一实施方案中,该体积为大约325μl。在另一实施方案中,该体积为大约350μl。在另一实施方案中,该体积为大约375μl。在另一实施方案中,该体积为大约400μl。在另一实施方案中,该体积为大约450μl。在另一实施方案中,该体积为大约500μl。在另一实施方案中,该体积为大约550μl。在另一实施方案中,该体积为大约600μl。在另一实施方案中,该体积为大约650μl。在另一实施方案中,该体积为大约700μl。在另一实施
方案中,该体积在大约700和1000μl之间。
[0078]
上述重组载体可以根据公开的方法递送至宿主细胞。该raav,优选悬浮在生理相容性载体中,可以施用于人或非人哺乳动物患者。在另一实施方案中,该组合物包括载体、稀释剂、赋形剂和/或佐剂。合适的载体可以由本领域技术人员鉴于转移病毒针对的适应症容易地选择。例如,合适的载体包括盐水,其可以用多种缓冲溶液(例如磷酸盐缓冲盐水)配制。其它示例性载体包括无菌盐水、乳糖、蔗糖、磷酸钙、明胶、葡聚糖、琼脂、果胶、花生油、芝麻油和水。该缓冲剂/载体应包括防止raav附着到输注管但不会干扰raav体内结合活性的组分。
[0079]
任选地,本发明的组合物除了raav与载体之外可以含有其它常规药物成分,如防腐剂或化学稳定剂。合适的示例性防腐剂包括氯丁醇、山梨酸钾、山梨酸、二氧化硫、没食子酸丙酯、对羟基苯甲酸酯类、乙基香草醛、甘油、苯酚和对氯苯酚。合适的化学稳定剂包括明胶和白蛋白。
[0080]
本文中描述的病毒载体可用于制备药物以便将hgla递送至需要其的受试者(例如人患者)、向受试者提供功能性α-半乳糖苷酶a(gla)和/或治疗法布里病。治疗过程可以任选包括重复施用相同的病毒载体(例如aavx载体)或不同的病毒载体(例如aavx和aav8)。仍可以使用本文中描述的病毒载体和非病毒递送系统选择其它组合。
[0081]
本文中描述的hgla cdna序列可以使用本领域中熟知的技术体内合成产生。例如,可以采用长dna序列方法的基于pcr的精确合成(pas),如xiong等人,pcr-basedaccurate synthesis of long dna sequences,nature protocols 1,791-797(2006)所述。由young和dong描述了结合双不对称pcr和重叠延伸pcr法的方法,two-step totalgene synthesis method,nucleic acids res.2004;32(7):e59。还参见gordeeva等人,jmicrobiol methods.improved pcr-based gene synthesis method and itsapplication to the citrobacter freundii phytase gene codon modification.2010年5月;81(2):147-52.epub 2010年3月10日;还参见关于寡核苷酸合成和基因合成的以下专利,gene seq.2012年4月;6(1):10-21;us 8008005和us 7985565。这些文献各自经此引用并入本文。此外,经由pcr生成dna的试剂盒与方案是市售可得的。这些包括使用聚合酶,包括但不限于taq聚合酶;(new england biolabs);high-fidelity dna聚合酶(new england biolabs);和g2聚合酶(promega)。还可以由用含有本文中所述的hgla序列的质粒转染的细胞生成dna。试剂盒和方案是已知和市售可得的,并包括但不限于qiagen质粒试剂盒;pro filter质粒试剂盒(invitrogen);和质粒试剂盒(sigma aldrich)。在本文中可用的其它技术包括序列特异性等温扩增方法,其消除了对热循环的需要。这些方法通常使用链置换dna聚合酶如bst dna聚合酶、大片段(large fragment)(new england biolabs)而非加热来分离双链体dna。dna还可以经由使用逆转录酶(rt)通过扩增由rna分子生成,所述逆转录酶是rna依赖性dna聚合酶。rt聚合与原始rna模板互补的dna链,并被称为cdna。这种cdna随后可以通过pcr或如上所述的等温法进一步扩增。定制dna也可以经商业途径由公司生成,所述公司包括但不限于genscript;扩增。定制dna也可以经商业途径由公司生成,所述公司包括但不限于genscript;(life technologies)和integrated dnatechnologies。
[0082]
术语“表达”在本文中以其最广泛的含义使用,并包括生产rna或rna和蛋白。就rna而言,术语“表达”或“翻译”特别涉及生产肽或蛋白。表达可以是瞬时的,或可以是稳定的。
(或“一个”)、“一种或多种”和“至少一种”在本文中可互换使用。
[0092]
词语“包含(comprise、comprises和comprising)”应解释为包含性的而非排他性的。词语“组成(consist、consisting)”及其变体应解释为排他性的而非包含性的。虽然说明书中的各种实施方案出现使用“包含”的语言,但是在其它情况下,相关实施方案也意在使用“由
……
组成”或“基本由
……
组成”的语言来解释和描述。
[0093]
本文中所用的术语“大约”是指与给定的参考值相差10%(
±
10%),除非另行规定。
[0094]
本文中所用的“疾病”、“障碍”和“病症”可互换使用,以指示受试者体内的异常状态。
[0095]
除非在本说明书中另行定义,本文中使用的技术和科学术语具有与本领域普通技术人员,并且通过参照公开文本通常理解的相同的含义,其向本领域技术人员提供了对许多本技术中使用的术语的一般指导。
[0096]
ii.具体实施方式
[0097]
在一方面,本发明提供了一种重组腺相关病毒(aav)载体,其包含aavx衣壳和载体基因组,其中,所述载体基因组包含编码功能性α-半乳糖苷酶的核酸序列和引导α-半乳糖苷酶序列在宿主细胞中表达的表达控制序列。
[0098]
优选地,所述aavx衣壳包含seq id no:9所示的氨基酸序列。
[0099]
优选地,编码所述aavx衣壳的核酸序列包含seq id no:8所示的核苷酸序列。
[0100]
优选地,编码所述α-半乳糖苷酶的核酸序列包含seq id no:3序列或与其至少具有80%同一性的核苷酸序列。更优选地,与seq id no:3至少具有80%同一性的核苷酸序列是密码子优化序列。
[0101]
优选地,所述表达控制序列包含启动子;优选地,启动子为lp1启动子;更优选地,所述lp1启动子序列为seq id no:2所示序列。
[0102]
优选地,所述载体进一步包含内含子、kozak序列、polya、wpre和转录后调节元件中的一种或多种。
[0103]
优选地,所述载体进一步包含aav反向末端重复(itrs)序列。
[0104]
优选地,所述aav反向末端重复(itrs)来自不同血清型的aav,优选aav2。
[0105]
根据前一方面的重组腺相关病毒(aav)载体,所述载体选自腺相关病毒(aav)载体、腺病毒载体、慢病毒载体和杂合病毒组,优选地,所述aav载体是aav血清型2(aav2)载体,优选为自身互补腺相关病毒(scaav)载体。
[0106]
在一方面,本发明提供了一种分离的宿主细胞,其包含前述的重组腺相关病毒(aav)载体。
[0107]
在一方面,本发明提供了一种药物组合物,其包含前述的重组腺相关病毒(aav)载体和/或宿主细胞以及药学上可接受的赋形剂;优选地,其被配制用于静脉内给药。
[0108]
在一方面,本发明提供了前述重组腺相关病毒(aav)载体、宿主细胞和/药物组合物在制备用于预防或治疗法布里病的药物中的用途。
[0109]
根据前一方面的用途,其中所述重组腺相关病毒(aav)载体、宿主细胞和/或药物组合物可以与另一疗法结合施用。
[0110]
根据前一方面的用途,其中,所述重组腺相关病毒(aav)载体、宿主细胞和/或药物
组合物可以以大约1
×
10
10
vg/kg至大约1
×
10
16
vg/kg的剂量施用;优选地,所述重组腺相关病毒(aav)载体可以以大约5
×
10
13
vg/kg的剂量施用;优选地,所述重组腺相关病毒(aav)载体或组合物可以以大约2.5
×
10
12
vg/kg的剂量施用;优选地,所述重组腺相关病毒(aav)载体或组合物可以施用超过一次。
[0111]
在一方面,本发明提供了在受试者中治疗法布里病的方法,所述方法包括向需要其的受试者施用前述的重组腺相关病毒(aav)载体、宿主细胞和/或药物组合物。优选地,所述受试者是哺乳动物,更优选地,所述受试者是人。
[0112]
下面的实施例仅仅是说明性的,而非意在限制本发明。
[0113]
实施例1载体构建
[0114]
1.1 psc-dc172-gluc、psc-dc190-gluc以及psc-cmv-gluc质粒构建
[0115]
分别合成两端均带有xhoi和noti酶切位点的dc172启动子序列片段、dc190启动子序列片段、cmv启动子序列片段和两端分别带有noti和xbai酶切位点的荧光素酶gluc(gaussia luciferase)序列片段。其中,dc172启动子序列片段的核苷酸序列如seq id no:1所示,dc190启动子序列片段的核苷酸序列如seq id no:16所示。
[0116]
将psc-cmv-egfp质粒(如图1a所示)用xhoi和xbai双酶切后,与xhoi和noti双酶切的dc172及noti和xbai双酶切的gluc片段进行连接,形成psc-dc172-gluc质粒(如图1b所示);与xhoi和noti双酶切的dc190及noti和xbai双酶切的gluc片段进行连接,形成psc-dc190-gluc质粒(如图1c所示);psc-cmv-egfp质粒(如图1a所示)用xhoi和xbai双酶切后,与xhoi和noti双酶切的cmv及noti和xbai双酶切的gluc片段进行连接,形成psc-cmv-gluc质粒(如图1d所示)。
[0117]
以上质粒包装成双链的aav病毒载体(scaavs)后用于第一轮体内启动子筛选工作。
[0118]
1.2 psnav2.0-dc172-gla、psnav2.0-dc172-gla-wpre、psnav2.0-lp1-gla以及psnav2.0-lp1-gla-wpre质粒构建
[0119]
分别合成两端分别带有xhoi和noti酶切位点的lp1启动子序列片段,两端分别含有noti和sali的α-半乳糖苷酶a(gla)核苷酸序列片段,两端均含有sali的土拨鼠肝炎病毒转录后调控元件wpre(wpre)序列片段。其中,lp1启动子序列的核苷酸序列如seq id no:2所示;gla核苷酸片段序列如seq id no:3所示,其氨基酸序列如seq id no:4所示;wpre序列片段的核苷酸序列如seq id no:5所示。
[0120]
将psnav2.0-egfp质粒(如图1e所示)用xhoi和sali双酶切后,与经xhoi和noti双酶切的dc172启动子序列片段及noti和sali双酶切的gla序列片段进行连接,形成psnav2.0-dc172-gla质粒(如图1f所示)。其中,dc172启动子序列片段和gla序列片段连接后dc172-gla片段的核苷酸序列如seq id no:6所示。
[0121]
将psnav2.0-dc172-gla用sali单酶切后,与sali酶切的wpre片段连接,形成psnav2.0-dc172-gla-wpre质粒(如图1g所示)。
[0122]
将psnav2.0-egfp用xhoi和sali双酶切后,与经xhoi和noti双酶切的lp1启动子序列片段及经noti和sali双酶切的gla片段进行连接,形成psnav2.0-lp1-gla质粒(如图1h所示)。其中,lp1启动子序列片段和gla序列片段连接后lp1-gla片段的核苷酸序列如seq id no:7所示。
[0123]
将psnav2.0-lp1-gla用sali单酶切后,与sali酶切的wpre片段连接,形成psnav2.0-lp1-gla-wpre质粒(如图1i所示)。
[0124]
以上质粒包装成单链aav病毒载体(ssaavs)后分别用于第二轮体内启动子筛选及表达调控元件筛选工作。
[0125]
实施例2病毒包装及基因组滴度检测
[0126]
本实施例采用hek293细胞(购于atcc,其编号为crl-1573)作为生产细胞系,常规三质粒包装系统生产重组aav病毒载体。所使用实验方法均为本领域常规方法(参见xiao xiao,juan li,and richard jude samulski.production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus.j.virol.1998,72(3):2224)。
[0127]
取适量纯化aav样品,按下表(表1)配制dnase i消化反应混合液,37℃孵育30min,75℃孵育10min,失活dnase i。
[0128]
表1
[0129]
aav样品5μl10
×
dnase i缓冲液5μldnase i1μl无rnase的水39μl合计50μl
[0130]
处理后的aav纯化样品稀释适当的倍数后,参照下表(表2)配置q-pcr反应体系,并按照下列程序进行检测。
[0131]
表2
[0132][0133]
其中使用的引物参见下表(表3):
[0134]
表3
[0135][0136]
包装产量结果参见下表(表4):
[0137]
表4
[0138][0139][0140]
aav2/x表示重组病毒的载体基因组itr来源于aav2、包装外壳来源于aavx;aav2/8表示重组病毒的载体基因组itr来源于aav2、包装外壳来源于aav8。
[0141]
实施例3候选药物的选择
[0142]
3.1候选药物中aav载体的选择
[0143]
(一)、aav载体靶向性的选择
[0144]
aav8是目前已知的对于肝脏靶向转导效率最高的病毒载体。aavx是通过dna改组(dna shuffling)的方法获得的载体,本实施例通过人或猴体内外肝脏靶向性研究来检测aavx是否具有比aav8更强的靶向性。
[0145]
3.1.1aav2/x和aav2/8载体在不同人肝细胞系上感染效率的比较
[0146]
首先用流式细胞术检测了重组病毒scaav2/8-cmv-egfp和scaav2/x-cmv-egfp对5种人肝细胞系(huh6、7402、huh7、hepg2和7721,其中huh6获自上海信裕生物科技有限公司、7402和7721获自北京昭衍生物、huh7获自中国医学科学院肿瘤医院肿瘤研究所、hepg2获自301医院)的感染效率,采用的评价方法是在两种aav在同种细胞系上感染效率相等的情况下,比较所使用的moi相差倍数。具体结果如图2所示。其中,aav2/x相关重组病毒的包装外壳编码核苷酸序列如seq id no:8所示,其氨基酸序列如seq id no:9所示。
[0147]
在多种人肝细胞系上,重组病毒scaav2/x-cmv-egfp感染效率要显著高于重组病毒scaav2/8-cmv-egfp;当两种病毒感染效率相当时,重组病毒scaav2/8-cmv-egfp感染人肝huh-6细胞系所使用moi约为scaav2/x-cmv-egfp的3倍;在人肝7402细胞上重组病毒scaav2/8-cmv-egfp所使用moi约为重组病毒scaav2/x-cmv-egfp的10倍;在感染人肝huh-7细胞时重组病毒scaav2/8-cmv-egfp所使用moi约为重组病毒scaav2/x-cmv-egfp的100-300倍;在感染人肝hepg2细胞时重组病毒scaav2/8-cmv-egfp所使用moi约为重组病毒scaav2/x-cmv-egfp的30-100倍;在感染人肝7721细胞时重组病毒scaav2/8-cmv-egfp所使用moi约为重组病毒scaav2/x-cmv-egfp的30-100倍。由此可见,在多种人肝细胞系上,重组病毒scaav2/x-cmv-egfp的感染效率远高于重组病毒scaav2/8-cmv-egfp。
[0148]
3.1.2重组病毒载体aav2/x和aav2/8在不同人肝原代细胞上感染效率的比较
[0149]
在细胞系上证明了重组病毒载体aav2/x的高转导效率后,又进行了hbv患者原代肝细胞转导实验。分离的并经pcr检测确认后的5株肝癌原代细胞分别命名为:hcc307n1、hcc061a2、hcc213f1、hcc893d1、hcc554a4。细胞对应患者信息如表5:
[0150]
表5
[0151][0152]
hcc表示肝癌
[0153]
5株肝癌原代细胞分离培养,分别用重组病毒scaav2/8-cmv-egfp与重组病毒scaav2/x-cmv-egfp感染。针对hcc307n1细胞,上述两种重组病毒采用相同的moi进行感染,moi分别为5000、15000、50000、150000、500000;针对hcc061a2细胞,scaav2/8-cmv-egfp采用moi为5000,15000,50000,150000,500000;scaav2/x-cmv-egfp采用moi为500,1500,5000,15000,50000;针对剩余3株细胞,2种病毒采用相同的moi进行感染,moi分别为500,1500,5000,15000,50000,150000,500000,每个moi做3复孔。48h后荧光显微镜拍照后,并用流式检测gfp阳性率及荧光强度。
[0154]
结果如图3所示,同一moi条件下,重组病毒scaav2/x-cmv-egfp比scaav2/8-cmv-egfp感染的阳性率更高,荧光更强。
[0155]
综合人肝细胞系实验结果及人原代肝细胞实验结果,可以充分证明,在体外实验中,重组病毒载体aav2/x对人肝脏细胞的靶向性比重组病毒载体aav2/8更具有优势。
[0156]
3.1.3aav2/x和aav2/8载体的猴体内靶向性比较
[0157]
选用食蟹猴6只,雌雄各半,分为2组,分别为scaav2/8-cmv-egfp组和scaav2/x-cmv-egfp组。给药剂量为1e 12vg/kg,给药方式为静脉输注,给药频率为单次给药。于药后7天将所有动物实施安乐死,采集心脏、肺脏、肝脏、大脑、睾丸、卵巢、股二头肌、胃、空肠、肾脏、脾脏组织,利用荧光显微镜对各组织中gfp蛋白表达情况进行了观察。
[0158]
动物组织荧光显微镜观察结果见图4、图5及表6,结果显示仅在各组动物的肝组织中观察到gfp蛋白表达,而其余组织(心脏、肺脏、大脑、睾丸、卵巢、股二头肌、胃、空肠、肾脏、脾脏)中均未见表达。其中重组病毒scaav2/8-cmv-egfp组中3只动物肝组织中平均gfp阳性细胞数分别为15.00
±
4.47、8.20
±
2.39、8.00
±
5.83个/视野,而重组病毒scaav2/x-cmv-egfp组中3只动物肝组织中平均gfp阳性细胞数分别为123.40
±
8.02、79.80
±
23.06、54.40
±
28.01个/视野。此外,来自同一个体肝脏的肝组织之间gfp蛋白表达未见明显差异。统计分析的结果表明,重组病毒scaav2/x-cmv-egfp组动物的肝组织中gfp蛋白阳性细胞数显著高于重组病毒scaav2/8-cmv-egfp组动物。上述体外和体内实验结果表明,aav2/x在体外和体内对肝脏的靶向性均优于aav2/8。
[0159]
表6肝脏组织中gfp阳性细胞的荧光显微镜观察(个/视野)
[0160][0161]
(二)、在人或猴血清中针对aav载体的中和抗体水平的检测
[0162]
3.1.4猴血清中aav2/x和aav2/8中和抗体水平的比较
[0163]
本实验采用固定的病毒感染指数(moi),将血清进行倍比稀释,比较食蟹猴血清中针对aav2/8与aav2/x的中和抗体的水平。在一系列血清稀释度中,选择血清病毒混合物感染细胞效率达到病毒在无血清时感染细胞效率的50%的稀释度,以此稀释度的倒数作为中和抗体量,针对每种病毒载体评价其中和抗体的水平(参见lochrie ma等,2006,virology 353:68-82;mori s等,2006,jpn j infect dis 59:285-293等)。本实验共对12只食蟹猴血清进行检测,对血清进行系列稀释,分别判定并比较每个样品中针对重组病毒aav2/8的中和抗体与针对重组病毒aav2/x的中和抗体的水平。
[0164]
实验步骤如下:7402细胞接种24孔板,食蟹猴血清样品进行系列梯度稀释,scaav2/8-cmv-egfp和scaav2/x-cmv-egfp病毒感染的moi为2000,将系列稀释的血清样品与病毒液1:1进行混合,混合后37℃共孵育1h,然后细胞中加入血清样品与病毒液混合液或病毒液,感染细胞。48h后收获细胞,流式细胞术检测感染效率。
[0165]
检测结果如表7所示,血清样本进行4个梯度的稀释,倍数范围为5-100倍,当中和抗体量低于5时,视为针对该种病毒的中和抗体为阴性。12份血清样本分别编号为1#、2#、3#、4#、5#、6#、7#、8#、9#、10#、11#、12#。其中1#、2#、4#样本中针对两种病毒载体的中和抗体均为阴性;3#和12#血清样本中针对重组病毒scaav2/8的中和抗体水平较高,针对重组病毒scaav2/x的中和抗体为阴性;7#样本中针对两种重组病毒的中和抗体水平均较低;5#、6#、8#、9#、10#、11#样品中针对重组病毒scaav2/x的中和抗体水平明显低于针对重组病毒scaav2/8的中和抗体水平。
[0166]
表7食蟹猴12份血清中和抗体检测结果
[0167]
血清编号aav2/x-nabaav2/8-nab1#<5<52#<5<53#≤5>1004#<5<55#10-50>1006#10-50>1007#1010
8#10-50>1009#50-100>10010#50-100>10011#50-100>10012#<510-50
[0168]
因此,通过对食蟹猴血清中aav2/x和aav2/8中和抗体水平的综合比较,在猴群体中针对aav2/x的中和抗体显著低于针对aav2/8的中和抗体。由此可见,重组病毒aav2/x作为药物递送载体,具有更低的免疫原性,有利于更好地发挥药物的治疗效果。
[0169]
3.1.5人血清中针对重组病毒aav2/x和重组病毒aav2/8的中和抗体水平的比较
[0170]
本实验共进行20人份血清检测,对血清进行了一系列稀释,在一系列血清稀释度中选择血清病毒混合物感染细胞效率达到病毒在无血清时感染细胞效率的50%的稀释度,以此稀释度的倒数作为中和抗体量,分别评价每个样品中针对重组病毒aav2/8的中和抗体与针对重组病毒aav2/x的中和抗体的水平。
[0171]
实验步骤如下:人肝7402细胞系接种24孔板,人血清样品进行系列梯度稀释,两种重组病毒scaav2/8-cmv-egfp和scaav2/x-cmv-egfp采用病毒感染指数(moi)为2000,将系列稀释的血清样品与病毒液1∶1进行混合,混合后37℃共孵育1h,然后细胞中加入血清样品与病毒液混合液或病毒液,感染细胞。48h后收获细胞,流式细胞术检测感染效率。
[0172]
检测结果如表8和图6所示,通过对20份健康人血清中中和抗体的检测,其中在9个样品(2#、5#、6#、7#、9#、15#、16#、17#、20#)中,观察到针对重组病毒aav2/8的中和抗体水平高于针对重组病毒aav2/x的中和抗体水平;在4个样品(4#、13#、14#、18#)中,针对重组病毒aav2/x的中和抗体水平高于针对重组病毒aav2/8的中和抗体水平;在3个样品(1#、3#、8#)中,针对重组病毒aav2/8的中和抗体水平与针对重组病毒aav2/x的中和抗体水平相当;4个样品(10#、11#、12#、19#)针对两种病毒的中和抗体水平均为阴性。
[0173]
本实验随机挑选20份人血清进行中和抗体水平检测,具有群体性。实验结果证明在人类群体中,针对重组病毒aav2/x的中和抗体较少,与重组病毒aav2/8比较,重组病毒aav2/x更适合作为药物递送载体,能够降低反应原性,从而有利于药效的发挥。
[0174]
表8 20份人血清中和抗体滴度
[0175][0176][0177]
3.2候选药物中启动子的选择
[0178]
为了选择合适的启动子,本发明在第一阶段使用三种不同启动子(cmv启动子、dc172启动子、dc190启动子)进行载体构建,其载体主体结构如图7j所示,并包装成重组病毒scaav2/x-cmv-gluc、重组病毒scaav2/x-dc172-gluc、重组病毒scaav2/x-dc190-gluc,然后在小鼠体内进行表达量的比较。
[0179]
选择正常129小鼠为受体,设置三个给药组,分别为重组病毒scaav2/x-cmv-gluc、重组病毒scaav2/x-dc172-gluc和重组病毒scaav2/x-dc190-gluc给药组,并设置pbs给药对照组,每组共3只实验动物。病毒载体给药剂量为3e 10vg/只,尾静脉注射后,分别于1、2、3、4周剪尾采血,用于荧光素酶活性测试,具体实验方法参照盖宁生物gaussia luciferase检测试剂盒说明书。
[0180]
第一轮启动子体内比较结果如图8a所示,所有pbs注射组均显示阴性。每个检测点的比较结果均显示重组病毒scaav2/x-dc172-gluc给药组中gluc基因的表达量最高,其次是重组病毒scaav2/x-dc190-gluc给药组,启动外源基因表达量最低的是重组病毒scaav2/x-cmv-gluc给药组。
[0181]
在第二阶段,分别把dc172启动子和lp1启动子进行载体构建,其载体主体结构如图7k,并包装成重组病毒ssaav2/x-dc172-gla和重组病毒ssaav2/x-lp1-gla,然后进行第二次体内比较实验。
[0182]
选择正常小鼠为受体,设置两个给药组,分别为重组病毒ssaav2/x-dc172-gla和重组病毒ssaav2/x-lp1-gla,并设置pbs给药对照组,每组共3只实验动物。病毒载体给药剂量为1e 15vg/只,尾静脉注射后,分别于2、3、4、5、6、7、8周剪尾采血,采用底物荧光法进行
gla酶活性测试。96孔荧光板中加入10μl血清待测样品,再加入40μl底物(5mm 4-甲基伞形酮-α-d-半乳糖苷(acros,337162500)和100mm n-乙酰基-d-半乳糖胺(sigma,a2795))混匀,置于37℃避光孵育1h后,用0.3mglycine-naoh终止反应。以不同摩尔浓度4-mu(4-methylumbelliferone四甲基伞形酮)(sigma,m1381)标准品作为定量指标,进行荧光读数。以标准品绘制标准曲线计算不同时间点样品酶活性值。结果如图8b所示,在每一个取样时间点,重组病毒ssaav2/x-lp1-gla中gla的酶活性都要高于重组病毒ssaav2/x-dc172-gla中gla的酶活性。因此,选择lp1启动子作为候选药物的启动子元件。
[0183]
3.3候选药物中表达调控元件的选择
[0184]
为了确认表达调控元件的作用,构建并包装了携带wpre调控元件和未携带wpre调控元件的载体。其中,未携带wpre调控元件载体的主体结构如图7k,携带wpre调控元件载体的主体结构如图9所示,构建载体,并包装成重组病毒ssaav2/x-lp1-gla-wpre。
[0185]
选择正常129小鼠为受体,设置2个给药组,ssaav2/x-lp1-gla和ssaav2/x-lp1-gla-wpre给药组,并设置pbs给药对照组,每组共3只实验动物。病毒载体给药剂量为3e 10vg/只,尾静脉注射后,ssaav2/x-lp1-gla和ssaav2/x-lp1-gla-wpre给药组于2、3、4、5、6、7、8周剪尾采血,进行gla酶活性测试。
[0186]
结果如图10所示,ssaav2/x-lp1-gla和ssaav2/x-lp1-gla-wpre实验组显示加入wpre后对外源基因的表达有所提高,仅是不含wpre的病毒载体的1.5-2倍。
[0187]
实施例4候选药物体外酶活性的检测
[0188]
鼠原代肝细胞的分离及培养,具体方法参见文献(seglen p o.preparation of isolated rat live cells[j].methods cell biol.1976,13:29-83),分离的鼠原代肝细胞贴壁培养16-20h后,消化1个孔细胞计数,弃去每孔细胞中的培养基,用2ml的无血清培养基(opt-mem)润洗细胞2次后弃去培养基。将不同moi(分别为5、10、20、40万)的重组病毒ssaav2/x-lp1-gla病毒稀释液加入6孔板中(感染体积为1ml),同时设置不含病毒的无血清培养基对照,放入5%co
2 37℃培养箱中培养。病毒感染5-7h后,吸弃病毒液,每孔用2ml的无血清培养基(opt-mem)洗细胞1-2次,每孔加入2ml肝细胞维持培养液,继续放入5%co2,37℃培养箱中培养。病毒感染48h后,收集细胞培养上清液,细胞用测活反应液(ph=4.6,28mm柠檬酸 44mm磷酸氢二钠)进行收集。细胞进行三次速冻速溶后,用bca试剂盒检测蛋白浓度。底物荧光法测定细胞内外α-半乳糖苷酶a活性。结果如图11显示,随着所选择的感染moi的倍增,胞内(图11a)及胞外(图11b)酶活性随之递增的,且具有明显的剂量依赖关系。
[0189]
实施例5候选药物体内药效学实验
[0190]
5.1施用重组病毒ssaav2/x-lp1-gla和ssaav2/8-lp1-gla后,不同组织中α-半乳糖苷酶a酶活的比较
[0191]
动物试验共设置两个给药组和两个对照组,每个给药组含有3只雌性模型鼠和3只雄性模型鼠,模型鼠为gla缺失模型鼠(ohshima t等,proc natl acad sci u s a(1997).94(6):2540-2544)。两个对照组,分别是野生型小鼠对照组及空白模型鼠(纯合子)对照组。两个给药组分别注射重组病毒ssaav2/x-lp1-gla或重组病毒ssaav2/8-lp1-gla,注射剂量为1e 10vg/只。给药后7天处死所有组别动物,提取血清、肝脏组织、心脏组织及肾脏组织。组织匀浆后4℃离心30min,取上清再次4℃离心10min,最后一次离心后,取出上清,bca测定蛋白浓度。采用底物荧光法测定血清及组织α-半乳糖苷酶a(α-gal a)活性。
[0192]
血清及不同组织gla酶活检测结果如图12a所示:采用同等剂量给药,在血清、肝脏、肾脏、心脏组织中,重组病毒ssaav2/x-lp1-gla和ssaav2/8-lp1-gla两种给药组中α-半乳糖苷酶a的酶活性水平均高于对照组野生型中α-半乳糖苷酶a的酶活性水平,且在所有组织中均发现,重组病毒ssaav2/x-lp1-gla给药组中gla酶活性水平高于ssaav2/8-lp1-gla给药组中gla酶活性水平。从图12a中可以看出,系统性给药后,血清和肝脏中gla酶活性水平明显高于肾脏和心脏,说明药物通过血液循环到达肾脏和心脏较少,但仍均高于野生型小鼠中gla酶活性水平,说明重组病毒ssaav2/x-lp1-gla和ssaav2/8-lp1-gla足以使肾脏等受影响器官表达正常水平活性的gla,并且重组病毒ssaav2/x-lp1-gla组中gla表达水平或酶活性水平远高于重组病毒saav2/8-lp1-gla组中gla表达水平或酶活性水平。
[0193]
5.2施用重组病毒aav2/x载体药物后,不同组织gla酶活分析
[0194]
体内动物实验测试给药剂量与gla表达水平之间的关系,共设置三个给药剂量组,分别以1e 9vg/只、3e 9vg/只以及1e 10vg/只的剂量注射重组病毒ssaav2/x-lp1-gla,每个给药组含有3只雌性模型鼠和3只雄性模型鼠。设置两个对照组,分别是野生型小鼠对照组及空白模型鼠对照组(模型鼠)。尾静脉给药后7天处死所有组别动物,提取血清、肝脏组织、心脏组织及肾脏组织。组织匀浆方法如上所述。提取不同组织蛋白后,bca测定蛋白浓度,底物荧光法测定血清及组织α-半乳糖苷酶a(α-gal a)活性。
[0195]
血清及不同组织gla酶活检测结果如图12b所示:血清酶活检测结果显示,gla酶活性水平随着给药剂量增加而提高,在使用低剂量即1e 9vg时,gla酶活性水平已经高于野生型小鼠的gla酶活性水平;肝脏酶活检测结果显示,gla酶活性水平随着给药剂量增加而提高,在使用低剂量即1e 9vg时,gla酶活性水平与野生型小鼠的gla酶活性水平相当;肾脏酶活检测结果显示,在使用低剂量和中剂量时,gla酶活性水平非常低,在使用高剂量即1e 10vg时,gla酶活性水平明显高于野生型小鼠的gla酶活水平;心脏酶活检测结果显示,gla酶活性水平随着给药剂量增加而提高,在使用中剂量即3e 9vg时,gla酶活性水平与野生型小鼠的gla酶活性水平一致。
[0196]
肾脏受累是法布里病的突出特征,由中性糖鞘脂(主要是神经酰胺三己糖苷)(gb3)的积累引起。因此,通过高分辨率电子显微镜评估小鼠肾实质的超微结构。在未经治疗的法布里模型小鼠中,足细胞形成足突融合,gb3积累,滤过裂孔形成多泡体并降解,并且裂孔隔膜形成复合物。发生这种现象时,可能会发展成蛋白尿和肾小球硬化。施用重组病毒ssaav2/x-lp1-gla后,观察到在高剂量1e 10vg下的模型小鼠整个肾实质的脂质积聚大量减少,肾脏结构趋于正常(未显示图)。因此,所有给药组小鼠的肾组织中较少、较小或较不致密的溶酶体的超微结构发现所示,在1e 10vg剂量水平下既可以消耗积累的gb3又防止其在小鼠中的再积聚。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。