e3泛素连接酶rbck1在制备治疗肝癌的药物中的应用
技术领域
1.本发明涉及生物医药技术领域,具体涉及一种e3泛素连接酶rbck1在制备治疗肝癌的药物中的应用。
背景技术:
2.肝癌是世界上最常见的恶性肿瘤之一,也是癌症相关死亡的第二大原因。尽管在诊断和治疗方法上有了很大的进步,但转移仍然是治疗失败和死亡的主要原因。虽然现代多学科护理策略已应用于肿瘤转移的治疗,但晚期肝癌。患者的5年总生存率仅为25%-39%,复发率约为80%。恶性肿瘤的转移往往是肝癌患者治疗失败的主要原因。肝癌转移的分子机制尚不清楚。
3.有氧糖酵解,也被称为warburg效应,是癌症细胞最典型的代谢表型之一,包括肝细胞癌(hcc),它在其中发挥着重要作用。有氧糖酵解主要受到致癌信号的影响,如pi3k/akt。值得注意的是,肿瘤细胞中的代谢紊乱可以抑制转移,这表明有氧糖酵解是肿瘤生长和生存的核心。因为肝脏是一个重要的器官,负责多种独特的代谢功能。所以在肝癌等疾病中更好地理解细胞代谢和转移之间的机制对于开发新的治疗方法至关重要。
4.葡萄糖转运蛋白1(glut1)属于促进性细胞表面葡萄糖转运蛋白家族,其成员调节葡萄糖穿过细胞膜的转运。glut1在几种癌症中过表达。越来越多的证据表明,glut1促进细胞增殖和转移,在包括hcc、乳腺癌和肾癌等多种癌症中发挥关键作用。许多研究表明sirt1/glut1轴通过调节葡萄糖摄取促进膀胱癌的进展。此外,在er阳性的乳腺癌细胞系中,下调glut1使细胞对他莫西芬治疗敏感,甚至恢复了对他莫西芬耐药细胞对药物的敏感性。然而,调节 glut1介导的有氧糖酵解在hcc转移中的作用机制尚不清楚。
5.泛素-蛋白酶体系统(ups)对细胞内信号传导和蛋白质代谢发挥重要调控作用。泛素化是细胞翻译后最广泛、最常见的修饰之一,它对细胞正常功能至关重要。e3泛素连接酶的翻译后修饰可以调节靶蛋白的功能,以及细胞内机制。越来越多的证据表明e3泛素连接酶是癌症的关键调控因子。最近研究表明, ranbp2-type and c3hc4-type zinc finger-containing 1(rbck1)是一种带有n末端泛素样结构域(ubl)的e3泛素连接酶,一个npl4-type zinc finger (nzf)和一个催化c末端rbr结构域,在肿瘤发展中发挥重要作用。然而,rbck1 在hcc进展中的确切作用和潜在的信号级联仍不清楚。
技术实现要素:
6.本发明目的在于提供一种e3泛素连接酶rbck1在制备治疗肝癌的药物中的应用。
7.本发明的上述目的是通过如下方式来实现的:
8.本发明人研究发现rbck1在肝癌组织中表达显著上调,rbck1的高表达与较差的肿瘤生存和远处侵袭显著相关。功能实验证明rbck1通过增强glut1介导的有氧糖酵解促进迁移和侵袭,进一步,rb0k1激活wnt/β-catenin/glut1 通路诱导hcc细胞迁移和有氧糖酵解依赖于pparγ/pgc1α复合物的破坏。机制上,rbck1促进pparγ泛素化降解,rbck1过表达增
强wnt/β-catenin转录活性,从而上调glut1介导的hcc细胞有氧糖酵解。总之,本发明人确定了肝癌细胞在营养不良的肿瘤微环境中生存的机制,并提供了rbck1在hcc细胞适应代谢应激中的作用。
9.有益效果
10.本发明分析了临床肝癌组织样本中rbck1的表达水平,发现rbck1的高表达水平与hcc患者预后不良相关。rbck1通过glut1增强warburg效应促进hcc 细胞转移,rbck1介导的wnt/β-catenin/glut1通路诱导的hcc细胞迁移和有氧糖酵解机制依赖于ppar7/pgc1α复合物的破坏。不论在体内还是体外,rbck1 在肝癌细胞的发生和进展过程中都发挥着重要的作用,并且依据rbck1在肝癌组织中的高表达结果,本发明为肝癌的诊断提供了新的生物标志物rbck1,并且rbck1可以作为治疗肝癌的新型靶点,为筛选诊治肝癌药物及治疗肝癌提供了新方向。
附图说明
11.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
12.图1为rbck1在转移性肝癌中过度表达,与患者不良预后密切相关。
13.其中,图1a为rbck1在tcga数据库中肝癌组织及癌旁组织中的mrna表达水平和tcga肝癌数据中rbck1 mrna配对分析表达谱;图1b为tcga队列中 hcc患者rbck1表达与临床病理特征的关系;图1c为临床收集肝癌数据中rbck1mrna水平和临床hcc组织及癌旁正常组织中rbck1 mrna配对分析表达谱;图 1d为western blot检测临床hcc组织及癌旁正常组织中rbck1蛋白的表达水平,**p<0.01和rbck1蛋白表达灰度值的统计图;图1e为免疫组织化学检测 rbck1蛋白在hcc组织及癌旁正常组织中的表达,比例尺,50μm;图1f为由 rbck1低表达和高表达界定的两组hcc患者总生存期的kaplan-meier曲线, rbck1低表达和高表达界定的两组hcc患者无病生存期的kaplan-meier曲线。
14.图2为rbck1在体外促进hcc细胞的迁移和侵袭,在体内加速hcc细胞的转移相关。
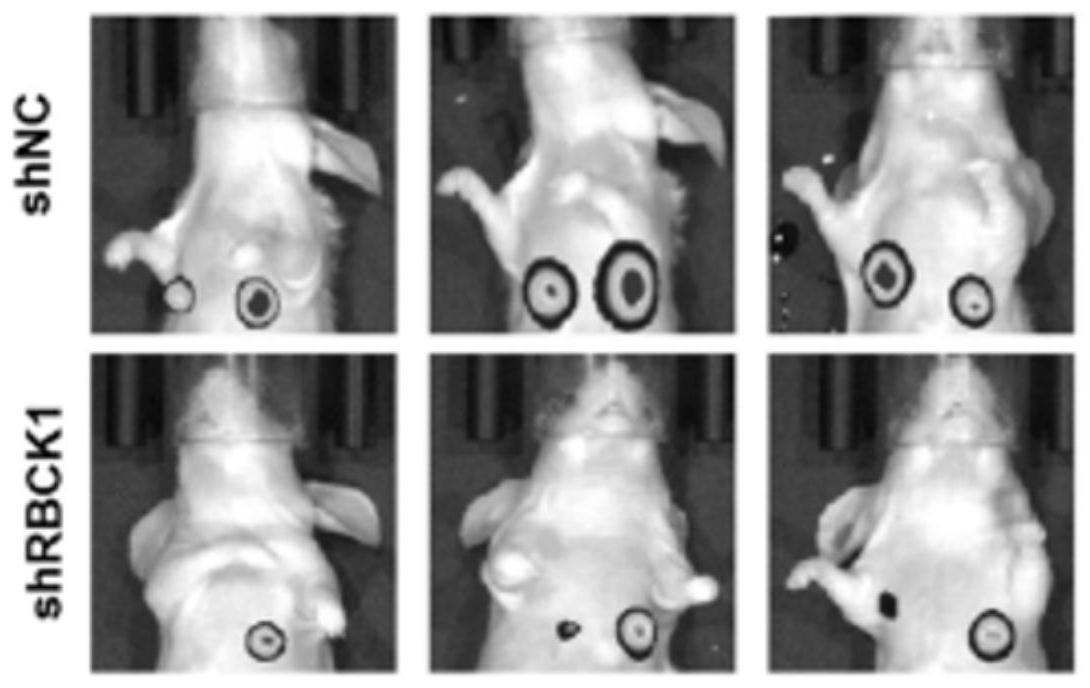
15.其中,图2a为hcc细胞株和正常人肝细胞(hl-7702)rbck1蛋白水平,正常人肝细胞(hl-7702)和hcc细胞株rbck1 mrna水平;图2b为westernblot 和qrt-pcr检测稳定转染rbck1沉默或过表达质粒的hcclm3和hep3b细胞中 rbck1的表达水平,*p<0.05,**p<0.01;图2c为rbck1敲低载体转染hcclm3 细胞的transwell迁移和transwell侵袭实验,*p<0.05,**p<0.01;图2d 为rbck1过表达质粒转染hep3b细胞的transwell迁移和transwell侵袭实验;图2e为共聚焦显微镜分析rbck1低表达的hcc细胞中e-cadherin和vimentin 表达情况;图2f为过表达rbck1的hcc细胞中e-cadherin和vimentin表达情况;图2g为监测稳定干扰hcc细胞中rbck1组及对照组原位肝移植转移模型中转移瘤产生的荧光,n=8;图2h为监测稳定过表达hcc细胞中rbck1组及对照组原位肝移植转移模型中转移瘤产生的荧光,n=8;图2i为稳定干扰 hcc细胞中rbck1组及对照组肝内和肺转移结节石蜡切片的h&e染色;图2j 为稳定过表达hcc细胞中rbck1组及对照组原位肝移植转移模型中肝内和肺转移结节的统计分析(n=8/组)。
16.图3为rbck1通过调节warburg效应促进hcc细胞的迁移和侵袭相关。
17.其中,图3a为在hcclm3/shrbck1细胞中g6p水平,葡萄糖消耗,乳酸产生和atp水平,*p<0.05,**p<0.01;图3b为ecar数据显示rbck1沉默的hcc 细胞的糖酵解速率,*p<0.05;图3c为ecar数据显示rbck1沉默的hcc细胞的容量,*p<0.05;图3d为ocr结果显示rbck1沉默的hcc细胞的基础呼吸, *p<0.05,**p<0.01;图3e为ocr结果显示rbck1沉默的hcc细胞的最大呼吸,*p<0.05,**p<0.01;图3f为过表达rbck1的hep3b细胞中细胞g6p水平、葡萄糖消耗、乳酸产生和atp水平;图3g为ecar数据显示rbck1过表达的hcc细胞的糖酵解速率,*p<0.05,**p<0.01;图3h为ecar数据显示rbck1 过表达的hcc细胞的糖酵解容量,*p<0.05,**p<0.01;图3i为ocr结果显示rbck1过表达的hcc细胞的基础呼吸,*p<0.05,**p<0.01;图3j为ocr 结果显示rbck1过表达的hcc细胞的最大呼吸,*p<0.05,**p<0.01;图3k 为在不同浓度2-dg存在下hcclm3/shrb0k1产生乳酸总量*p<0.05,** p<0.01;图3l为在不同浓度2-dg存在下hep3b/p-rbck1产生乳酸总量* p<0.05,**p<0.01;图3m为2-dg对hcclm3/shrbck1细胞迁移和侵袭的影响, *p<0.05,**p<0.01;图3n为2-dg对hep3b/p-rbck1细胞迁移和侵袭的影响,*p<0.05,**p<0.01;图3o为在含半乳糖但不含葡萄糖的培养基中培养 hepg2细胞,消除rbck1过表达对细胞迁移和侵袭的影响。
18.图4为rbck1在hcc细胞中的作用部分依赖于调节glut1的表达相关。
19.其中,图4a为western blotting和qrt-pcr分析hcclm3/shrbck1细胞中glut1的表达水平,*p<0.05,**p<0.01;图4b为western blotting和qrt-pcr分析hep3b/p-rbck1细胞中glut1的表达水平,*p<0.05,**p<0.01;图4c为western blotting检测各组rbck1和glut1的表达,tubulin作为内参;图4d为不同处理组间细胞迁移的数量,*p<0.05**p<0.01;图4e为不同处理组间细胞侵袭的数量,*p<0.05**p<0.01;图4f为不同组裸鼠(n=8) 肝内和肺转移的代表性图像(右)和定量(左);图4g为各组细胞g6p水平、葡萄糖消耗、乳酸产生和atp水平;图4h为ecar数据显示不同处理组间细胞的糖酵解速率,*p<0.05;图4i为ocr结果显示不同处理组间细胞的基础呼吸, *p<0.05;图4j为ecar数据显示不同处理组间细胞的糖酵解容量,*p<0.05;图4k为ocr结果显示不同处理组间细胞的最大呼吸,*p<0.05;图4l为westernblotting检测各组rbck1和glut1的表达,tubulin作为内参;图4m为不同处理组间细胞迁移的数量,*p<0.05**p<0.01;图4n为不同处理组间细胞侵袭的数量,*p<0.05**p<0.01;图4o为不同组裸鼠(n=8)肝内和肺转移的代表性图片(右)和定量(左);图4p为细胞g6p水平、葡萄糖消耗、乳酸产生和 atp水平;图4q为ecar数据显示不同处理组间细胞的糖酵解速率,*p<0.05;图4r为ocr结果显示不同处理组间细胞的基础呼吸,*p<0.05;图4s为ecar 数据显示不同处理组间细胞的糖酵解容量,*p<0.05;图4t为ocr结果显示不同处理组间细胞的最大呼吸,*p<0.05,*p<0.05。
20.图5为rbck1通过wnt/β-catenin信号通路促进glut1介导的warburg效应相关。
21.其中,图5a为基因集富集分析(gene set enrichment analysis,gsea)显示rbck1诱导wnt/β-catenin、氧化磷酸化和ppar信号转导发生显著变化;图5b为通过western blotting检测rbck1沉默的hcclm3细胞中β-catenin的总蛋白和核蛋白水平,以微管蛋白和组蛋白3作为负荷对照;图5c为在rbck1 沉默的hcclm3细胞中,转染top-flash和fop-flash载体的细胞的相对荧光素酶活性水平显示,*p<0.05,**p<0.01;图5d为通过western blotting 检测rbck1过表达的hep3b细胞中β-catenin的总蛋白和核蛋白水平,以微管蛋白
和组蛋白3作为负荷对照;图5e为在rbck1过表达的hep3b细胞中,转染top-flash和fop-flash载体的细胞的相对荧光素酶活性水平显示,* p<0.05,**p<0.01;图5f为western blotting检测各组rbck1、β-catenin和glut1的表达水平,tubulin作为内参,*p<0.05,**p<0.01;图5g为qrt-pcr 检测各组rbck1、β-catenin和glut1的表达水平,tubulin作为内参,* p<0.05,**p<0.01;图5h为对指定组的transwell测定进行定量,*p<0.05, **p<0.01;图5i为不同组裸鼠肝内和肺转移的定量(n=8) ;图5j为westernblotting显示转染shrbck1和xav-939的hcclm3细胞中rbck1、β-catenin和glut1的表达水平,tubulin作为内参,*p<0.05;图5k为qrt-pcr显示转染shrbck1和xav-939的hcclm3细胞中rbck1、β-catenin和glut1的表达水平,tubulin作为内参,*p<0.05;图5l为转染shrbck1或xav-939的hcclm3 细胞中transwell测定的定量,*p<0.05,**p<0.01;图5m为转染shrbck1 或xav-939的hcclm3细胞中细胞g6p水平、葡萄糖消耗、乳酸产生和atp水平,*p<0.05,**p<0.01;图5n为在转染shrbck1或xav-939的hcclm3 细胞中检测ecar;图5o为western blotting检测rbck1过表达的hep3b细胞转染xav-939后rbck1、β-catenin和glut1的表达水平,tubulin作为内参, *p<0.05;图5p为qrt-pcr检测rbck1过表达的hep3b细胞转染xav-939后 rbck1、β-catenin和glut1的表达水平,tubulin作为内参,*p<0.05;图 5q为xav-939处理rbck1过表达的hep3b细胞迁移定量分析,*p<0.05,** p<0.01;图5r为xav-939处理rbck1过表达的hep3b细胞侵袭定量分析,* p<0.05,**p<0.01;图5s为在xav-939处理过rbck1的hep3b细胞中,细胞g6p水平、葡萄糖消耗、乳酸产生和atp水平,*p<0.05,**p<0.01;图5t为ecar检测在xav-939处理过rbck1的hep3b细胞中糖酵解速率。
22.图6为rbck1通过破坏pparγ/pgc1α复合物激活hcc细胞 wnt/β-catenin通路和warburg效应相关。
23.图6a为co-ip检测显示rbck1与β-catenin之间没有相互作用;图6b 为western blotting显示rbck1沉默的hcclm3细胞中rbck1、pparγ、pgc1α、β-catenin和glut1的表达水平,tubulin作为内参;图6c为co-ip联合 western blotting检测在rbck1沉默的hcclm3细胞中pparγ和pgc1α的表达水平,tubulin作为内参;图6d为western blotting显示rbck1过表达的 hep3b细胞中rbck1、pparγ、pgc1α、β-catenin和glut1的表达水平,tubulin 作为内参;图6e为co-ip联合western blotting检测rbck1过表达的hep3b 细胞中pparγ和pgc1α的表达水平,tubulin作为内参;图6f为qrt-pcr 显示rbck1沉默的hcclm3细胞中rbck1和pparγ的表达水平;图6g为westernblotting显示转染shpparγ的rbck1沉默的hcclm3细胞中rbck1、pparγ、β-catenin和glut1的表达水平,tubulin作为内参;图6h为转染shpparγ的rbck1沉默的hcclm3细胞中transwell测定的定量,*p<0.05;图6i为转染shpparγ的rbck1沉默的hcclm3细胞中细胞g6p水平、葡萄糖消耗、乳酸产生和atp水平,*p<0.05,**p<0.01;图6j为western blotting显示转染p-pparγrbck1过表达的hep3b细胞中rbck1、pparγ、β-catenin和 glut1的表达水平,tubulin作为内参;图6k为rbck1过表达的hep3b细胞转染p-pparγ的迁移数目测定的定量,*p<0.05;图6l为rbck1过表达的hep3b 细胞转染p-pparγ的侵袭数目测定的定量,*p<0.05;图6m为转染shpparγ的rbck1沉默的hcclm3细胞中细胞g6p水平、葡萄糖消耗、乳酸产生和atp 水平,*p<0.05,**p<0.01;图6n为免疫组织化学方法检测rbck1、ki67、pparγ、pgc1α、β-catenin、glut1、vimentin蛋白在hcc组织及癌旁正常组织中的表达,比例尺,50μm。
24.图7为rbck1通过促进pparγ泛素化和降解与hcc细胞相互作用并使 pparγ失稳相关。
25.其中图7a为go-ip显示在hcclm3细胞中内源性rbck1和pparγ直接结合;图7b为go-lp表明内源性rbck1和pparγ没有直接结合;图7c为gst 下拉实验表明rbck1和pparγ在hcclm3细胞中直接结合;图7d为gst下拉实验表明rbck1和pparγ在hep3b细胞中直接结合;图7e为用mg132 (z-leu-leu-leu-cho,15μmol/l)处理hcclm3和f细胞,测定pparγ水平;图7f为用mg132(z-leu-leu-leu-cho,15μmol/l)处理mhcc97h细胞,测定 pparγ水平;图7g为在e1、e2(ubch5c)、fbx09和ub存在下检测hek293 细胞ha-pparγ泛素化水平;图7h为在hcclm3细胞中rbck1的下调或过表达改变pparγ的泛素化,各组细胞均用蛋白酶体抑制剂mg132处理,制备细胞裂解液,并使用抗pparγ抗体进行免疫沉淀,用抗ub抗体western blotting 检测泛素附着pparγ水平;图7i为在hep3b细胞中rbck1的下调或过表达改变pparγ的泛素化,各组细胞均用蛋白酶体抑制剂mg132处理,制备细胞裂解液,并使用抗pparγ抗体进行免疫沉淀,用抗ub抗体western blotting 检测泛素附着pparγ水平。图7j为野生型pparγ或pparγ基因所有lys位点突变的k-to-r突变体在hek293细胞中的泛素化;图7k为hek293细胞 pparγ泛素化型的测定;图7l为将编码ha-pparγ的质粒与flag-rbck1质粒分别转染hcclm3细胞,然后,在特定时间对细胞进行环己亚胺(chx)(20 μmol/l)处理,用抗ha抗体检测ppar7的降解;图7m为将编码ha-pparγ的质粒与flag-rbck1质粒分别转染mhcc97h细胞,然后,在特定时间对细胞进行环己亚胺(chx)(20μmol/l)处理,用抗ha抗体检测pparγ的降解;图 7n为提出了e3泛素连接酶rbck1通过破坏pparγ/pgc1α复合物促进glut1 介导的warburg效应的模型。
具体实施方式
26.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
27.实施例1
28.病人和标本:
29.研究对象为南昌大学第二附属医院普外科216例原发性肝癌患者的癌和癌旁组织。本研究经南昌大学第二附属医院临床研究伦理委员会批准,所有受试者同意提供样本用于研究。表1总结了所有患者的临床特征。
30.表1 rbck1表达与临床病理特征的关系
[0031][0032]
细胞系与培养:
[0033]
从美国rockville获得4株hcc细胞株(hcclm3、hep3b、smmc7721和 mhcc97h)和正常人肝细胞(hl-7702)。细胞在rpmi 1640或dmem(gibco)中添加10%胎牛血清、100u/ml青霉素和100mg/ml链霉素,在37℃和5%co2 条件下培养。
[0034]
免疫印迹分析:
[0035]
使用4-12%的bis-tris凝胶(life technologies,usa)分离细胞裂解液并转移到pvdf膜上。用5%脱脂牛奶封闭膜,并与相应的抗体孵育。使用的抗体有anti-rbck1(1∶1000,abcam,ab219955)、anti-glut1(1∶1000,abcam, ab115730)、anti-pparγ(1∶1000,abcam,ab176328)、anti-pgc1α(1∶1000, abcam,ab176328)、anti-β-catenin(1∶1000,abcam,ab16051)、anti-ub (1∶1000,abcam,ab134953)、anti-ube1(1∶1000,proteintech,15912-1-ap)、 anti-ubch5c(1∶1000,proteintech,15912-1-ap)、anti-fbx09(1∶1000, proteintech,11161-1-ap)和anti-tubulin(1:1000,santa cruz,sc-8035)。
[0036]
免疫组织化学染色(ihc):
[0037]
固定、包埋、切片、脱蜡。部分脱蜡切片进行苏木精和伊红(h&e)染色。根据制造商的说明,使用dako envision
tm
系统(agilent technologies,美国) 进行免疫组化染色。细胞分别与anti-rbck1(1∶2000,abcam,ab219955)、 anti-glut1(1∶2000,abcam,ab115730)、
anti-pparγ(1∶2000,abcam, ab45036)、anti-pgc1α(1∶2000,abcam,ab191838)、anti-β-catenin(1∶20 00,abcam,ab92547)、anti-vimentin(1∶2000,abcam,ab92547)和anti-ki67 (1∶2000,proteintech,27308-1-ap)孵育30分钟。
[0038]
shrna和质粒构建:
[0039]
上海吉凯基因制药公司合成了shrna介导的双链rna(shrna)沉默rbck1 (shrbck1)、β-catenin(shβ-catenin)或glut1(shglut1)。利用基因技术合成人rbck1、β-catenin和glut1的全长cdna,并与pcdna3.1载体连接,分别生成p-rbck1、p-β-catenin和p-glut1。空白载体作为阴性对照。根据制造商的说明书,使用lipofectamine 2000转染试剂(invitrogen公司,美国) 转染这些shrna和质粒。
[0040]
细胞迁移和侵袭试验:
[0041]
常规使用transwell试验来评估hcc细胞系的迁移和侵袭。在聚碳酸酯膜的上部预涂一层基质凝胶用于细胞侵袭检测。
[0042]
体内转移试验:
[0043]
在体内转移实验中,将100μl含有1
×
106细胞的磷酸盐缓冲生理盐水注入裸鼠大腿根部。一旦皮下肿瘤直径达到1-2厘米,将其切除并切成体积约为1mm3的碎片,然后将碎片植入裸鼠(每组8只,balb/c-nu/nu雄性,6-8 周龄)的肝脏。肿瘤植入6周后处死小鼠。然后对肝脏和肺进行处理并包埋在石蜡中。动物实验经南昌大学第二附属医院动物实验伦理委员会批准,依据《实验动物护理与使用指南》进行。
[0044]
耗氧率(ocr)和细胞外酸化率(ecar)的测定:
[0045]
细胞外通量分析仪xf96(seahorse bioscience,billerica,ma,usa) 使用xf cell mito stress test kit和gly酵解stress test kit(seahorsebioscience)分别根据制造商的说明书测量细胞糖酵解能力和细胞线粒体呼吸。
[0046]
共免疫沉淀(co-ip)和泛素化分析:
[0047]
免疫沉淀分析如前所述。在体内泛素化实验中,稳定转染ha-ub质粒到 rbck1敲低的人肝癌细胞或对照细胞中。转染后2天,用10mmol/l mg132处理细胞10h,以防止蛋白酶体降解。裂解液用2mg ha标记或igg抗体提取。洗脱液经sds-page分离,用rbck1、pparγ和tubulin抗体进行western blot 实验。体外泛素化检测的标准反应混合物(25μl)由20mm hepes naoh(ph 7.5)、 50mm nacl、0.02mg ml-1bsa、1mm dtt、5mm mgcl2、1mm atp、his-pparγ (1pmol为四聚体)、e1(0.85pmol)、ubch5c(1.25pmol)、fbx09(0.8pmol) 和ub(174pmol)组成。将反应混合物置于冰上,30℃孵育10分钟。加入sds 缓冲液终止反应,使用pparγ和tubulin抗体进行western blot实验。
[0048]
统计分析:
[0049]
所有结果均以均数
±
标准差表示,使用graphpad prism 5软件对至少三个独立实验进行分析。我们使用kaplan-meier方法生成生存曲线,使用 log-rank检验评估统计学意义。各组间差异采用双尾t检验和方差分析。当 p<0.05,认定结果存在统计学差异。
[0050]
结果:
[0051]
1、rbck1的高表达与hcc患者不良预后相关
[0052]
tcga组(n=424)分析显示rbck1在肝癌组织中高表达,高表达的rbck1 与肿瘤分期和远处转移呈正相关(图1a和b)。为进一步确定rbck1在肝细胞癌中表达水平,我们运用
qrt-pcr实验检测,结果显示,与配对癌旁组织相比,肝癌组织中rbck1 mrna的表达高于癌旁组织(图1c)。western blot实验(图 1d)和免疫组化染色(图1e)结果分析显示,与相邻癌旁组织相比,rbck1蛋白在hcc组织中上调。这些结果表明,rb0k1在hcc组织中表达显著上调。
[0053]
进一步评估rbck1过表达与hcc临床病理参数之间的相关性,发现rbck1 表达与肿瘤大小、年龄或组织学类型之间没有显著相关性,但与tnm (p<0.002)、远处转移(p=0.013)和临床分期(p=0.006)存在显著相关性(表1)。根据免疫组织化学分析结果,将216例hcc患者分为rbck1高表达组146例和 rbck1低表达组70例。kaplan-meier生存分析显示,与低rbck1水平的hcc 患者相比,rbck1高表达的hcc患者总生存期(0s)较差(p=0.025),无病生存期 (dfs)较差(p=0.0034)(图1f),需要注意的是,多因素cox回归分析结果显示 rbck1过表达是hcc患者不良预后的独立预测因素之一(表2)。总的来说,这些数据表明rbck1在hcc组织中上调,并与hcc患者不良预后相关。
[0054]
表2肝癌患者总生存率的单变量和多变量分析
[0055][0056]
2、rbck1在体内外均可促进肝癌细胞的转移
[0057]
为了研究rbck1在hcc进展中的潜在生物学功能,我们首先评估了rbck1 在hcc细胞系中的表达。qrt-pcr和western blot结果显示,与正常hl-7702 细胞相比,rbck1在hcc细胞中显著上调(图2a)。根据hcc细胞中rbck1的表达水平,我们下一步在建立了稳定敲低rbck1的细胞系hcclm3sh-rbx1细胞,以及在hep3b细胞系中稳定过表达rbck1的细胞系hep3b p-rbx1细胞(图 2b)。transwell实验证明,敲低rbx1能够明显降低肝癌细胞的侵袭迁移能力,而过表达rbx1能够明显增加肝癌细胞的侵袭迁移能力(图2c和d)。同样,rtca 试验结果还表明,敲低rbck1抑制hcclm3细胞的转移能力。由于emt与癌细胞的转移能力显著相关,我们研究了rbck1表达对hcc细胞emt表型的影响。如图2e和f所示,免疫荧光检测表明敲低rbck1增加了hcclm3细胞的上皮标志物,减少了间充质标志物。因此,得出结论,稳定敲低rbck1的抑制了hcc的侵袭和转移。
[0058]
我们通过建立裸鼠原位肝肿瘤模型(包括shnc组和shrbck1组),检测 rbck1对肝癌转移的影响。组织学分析显示,shnc组中发生5例肝内转移, shrbck1组中只发生1例(图2g和h)。此外,肺脏he染色显示shrbck1组肝细胞癌肺癌微转移的数量显著减少(图2i)。相反,过表达rbck1增加了肝内和肺转移结节的数量(图2j)。综上所述,这些结果表明稳定下调rbck1在体外和体内均可抑制肝癌的侵袭和转移,证明rbck1是肝癌进展和转移的一种致癌基因。
[0059]
3、rbck1通过增强warburg效应促进hcc进展
[0060]
已有研究证明e3泛素连接酶在几种癌症进展中促进了代谢重编程。由于 warburg效应是一种广泛存在于肿瘤细胞(包括hcc)中的具有良好特征的代谢转移,我们探索了rbck1在hcc糖代谢中的作用。rbck1的下调也显著降低了 hcclm3细胞中葡萄糖-6-磷酸(g6p)、葡萄糖消耗、乳酸产生和atp水平(图3a),而过表达rbck1在hep3b细胞中导致相反的趋势(图3f)。为了进一步验证rbck1 对hcc中糖酵解的影响,我们测量了反映细胞总糖酵解通量的ecar。rbck1敲低显著降低了hcclm3细胞的糖酵解速率和总量(图3b和c),而过表达rbck1 增加了hep3b细胞的ecar(图3g和h)。线粒体呼吸指标ocr的测量结果显示,在hcclm3中干扰rbck1,细胞ocr值增加(图3d和e),而过表达rbck1导致 hep3b细胞ocr值减少(图3i和j)。此外,以上结果也在mhcc97h/shrbck1和 smcc7721/p-rbck1细胞中观察到。
[0061]
为了研究warburg效应是否与hcc细胞的进展有关,我们用不同浓度(0、 4或8mm)的2-dg处理hcclm3/shrbck1和hep3b/p-rbck1细胞24小时。结果表明,在hcclm3/shrbck1和hep3b/p-rbck1细胞中,2-dg以剂量依赖的方式显著抑制糖酵解(图3k和l)。hcclm3/shrbck1和hep3b/p-rbck1细胞的迁移和侵袭能力也以剂量依赖的方式降低(图3m和n)。细胞在含有半乳糖而不是葡萄糖的培养基中培养,减少糖酵解通量,迫使细胞依赖氧化磷酸化。我们观察到糖酵解通量的减少极大地消除了rbck1过表达引起的hep3b细胞迁移和侵袭能力的增强(图3o)。这些结果表明,rbck1在hcc细胞中抑制氧化磷酸化,促进有氧糖酵解(warburg效应),但在体外通过增强warburg效应促进hcc细胞系的迁移和侵袭。
[0062]
4、rbck1通过glut1促进肝癌细胞的warburg效应
[0063]
先前的研究表明glut1在糖酵解中起重要作用。下一步,我们通过初步观察在敲低rbck1和过表达rbck1的hcc细胞中glut1的表达,探究rbck1是否调控glut1的表达。western blotting结果显示,敲低rbck1显著降低了hcclm3 细胞中glut1的表达(图4a)。相反,过表达rbck1显著增加hep3b细胞中glut1 的表达(图4b)。此外,在hcclm3/shrbck1细胞中,上调glut1可减弱因敲低 rbck1导致的glut1表达下降(图4c)。此外,回复实验表明,glut1表达的恢复消除了rbck1沉默导致的肝癌细胞转移能力下降(图4d和e)。体内肿瘤转移实验显示,过表达glut1增加了降低rbck1导致的hcclm3细胞肝内和肺转移发生率下降(图4f)。此外,关于rbck1是否通过glut1表达增加糖酵解的研究显示,上调glut1表达挽救了rbck1介导的hcc细胞中g6p、葡萄糖消耗、乳酸产生和atp水平的降低(图4g)。同时,敲低rbck1降低了hcc细胞的ecar 和ocr,而同时过表达glut1减弱了糖酵解速率和能力的下降(图4h-k)。
[0064]
接下来,我们评估了在过表达rbck1的hep3b细胞中,降低glut1表达对 rbck1和glut1蛋白水平以及细胞迁移和侵袭能力的影响。western blotting 分析显示,过表达rbck1显著增加了hep3b细胞中glut1的表达,而下调glut1 的表达显著抑制了rbck1诱导的glut1表达的增加(图4l)。此外,下调glut1 显著降低了rbck1增强介导的细胞迁移和侵袭
(图4m和n)。此外,体内转移实验结果显示,在hep3b p-rbck1组中,glut1下调降低了肝内和肺转移的发生率(图4o)。此外,研究rbck1是否通过glut1表达增加糖酵解,结果显示,下调glut1表达挽救了rbck1介导的hcc细胞中g6p、葡萄糖消耗、乳酸产生和 atp水平的增加(图4p)。同时,过表达rbck1增加了hcc细胞中的ecar和ocr,而同时敲低glut1抑制了糖酵解速率和容量的增加(图4q-t)。总的来说,这些发现表明glut1是rbck1调控有氧糖酵解的下游靶点,在rbck1介导的肿瘤进展中至关重要。
[0065]
5、rbck1通过wnt/β-catenin信号通路激活glut1
[0066]
为了进一步阐明rbck1在hcc中调控glut1的机制,我们进行了基因集富集分析(gene set enrichment analysis,gsea),以确定转录组变化对生物学功能和通路的影响。在hcclm3细胞中,wnt信号通路与rbck1显著正相关(图 5a)。由于glut1是wnt/β-catenin的靶基因,我们推测rbck1通过 wnt/β-catenin信号通路调控glut1。为了验证这一假设,我们检测了在rbck1 敲低的hcclm3细胞中β-catenin的表达变化。western blotting分析显示,在hcclm3细胞中,总体β-catenin蛋白和核内β-catenin表达水平随着 rbck1表达水平的降低而降低(图5b)。top-flash报告荧光素酶实验表明,与 shnc对照相比,敲低rbck1降低了hcclm3细胞中tcf4的转录活性(图5c)。相反,在hep3b细胞中过表达rbck1产生了相反的作用(图5d和e)。我们进一步确定,β-catenin上调回复了rbck1下调引起的glut1表达、细胞迁移和细胞侵袭的降低(图5f-i)。
[0067]
为了验证rbck1通过wnt/β-catenin信号通路调控glut1的表达,我们在wnt/β-catenin信号通路抑制剂xav-939的作用下检测了glut1和β-catenin的水平。xav-939始终抑制hcclm3细胞中glut1的mrna和蛋白水平(图5j和k)。transwell实验分析表明,xav-939显著降低细胞迁移和侵袭(图 5l)。xav-939导致肝癌细胞中g6p、葡萄糖消耗、乳酸产生和atp水平的降低 (图5m)。同时,xav-939抑制hcc细胞中的ecar(图5n)。此外,挽救实验表明,xav-939减弱了rbck1过表达引起的肝癌细胞转移能力增强和warburg效应(图5o-t)。总之,rbck1通过激活wnt/β-catenin信号通路,激活glut1 介导的warburg效应促进hcc细胞转移。
[0068]
6、rbck1通过破坏pparγ/pgc1α复合物激活肝癌细胞wnt/β-catenin 通路和warburg效应
[0069]
为了阐明rbck1在hcc细胞中调控wnt/β-catenin信号通路的机制,我们首先确定rbck1与β-catenin蛋白之间是否存在直接的相互作用。co-ip 表明两者之间不存在直接相互作用(图6a)。pparγ/pgc1α复合物抑制 wnt/β-catenin通路,并有助于葡萄糖稳态。因此,我们推测rbck1通过破坏 pparγ/pgc1α复合物调控wnt/β-catenin。为了验证这一假设,我们首先确定rbck1是否通过破坏pparγ/pgc1α复合物影响β-catenin/glut1通路的激活。在rbck1敲低的hcc细胞中检测β-catenin、glut1、pgc1α和pparγ表达的变化,以及pparγ/pgc1α复合物的变化。结果表明,在hcclm3细胞中,敲低rbck1显著增加了pparγ表达水平和pparγ/pgc1α复合物,降低了β-catenin和glut1表达,但pgc1α蛋白水平没有产生变化(图6b和c)。相反,在hep3b细胞中过表达rbck1显著降低pparγ蛋白表达水平和 pparγ/pgc1α复合物水平,增加了β-catenin和glut1表达,但pgc1α蛋白水平没有变化(图6d和e)。hcc细胞中pparγmrna水平仍然不受rbck1表达变化的影响(图6f)。pparγ/pgc1α复合物参与了rbck1介导的β-catenin/glut1通路的调控。
[0070]
验证rbck1调节β-catenin/glut1通路通过破坏pparγ/pgc1α复合物,在rbck1敲低的肝癌细胞中敲减pparγ,发现敲低了pparγ后,抑制了由敲低rbck1引起的β-catenin和glut1表达的下降,细胞迁移和有氧糖酵解 (图6g-i)。相反,pparγ的上调抑制了rbck1上调的hep3b细胞中β-catenin 和glut1表达的增加、细胞迁移和有氧糖酵解(图6j-m)。重要的是,免疫组化染色(图6n)显示,与相邻非肿瘤组织相比,hcc组织中rbck1、ki67、β-catenin、glut1和vimentin蛋白上调,而pparγ和pgc1α下调。这些结果表明,rbck1激活的β-catenin/glut1通路促进hcc细胞迁移和有氧糖酵解依赖于pparγ/pgc1α复合物的破坏。
[0071]
7、rbck1通过促进pparγ的泛素化和降解,破坏pparγ/pgc1α复合物
[0072]
rbck1与不同的底物相互作用发挥作用。我们进一步研究了rbck1、pparγ和pgc1α在hcc细胞中是否直接相互作用。co-ip分析检测到免疫沉淀中内源性的rbck1和pparγ,表明rbck1和pparγ之间存在相互作用,但rbck1和 pgc1α之间没有直接的相互作用(图7a和b)。此外,gst pull-down实验表明,在体外系统中rbck1与pparγ结合(图7c和d)。这些发现证实,在hcc细胞中,rbck1直接与pparγ结合,并且rbck1通过调节pparγ表达破坏pparγ/pgc1α复合物。
[0073]
接下来,我们探究了rbck1调控pgc1α的机制。与之前的研究结果一致的是,pparγ通过泛素-蛋白酶体途径降解,蛋白酶体抑制剂mg132的处理导致hcc细胞内源性pparγ蛋白显著积累(图7e和f)。此外,数据表明,有效的his-pparγ泛素化存在于e1、e2(ubch5c)、fbx09(pparγ的e3泛素连接酶)和ub中(图7g)。pparγ在hcc细胞中也被ups降解。下一步,我们确定rbck1是否能直接介导pparγ泛素化。有趣的是,pparγ多泛素化在异位 rbck1表达时显著增加,而在rbck1敲低时显著降低(图7h和i)。数据还显示 pparγ的所有lys位点的突变消除了其多泛素化(图7j)。正如预期的那样,泛素(ub)上lys48位点的突变几乎完全消除了rbck1介导的pparγ泛素化,而k63r突变没有产生影响(图7k)。与泛素化结果一致,降解动力学分析证实,与对照组细胞相比,外源表达pparγ在rbck1过表达的hcc细胞中的半衰期显著降低(图7l和m)。这些数据表明,rbck1介导pparγlys48多泛素化,从而导致pparγ被蛋白酶体降解。总之,这些结果表明,rbck1通过促进pparγ泛素化和降解,破坏pparγ/pgc1α复合物(图7n)。
[0074]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求的保护范围为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。