1.本发明涉及免疫检测的技术领域,更具体地说,它涉及一种全血检测胸苷激酶1的试剂盒及检测方法。
背景技术:
2.胸苷激酶1(thymidine kinase 1,tk1),又称为细胞质胸苷激酶,是首个血清学细胞增殖标志物。tk1与细胞增殖有密切关系:dna复制合成是新旧细胞保持一致性的关键,是细胞增殖的重要步骤,发生在细胞分裂的s期;细胞增殖以四种脱氧核苷酸作为原料,而tk1是其中dttp合成的关键酶,因此tk1可以监测细胞异常增殖的速度。
3.tk1的应用主要有两个方面,(1)体检应用:评估各类增殖类疾病恶变风险,处于过度增殖的增殖类疾病是肿瘤形成的第一步。基于tk1与细胞增殖的密切关系,能够灵敏地检查出tk1的浓度变化,从而发现恶性增殖风险,为肿瘤的预防提供增殖信息,适用于健康人群的肿瘤预防检测。(2)临床应用:ⅰ、评估放化疗效果:能够对各种实体肿瘤(例如:肺癌,胃癌,结肠癌,直肠癌,食道癌,乳腺癌,宫颈癌,前列腺癌等)以及白血病和淋巴癌患者的治疗效果进行评估,为治疗方案的改善提供参考;ⅱ、评估手术效果:通过比较肿瘤患者手术前后肿瘤细胞的增殖情况,为手术效果评价提供参考;ⅲ、评估肿瘤复发风险:对肿瘤患者手术及治疗恢复期的残留肿瘤细胞的增殖状态进行动态评估,较影像学更早发现复发转移风险。
4.目前,临床上检测tk1的常见方法有酶联免疫吸附法(elisa)、放射免疫分析法、酶促化学方法等。酶联免疫法通常依靠手工操作,耗费人力和时间,且其检测的灵敏度和线性范围也较低,适用于实验室分析,在临床的检测应用上具有一定的局限性,远不能满足临床需求。
5.申请号为cn 2019105790521的发明专利公开了一种胸苷激酶化学发光法检测试剂盒及其制备方法(待检物为血清或血浆,非全血),其基于双抗体夹心化学发光法对人血清中的tk1含量进行检测。该检测方法的第一步即为制备抗体包被载体,将抗tk1抗体负载于微孔板上,随后进行其他的制备和检测步骤。
6.申请号为cn 2019113325095的发明专利公开了一种胸苷激酶1磁微粒化学发光测定试剂盒及其制备方法,该申请采用的是磁微粒化学发光法进行人血中tk1含量的测定。该方法是在试剂a中,将tk1抗体包被于磁微粒上,与样品中的tk1进行反应并形成tk1-tk1抗体包被的磁微粒复合物;同时试剂b为碱性磷酸酶标记的tk1单抗酶结合物;试剂a和试剂b混合后,碱性磷酸酶标记的tk1单抗酶结合物与tk1-tk1抗体包被的磁微粒复合物反应,形成tk1抗体包被的磁微粒-tk1-碱性磷酸酶标记的tk1单抗复合物,在加入发光底物后发光,通过测定产生的化学发光信号得到样品中tk1的含量。该申请方法的线性范围为:0.2-50pmol/ml。
7.采用上述的方法进行人血中tk1含量的测定时,对检测样本的要求较高,需要对采取得到的人全血进行离心处理之后得到血清样本后进行检测,那么在将上述的检测试剂盒
和方法用于医学检测时,从获得人全血样本后,其检测时间过长,使得人血中tk1含量的检测效率较低;除此以外,制备上述的检测试剂盒时,往往需要加入抗体包被板和磁微粒及其他抗体载体,以便包被抗体,并在检测过程中需要进行载体的清洗,这些步骤均使得检测过程步骤繁杂、操作低效。
技术实现要素:
8.针对现有技术存在的不足,本技术第一个目的在于提供一种全血检测胸苷激酶1的试剂盒,本技术的第二个目的在于提供一种全血检测胸苷激酶1的检测方法。采用本技术的试剂盒进行人全血样本中胸苷激酶1的检测时,以磁分离技术替代离心操作,以将人全血样本中的红细胞去除,缩短了每个样本的检测时间;其次,采用现有技术进行tk1含量检测时,通常利用包被载体(如包被板或者磁珠)携带tk1至固相,并检测固相中的tk1,检测对象是固相;而本技术则利用磁珠携带红细胞至液相以与tk1分离,将tk1留在液相中,并对液相中tk1进行检测,检测对象是液相,本技术的纯液相检测方法,具有快速检测人血中tk1含量且检测灵敏度高的优点。
9.为实现上述第一个目的,本发明提供了如下技术方案:一种全血检测胸苷激酶1的试剂盒,包括生理盐水、用于结合人全血样本中红细胞的r1试剂、使得人全血样本中的tk1具有hrp标记的r2试剂以及使得人全血样本中的tk1具有acridan标记的r3试剂;其中,所述r1试剂包括能够与人全血中的红细胞特异性结合的抗红细胞抗体以及能够结合抗红细胞抗体的磁分离试剂;所述r2试剂包括能够与人全血中的tk1特异性结合的hrp标记的tk1单抗;r3试剂包括能够与人全血中的tk1特异性结合的acridan标记的tk1单抗。
10.通过采用上述技术方案,在使用本技术的试剂盒时,直接用人全血样本进行检测即可。用r1试剂中的磁分离试剂结合抗红细胞抗体,随后抗红细胞抗体和人全血中的红细胞特异性结合,形成磁分离试剂-抗红细胞抗体-红细胞复合物,便于后期通过磁分离处理将人全血中的红细胞高效完全地去除。通过r2试剂和r3试剂的组合使用,将二者和人全血样本混合后,能够形成hrp-tk1-acridan复合物,hrp-tk1-acridan复合物在激发剂和隔离剂的作用下产生剧烈的发光反应,实现最终的检测。其中r2试剂中的hrp标记的tk1单抗和人全血样本中的tk1进行特异性结合,r3试剂中的acridan标记的tk1单抗和人全血样本中的tk1的其他结合位点进行特异性结合。
11.进一步地,所述磁分离试剂的制备方法包括:将粒径为2-4um的羧基磁珠,经缓冲液清洗,随后利用edc试剂活化,接着进行稀释,即得到磁分离试剂。
12.通过采用上述技术方案,于羧基磁珠内加入edc试剂后,羧基磁珠上的羧基被活化,使得羧基磁珠上具有活化的能够非特异性结合蛋白质或者氨基酸的结合位点,以便在后期实现将蛋白质负载于羧基磁珠上的目的。而且本技术的羧基磁珠的粒径仅为2-4um,盛放在容器内的羧基磁珠为类似于流体的状态,且能够负载较多的蛋白质或者氨基酸。
13.进一步地,所述r1试剂的制备方法包括以下步骤:s1-1、于所述磁分离试剂中加入所述抗红细胞抗体,单位体积的所述羧基磁珠中所述抗红细胞抗体的加入量为6-10mg/ml,充分混匀后反应28-32min,使得所述抗红细胞抗体和所述羧基磁珠交联,得到羧基磁珠-抗红细胞抗体交联溶液;s1-2、于所述羧基磁珠-抗红细胞抗体交联溶液中加入甘氨酸溶液,将所述羧基磁
珠上未反应的活化氨基酸位点完全反应,随后经磁吸附处理,于固相得到交联后的羧基磁珠-抗红细胞抗体复合物;s1-3、用缓冲液2对所述羧基磁珠-抗红细胞抗体进行清洗后,于固相内加入所述缓冲液2,即得到所述r1试剂,其中所述r1试剂中所述抗红细胞抗体的浓度为1.1-1.5mg/l。
14.通过采用上述技术方案,首先磁分离试剂中的羧基磁珠已经被活化,使得羧基磁珠具有结合抗红细胞抗体的能力,进而实现羧基磁珠和抗红细胞抗体的非特异性结合。但此时,羧基磁珠上活化氨基酸位点并未全部负载有抗红细胞抗体,因此加入过量的甘氨酸,使得羧基磁珠上的活化氨基酸位点均负载有蛋白质或者氨基酸,进而使得形成的氨基酸-羧基磁珠-蛋白质复合物的稳定性更好。步骤s1-3中缓冲液2的清洗操作,主要是为了将氨基酸-羧基磁珠-蛋白质复合物上黏附的例如甘氨酸溶液等杂质洗去,避免这些杂质对后续的反应带来干扰。步骤s1-3中缓冲液2的再次加入,其目的在于进一步提高羧基磁珠-抗红细胞抗体复合物的稳定性;而羧基磁珠和抗红细胞抗体的稳定交联,有利于全面去除人全血样本中的红细胞。
15.进一步地,所述hrp标记的tk1单抗的制备方法包括以下步骤:s2-1、取摩尔比为1:(1.3-1.6)的tk1抗体和hrp分别做脱盐处理后,将分别含有两种蛋白质的溶液混合并浓缩,得到tk1抗体-hrp浓缩液;s2-2、于所述tk1抗体-hrp浓缩液里加入bs3试剂,并在水浴环境下反应,使得tk1抗体和hrp交联,得到含有tk1抗体-hrp复合物的交联液1;所述bs3试剂和tk1抗体的质量比为(0.3-0.5):1;s2-3、于所述交联液1中加入甘氨酸溶液,使得未反应的活化氨基酸位点完全反应;s2-4、对步骤s2-3最终获得的溶液进行蛋白纯化,收集含有纯化后的tk1抗体-hrp复合物的纯化液1并浓缩,使得溶液中tk1抗体-hrp复合物的浓度为0.6-1.0mg/ml,即得hrp标记的tk1单抗。
16.通过采用上述技术方案,首先使用bs3试剂将tk1抗体和hrp交联,实现tk1的hrp标记;随后将hrp标记的tk1单抗脱盐纯化,得到纯化后的hrp标记的tk1单抗。最后将纯化后的hrp标记的tk1单抗溶液进行浓缩,使得hrp标记的tk1单抗的稳定性更佳,其原因在于:蛋白纯化后得到的是tk1抗体-hrp复合物,当蛋白质存在溶液中时,蛋白质的浓度越大,蛋白质的稳定性越高,因此,将纯化后的hrp标记的tk1单抗溶液进行浓缩,使得纯化液中的蛋白质浓度变大,tk1抗体-hrp复合物的稳定性更高。
17.进一步地,所述r2试剂的制备方法包括以下步骤:于所述hrp标记的tk1单抗中加入缓冲液3,使得所述hrp标记的tk1单抗的浓度为0.015-0.025mg/l,最终得到的溶液即为所述r2试剂。
18.通过采用上述技术方案,采用缓冲液3将hrp标记的tk1单抗封闭,使得hrp和tk1单抗的交联更稳定。在上述的原料用量下,hrp标记的tk1单抗易于与待检样本中的tk1结合。
19.进一步地,所述acridan试剂标记的tk1单抗的制备方法包括以下步骤:s3-1、取tk1抗体进行脱盐处理,得到脱盐处理的tk1抗体溶液;s3-2、将所述脱盐处理的tk1抗体溶液浓缩后,加入交联剂acridan试剂,得到tk1抗体-acridan交联液;所述acridan试剂和tk1抗体的质量比为(0.15-0.25):1;
s3-3、于所述tk1抗体-acridan交联液中加入甘氨酸溶液,使得未反应的活化氨基酸位点完全反应;s3-4、将步骤s3-3最终得到的溶液进行脱盐处理后,即得到acridan标记的tk1单抗溶液,其中,acridan标记的tk1单抗浓度为0.9-1.0mg/ml。
20.进一步地,所述r3试剂的制备方法包括以下步骤:于所述acridan标记的tk1单抗中加入缓冲液4,使得acridan标记的tk1单抗的浓度为0.015-0.025mg/l,最终得到的溶液即为得到r3试剂。
21.通过采用上述技术方案,首先使用acridan试剂标记tk1抗体,实现tk1的acridan标记;随后对acridan标记的tk1单抗进行脱盐纯化,得到acridan标记的tk1单抗;最后用缓冲液4将acridan标记的tk1单抗封闭,进一步稳定acridan和tk1抗体之间的交联效果。在上述的原料用量下,交联后其交联稳定性较佳;除此以外,得到的acridan标记的tk1单抗易于与待检样本中的tk1结合。
22.为实现上述第二个目的,本发明提供了如下技术方案:一种采用上述的全血检测胸苷激酶1的试剂盒检测全血检测胸苷激酶1的方法,所述方法包括以下步骤:ⅰ、取人全血样本,随后于人全血样本中加入所述生理盐水和所述r1试剂,在反应时间大于3min后,进行磁分离处理,收集液相;ⅱ、于所述液相中加入所述r2试剂和所述r3试剂,在35-37℃的条件下孵育12-17min后,得到hrp-tk1抗体-acridan交联液;ⅲ、于所述hrp-tk1抗体-acridan交联液中加入激发液和隔离剂后,测定发光值即可。
23.通过采用上述技术方案,本技术提供的是基于夹心法化学发光免疫分析法与邻近化学发光技术相结合的原理,实现人全血中tk1含量检测的一种新方法。在本技术的方法中,首先在检测样本的选择上,选用的是人全血,未对人全血进行离心处理,省去了离心步骤(通常离心步骤的时间需要15-30min),进而缩短了每个样品的检测时间,由此,本技术的试剂盒和方法在医学检测应用上,具有较好的应用前景。在本技术的检测方法中,生理盐水的加入使得人全血样本中的红细胞维持正常的渗透压,避免因红细胞破裂后,其内容物释放到外部溶液中,影响后续的反应和检测。在该方法中,磁分离试剂和抗红细胞抗体先行交联,交联产物在接触人血样本时,人血样本中的红细胞通过抗原-抗体间的特异性结合,与交联产物形成磁分离试剂-抗红细胞抗体-红细胞复合物(即为固相)。在磁吸附的作用下,磁分离试剂-抗红细胞抗体-红细胞复合物与人血样本进行固液分离,摒弃固相,留有液相(液相中含有待检测的tk1)以进行后面的处理过程。该脱除人全血中红细胞的磁分离方式与现有技术的离心方式相比,首先花费的时间较短,其次,红细胞的脱除是基于抗原抗体的靶向性特异性结合以及磁分离原理来实现的,使得红细胞的脱除效率更高。
24.在待检测样本中加入定量的hrp标记的tk1单抗、acridan标记的tk1单抗,孵育后,hrp标记的tk1单抗和acridan标记的tk1单抗分别与tk1抗原上的不同结合位点进行结合,形成“三明治”结构。在这个结构中,acridan与hrp在空间位置上逐渐靠近;在加入激发液和隔离剂后能够产生剧烈的发光反应,即为临近化学发光。随后根据标准曲线即可算出样品中的tk1含量。在检测范围内,发光强度与样本中的tk1浓度成正比。
25.本技术的方法首先采用的是人全血样本进行检测,免去人全血离心过程,样品的
预处理步骤简单,且总检测时间短;其次,本技术的检测方法是基于液-液相反应进行的检测,和现有的固-液相(固相指包被载体,包被载体包括包被板、磁性微球等能够负载蛋白质的固相物质)反应的检测体系相比,本技术的检测方法的灵敏度更优,尤其是针对于低浓度tk1的检测,具有反应更快、更彻底的优势;在低浓度范围内的tk1检测,其灵敏度优于传统的检测方法。
26.综上所述,本发明具有以下有益效果:1.本技术提出了一种新的方法学,本技术的方法学基于磁分离技术、夹心法化学发光免疫分析法与邻近化学发光技术的技术原理,实现了对人全血样本中tk1含量的检测。
27.2.由于本技术的方法采用的是人全血样本进行检测,不包含针对人全血的离心处理过程,针对一个样本,其检测时间短于22min,具有总检测时间短的优势;其次,本技术的检测方法中,在将红细胞去除后,后续的反应均为液-液相反应,检测方法的灵敏度不大于1pmol/l,优于现有的固液相反应;同时,对于低浓度范围(0-2pmol/l)内的tk1检测,本技术方法的符合率较高(r2≥0.95),优于现有技术。
28.3.本发明通过采用磁分离技术并引入抗原-抗体的特异性结合,能够快速有效地将人全血中的红细胞去除,操作高效。
具体实施方式
29.本技术中以下原料为购买获得:其中,羧基磁珠的粒径为3um,购自merck。mes缓冲液的配置:将1.952g的mes溶于80ml的纯水中,调节ph为6.0,用纯水定容到100ml即可。抗红细胞抗体的来源为holmes。edc试剂购自sigma。配置tris缓冲液的试剂中,其中,tween-20购自sigma;bsa-v(牛血清白蛋白,不含脂肪酸)购自roche。
30.tk1抗体为市售,可购自abnova;tk1标准品为普通市售。辣根过氧化物酶(horseradish peroxidase,hrp)购自sigma;pd-10纯化柱购自ge。bs3试剂购自sigma;bio-rad蛋白纯化仪的lp系统购自美国伯乐bio-rad,其为液相色谱,设备型号为:biologic lp。羊血清购自四季青,小鼠血清购自春雷杰创。
31.acridan试剂的主要成分为9,10-二氢吖啶,购自lumigen;激发液、隔离剂购自lumigen。底物液为aps-5(即:9-(4
’‑
氯苯硫代磷酰氧亚甲基)-10-甲基-9,10-二氢化吖啶二钠盐),购自于lumigen。人血清样本来自北京市顺义区医院,碱性磷酸酶购自sigma-aldrich。
32.磁分离试剂的制备本技术的磁分离试剂的制备方法包括以下步骤:取羧基磁珠,用缓冲液1多次清洗后备用;随后加入edc试剂,使得羧基磁珠被活化,混合均匀后备用;将上述溶液用缓冲液1清洗,即得到磁分离试剂。
33.其中,羧基磁珠的尺寸可以是2-5um,例如可以是3um,4um。由于羧基磁珠的粒径较小,所以将羧基磁珠置于容器内时,为流体形态,因此在本技术的表述中,相关溶液的用量以羧基磁珠的体积计。
34.缓冲液1为酸性缓冲液,可以是ph6.0的mes缓冲液。
35.以单体体积的羧基磁珠计,每次清洗羧基磁珠时缓冲液1的用量为30-50ml,例如
缓冲液1的用量为35ml、40ml、45ml;用缓冲液1清洗羧基磁珠的操作可以进行多次,例如清洗2-4次。
36.单位体积的羧基磁珠内edc的加入量为4.5-6mg/ml,例如5mg/ml,5.5mg/ml。
37.r1试剂的制备r1试剂的制备方法,包括以下步骤:s1-1、于磁分离试剂中加入抗红细胞抗体,以单位体积的羧基磁珠计,抗红细胞抗体的加入量为6-10mg/ml,充分混匀后反应28-32min,使得所述抗红细胞抗体和所述磁分离试剂交联,得到羧基磁珠-抗红细胞抗体交联溶液;s1-2、于所述羧基磁珠-抗红细胞抗体交联溶液中加入用于结合未反应的活化氨基酸位点的甘氨酸溶液后,于室温反应4.5-8min,得到交联后的羧基磁珠-抗红细胞抗体;s1-3、用缓冲液2清洗步骤s1-2最终获得的交联后的羧基磁珠-抗红细胞抗体,随后加入缓冲液2进行溶液的稀释,使得抗红细胞抗体的浓度为1.1-1.5mg/l,即得到r1试剂。
38.其中,步骤s1-1中,单位体积的羧基磁珠中抗红细胞抗体的加入量可以为6-10mg/ml,例如7mg/ml、8mg/ml、9mg/ml;充分混匀后的反应时间可以为28-32min,如29min,30min,31min。步骤s1-2中,甘氨酸溶液的浓度和用量不做限制,只要达到于未反应的活化氨基酸位点上完全结合氨基酸的目的即可;进一步地,甘氨酸溶液的浓度可以为1m、2m、3m;选择1m甘氨酸溶液时,甘氨酸溶液与羧基磁珠-抗红细胞抗体交联溶液的体积比可以为(90-110):1000,例如100:1000;加入甘氨酸溶液后,反应时间至少为4.5min,可以选择为4.5-8min,例如5min,6min,7min。
39.hrp标记的tk1单抗的制备hrp标记的tk1单抗的制备方法,包括以下步骤:s2-1、取tk1抗体和hrp,分别加入缓冲液5后进行脱盐处理,得到tk1抗体溶液和hrp溶液,其中,tk1抗体和hrp的摩尔比为1:(1.3-1.6);s2-2、将tk1抗体溶液和hrp溶液混合到一起并浓缩,得到tk1抗体-hrp浓缩液,tk1抗体-hrp浓缩液中tk1抗体的浓度为0.9-1.1mg/ml;s2-3、于步骤s2-2中得到的tk1抗体-hrp浓缩液里加入bs3试剂,充分混匀并在35-37℃的水浴条件下反应1.7-2.3h,使得tk1抗体和hrp交联,得到含有tk1抗体-hrp复合物的交联液1;其中,bs3试剂和tk1抗体的质量比为(0.3-0.5):1;s2-4、于步骤s2-3获得的tk1抗体-hrp交联液中加入甘氨酸溶液,用于结合未反应的活化氨基酸位点,随后在室温条件下至少反应20min;s2-5、对步骤s2-4最终获得的溶液进行蛋白纯化后,收集含有纯化后tk1抗体-hrp复合物的溶液,浓缩溶液中tk1抗体-hrp复合物的浓度为0.6-1.0mg/ml,即得hrp标记的tk1单抗。
40.其中,步骤s2-1中,缓冲液5为碱性缓冲液,可以为ph7.2的pb磷酸盐缓冲液;tk1抗体和hrp的摩尔比可以为1:(1.3-1.6),例如1:1.4,1:1.5。步骤s2-2中,tk1抗体-hrp浓缩液中tk1抗体的浓度可以为0.9-1.1mg/ml,例如0.95mg/ml,1.0mg/ml。步骤s2-3中,水浴的时间可以为1.7-2.3h,例如1.8h,1.9h,2.0h,2.1h,2.2h;bs3试剂和tk1抗体的质量比可以为(0.3-0.5):1,例如0.4:1。步骤s2-4中,甘氨酸溶液的浓度和用量不做限制,只要达到将未反应的活化氨基酸位点全部结合有氨基酸的目的即可;进一步地,甘氨酸溶液的浓度可以
为1m、2m、3m;选择1m甘氨酸溶液时,甘氨酸溶液与交联液1的体积比可以为(90-110):1000,例如100:1000;加入甘氨酸溶液后,反应时间至少为20min,可以选择为20-25min,25-35min,例如22min,24min,26min,28min。步骤s2-5中,浓缩溶液中tk1抗体-hrp复合物的浓度可以为0.6-1.0mg/ml,例如0.7mg/ml,0.8mg/ml,0.9mg/ml。
41.r2试剂的制备r2试剂的制备包括以下步骤:于制备得到的hrp标记的tk1单抗(即上述制备得到的含有0.6-1.0mg/ml的tk1抗体-hrp复合物的浓缩溶液)中加入缓冲液3,使得hrp标记的tk1单抗的浓度为0.015-0.025mg/l,最终得到的溶液即为r2试剂。
42.其中,hrp标记的tk1单抗的浓度可以为0.015-0.025mg/l,例如0.017mg/l,0.019mg/l,0.021mg/l,0.023mg/l。
43.acridan试剂标记的tk1单抗acridan试剂标记的tk1单抗的制备方法包括以下步骤:s3-1、取tk1抗体,用缓冲液6冲洗后做脱盐处理并浓缩,得到tk1抗体浓缩液,且tk1抗体浓缩液中tk1抗体浓度为0.9-1.1mg/ml;s3-2、于tk1抗体浓缩液中加入acridan试剂,充分混匀后在35-37℃的水浴条件下至少反应0.8h,得到含有tk1抗体-acridan复合物的交联液2;其中,acridan试剂和tk1抗体的质量比为(0.15-0.25):1;s3-3、于交联液2中加入甘氨酸溶液,用于结合未反应的活化氨基酸位点,随后在室温条件下反应17-23min;s3-4、将步骤s3-3最终得到的溶液进行脱盐处理,即得到acridan试剂标记的tk1单抗;其中,acridan标记的tk1单抗浓度为0.9-1.0mg/ml。
44.其中,步骤s3-1中,缓冲液6为碱性缓冲液即可,例如可以为ph7.2的pb磷酸盐缓冲液;tk1抗体浓缩液中tk1抗体浓度可以为0.9-1.1mg/ml,例如0.95mg/ml,1.0mg/ml。步骤s3-2中,acridan试剂和tk1抗体的质量比可以为(0.15-0.25):1,例如0.15:1,0.17:1,0.19:1,0.21:1;水浴时间至少为0.8h,可以为0.8-1.2h,例如0.9h,1.0h,1.1h。步骤s3-3中,甘氨酸溶液的浓度和用量不做限制,只要达到将未反应的活化氨基酸位点全部结合有氨基酸的目的即可;进一步地,甘氨酸溶液的浓度可以为1m、2m、3m;选择1m甘氨酸溶液时,甘氨酸溶液与交联液2的体积比可以为(90-110):1000,例如100:1000;加入甘氨酸溶液后,反应时间至少为20min,可以选择为20-25min,25-35min,例如22min,24min,26min,28min。
45.r3试剂的制备r3试剂的制备方法包括以下步骤:于上述制备得到的acridan标记的tk1单抗(即上述制备得到的含有0.9-1.0mg/ml的acridan标记的tk1单抗的溶液)中加入缓冲液4,使得acridan标记的tk1单抗的浓度为0.015-0.025mg/l,即为r3试剂。
46.其中,acridan标记的tk1单抗的浓度可以为0.015-0.025mg/l,例如0.017mg/l,0.019mg/l,0.021mg/l,0.023mg/l。
47.一种全血检测胸苷激酶1的化学发光免疫检测方法一种全血检测胸苷激酶1的化学发光免疫检测方法,包括以下步骤:ⅰ、取人全血样本加入到洁净的样本杯中,随后加入生理盐水和r1试剂,反应大于3min后,至少进行2min的磁分离处理,然后弃去固相,得到磁分离溶液;其中,生理盐水的加
入只要能够维持人全血样本的渗透压即可,r1试剂和人全血样本的体积比为(1-11):10;ⅱ、随后取磁分离溶液于洁净的反应杯中;在反应杯中加入r2试剂和r3试剂,随后在水浴条件下至少孵育15min后,得到hrp-tk1抗体-acridan试剂交联液,hrp-tk1抗体-acridan试剂交联液中含有hrp-tk1抗体-acridan复合物;其中,r2试剂和磁分离溶液的体积比为(9-15):6,r3试剂和磁分离溶液的体积比为(9-15):6;ⅲ、于hrp-tk1抗体-acridan试剂交联液中加入的激发液和的隔离剂后,在25-30s后测定发光值;其中,激发液和磁分离溶液的体积比为(9-15):6,隔离剂和磁分离溶液的体积比为(9-15):6。
48.其中,步骤ⅰ中,于人全血样本中加入生理盐水和r1试剂后,反应时间至少为3min,主要使得人全血样本中的红细胞维持正常的渗透压,反应时间可以为3-5min,可以为5-10min;随后的磁分离处理时间至少为2min,可以为2-5min;r1试剂和人全血样本的体积比可以为(1-11):10,可以为(3-9):10,可以为(5-7):10,例如2:10,4:10,6:10,8:10,10:10。
49.步骤ⅱ中,在反应杯中加入r2试剂和r3试剂后,水浴时间至少为15min,可以为15-20min,20-25min,例如18min,23min,28min;r2试剂和磁分离溶液的体积比可以为(9-15):6,可以为(11-13):6,例如10:6,12:6;r3试剂和磁分离溶液的体积比可以为(9-15):6,可以为(11-13):6,例如10:6,12:6。
50.步骤ⅲ中,激发液和磁分离溶液的体积比可以为(9-15):6,可以为(11-13):6,例如10:6,12:6;隔离剂和磁分离溶液的体积比可以为(9-15):6,可以为(11-13):6,例如10:6,12:6。
51.制备例磁分离试剂的制备例磁分离试剂的制备方法,具体包括以下步骤:取50ul的羧基磁珠,用缓冲液1清洗,本制备中选择的缓冲液为ph6.0的mes缓冲液,将羧基磁珠清洗3次,每次mes缓冲液的加入量为2ml,弃去清洗液后留有羧基磁珠备用。称取5mg的edc试剂,加入到1ml的ph6.0的mes溶液中,得到edc试剂-mes溶液,edc试剂-mes溶液中edc的含量为5mg/ml,混合均匀后备用。
52.将上述获得的edc试剂-mes溶液全部加入到上述备用的羧基磁珠中,使得羧基磁珠被活化,得到的最终溶液为磁分离试剂。该活化过程使得羧基磁珠上具有结合氨基酸的活化氨基酸位点,以便在后期结合相关的氨基酸或蛋白质。
53.r1试剂的制备例r1试剂的制备方法,即为磁珠标记的抗红细胞抗体的制备方法,具体包括以下步骤:s1-1、于制备例1中得到的磁分离试剂中加入0.4mg的抗红细胞抗体,充分混匀后反应30min,由于活化的羧基磁珠上具有结合氨基酸的活化氨基酸位点,因此抗红细胞抗体能够和羧基磁珠上的活化氨基酸位点非特异性结合,即完成抗红细胞抗体和羧基磁珠的交联,得到羧基磁珠-抗红细胞抗体交联溶液。
54.s1-2、于步骤s1-1最终获得的羧基磁珠-抗红细胞抗体交联溶液中加入甘氨酸溶液,用于结合羧基磁珠上未结合到抗红细胞抗体的活化氨基酸位点。然后留下羧基磁珠(该羧基磁珠上交联有抗红细胞抗体),弃去液相。其中,本制备例中添加的是100ul的1m甘氨酸
溶液,随后于室温反应5min,步骤s4-1和步骤s4-2实现了羧基磁珠和抗红细胞抗体的稳固交联。
55.s1-3、用缓冲液2清洗步骤s1-2最终获得的羧基磁珠(该羧基磁珠上交联有抗红细胞抗体),清洗3次,每次清洗的缓冲液用量为2ml。然后通过磁分离处理后留有羧基磁珠,弃去清洗液;此处的羧基磁珠上交联有抗红细胞抗体。最后于羧基磁珠内加入20ml的缓冲液2。缓冲液2的加入主要实现了羧基磁珠和抗红细胞抗体在交联后的封闭及保存。本制备例中选择的缓冲液2,是将tris、nacl、nan3、tween-20以及bsa-v分别加入纯水中,即得到缓冲液2;使得溶液为ph 8.0的含有0.01m tris,0.2m nacl,0.005m nan3,0.01%(w/w)tween-20和0.1%(w/w)bsa-v的溶液。
56.s1-4、于步骤s1-3最终获得的溶液中加入缓冲液2以将其稀释,使得稀释液中抗红细胞抗体的浓度为1.3mg/l,即得到r1试剂。
57.hrp标记的tk1单抗的制备例hrp标记的tk1单抗的制备方法,包括以下步骤:s2-1、取1mg的tk1抗体和1.5mg的hrp,分别用缓冲液5冲洗后进行脱盐处理,本实施例的缓冲液5选择为ph7.2的pb磷酸盐缓冲液,本制备例中以下步骤里提到的pb磷酸盐缓冲液均为ph7.2的pb磷酸盐缓冲液。
58.(i)获得脱盐处理的tk1抗体溶液:将1mg的tk1抗体加入0.2ml的pb磷酸盐缓冲液中,混匀;采用pd-10纯化柱进行tk1抗体的脱盐处理,具体按照以下步骤进行:上样:在pd-10纯化柱的柱子平衡后,取0.2ml的溶解有tk1抗体的pb磷酸盐缓冲液加到一次性pd-10纯化柱的柱子顶上,行脱盐纯化;洗脱:样品全部进入pd-10纯化柱内后,自柱顶加入2.3ml的pb磷酸盐缓冲液,待缓冲液全部进入纯化柱后再加入2.5ml的pb磷酸盐缓冲液洗脱得到脱盐处理的tk1抗体溶液。
59.(ii)获得脱盐处理的hrp溶液:将1.5mg的hrp加入0.2ml的pb磷酸盐缓冲液中,混匀;采用pd-10纯化柱进行hrp的脱盐处理,具体按照以下步骤进行:上样:在pd-10纯化柱的柱子平衡后,取0.2ml的溶解有hrp的pb磷酸盐缓冲液加到一次性pd-10纯化柱的柱子顶上,行脱盐纯化;洗脱:样品全部进入pd-10纯化柱内后,自柱顶加入2.3ml的pb磷酸盐缓冲液,待缓冲液全部进入纯化柱后再加入2.5ml的pb磷酸盐缓冲液洗脱得到脱盐处理的hrp溶液。
60.上述的步骤(i)和(ii)的脱盐处理分别实现了tk1的脱盐纯化和hrp的脱盐纯化。
61.s2-2、将经过脱盐处理的tk1抗体溶液和脱盐处理的hrp溶液混合到一起并采用ge的10k的离心浓缩管进行离心浓缩,使得最终溶液的体积浓缩到1ml,得到tk1抗体-hrp浓缩液,tk1抗体-hrp浓缩液中tk1抗体的浓度为1mg/ml。
62.s2-3、于通过步骤s2-2得到的tk1抗体-hrp浓缩液中加入0.4mg的交联剂bs3试剂,充分混匀,并在37℃的水浴条件下反应2h,使得tk1抗体和hrp交联,得到含有tk1抗体-hrp复合物的交联液1,交联液1的体积为1ml。
63.s2-4、于步骤s2-3中获得的交联液1中加入100ul的1m甘氨酸溶液,用于结合hrp上未结合有tk1抗体的活化氨基酸位点,在室温条件下反应20min,用于结合未反应的活化氨
基酸位点的。
64.s2-5、使用bio-rad蛋白纯化仪的lp系统进行蛋白纯化,纯化柱为ge的superdex200pg。上样前将步骤s2-4的溶液浓缩到500ul以内,本制备例将步骤s2-4的溶液浓缩至450ul。
65.s2-6、纯化仪流速设置为1ml/min,收集40-65min之间的纯化峰对应的蛋白质溶液,混匀后浓缩至1ml以下,本实施例浓缩至0.9ml,通过紫外分光光度计测得浓缩液中hrp标记的tk1单抗的浓度为0.87mg/ml。随后加入0.9ml的甘油,充分混匀后放于-20℃冰箱中冷冻备用。
66.以上步骤s3-1~s3-5,即制备得到hrp标记的tk1单抗,hrp标记的tk1单抗以溶解于液体的状态保存。
67.r2试剂的制备例r2试剂的制备方法,包括以下步骤:于上述制备得到的含有hrp标记的tk1单抗的溶液内加入缓冲液3,以将上述步骤s2-6最终得到的溶液稀释,使得hrp标记的tk1单抗的浓度为0.02mg/l,此稀释后的溶液即为r2试剂。本制备例中的缓冲液3是将ph8.0的tris、nacl、青霉素、羊血清和小鼠血清分别加入至纯水中,配置得到0.01m tris,0.015m nacl,0.001m青霉素,0.1%羊血清和0.01%小鼠血清的溶液。缓冲液3的加入主要实现了交联后hrp标记的tk1单抗封闭和稳定。
68.acridan标记的tk1单抗的制备例acridan标记的tk1单抗的制备方法,包括以下步骤:s3-1、取1mg的tk1抗体,加入缓冲液6之后做脱盐处理,使用的纯化柱是一次性pd-10纯化柱。其具体的纯化步骤同r2试剂的制备例中的步骤s2-1(i),最终得到脱盐处理的tk1抗体溶液。本制备例中缓冲液6选用ph7.2的pb磷酸盐缓冲液。
69.将上述最终得到的脱盐处理的tk1抗体溶液浓缩到1ml左右,本制备例浓缩至0.9ml,得到tk1抗体浓缩液,且tk1抗体浓缩液中tk1抗体浓度为0.9mg/ml。当溶液中tk1抗体的浓度较大时,tk1抗体的稳定性更高。
70.s3-2、于通过步骤s3-1得到的tk1抗体浓缩液内加入0.2mg的acridan试剂,充分混匀后在37℃的水浴条件下反应1h,使得tk1抗体和acridan试剂交联,得到acridan试剂-tk1抗体交联液,acridan试剂-tk1抗体交联液内含有acridan试剂标记的tk1抗体。同时,acridan试剂-tk1抗体交联液中可能含有还未完全结合有tk1抗体的acridan试剂,这部分acridan试剂上存在未反应的活化氨基酸位点,会影响acridan试剂-tk1抗体的交联稳定性,此未反应的活化氨基酸位点在以下步骤中进一步处理。
71.s3-3、于步骤s3-2中最终得到的acridan试剂-tk1抗体交联液中加入100ul的1m甘氨酸溶液,在室温条件下反应20min,使得步骤s3-3中acridan试剂上的未反应的活化氨基酸位点,全部结合有甘氨酸。
72.s3-4、将步骤s3-3最终得到的反应液,使用pd-10纯化柱进行脱盐处理,获得脱盐处理的acridan标记的tk1单抗溶液的具体步骤为:上样:在柱子平衡后,将步骤s3-3最终得到的反应液取0.6ml加到一次性pd-10纯化柱的柱子顶上,行脱盐纯化;洗脱:样品全部进入pd-10纯化柱内后,自柱顶加入1.9ml的pb磷酸盐缓冲液,待pb
磷酸盐缓冲液全部进入纯化柱后再加入2.5ml的pb磷酸盐缓冲液洗脱得到脱盐处理的acridan标记的tk1单抗溶液。
73.收集1ml经脱盐处理的acridan标记的tk1单抗溶液,通过紫外分光光度计测得acridan标记的tk1单抗的浓度为0.9mg/ml,同时加入0.9ml的甘油,充分混匀后放于-20℃的冰箱冷冻备用。
74.以上步骤s3-1~s3-5,即制备得到acridan标记的tk1单抗。acridan标记的tk1单抗以溶解于液体的状态保存。
75.r3试剂的制备例r3试剂的制备方法,包括以下步骤:与上述制备得到的含有acridan标记的tk1单抗的溶液中加入缓冲液4,将上述步骤s3-5最终得到的溶液稀释,使得acridan标记的tk1单抗的浓度为0.02mg/l,此稀释后的溶液即为r3试剂。本制备例中的缓冲液4是用tris、nacl、青霉素、羊血清和小鼠血清分别加入至纯水中,配置得到ph8.0的0.01m tris,0.015m nacl,0.001m青霉素,0.1%羊血清,0.01%小鼠血清的溶液。缓冲液4的加入主要实现了在acridan试剂和tk1抗体交联后的封闭和稳定。
76.碱性磷酸酶标记的tk1单抗的制备例本制备例与hrp标记的tk1单抗的制备例的区别在于,本制备例以等量的碱性磷酸酶替换hrp标记的tk1单抗的制备例中的hrp,其它同hrp标记的tk1单抗的制备例的操作。
77.磁珠标记的tk1单抗的制备例本制备例与磁分离试剂的制备例的区别在于,本制备例以等量的tk1单抗替换磁分离试剂的制备例中的抗红细胞抗体,其它同磁分离试剂的制备例的操作。实施例
78.本实施例提供了一种全血检测胸苷激酶1的试剂盒,本技术的试剂盒包括r1试剂、r2试剂、r3试剂和r4试剂。其中r1试剂为磁分离试剂、1.3mg/l的抗红细胞抗体、tween-20和bsa-v的混合物;r1试剂盛放于试剂瓶内,且r1试剂的装量为6ml。r2试剂为0.02mg/l的辣根过氧化物酶标记的tk1单抗,羊、小鼠血清的混合物;r2试剂盛放于试剂瓶内,且r2试剂的装量为12ml。r3试剂为0.02mg/l的acridan标记的tk1单抗,羊、小鼠血清的混合物;r3试剂盛放于试剂瓶内,且r3试剂的装量为12ml。试剂r4为生理盐水;r4试剂盛放于试剂瓶内,其装量为20ml。
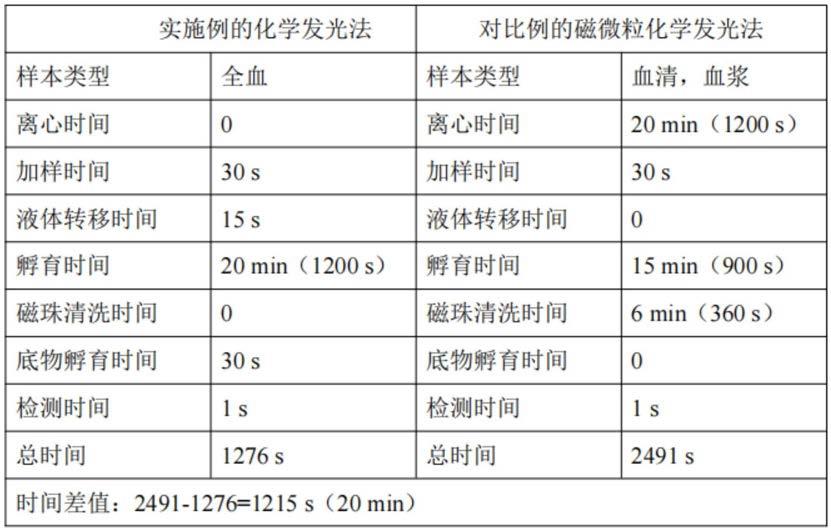
79.本技术的全血检测胸苷激酶1的试剂盒的组成具体见表1。
80.表1本实施例的tk1试剂盒的组成名称装量/ml成分r16磁分离试剂,抗红细胞抗体(1.3mg/l),缓冲液2r212hrp标记的tk1单抗(0.02mg/l),缓冲液3r312acridan标记的tk1单抗(0.02mg/l),缓冲液4r420生理盐水一种全血检测胸苷激酶1的检测方法,包括以下步骤:s1、取获取得到的人全血样本100ul加入到洁净的样本杯中,随后加入100ul的r4试剂和60ul的r1试剂,反应3min,然后磁分离2min后,弃去固相,得到反应液a;取60ul反应液a到一个洁净的反应杯中并丢弃样本杯。
81.s2、在反应杯中加入120ul的r2试剂和120ul的r3试剂,随后在37℃的条件下孵育15min后,得到反应液b。在该步骤中,r2试剂中的hrp标记的tk1单抗、反应液a中的tk1、r3试剂中的acridan标记的tk1单抗反应后生成hrp标记的tk1单抗-tk1-acridan标记的tk1单抗复合物。
82.s3、于步骤s2中得到的反应液b中加入100ul的激发液和100ul的隔离剂后,在30s后使用滨松光子的bhp9507测定仪测定发光值。
83.r1试剂通过r1试剂的制备例制备得到;r2试剂通过r2试剂的制备例制备得到;r3试剂通过r3试剂的制备例制备得到。
84.对比例本对比例和实施例的区别在于,本对比例是采用另一种检测方法检测人血中tk1含量采用商用的tk1试剂盒,购自华瑞同康生物技术(深圳)有限公司)。本对比例采用常规的磁微粒化学发光法检测tk1含量,其他公司的类似产品在加样量,孵育时间上存在差异,但整体流程相同,包括以下步骤:步骤一:直接使用采血管取样,将采集得到的全血样本在3000rpm的转速下离心25min,取上清液于洁净的样本杯中,得到血清样本。
85.步骤二:取15ul的血清标本于一洁净的反应管中,于血清样本中加入120ul的碱性磷酸酶标记的tk1单抗,60ul羧基磁珠标记的tk1单抗和120ul的缓冲液,得到溶液i;随后在37℃的条件下孵育15min。在该反应中,血清中的tk1单抗完全反应。碱性磷酸酶标记的tk1单抗和tk1(血清样本中的tk1)特异性结合,羧基磁珠标记的tk1单抗和tk1(血清样本中的tk1)上的其它结合位点特异性结合,最终形成磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物。
86.其中,碱性磷酸酶标记的tk1单抗通过制备例5的方法制备得到;缓冲液为制备例4中的使用液c。
87.步骤三:将步骤二中获得的溶液用磁性架吸附1min,羧基磁珠被吸附,随后丢弃液相(即剩余液)。此处的羧基磁珠是磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物,被吸附在磁性架上;而血清中的其它杂质以及未反应的碱性磷酸酶-tk1单抗被保留在剩余液中。该过程实现了将羧基磁珠(磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物)和杂质的分离。同时,被吸附在磁性架上的磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物上,由于羧基磁珠外表面上还黏附有血清中的杂质物质等(该部分杂质会对后期的发光反应产生干扰),这部分杂质有待在接下来的步骤中去除。
88.然后加入400ul清洗液,震荡混匀,实现清洗羧基磁珠(羧基磁珠是磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物)的目的,将羧基磁珠外表面上非特异性吸附的血清中的杂质物质等去除。其中,清洗液为含0.1%tween-20的生理盐水。
89.步骤四:重复步骤三4次。
90.步骤五:用磁性架吸附1min,随后吸取反应管中的剩余液,清除剩余液体,保留羧基磁珠,此处的羧基磁珠上负载磷酸酶标记的tk1单抗和tk1,即为磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物。
91.然后于羧基磁珠内加入200ul底物液aps-5,底物液中含有发光底物aps-5,震荡混匀后进行检测即可。
92.检测方法的验证采取获得同样的人全血样本,分别采用实施例和对比例的方法进行人血中tk1的含量测定。使用实施例的tk1试剂盒,按照实施例的tk1检测方法制备得到的实施例样本,采用hm240全自动分析系统进行检测;使用对比例的tk1试剂盒,按照对比例的tk1检测方法制备得到的对比例样本,采用axceed 260全自动化学发光免疫系统进行检测。
93.(1)检测时间比较通过对实施例样本和对比例样本进行检测,发现,和采用对比例的检测方法进行人全血中tk1含量的方法相比,采用实施例的检测方法,其总的操作及反应时间比对比例的方法短,即检测一个人全血样本中tk1的含量的总用时少,各个处理阶段的具体用时见表2。
94.表2实施例和对比例两种检测方法的各个处理阶段的用时注:实施例中的孵育时间即为实施例步骤s1中所述的反应时长(3min)、磁分离时长(2min)和步骤s2中所述的孵育时长(15min)的总和时间,即20min。
95.从表2的数据看出,采用实施例的方法进行人全血中tk1含量测定时,由于实施例的方法能够针对人全血样本直接进行检测,不需要增加人全血样本的离心处理,因此在获取人全血样本后,整个检测时间仅花费1276s,即21.3min;而采用传统的磁微粒化学发光法进行人血中tk1含量测定时,首先要做的就是对获取得到的人全血进行离心处理,随后获得血清样本后再进行其它的操作,而仅仅离心这一步骤就用时20min,接近于实施例的检测方法的总用时;且采用对比例的检测方法,其总用时达2491s,即41.5min。
96.(2)线性比对取tk1标准品配置tk1标准溶液,tk1的浓度(pmol/l)分别为:0、2、4、8、20、40。分别使用实施例的tk1试剂盒和检测方法、对比例的tk1试剂盒和检测方法进行检测,分别得到对应tk1浓度的发光数值,具体结果见表3。通过表3的结果,分析两种检测方法的线性回归。
97.表3实施例和对比例的检测方法的线性回归的对比
将表3的结果计算后,实施例中检测方法的一元线性标准曲线的方程为:y=12894x-8534.3,r2=0.9989;对比例中检测方法的一元线性标准曲线的方程为:y=10236x-8133.2,r2=0.9989。从该结果看出,本技术的检测方法和现有的检测方法的线性回归相似;且两种方法的一元线性标准曲线的r2均为0.9989,表明本技术的检测方法的线性回归和现有的对比例的方法相比,无明显差异。
98.(3)灵敏度比对表4实施例和对比例的检测方法的灵敏度对比检测方法灵敏度(pmol/l)实施例1对比例2.3表4的结果表明,本技术实施例的方法能够获得更高的检测灵敏度。出现这种结果的可能原因为:实施例的方法为纯液相反应,各个反应物之间的反应进行地高效完全。而对比例中存在的固相的非特异性吸附的反应底物(羧基磁珠标记的tk1,羧基磁珠和tk1之间是非特异性吸附),使得反应不够完全、充分。因此实施例的方法灵敏度优于传统方法。
99.进一步具体的解释为:实施例的方法中,参与反应的底物有:hrp标记的tk1单抗、tk1、acridan标记的tk1单抗,三者反应得到hrp标记的tk1单抗-tk1-acridan标记的tk1单抗复合物,所有反应均在液相中进行。而对比例的方法中,参与反应的底物为:碱性磷酸酶标记的tk1单抗、tk1、羧基磁珠标记的tk1单抗,三者反应得到碱性磷酸酶标记的tk1单抗-tk1-羧基磁珠标记的tk1单抗复合物。其中,碱性磷酸酶标记的tk1单抗和tk1的结合为抗原(tk1)和抗体(碱性磷酸酶标记的tk1单抗)之间的特异性吸附,该反应在液相中进行;tk1和羧基磁珠标记的tk1单抗之间的结合是液相(血清中tk1)和固相(羧基磁珠标记的tk1单抗)之间的特异性吸附反应;且羧基磁珠标记的tk1单抗本身在制备时,tk1和羧基磁珠的连接是非特异性吸附连接,本身会存在羧基磁珠上用于结合氨基酸的活化氨基酸位点上没有结合到tk1单抗(有部分活化氨基酸位点结合了甘氨酸);除此以外,tk1单抗和羧基磁珠的结合是非特异性结合,不够牢固。因此,实施例中纯液相的反应和对比例的反应相比,底物稳定性更强、反应更完全,因此其灵敏度更高。
100.(4)临床样本对比本技术对比了使用实施例的tk1检测方法和对比例的(对比例中的检测方法即商用的tk1检测方法)tk1检测方法对临床样本的测试结果。临床样本为不大于80pmol/l的样本,在每个区间段选取了10例样本进行比对测试。
101.表5检测不同浓度范围的tk1时实施例和对比例方法的符合率结果对比浓度范围(pmol/l)0-22-44-88-2020-40实施例的r2值0.950.920.970.930.96对比例的r2值0.820.930.920.940.94本技术对比了在不同浓度范围内的tk1血清临床样本,发现使用本技术实施例的tk1检测方法,在低浓度(0-2pmol/l)的范围内其符合率优于传统的对比例中的检测方法,证明在针对低浓度(0-2pmol/l)tk1含量样本进行检测时,实施例方法的可重复性、再现性优于对比例的方法。
102.本具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。