1.本发明涉及基于培养聚羟基烷酸酯生产微生物的聚羟基烷酸酯的制造方法。
背景技术:
2.在对环境问题、粮食问题、健康及安全的意识增高、天然或自然意愿增高等的背景下,利用微生物的物质制造(发酵生产、生物转化等)的意义及重要性日益增加,蛋白质医药品、基因治疗用的核酸等的制造也应用了基于微生物的物质生产。例如,利用了酵母、细菌等微生物的乙醇、乙酸、医疗用蛋白质的生产等在工业上得到了积极地应用。
3.作为其一例,可以举出聚羟基烷酸酯(以下也称为pha)的基于微生物的生产,所述聚羟基烷酸酯被期待作为生物降解性塑料而进行工业利用(参照非专利文献1)。pha是在多个微生物种类的细胞(以下也称为菌体)中作为能量储存物质而产生、蓄积的热塑性聚酯,具有生物降解性。目前,随着环保意识的提高,来源于非石油的塑料备受关注,特别是微生物在菌体内产生并蓄积的pha会被纳入自然界的碳循环过程,因此预计对生态系统的不良影响小,迫切希望它的实用化。在利用微生物的pha生产中,已知例如对贪铜菌属细菌给予作为碳源的糖、植物油脂、脂肪酸,使pha在细胞内蓄积,从而生产pha(参照非专利文献2及3)。
4.然而,在利用了微生物的物质生产中,存在目标产物的分离回收工序繁杂、生产成本增高成为问题的情况。因此,提高目标产物的分离回收效率是降低生产成本的一大课题。
5.非专利文献4报告了在贪铜菌属细菌中通过破坏编码phasin蛋白的基因phap1,从而蓄积了比非破坏时更大粒径的pha。但是,该phap1破坏株显示出pha蓄积量明显减少,并不适合工业生产。
6.另外,非专利文献5记载了通过对蓄积有pha的菌体施加温度、ph等刺激,细胞内部的pha会发生凝聚。但是,从显微镜照片中仅能观察到很小一部分的pha粒子在细胞内相互附着的情况,无法读取到pha粒子的平均粒径的变化。此外,该文献中由于整体上细胞本身较小,因此可以认为对pha粒子的平均粒径的影响是有限的。
7.现有技术文献
8.非专利文献
9.非专利文献1:anderson aj.,et al.,int.j.biol.macromol.,12,102-105(1990)
10.非专利文献2:sato s.,et al.,j.biosci.bioeng.,120(3),246-251(2015)
11.非专利文献3:insomphun c.,et al.,metab.eng.,27,38-45(2015)
12.非专利文献4:potter m.,et al.,microbiology,151(pt 3),825-833(2005)
13.非专利文献5:sedlacek p.,et al.,appl.microbiol.biotechnol.,103(4),1905-1917(2019)
技术实现要素:
14.发明要解决的课题
15.pha在微生物细胞内以粒子状蓄积。为了将微生物细胞内蓄积的pha作为生物降解性塑料而利用,需要将细胞破碎,取出pha粒子,与其它细胞成分分离并进行回收。分离回收的方法大致可以分为基于有机溶剂体系的方法和基于水体系的方法,有机溶剂的使用会导致高环境负担、高成本,因此在工业上优选为基于水体系的方法。在基于水体系的方法中,例如,可以利用离心分离机、分离膜等从包含pha粒子的细胞破碎液中分离pha粒子。在这样的情况下,分离回收的效率取决于pha粒子的大小。即,分离工序前的pha粒子越大,越可以容易地实施利用离心分离机、分离膜等进行的分离回收,可降低生产成本。
16.在将蓄积有pha粒子的微生物细胞破碎之后,进行了在分离前使细胞破碎液中的pha粒子凝聚而将该粒子增大的尝试。但是,凝聚度的控制困难,而且,由于在将破碎而片段化的细胞成分等夹杂物卷入的同时pha粒子发生凝聚,因此难以进行随后的杂质去除,因此,使细胞破碎液中的pha粒子凝聚的方法不适合工业生产。
17.鉴于上述现状,本发明的目的在于提供在微生物细胞内使pha粒子凝聚而得到平均粒径大的pha粒子的方法。
18.解决课题的方法
19.本发明人等进行了深入研究,结果发现,通过对pha生产微生物进行培养,得到蓄积有pha粒子且平均细胞直径为2μm以上的菌体,并对该菌体进行热处理,从而可在上述菌体内形成平均粒径为1.8μm以上的pha粒子,由此完成了本发明。
20.即,本发明涉及一种聚羟基烷酸酯的制造方法,该方法包括:对聚羟基烷酸酯生产微生物进行培养,得到积蓄有聚羟基烷酸酯粒子且平均细胞直径为2μm以上的菌体的工序;将上述菌体在比上述培养时的温度更高的温度下进行热处理,在上述菌体内使聚羟基烷酸酯粒子的平均粒径为1.8μm以上且平均细胞直径以下的工序。
21.优选上述热处理后的聚羟基烷酸酯粒子的平均粒径相对于上述热处理前的聚羟基烷酸酯粒子的平均粒径的比率为1.1以上。
22.优选相对于上述培养后的菌体的干燥重量,聚羟基烷酸酯重量所占的比例为80%以上。
23.优选在上述热处理后的聚羟基烷酸酯粒子的粒度分布中,粒径1μm以下的聚羟基烷酸酯粒子的比例为2.0体积%以下。
24.优选蓄积有上述聚羟基烷酸酯粒子的上述菌体的平均细胞直径为2.2μm以上。
25.优选在40~100℃的温度下实施5分钟以上上述热处理。
26.优选在ph7.0以上的条件下实施上述热处理。
27.优选对包含上述培养后的菌体的培养液实施上述热处理。
28.优选上述制造方法进一步包括:将上述热处理后的菌体破碎而得到细胞破碎液的工序;以及从上述细胞破碎液的水相中分离聚羟基烷酸酯粒子的工序。
29.优选上述聚羟基烷酸酯为2种以上的羟基烷酸的共聚物,更优选为含有3-羟基己酸作为单体单元的共聚物,进一步优选为3-羟基丁酸与3-羟基己酸的共聚物。
30.优选上述聚羟基烷酸酯生产微生物属于贪铜菌属,更优选上述聚羟基烷酸酯生产微生物为钩虫贪铜菌的转化微生物。
31.发明的效果
32.根据本发明,可以提供在微生物细胞内使pha粒子凝聚而得到平均粒径大的pha粒
子的方法。根据本发明,可以在将菌体破碎之前在微生物细胞内形成平均粒径大的pha粒子,因此能够避免将因破碎而片段化的细胞成分等夹杂物卷入的同时pha粒子发生凝聚。此外,平均粒径大的pha粒子能够高效地实施从细胞成分中的分离回收,因此可以实现生产成本的降低。
附图说明
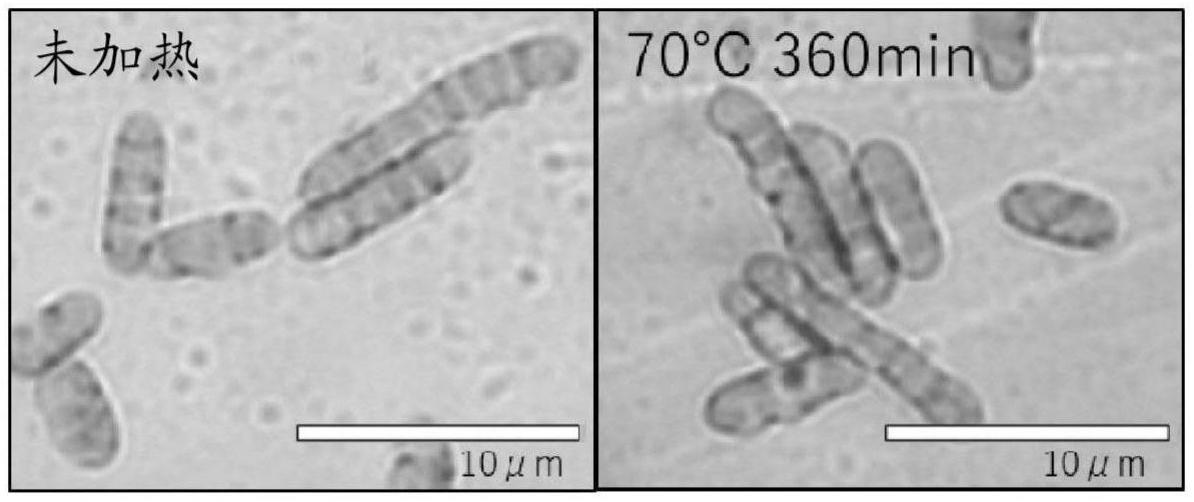
33.图1是对实施例1的培养后、热处理前(左侧)或热处理后(右侧)的细胞进行拍摄而得到的显微镜照片
34.图2是对实施例2的培养后、热处理前(左侧)或热处理后(右侧)的细胞进行拍摄而得到的显微镜照片
具体实施方式
35.以下,对本发明的实施方式详细地进行说明。
36.本实施方式包括:对pha生产微生物进行培养,得到蓄积有pha粒子且平均细胞直径为2μm以上的菌体的工序;将上述菌体进行热处理,在上述菌体内形成平均粒径为1.8μm以上的pha粒子的工序。需要说明的是,本技术中的平均粒径均是指体积平均粒径。
37.(pha生产微生物)
38.pha生产微生物只要是具有pha蓄积能力、且可使pha蓄积后的平均细胞直径达到2μm以上的微生物即可,没有特别限定。该微生物的平均细胞直径并不需要在培养中总是在2μm以上,只要在将该微生物供于热处理工序之前的蓄积pha的阶段中达到2μm以上即可。pha蓄积后的平均细胞直径小于2μm时,即使进行后述的热处理,也难以形成平均粒径为1.8μm以上的pha粒子。上述平均细胞直径更优选为2.2μm以上,进一步优选为2.4μm以上,更进一步优选为2.6μm以上,特别优选为2.8μm以上。上述平均细胞直径的上限没有特别限定,例如可以为10μm以下,另外可以为5μm以下。
39.上述pha生产微生物所蓄积的pha的量没有特别限定,在供于热处理工序之前的蓄积pha的阶段中,相对于菌体干燥重量,pha重量所占的比例优选为80%以上,更优选为85%以上。上述比例的上限值只要小于100%即可,没有特别限定,例如可以为98%以下,另外可以为95%以下。
40.上述pha生产微生物只要是具有pha合成酶基因而蓄积pha的微生物即可,没有特别限定,可以列举例如属于罗尔斯通氏菌(ralstonia)属、贪铜菌(cupriavidus)属、沃特斯氏菌(wautersia)属、气单胞菌(aeromonas)属、埃希氏菌(escherichia)属、产碱杆菌(alcaligenes)属、假单胞菌(pseudomonas)属等的细菌类作为优选的例子。从安全性及pha生产性的观点考虑,更优选为属于罗尔斯通氏菌属、贪铜菌属、气单胞菌属、沃特斯氏菌属的细菌,进一步优选为属于贪铜菌属或气单胞菌属的细菌,更进一步优选为属于贪铜菌属的细菌,特别优选为钩虫贪铜菌(cupriavidus necator)。
41.上述pha生产微生物可以是原本蓄积pha的野生株,也可以是将这样的野生株进行人工突变处理而得到的突变株、或者通过基因工程方法导入了外来的pha合成酶基因而赋予了pha蓄积能力的菌株。
42.作为上述pha生产微生物,可以举出例如,作为后述的钩虫贪铜菌的转化体的
mincd表达a2405破坏株、a1386缺失破坏株等,但并不限定于此。
43.作为上述pha生产微生物所生产的pha的种类,只要是微生物能够生产的pha即可,没有特别限定,优选为选自碳原子数4~16的3-羟基烷酸的1种单体的均聚物、选自碳原子数4~16的3-羟基烷酸的1种单体与其它羟基烷酸(例如,碳原子数4~16的2-羟基烷酸、4-羟基烷酸、5-羟基烷酸、6-羟基烷酸等)的共聚物、以及选自碳原子数4~16的3-羟基烷酸的2种以上单体的共聚物。可以列举例如:作为3-羟基丁酸(简称:3hb)的均聚物的p(3hb)、3hb与3-羟基戊酸(简称:3hv)的共聚物p(3hb-共-3hv)、3hb与3-羟基己酸(简称:3hh)的共聚物p(3hb-共-3hh)(简称:phbh)、3hb与4-羟基丁酸(简称:4hb)的共聚物p(3hb-共-4hb)、包含乳酸(简称:la)作为构成成分的pha、例如3hb与la的共聚物p(la-共-3hb)等,但并不限定于此。其中,从作为聚合物的应用范围广的观点考虑,优选为phbh。需要说明的是,根据目的,生产的pha的种类可以通过待使用的微生物所保有或另行导入的pha合成酶基因的种类、与其合成相关的代谢体系的基因的种类、培养条件等而适当选择。
44.(pha生产微生物的培养)
45.通过对上述pha生产微生物进行培养,可以使pha粒子蓄积在菌体内。作为培养的方法,可以依照通常的微生物培养法,只要在存在适当碳源的培养基中进行培养即可。培养基组成、碳源的添加方法、培养规模、通气搅拌条件、培养温度、培养时间等没有特别限定,考虑到蓄积足够量的pha,优选连续或间歇地将碳源添加于培养基。
46.作为培养时的碳源,只要pha生产微生物能够同化即可,可以使用任意碳源。可以列举:葡萄糖、果糖、蔗糖等糖类;棕榈油、棕榈仁油(也包括作为将它们分离而得到的低熔点级分的棕榈油精、棕榈双油精、棕榈仁油精等)、玉米油、椰子油、橄榄油、大豆油、菜籽油、麻疯树油(jatropha oil)等油脂、其分离油类、或其纯化副产物;月桂酸、油酸、硬脂酸、棕榈酸、肉豆蔻酸等脂肪酸、其衍生物、或甘油等,没有特别限定。另外,在上述pha生产微生物能够利用二氧化碳、一氧化碳、甲烷、甲醇、乙醇等气体、醇类的情况下,也可以使用它们作为碳源。
47.在上述pha生产微生物的培养中,优选使用包含作为上述碳源、碳源以外的营养源的氮源、无机盐类、其它有机营养源的培养基对上述微生物进行培养。作为氮源,可以列举例如:氨;氯化铵、硫酸铵、磷酸铵等铵盐;蛋白胨、肉提取物、酵母提取物等,但并不限定于此。作为无机盐类,可以列举例如:磷酸二氢钾、磷酸氢二钠、磷酸镁、硫酸镁、氯化钠等。作为其它有机营养源,可以列举例如:甘氨酸、丙氨酸、丝氨酸、苏氨酸、脯氨酸等氨基酸、维生素b1、维生素b12、维生素c等维生素等。
48.(热处理)
49.通过将蓄积有pha粒子且平均细胞直径为2μm以上的微生物细胞在比该微生物细胞培养时的温度更高的温度下进行热处理,可以在上述微生物细胞内增大pha粒子的平均粒径。上述热处理只要在将上述微生物细胞破碎之前进行即可,可以对进行了pha生产微生物的培养后的包含菌体的培养液进行,也可以从该培养液中回收菌体,对再悬浮于水、缓冲液等而得到的悬浮液进行。由于可以容易地实施,因此优选对培养后的培养液进行热处理。
50.上述热处理的条件只要是能够在菌体内使pha粒子的平均粒径达到1.8μm以上的条件即可,没有特别限定,优选为细胞骨架被破坏而不使pha漏出至细胞外的条件。具体而言,上述热处理的温度为比上述微生物细胞的培养时温度更高的温度,优选为40℃以上,更
优选为50℃以上,进一步优选为60℃以上,更进一步优选为70℃以上。上述热处理的温度的上限值没有特别限定,例如可以为100℃以下,优选为90℃以下。
51.作为上述热处理的时间,优选为5分钟以上,更优选为30分钟以上,进一步优选为180分钟以上,更进一步优选为360分钟以上。上述热处理的温度的上限值没有特别限定,例如可以为1天以下,优选为720分钟以下。
52.在进行上述热处理时,包含菌体的液体(例如,包含菌体的培养液或包含菌体的悬浮液)所显示的ph没有特别限定,可以小于7.0,也可以为7.0以上。但是,从通过热处理而使pha粒子的平均粒径变得更大的方面考虑,优选为7.0以上,更优选为7.5以上,进一步优选为8.0以上,更进一步优选为8.5以上。上述ph只要为不使菌体破碎的范围即可,其上限值没有特别限定,例如可以为12以下,优选为11以下。需要说明的是,ph可以通过在包含菌体的液体中添加适当的量的酸、碱等而进行控制。
53.上述热处理后的菌体内的pha粒子的平均粒径只要为1.8μm以上、且平均细胞直径以下即可,没有特别限定。上述平均粒径优选为1.9μm以上,更优选为2.0μm以上,进一步优选为2.1μm以上。
54.通过上述热处理,可使上述菌体内的pha粒子的平均粒径增大。具体而言,上述热处理后的菌体内的pha粒子的平均粒径相对于上述热处理前的菌体内的pha粒子的平均粒径的比率(热处理后的平均粒径/热处理前的平均粒径)为超过1.0的数值,优选为1.1以上,更优选为1.2以上,进一步优选为1.3以上,更进一步优选为1.4以上,最优选为1.5以上。
55.由于通过上述热处理而在上述菌体内使pha粒子凝聚,因此,相对于pha粒子总体,粒径小的pha粒子所占的比例为较小的值。具体而言,在对于上述热处理后的菌体内的pha粒子进行测定而得到的粒度分布中,粒径1μm以下的pha粒子相对于pha粒子总体的比例优选为2.5体积%以下,更优选为2.0体积%以下,进一步优选为1.5体积%以下,更进一步优选为1.0体积%以下,特别优选为0.5体积%以下。
56.在本实施方式中,蓄积有pha粒子且菌体的平均细胞直径大至2μm以上,但对于这样的细胞直径大的菌体而言,具有在热处理前粒径小的pha粒子所占的比例大的倾向。这样,即使在粒径小的pha粒子所占的比例在热处理前为较大的数值(例如,3.0体积%以上或4.0体积%以上),也可以通过进行热处理而使其降低至上述那样的较小的值。这样,根据本实施方式,由于粒径小的pha粒子的比例减少,因此能够获得使pha粒子从细胞成分中的分离回收变得高效的优点。
57.(细胞的破碎及pha的分离回收)
58.如以上所述进行蓄积有pha粒子的菌体的热处理而在该菌体内使pha粒子的平均粒径增大后,可以使用公知的方法将该菌体破碎,从得到的细胞破碎液的水相中分离回收pha粒子。
59.作为菌体的破碎方法,没有特别限定,可以应用公知的方法,例如,可以通过施加机械性剪切力或使用表面活性剂、碱、酶等将细胞破碎,从而得到pha以外的细胞成分溶解于水中的细胞破碎液。
60.作为pha的分离回收方法,没有特别限定,可以应用公知的方法,例如,在通过上述细胞破碎液的过滤、离心分离而从水相中分离了pha粒子之后进行干燥,可以回收pha。通过本实施方式制造的平均粒径大的pha粒子能够高效地实施这样的基于水体系的分离回收,
因此是优选的。
61.实施例
62.以下,通过实施例对本发明更具体地进行说明。但是,本发明并不受这些实施例的限定。需要说明的是,全部基因操作例如可以如molecular cloning(cold spring harbor laboratory press(1989))中记载的那样进行。另外,基因操作所使用的酶、克隆宿主等可以从市场的供应商购入,按照其说明使用。需要说明的是,作为酶,只要能够用于基因操作即可,没有特别限定。
63.(制造例1)mincd表达a2405破坏株的制备
64.首先,进行了基因缺失用质粒的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了具有a2405结构基因的上游及下游的碱基序列的dna片段(序列号1)。用限制性内切酶swai消化该dna片段,将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb和dna连接酶(ligation high(东洋纺株式会社制))连接,制备了具有a2405结构基因的上游及下游的碱基序列的基因缺失用质粒载体pns2x-sacb a2405ud。
65.接下来,使用基因缺失用质粒载体pns2x-sacb a2405ud,如下所述进行了a2405缺失破坏株的制备。
66.用基因缺失用质粒载体pns2x-sacb a2405ud对大肠杆菌s17-1株(atcc47055)进行转化,将由此得到的转化微生物和knk-005株在nutrient agar培养基(difco公司制)上进行混合培养,进行了接合转移(conjugation transfer)。knk-005株是在钩虫贪铜菌h16株的染色体上导入了豚鼠气单胞菌来源的pha合成酶基因(编码具有序列号2所述的氨基酸序列的pha合成酶的基因)的转化体,可以基于美国专利第7384766号说明书中记载的方法制备。
67.将得到的培养菌体接种于包含250mg/l的卡那霉素的simmons’琼脂培养基(柠檬酸钠2g/l、氯化钠5g/l、七水硫酸镁0.2g/l、磷酸二氢铵1g/l、磷酸氢二钾1g/l、琼脂15g/l、ph6.8),选择能够在琼脂培养基上生长的菌株,获得了在knk-005株的染色体上导入了质粒的菌株。将该菌株用nutrient broth培养基(difco公司制)进行两代培养后,稀释并涂布在包含15%的蔗糖的nutrient agar培养基上,获得了生长的菌株作为质粒脱落后的菌株。进一步通过基于pcr及dna测序仪的分析,分离出了将染色体上的a2405结构基因的起始密码子至终止密码子缺失的1个菌株。将该a2405基因缺失株命名为a2405缺失破坏株。
68.接着,进行mincd基因表达用质粒载体pns2x-sacb-pa-mincd的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了具有启动子序列和mincd基因序列及基因组上的引入区域的碱基序列的dna片段(序列号3)。用限制性内切酶swai消化该dna片段,将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb和dna连接酶(ligation high(东洋纺株式会社制))连接,制备了mincd基因表达用质粒载体pns2x-pa-mincd。
69.通过与上述相同的使用了接合转移的方法将制备的mincd基因表达用质粒载体pns2x-sacb-pa-mincd导入a2405缺失破坏株。进一步,通过与上述相同的培养及利用包含15%蔗糖的nutrient agar培养基进行的挑选,分离出了在染色体上插入了启动子序列和mincd基因序列的1个菌株。将得到的菌株命名为mincd表达a2405破坏株。
70.(制造例2)a1386缺失破坏株的制备
71.首先,进行了基因缺失用质粒的制备。如下所述进行了制备。通过使用了合成寡聚dna的pcr,得到了具有a1386结构基因的上游及下游的碱基序列的dna片段(序列号4)。用限制性内切酶swai消化该dna片段,将得到的dna片段与同样经swai消化的日本特开2007-259708号公报中记载的载体pns2x-sacb和dna连接酶(ligation high(东洋纺株式会社制))连接,制备了具有a1386结构基因的上游及下游的碱基序列的基因缺失用质粒载体pns2x-sacb a1386ud。
72.接下来,通过与制造例1相同的方法将a1386基因缺失用质粒载体pns2x-sacb a1386ud导入knk-005株。进一步,通过与制造例1相同的方法,分离出了将染色体上的a1386结构基因的起始密码子至终止密码子缺失的1个菌株。将该a1386基因缺失株命名为a1386缺失破坏株。
73.(比较例1)基于knk-005株进行的pha生产
74.在下述的条件下进行了knk-005株的培养。
75.(培养基)
76.种子培养基的组成设为1w/v%肉提取物、1w/v%细菌用胰蛋白胨(bacto-tryptone)、0.2w/v%酵母提取物、0.9w/v%na2hpo4·
12h2o、0.15w/v%kh2po4、(ph6.8)。
77.前培养培养基的组成设为1.1w/v%na2hpo4·
12h2o、0.19w/v%kh2po4、1.29w/v%(nh4)2so4、0.1w/v%mgso4·
7h2o、2.5w/v%棕榈油精油、0.5v/v%微量金属盐溶液(在0.1n盐酸中溶有1.6w/v%fecl3·
6h2o、1w/v%cacl2·
2h2o、0.02w/v%cocl2·
6h2o、0.016w/v%cuso4·
5h2o、0.012w/v%nicl2·
6h2o)。作为碳源,以10g/l的浓度一次性添加了棕榈油精油。
78.pha生产培养基的组成设为0.385w/v%na2hpo4·
12h2o、0.067w/v%kh2po4、0.291w/v%(nh4)2so4、0.1w/v%mgso4·
7h2o、0.5v/v%微量金属盐溶液(在0.1n盐酸中溶有1.6w/v%fecl3·
6h2o、1w/v%cacl2·
2h2o、0.02w/v%cocl2·
6h2o、0.016w/v%cuso4·
5h2o、0.012w/v%nicl2·
6h2o)。
79.(pha蓄积量相对于干燥菌体的比例的测定方法)
80.如下所述测定了pha蓄积量相对于干燥菌体的比例。通过离心分离,从培养液中回收菌体,用乙醇进行清洗,冷冻干燥,得到干燥菌体,测定了重量。向得到的干燥菌体1g中加入100ml的氯仿,在室温下搅拌一昼夜,提取出菌体内的pha。滤去菌体残渣后,用蒸发器浓缩至总容量为30ml后,逐渐加入90ml的己烷,一边缓慢搅拌,一边放置1小时。将析出的pha滤去后,在50℃下真空干燥3小时。测定干燥pha的重量,计算出pha蓄积量相对于干燥菌体量所占的比例。
81.(平均细胞直径的测定方法)
82.如下所述测定了平均细胞直径。将培养结束后的培养液在60℃下处理10分钟,进行了菌体细胞失活后,通过激光衍射/散射式粒径分布测定装置(microtrac mt3300exii)进行分析,测定了pha蓄积细胞的体积平均粒径(mv)。测定以标准设定(粒子透射性:透射,粒子折射率:1.81,粒子形状:非球形,溶剂折射率:1.333)进行。
83.(pha平均粒径的测定方法)
84.如下所述测定了pha平均粒径。在培养结束后,分取热处理前或热处理后的培养液
0.2ml,悬浮于20ml的0.02w/v%苯扎氯铵水溶液。进一步加入10ml的10w/v%十二烷基硫酸钠水溶液进行混合,通过超声波破碎得到了pha提取液。利用激光衍射/散射式粒径分布测定装置(microtrac mt3300exii)对得到的pha提取液进行分析,测定了pha粒子的体积平均粒径(mv)、以及粒径1μm以下的pha粒子相对于pha粒子总体的比例(体积%)。测定以标准设定(粒子透射性:透射,粒子折射率:1.81,粒子形状:非球形,溶剂折射率:1.333)进行。
85.(pha生产培养)
86.如下所述进行了pha生产培养。首先,将knk-005株的甘油原液(50μl)接种于种子培养基(10ml),培养24小时,进行了种子培养。接下来,将种子培养液以1.0v/v%接种于加入有1.8l前培养培养基的3l发酵罐(jar fermentor)(marubishi bioengineering公司制mdl-300型)。运行条件设为培养温度33℃、搅拌速度500rpm、通气量1.8l/min,在将ph控制为6.7~6.8之间的同时培养28小时,进行了前培养。ph控制使用了14%氢氧化铵水溶液。
87.接下来,将前培养液以5.0v/v%接种于加入有2.5l的pha生产培养基的5l发酵罐(marubishi bioengineering公司制mds-u50型)。运行条件设为培养温度33℃、搅拌速度420rpm、通气量2.1l/min,将ph控制为6.7~6.8之间。ph控制使用了25%氢氧化铵水溶液。间断地添加了碳源。作为碳源,使用了棕榈油精油。培养进行至pha蓄积量相对于干燥菌体达到80%以上。对于得到的培养液,在表1-1中记载的时间及温度下进行了热处理。
88.如上所述测定了pha蓄积量相对于干燥菌体的比例、平均细胞直径、热处理前及热处理后的pha平均粒径、以及热处理前及热处理后的1μm以下的pha粒子的比例。另外,计算出了热处理所引起的pha平均粒径的增大率(热处理后的pha平均粒径/热处理前的pha平均粒径)。将结果示于表1-1。
89.培养后的knk-005株的平均细胞直径为1.89μm,pha蓄积量相对于干燥菌体的比例为89%,热处理前的pha平均粒径为1.72μm,热处理前的1μm以下的pha粒子的比例为2.45体积%。在本比较例中,培养后的pha生产微生物的平均细胞直径为1.89μm,因此,即使进行热处理,如表1-1所示,pha平均粒径也未增大,1μm以下的pha粒子的比例也基本上没有减少。
90.(实施例1)基于mincd表达a2405破坏株进行的pha生产
91.在与比较例1相同的条件下进行了使用mincd表达a2405破坏株的培养。对于得到的培养液,在表1-1所记载的时间及温度下进行了热处理。将pha蓄积量相对于干燥菌体的比例、平均细胞直径、热处理前及热处理后的pha平均粒径、热处理前及热处理后的1μm以下的pha粒子的比例、以及由热处理引起的pha平均粒径的增大率示于表1-1。另外,在将热处理前后的细胞放在载玻片上进行干燥后,利用品红染色,通过光学显微镜进行了观察。将显微镜观察时拍摄到的照片示于图1。在热处理前后,细胞保持了形状。
92.培养后的mincd表达a2405破坏株的平均细胞直径为2.95μm,pha蓄积量相对于干燥菌体的比例为86%,热处理前的pha平均粒径为1.62μm,热处理前的1μm以下的pha粒子的比例为5.08体积%。在本实施例中,通过进行热处理,如表1-1所示,pha平均粒径增大,增大率最大为1.72。另外,1μm以下的pha粒子的比例从热处理前的5.08体积%大幅减少,最小达到0.00体积%。
93.(实施例2)基于a1386缺失破坏株进行的pha生产
94.在与比较例1相同的条件下进行了使用a1386缺失破坏株的培养。对于得到的培养液,在表1-2所记载的时间及温度下进行了热处理。将pha蓄积量相对于干燥菌体的比例、平
均细胞直径、热处理前及热处理后的pha平均粒径、热处理前及热处理后的1μm以下的pha粒子的比例、由热处理引起的pha平均粒径的增大率示于表1-2。另外,在将热处理前后的细胞放在载玻片上进行干燥后,利用品红染色,通过光学显微镜进行了观察。将显微镜观察时拍摄到的照片示于图2。在热处理前后,细胞保持了形状。
95.培养后的a1386缺失破坏株的平均细胞直径为2.48μm,pha蓄积量相对于干燥菌体的比例为88%,热处理前的pha平均粒径为1.48μm,热处理前的1μm以下的pha粒子的比例为10.86体积%。在本实施例中,通过进行热处理,如表1-2所示,pha平均粒径增大,增大率最大为1.59。另外,1μm以下的pha粒子的比例从热处理前的10.86体积%大幅减少,最小达到0.00体积%。
96.需要说明的是,通过hplc分析确认了由比较例1以及实施例1和2生产的pha为phbh。
97.[表1-1]
[0098][0099]
[表1-21
[0100][0101]
(实施例3)热处理时的ph条件
[0102]
与实施例2同样地进行a1386缺失破坏株的培养,分取得到的培养液。将分取到的培养液的ph控制为表2中记载的值( 0.1以内),并且在该表所记载的时间及温度下进行了热处理。ph控制使用了10%氢氧化钠水溶液。将平均细胞直径、热处理前及热处理后的pha平均粒径、热处理前及热处理后的1μm以下的pha粒子的比例、由热处理引起的pha平均粒径的增大率示于表2。
[0103]
培养后的a1386缺失破坏株的平均细胞直径为2.60μm,pha蓄积量相对于干燥菌体的比例为89%,热处理前的pha平均粒径为1.55μm,热处理前的1μm以下的pha粒子的比例为7.08体积%。在本实施例中,将ph控制为7.0以上,并且进行热处理,由此,如表2所示,pha平均粒径有效地增大。需要说明的是,在控制ph后,在热处理前的状态下,pha平均粒径的变化率为5%以内。热处理时,在ph8.5下通过70℃、30分钟的处理,增大率达到1.58。另外,1μm以下的pha粒子的比例从热处理前的7.08体积%大幅减少,达到0.02体积%。
[0104]
需要说明的是,通过hplc分析确认了由实施例3生产的pha为phbh。
[0105]
[表2]
[0106]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。