与肉兔肌肉滴水损失性状相关的snp分子标记及其应用
技术领域
1.本发明属于兔的分子标记制备技术领域,具体涉及一种与肉兔肌肉滴水损失性状相关的snp分子标记及其应用。
背景技术:
2.肉兔具有经济价值高、用途广、高产低耗和见效快等优点,随着人们生活水平不断提高以及对外出口不断增加,养兔业已经成为畜牧业的新亮点,具有广阔的发展前景。然而,肉兔品种退化严重,饲料营养不均衡、疾病防治体系不健全及饲养技术落后影响整个养兔业的发展进程。种业是影响养兔业最重要的环节之一,决定肉兔生产水平的关键是育种。中国养兔历史悠久,但肉兔专业育种工作起步较晚,与养兔发达国家及中国其他畜禽育种相比,尚存在较大的差距随着分子数量遗传学和生物技术的发展,中国肉兔育种逐渐由传统育种的方法向传统育种和分子育种相结合方法转变,并取得了较好的进展。
3.snp(单核苷酸多态性)分子标记是基因序列单个核苷酸发生变异而产生多态性的dna分子标记之一,主要表现为基因组同一位点上单个核苷酸的变异,包括转换、颠换、缺失和插入,是二等位基因多态。snp标记具有分布广泛,遗传稳定,并且适宜高通量自动化分析。在肉兔育种中,人们希望通过对与生产性状密切相关的snp分子标记的选择,期望达到提高育种效率,获得更大的育种进展的目的。
4.肌肉的滴水损失与肉兔品质密切相关,影响肉品的加工产量、适口性、营养价值和消费者受欢迎程度。因此,研究肉兔肌肉滴水损失性状相关的snp分子标记及其应用对于肉兔的选育具有积极的意义。
技术实现要素:
5.本发明的目的在于提供一种与肉兔肌肉滴水损失性状相关的snp分子标记及其应用。
6.为实现上述目的,本发明采用如下技术方案:一种与肉兔肌肉滴水损失性状相关的snp分子标记,所述snp分子标记从肉兔fabp4基因3’端非编码区(登录号:nc_013671.1)克隆得到,核苷酸序列如下所示:5
’‑
tatttaatcaacacaaccacaggcaaaaaaatcagcttgggggaaaattagttccttgctaattagtgaaaaataacaatatctgtttaaacaatacttcyaacagaatgtcgtagaattcaatgcaaacttcagtccagctcagtgtccccgggcttatgctctttcataaattctggtggaa
‑3’
(seq id no.1)上述序列中的第101bp处的y是c或t,导致多态性。
7.一种扩增上述分子标记的引物对,所述引物对是:上游引物(seq id no.2):5
’‑
tatttaatcaacacaaccacaggc
‑3’
;下游引物(seq id no.3):5
’‑
ttccaccagaatttatgaaagagc
‑3’
。
8.上述分子标记在选育优质肉兔中的应用。
9.上述分子标记在肉兔肌肉滴水损失含量检测中的应用。
10.上述分子标记在肉兔肌肉滴水损失含量检测中的应用,其中所述分子标记序列自5’端起第101bp处c/t突变位点为tt型时,判定该肉兔属于滴水损失低的个体。
11.上述引物对在选育优质肉兔中的应用。
12.上述引物对在肉兔肌肉滴水损失含量检测中的应用。
13.进而证明seq id no.1所示核苷酸序列自5’端起第101bp处c/t突变与肉兔肌肉滴水损失极显著相关(p<0.01),为肉兔肌肉滴水损失相关的snp标记。由此可见,在肉兔群体中,继代选育seq id no.1所示核苷酸序列自5’端起第101bp处c/t突变位点为tt型的个体,可逐步降低肉兔的滴水损失,从而达到提高肉兔肉质性能的目的。并且,当肉兔个体seq id no.1所示核苷酸序列自5’端起第101bp处c/t突变位点为tt型时,可判定该肉兔属于滴水损失低的个体。
14.本发明的优点在于:本发明提供的snp标记与兔肌肉滴水损失相关,基于该snp开发的分子标记及引物可用于snp的检测,因此,可以通过鉴定该snp标记来筛选低滴水损失肉兔品系,所得的低滴水损失肉兔品系具有重要的经济效益与社会价值。
附图说明
15.图1是本发明用序列为seq id no.2和seq id no.3的引物克隆肉兔fabp4基因3’端非编码区序列得到的pcr扩增片段电泳图,扩增产物片段长度为184bp,即本发明筛选的分子标记的核苷酸序列。
16.图2是不同基因型在兔群中的分布图。
具体实施方式
17.以下实施例用于说明本发明,但不用来限制本发明的范围。
18.实施例11. 试验动物来源本实施例所使用的实验肉兔品种如下:福建黄兔,由福建省连江玉华山自然生态农业试验场提供;闽西南黑兔,由龙岩市通贤兔业发展有限公司提供;新西兰白兔、福建白兔,由武平县武东乡袁田村福建白兔保种场提供。
19.2. 兔肉滴水损失测定在肉兔宰后的1
‑
2小时内取其4
‑
7节腰椎处长2.5cm左右的背最长肌称重,吊挂在4℃冰箱中贮存,24后取出,用滤纸吸干肉样表面水分,并再次称重。滴水损失(%)=(贮前肉样重
‑
贮后肉样重)/贮前肉样重
×
100%。
20.3. 兔基因组dna提取采用全血基因组dna提取试剂盒(北京全式金生物技术有限公司)提取福建地方肉兔基因组dna,具体步骤如下所述:采集兔耳静脉血液1ml于乙二胺四乙酸二钾(edta
‑
k2)抗凝的真空管中,充分与抗凝剂混匀,然后取250μl抗凝血于新的2ml eppendorf管中,向其中加入20μl蛋白酶k和500μl bb3裂解液,充分混匀后,在室温下孵育10min;将全部溶液加入离心柱中,12000g离心1min,弃流出液;向离心柱中加入500μl cb3平衡液,12000g离心30s,弃流出液;向离心柱中
加入500μl wb3漂洗液,12000g离心30s,弃流出液,并重复一次,随后12000g离心2min,彻底去除残留wb3漂洗液;向离心柱中加入50
‑
200μl预热的eb洗脱液(使用前于60
‑
70℃下预热),室温下静置1min,12000g离心1min,洗脱dna;对提取出的dna的浓度及质量进行检测,并将合格的dna样品稀释至100
‑
300ng/μl后,置于
‑
20℃下保存备用。
21.上述蛋白酶k、bb3裂解液、cb3平衡液、wb3漂洗液、eb洗脱液均由dna提取试剂盒配套提供。
22.4. snp位点筛选及基因分型用primer premier5.0软件根据家兔fabp4基因3’端非编码区的一段序列(nc_013671.1)设计引物,委托上海英俊生物技术有限公司合成。引物对序列如下:上游引物(seq id no.2):5
’‑
tatttaatcaacacaaccacaggc
‑3’
;下游引物(seq id no.3):5
’‑
ttccaccagaatttatgaaagagc
‑3’
。
23.用已提取的dna为模板,根据所设计的引物,进行pcr扩增。pcr反应体系为10μl:5u/μl taq酶0.1μl、1μm上游引物1μl、1μm下游引物1μl、模板 dna 2μl、10
×
buffer 1μl、2.5mm dntp 0.8μl、100mm mg
2 1μl、补充ddh2o 至终体积10μl。pcr程序如下:95℃ 15min;94℃ 30s,60℃ 90s,72℃ 30s,共35个循环;72 ℃ 10min。pcr产物经2%的琼脂糖凝胶电泳检测,扩增的目的片段大小为184bp(seq id no.1),电泳图见图1。将剩余的扩增产物送至上海英俊生物技术有限公司克隆测序,应用dnastar中的seqman软件将测序结果与 genbank中兔的相关基因片段序列比对分析进行比对,寻找snps。
24.利用上述引物,以167只福建白兔、101只闽西南黑兔、30只新西兰白兔和84只福建黄兔个体dna为模板检测上述snp位点的基因型。
25.首先对福建地方肉兔基因组dna进行三轮pcr扩增。第一轮pcr反应体系10μl:10
×
buffer 1μl、50nm上游引物1μl、50nm下游引物1μl、2.5mm dntp 0.8μl、热启动taq酶0.5u、模板dna 2μl、100mm mg
2 1μl、补充ddh2o至终体积10μl;pcr的运行程序如下:95℃ 15min;94℃ 30s,60℃ 10min,72℃ 30s,共4个循环;94℃ 30s,60℃ 1min,72℃ 30s,共20个循环。第二轮pcr反应体系10 μl:第一轮pcr所得产物3μl、10
×
buffer 1μl、2.5mm dntp 0.8μl、热启动taq酶0.5u、100mm mg
2 1μl、补充ddh2o至终体积10μl;pcr的运行程序如下:95℃ 15min;94℃ 30s,60℃ 10min,72℃ 30s,共4个循环;94℃ 30s,65℃ 1min,72℃ 30s,共40个循环。第三轮pcr反应体系20 μl:第二轮pcr所得产物10μl、10
×
buffer 2μl、2μm barcode 3.6μl、2.5mm dntp 0.8μl、热启动taq酶0.5u、100mm mg
2 1μl、补充ddh2o至终体积20μl;pcr的运行程序如下:95℃ 15min;94℃ 30s,60℃ 4min,72℃ 30s,共4个循环;94℃ 30s,65℃ 1min,72℃ 30s,共40个循环。第三轮扩增结束后,将pcr产物进行琼脂糖凝胶电泳检测,pcr产物上样5μl。
26.接着进行pcr产物的回收。将382只福建地方肉兔dna样本扩增得到的合格pcr扩增产物各取5μl转移至同一u型槽中混合,然后取200μl混合物转移至新的圆底离心管,涡旋震荡30s后将离心管固定摇床,常温、250rpm,震荡过夜。然后将混样文库进行琼脂糖凝胶电泳,电泳后回收含有目的片段的胶块,回收后的产物于4℃暂存备用。
27.然后进行snp分型。将上述存于4℃的产物委托上海翼合生物有限公司通过illumina x
‑
10测序平台进行二代测序分型(ngs,next
‑
generation sequencing),测序结果利用illumina rta和illumina bcl2fastq软件进行图像识别和基因型分型及统计。382
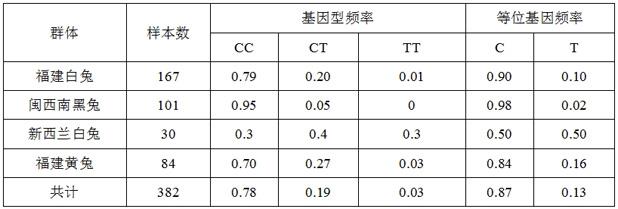
只肉兔肌肉胆固醇和低密度脂蛋白含量相关snp位点的基因分型见图2。不同基因型及等位基因在382只肉兔中的分布频率如表1所示,cc基因型频率为0.78,tt基因型频率为0.03,ct基因型频率为0.19,c等位基因频率为0.87,t等位基因频率为0.13。
28.表1 不同肉兔群体基因型及等位基因频率5. snp分子标记与肉兔肌肉滴水损失性状的关联分析采用sas 9.4软件的glm模型进行方差分析,对多态位点的各个基因型与肉兔肌肉滴水损失性状进行关联分析。分析模型为:y
ijkl
=μ g
i
b
j
p
k
s
i
e
ijkl
其中,y
ijkl 为兔的滴水损失,μ为均值,g
i
为基因型效应,b
j
为品种效应,p
k
为批次效应,s
i
为性别效应向量,e
ijkl
为随机误差。分析结果采用bonferrroni多重比较进行验证。
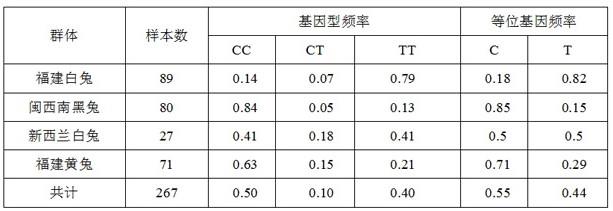
29.结果如表2所示,tt基因型个体肉兔肌肉滴水损失均值极显著低于cc基因型和ct基因型个体(p<0.01),进而证明seq id no.1所示核苷酸序列自5’端起第101bp处c/t突变与肉兔肌肉滴水损失极显著相关(p<0.01),为肉兔肌肉滴水损失相关的snp标记。由此可见,在肉兔群体中,继代选育seq id no.1所示核苷酸序列自5’端起第101bp处c/t突变位点为tt型的个体,可逐步降低肉兔的滴水损失,从而达到提高肉兔肉质性能的目的。并且,当肉兔个体seq id no.1所示核苷酸序列自5’端起第101bp处c/t突变位点为tt型时,可判定该肉兔属于滴水损失低的个体。
30.表2 snp位点的基因型与兔肉滴水损失的关联分析注:上标小写字母不同表示差异极显著(p<0.01)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。