1.本发明涉及一种抑制壳寡糖褐变的方法,属于发酵工程、酶工程领域。
背景技术:
2.壳寡糖是一种来源于海洋的具有生物活性的小分子寡糖,是由大分子壳聚糖降解得到的,其分子量小于3.2 kda。壳寡糖作为壳聚糖的水解产物,具有分子量低、水溶性好、细胞通透性高、生物活性独特、易被机体吸收利用等特点,其在营养与健康、辅助治疗、食品、医药、农业、日用化工等领域均得到了较为广泛的研究应用,是一种具有广阔应用前景的海洋功能性寡糖。
3.目前,壳寡糖的制备方法主要包括物理法、化学法和酶解法,其中酶解法反应条件温和,无污染,产物均一度高,是一种高效绿色的壳寡糖制备方法。但与采用物理法及化学法制备壳寡糖相似的是,酶解法制备壳寡糖的过程中,由于壳寡糖是带正电荷阳离子碱性氨基低聚糖,其结构中含有大量的氨基,很容易发生美拉德反应,使得壳寡糖溶液的颜色随着反应时间的增长逐渐变深,褐变程度不断增加。壳寡糖褐变会降低其纯度,影响产品品质,同时也会降低其生物活性。目前市面上出售的壳寡糖普遍存在褐变程度过高、产品颜色过深等问题,限制了壳寡糖及相关产品的推广应用。
技术实现要素:
4.针对上述现有技术,本发明提供了一种抑制壳寡糖褐变的方法。本发明还提供了mn
2
的一种新用途——在抑制壳寡糖褐变中的应用。
5.本发明是通过以下技术方案实现的:一种抑制壳寡糖褐变的方法:向壳寡糖溶液或制备壳寡糖的反应液中加入mn
2
使其终浓度为1~10 mmol/l,优选5~10 mmol/l。
6.进一步地,所述mn
2
是以锰盐的形式加入的。更进一步地,所述锰盐选自mncl2。
7.进一步地,所述制备壳寡糖的反应液是通过以下方式得到的:向浓度为0.08~0.12 g/ml的壳聚糖溶液中加入壳聚糖酶,加酶量为2.0~3.0 u/g壳聚糖,在52~58℃下酶解,酶解时间为6小时或7小时。
8.进一步地,所述壳聚糖酶,其氨基酸序列如seq id no.1所示。
9.进一步地,所述壳聚糖溶液选自壳聚糖的水溶液、壳聚糖的醋酸溶液;所述壳聚糖的醋酸溶液中,醋酸的质量百分数为2.5%~3.5%,优选3.0%。
10.mn
2
在抑制壳寡糖褐变中的应用。
11.本发明的抑制壳寡糖褐变的方法,向制备壳寡糖的反应液中加入mn
2
,经实验研究,可有效抑制壳寡糖的褐变,褐变率可降低56.4%。现有技术中有研究探讨了壳寡糖的单体氨基葡萄糖的褐变抑制,通过添加质量浓度为0.5%~1.5%的na2so3溶液抑制氨基葡萄糖的褐变,na2so3是一种还原剂,能够与酶解反应过程中的生成的氧化物质结合,从而减少氨基葡萄糖中氨基褐变反应。本发明的方法可直接抑制壳寡糖的褐变,降低壳寡糖的褐变程度,具有适用面广、成本低、操作便捷的优势。
12.本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。
附图说明
13.图1:金属离子对壳寡糖溶液褐变程度的影响图。
14.图2:不同浓度的mn
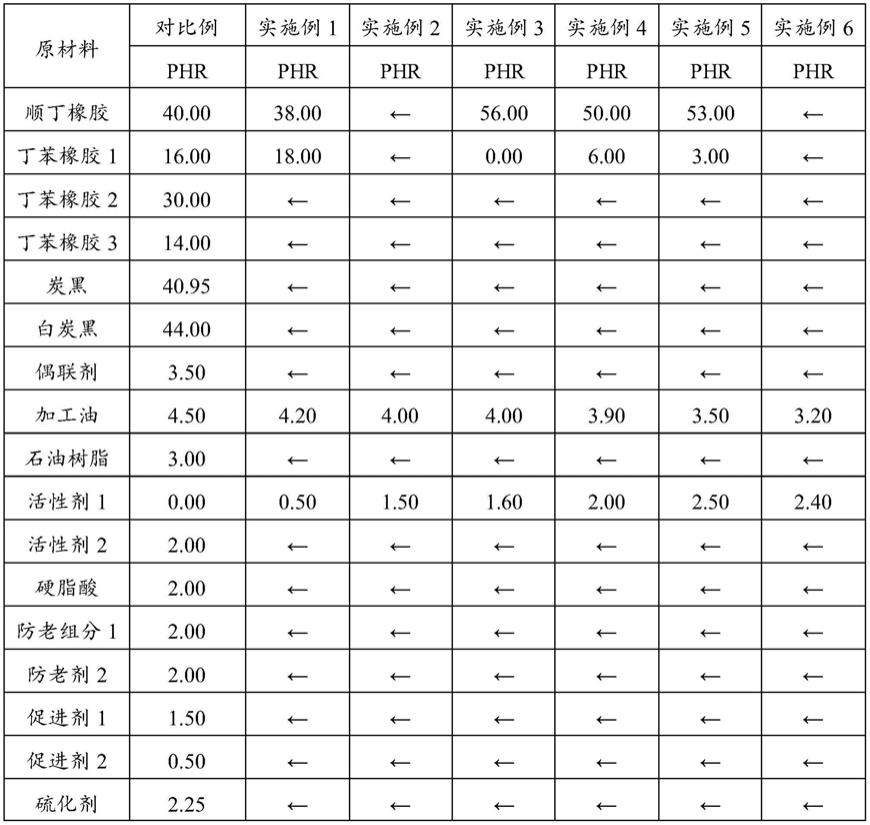
2
对壳寡糖溶液褐变程度的影响图。
15.图3:经mn
2
处理的壳寡糖溶液tlc分析结果图。
16.图4:未经mn
2
处理的壳寡糖溶液tlc分析结果图。
17.图5:壳寡糖液相色谱各聚合度含量结果图。
具体实施方式
18.下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域技术人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
19.下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
20.本发明各实施例中,所采用的壳聚糖购自上海源叶生物科技有限公司,商品名称为壳聚糖,商品号为a25o10k00987,脱乙酰度90 %以上。
21.本发明各实施例中,所采用的壳聚糖的醋酸溶液中醋酸的质量百分数为3%。
22.本发明各实施例中,所采用的壳聚糖酶均是以含壳聚糖酶的溶液的形式加入的。含壳聚糖酶的溶液是发酵菌株得到的,具体的制备方法为:(1)菌种活化:取lb培养基,高压灭菌锅中115 ℃高压灭菌30 min,冷却备用;将保存在保菌管里的菌种(菌种分类命名为bacillus subtilis,来自中国微生物菌种保藏管理委员会普通微生物中心,保藏号:cgmcc no.1.14985,保藏日期为2014年12月10日,保藏人为毛相朝;该枯草芽孢杆菌能表达氨基酸序列如seq id no.1所示的壳聚糖酶;该枯草芽孢杆菌是现有技术中已经公开的菌株)按照1%(体积比)接种量移种至lb培养基中,在37℃、200 rpm摇床活化12小时,得到种子液。
23.(2)发酵培养:将种子液按照1%(体积比)的接种量接种至500 l发酵罐中,发酵温度30℃,搅拌转速150 rpm,通气量1.25 vvm,利用质量百分数为10 %的醋酸溶液及质量百分数为10%的氨水控制发酵ph恒定7.0(
±
0.1),发酵时间24小时;发酵液10000 rpm 离心2 min,得上清液,即为含壳聚糖酶的溶液,测得其酶活力为25 u/ml。
24.壳聚糖酶活的定义:水解壳聚糖产生1 μmol氨基葡萄糖所需要的壳聚糖酶量。
25.采用dns法测定酶活力:取一定量的发酵液,在10000 rpm条件下离心2 min得上清液,同时,取10 μl上清液沸水浴20 min灭活(作为空白对照组)。取10 μl上清液,加入190 μl的浓度为0.02 g/ml的壳聚糖的醋酸溶液及400 μl的ph=5.6的hac-naac缓冲液,振荡混合均匀,在55℃水浴条件下反应15 min,取出后摇匀,取出200 μl反应液,加入300 μl 的dns试剂终止反应,沸水浴反应显色10 min后冰浴冷却,10000 rpm离心1 min,取上清液200 μl,加入1 ml水稀释后在540 nm条件下测量吸光值。
26.壳聚糖酶的氨基酸序列如下所示(如seq id no.1所示):mngkrniftcisivgiglasfsnssfaasvtdnsiqnsipvvnqqvtaakemkpfpqqvnyagvikpn
hvtqeslnasvrsyydnwkkkylkndlsslpggyyvkgeitgdadgfkplgtsegqgygmiitvlmagydsnaqkiydglfktartfkssqnpnlmgwvvadskkaqghfdsatdgdldiayslllahkqwgsngavnylkeaqdmitkgikasnvtnnsrlnlgdwdskssldtrpsdwmmshlrafyeftgdktwltvinnlydvytqfsnkyspntglisdfvvknppqpapkdflneseytnayyynasrvplrivmdyamygekrskvisdkvsswiqnktngnpskivdgyqlngsnigsyptgvfvspfiaasitnsnnqkwvnsgwdwmknkregyfsdsynlltmlfitgnwwkpipdnkktqnqindaiyegydn。
27.实施例1金属离子对壳聚糖水解液褐变的影响向600ml浓度为0.10g/ml的壳聚糖的醋酸溶液中加入6ml含壳聚糖酶的溶液(加酶量为2.5u/g壳聚糖)。均分为6份,取其中5份,分别加入mgcl2、mncl2、cacl2、kcl、bacl2,使金属离子的终浓度为1mmol/l,最后1份不加金属离子,作为对照,于55℃、200rpm水浴摇床反应6小时;酶解液加水稀释,酶解液与水的体积比为1:9,于420nm条件下测量吸光值,以测量值作为褐变指数,探究金属离子对壳寡糖褐变的影响。
28.结果如图1所示,与未添加金属离子相比,当酶解液中存在1mmol/l的mn
2
时,反应6小时后褐变程度降低了43.7%,而其他种类的金属离子(mg
2
、ca
2
、k
、ba
2
)对酶解液的褐变基本无影响。
29.实施例2壳聚糖水解液褐变控制向500ml浓度为0.10g/ml的壳聚糖的醋酸溶液中加入5ml含壳聚糖酶的溶液(加酶量为2.5u/g壳聚糖)。均分为5份,取其中4份,分别加入mncl2,使其终浓度分别为1mmol/l、2mmol/l、5mmol/l、10mmol/l,最后1份不加mncl2,作为对照,于55℃、200rpm水浴摇床反应,从反应开始间隔1小时取样。将不同时间段(1小时、2小时、3小时、4小时、5小时、6小时、7小时)的酶解液加水稀释,酶解液与水的体积比为1:9,于420nm条件下测量吸光值,以测量值作为褐变指数,探究抑制壳寡糖褐变的最佳mn
2
浓度。
30.实验结果如图2所示,由图2可知,在酶解7小时时,与未添加mn
2
的对照组相比,1~10mmol/l的mn
2
能有效抑制壳寡糖溶液的褐变,最高可使褐变率降低56.4%。不同浓度的mn
2
在反应1~5小时内对壳寡糖溶液的抑制效果差别不大,在反应进行到6小时时,5~10mmol/l的mn
2
的抑制褐变效果与1~2mmol/l的mn
2
相比,效果提升了约10%,与未添加mn
2
对照组相比,褐变率降低了54.1%。在反应进行到7小时时,5~10mmol/l的mn
2
的抑制褐变效果与1~2mmol/l的mn
2
相比,效果提升了约20%,与未添加mn
2
对照组相比,褐变率降低了56.4%。
31.以上的实验结果表明,随着酶解时间的延长,mn
2
对壳寡糖褐变抑制效果越明显,mn
2
浓度越高,抑制褐变的效果越好。5mmol/l的抑制效果与10mmol/l的抑制效果相差不大,因此在浓度达到5mmol/l时,继续增加mn
2
的浓度对褐变的抑制影响不大。
32.实施例3酶解终产物的变化向200ml浓度为0.10g/ml的壳聚糖的醋酸溶液中加入2ml含壳聚糖酶的溶液(加酶量为2.5u/g壳聚糖)。均分为2份,其中一份加入mncl2,使其终浓度为5mmol/l(作为实验组),另一份不加mn
2
(作为对照组),于55℃、200rpm水浴摇床反应,从反应开始间隔1小时取样。
33.利用薄层色谱法(tlc)分析该酶液水解壳聚糖的产物,将取得的样品点板后在展开剂(体积比8:3:1的异丙醇-水-氨水)中展开两次,展开结束后吹风机吹干并用染色剂(0.1%茚三酮-乙醇溶液)染色,于110℃条件下显色10min,观察水解产物条带分布情况,结
果如图3、图4所示,其中图3为添加mn
2
处理组,图4为未添加mn
2
对照组,std为壳寡糖标准品混合物(1~6糖),从上到下glcn~(glcn)6分别表示聚合度1~6的壳寡糖标准品。对比图3、图4可知,mn
2
的添加对壳寡糖的聚合度没有影响。
34.通过液相色谱分析实验组与处理组各聚合度壳寡糖含量(重量百分比),结果如图5所示,其中,实验组中,各壳寡糖的含量为:glcn的含量为0.84%,(glcn)2的含量为20.44%,(glcn)3的含量为24.17%,(glcn)4的含量为21.29%,(glcn)5的含量为20.70%,(glcn)6的含量为12.56%;对照组中,各壳寡糖的含量为:glcn的含量为0.84%,(glcn)2的含量为19.70%,(glcn)3的含量为24.57%,(glcn)4的含量为21.51%,(glcn)5的含量为20.74%,(glcn)6的含量为12.64%。对比实验组和对照组的数据可知,mn
2
的添加对壳寡糖的聚合度几乎没有影响,能够保证不同批次壳寡糖产品的稳定性。
35.给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。