抗tau抗体及其用途
技术领域
1.本发明涉及一种特异性结合tau蛋白的抗tau抗体及其用途。
背景技术:
2.阿尔茨海默氏病占痴呆发病形式的约50%,是一种自65岁起发病率增加的退行性脑神经疾病,并且随着人口老龄化,其在全世界范围内迅速增加。
3.据信,阿尔茨海默氏病发病的原因主要归因于β-淀粉样蛋白的积累、tau蛋白的过度磷酸化、或由早老素1引起的β-淀粉样蛋白产生增加。这些之中,由β-淀粉样蛋白积累引起的神经细胞毒性被认为是阿尔茨海默氏痴呆发病的主要原因(hardy aj等人,science,256,184-185,1992)。然而,随着作为美国礼来公司(eli lilly and company)的阿尔茨海默氏病新药候选物的索拉珠单抗(solanezumab)的iii期试验失败,已经发现由β-淀粉样蛋白积累引起的神经细胞毒性并不显著。因此,重点是tau蛋白的异常过度磷酸化是阿尔茨海默氏病发病的主要原因。
4.tau蛋白是一种稳定微管的蛋白,微管是一种运输细胞物质的蛋白。tau蛋白在人体内以六种同种型存在,并且在中枢神经系统的神经元中是丰富的。此外,在tau蛋白发生突变的情况下,已知tau蛋白被过度磷酸化,这允许神经元纤维缠结(neurofibrillary tangles,nfts)在神经细胞中异常积累,从而导致退行性神经疾病,例如痴呆和帕金森氏病(dong hee choi等人,brain&neurorehabilitation,4,21-29,2011)。
5.然而,由441个氨基酸组成的人tau蛋白具有各种可能发生翻译后修饰的位置,这使得难以在tau蛋白中找到对痴呆表现出预防或治疗效应的靶部分。由于此类各种修饰,开发治疗剂也有困难。
技术实现要素:
6.技术问题
7.因此,本发明人已经研究开发了一种用于退行性神经疾病的有效治疗剂。因此,本发明人已发现,抗体减少了tau蛋白的聚集,所述抗体特异性结合其中第280个赖氨酸被乙酰化的tau蛋白的片段。此外,本发明人已发现在使用痴呆诱导的动物模型的实验中,已经施用了该抗体的动物模型表现出了改善的运动功能和认知功能。
8.问题的解决方案
9.为了解决上述问题,在本发明的一个方面中,提供了一种抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含(i)重链可变区(heavy chain variable region,vh),所述重链可变区包含具有由seq id no:1表示的氨基酸序列的重链cdr1、具有由seq id no:2表示的氨基酸序列的重链cdr2和具有由seq id no:3表示的氨基酸序列的重链cdr3;和(ii)轻链可变区(light chain variable region,vl),所述轻链可变区包含具有由seq id no:4表示的氨基酸序列的轻链cdr1、具有由seq id no:5表示的氨基酸序列的轻链cdr2和具有由seq id no:6表示的氨基酸序列的轻链cdr3。
10.在本发明的另一方面中,提供了一种多核苷酸,所述多核苷酸编码所述抗tau抗体或其抗原结合片段、或所述抗tau抗体的重链可变区和/或轻链可变区。
11.在本发明的另一方面中,提供了一种包含所述多核苷酸的表达载体。
12.在本发明的另一方面中,提供了一种导入了所述表达载体的宿主细胞。
13.在本发明的又一方面中,提供了一种用于产生抗tau抗体或其抗原结合片段的方法,所述方法包括培养所述宿主细胞的步骤。
14.在本发明的又一方面中,提供了一种保藏号为kctc 14155bp的杂交瘤。
15.在本发明的又一方面中,提供了一种用于预防或治疗退行性神经疾病的药物组合物,所述药物组合物包含所述抗tau抗体或其抗原结合片段作为活性成分。
16.在本发明的又一方面中,提供了一种用于诊断退行性神经疾病的组合物,所述组合物包含抗tau抗体或其抗原结合片段。
17.在本发明的又一方面中,提供了一种用于预防、治疗或诊断退行性神经疾病的试剂盒,所述试剂盒包含所述抗体或其抗原结合片段、所述多核苷酸、所述表达载体、或所述宿主细胞。
18.发明的有利效果
19.根据本发明的抗tau抗体可以特异性结合其中第280个赖氨酸被乙酰化的tau蛋白,并且抑制异常tau蛋白的聚集。此外,在将根据本发明的抗tau抗体施用于痴呆诱导的动物模型的情况下,所述抗tau抗体可以改善所述动物模型的运动功能和认知功能。因此,根据本发明的抗tau抗体可以有利地用于预防或治疗退行性神经疾病。
附图说明
20.图1示意性地示出了在本发明的实施方式中制备的tau蛋白片段k280-ac。
21.图2是在本发明的实施方式中使用的表达载体pet-21b-tau(k18)的示意图。
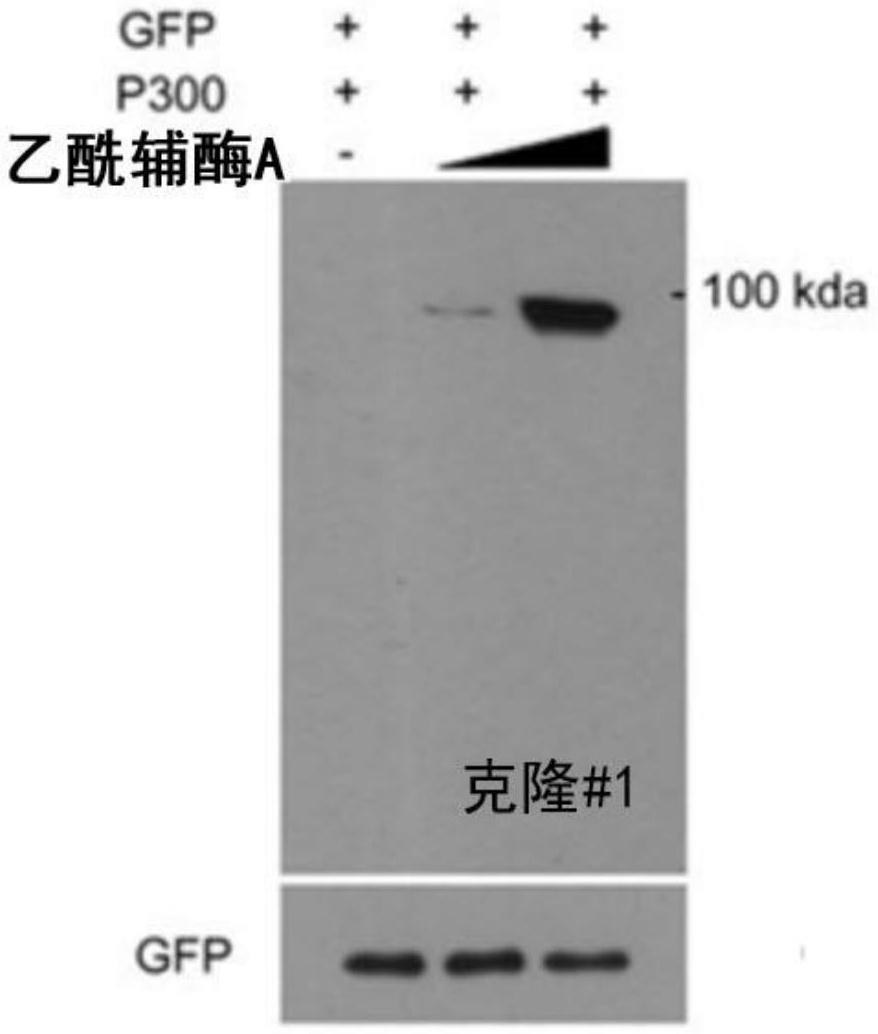
22.图3示出了为了选择特异性结合蛋白片段k280-ac的单克隆抗体而执行的用于鉴定抗体与蛋白片段k280-ac之间的结合的蛋白质印迹试验的结果。
23.图4示出了为了选择特异性结合蛋白片段k280-ac的单克隆抗体而执行的用于鉴定抗体与蛋白片段k280-ac之间的结合的elisa试验的结果。
24.图5示出了为了鉴定选定的抗体adel-y01是否与乙酰化的野生型tau蛋白(tau)和具有第280个氨基酸赖氨酸被丙氨酸取代的的tau蛋白(tau k280a)结合而执行的测试的结果。
25.图6示出了为了鉴定乙酰化野生型蛋白和非乙酰化野生型tau蛋白是否特异性结合adel-y01h_v01抗体而执行的试验的结果。
26.图7示出了使用k2系统测量的解离常数(kd)值,以鉴定adel-y01m抗体与蛋白片段k280-ac之间的亲和力。
27.图8示出了为了鉴定adel-y01h抗体(v01至v12)与蛋白片段k280-ac之间的结合而执行的elisa试验的结果。
28.图9示出了4月龄或12月龄的正常小鼠(野生型)和痴呆小鼠(tau p301l)的脑组织中的tau蛋白(tau5)和乙酰化tau蛋白(tau-ack208)的表达水平和模式。
29.图10示出了使用痴呆诱导的小鼠模型鉴定在脑室内施用adel-y01m抗体时获得的
行为改善效应的实验方案。
30.图11示出了筑巢试验的结果(***p《0.001),在该筑巢试验中将adel-y01m抗体脑室内施用到痴呆诱导的小鼠模型中。
31.图12示出了y迷宫试验的结果(*p《0.05),在该y迷宫试验中将adel-y01m抗体脑室内施用到痴呆诱导的小鼠模型中。
32.图13示出了水迷宫试验的结果,在该水迷宫试验中将adel-y01m抗体脑室内施用到痴呆诱导的小鼠模型中。
33.图14示出了在水迷宫试验中停留在每个区域所花费的时间(**p《0.01),在该水迷宫试验中将adel-y01m抗体脑室内施用到痴呆诱导的小鼠模型中。
34.图15示出了握力试验的结果(*p《0.05,**p《0.01),在该握力试验中将adel-y01m抗体脑室内施用到痴呆诱导的小鼠模型中。
35.图16示出了使用痴呆诱导的小鼠模型鉴定在腹膜内施用adel-y01m抗体时获得的行为改善效应的实验方案。
36.图17示出了筑巢试验的结果(*p《0.05,**p《0.01),在该筑巢试验中将adel-y01m抗体腹膜内施用到痴呆诱导的小鼠模型中。
37.图18示出了y迷宫试验的结果(*p《0.05),在该y迷宫试验中将adel-y01m抗体腹膜内施用到痴呆诱导的小鼠模型中。
38.图19示出了水迷宫试验的结果,在该水迷宫试验中将adel-y01m抗体腹膜内施用到痴呆诱导的小鼠模型中。
39.图20示出了在水迷宫试验中停留在每个区域所花费的时间(*p《0.05),其中在执行水迷宫试验之前,将adel-y01m抗体腹膜内施用到痴呆诱导的小鼠模型中。
40.图21示出了免疫沉淀和蛋白质印迹试验的结果,该等试验经执行以用于鉴定adel-y01m抗体与在正常小鼠(野生型)或痴呆诱导小鼠模型(tau p301l)的大脑皮层和海马组织中表达的乙酰化tau蛋白(tau-ack280)之间的结合。
41.图22示出了使用adel-y01m抗体对正常老年人的脑组织和阿尔茨海默氏病患者的脑组织进行免疫组织化学染色后拍摄的照片。
42.图23a示出了为鉴定正常老年人的脑组织或阿尔茨海默氏病患者的脑组织中的整个tau蛋白(tau5)、乙酰化tau蛋白(tau-ack280)和淀粉样β蛋白的表达水平而执行的试验的结果。
43.图23b示出了为鉴定adel-y01m抗体与在正常老年人的脑组织或阿尔茨海默氏病患者的脑组织中表达的乙酰化tau蛋白之间的结合而执行的试验的结果(*p《0.05)。
44.图24示出了为鉴定正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中完整tau蛋白(tau5)、乙酰化tau蛋白(tau-ack280)和磷酸化tau蛋白(pser396)的表达水平而执行的试验的结果。
45.图25示出了正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中完整tau蛋白(tau5)的表达水平(*p《0.05,***p《0.001)。
46.图26示出了正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中磷酸化tau蛋白(pser396)的表达水平(**p《0.01)。
47.图27示出了正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的
痴呆诱导的小鼠模型的脑组织中的乙酰化tau蛋白(tau-ack280)的表达水平。
48.图28示出了显示用adel-y01m抗体免疫染色的脑组织的照片,其中所述脑组织是从正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型(tau-p301l-adel-y01m)获得的。
49.图29示出了正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型(tau-p301l-adel-y01m)的脑组织中at8和磷酸化tau蛋白(pt231)的表达水平(*p《0.05)。
50.图30示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型(tau-p301l-adel-y01m)的脑组织中完整tau蛋白(tau5)、乙酰化tau蛋白(tau-ack280)和磷酸化tau蛋白(pt231)的表达水平。
51.图31示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中完整tau蛋白(tau5)的表达水平(*p《0.05)。
52.图32示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中的乙酰化tau蛋白(tau-ack280)的表达水平(*p《0.05)。
53.图33示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中的磷酸化tau蛋白(pt231)的表达水平(*p《0.05)。
54.图34示出了正常小鼠、痴呆诱导的小鼠模型和脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中突触相关蛋白(psd95和突触蛋白-1)的表达水平。
55.图35示出了正常小鼠、痴呆诱导的小鼠模型、脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中psd95的表达水平(*p《0.05)。
56.图36示出了正常小鼠、痴呆诱导的小鼠模型、脑室内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中突触蛋白-1的表达水平(*p《0.05)。
57.图37示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中突触相关蛋白(psd95和突触蛋白-1)的表达水平。
58.图38示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中psd95的表达水平(*p《0.05)。
59.图39示出了正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织中突触蛋白-1的表达水平(*p《0.05)。
60.图40示出了为鉴定adel-y01m抗体是否渗透入正常小鼠、痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的痴呆诱导的小鼠模型的脑组织以及抗体是否与tau蛋白结合而执行的试验的结果。
61.图41示出了使用老年痴呆诱导的小鼠模型鉴定在脑室内施用adel-y01m抗体时获得的行为改善效应的实验方案。
62.图42示出了筑巢试验的结果(*p《0.05),在该筑巢试验中将adel-y01m抗体脑室内施用到老年痴呆诱导的小鼠模型中。
63.图43示出了y迷宫试验的结果(*p《0.05),在该y迷宫试验中将adel-y01m抗体脑室内施用到老年痴呆诱导的小鼠模型中。
64.图44示出了在水迷宫试验中停留在每个区域所花费的时间(*p《0.05),在该水迷宫试验中将adel-y01m抗体脑室内地施用到老年痴呆诱导的小鼠模型中。
65.图45示出了正常小鼠、老年痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的老年痴呆诱导的小鼠模型的脑组织中完整tau蛋白(tau5)、乙酰化tau蛋白(tau-ack280)和磷酸化tau蛋白(pt231)的表达水平。
66.图46示出了正常小鼠、老年痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的老年痴呆诱导的小鼠模型的脑组织中完整tau蛋白(tau5)的表达水平(*p《0.05,**p《0.01)。
67.图47示出了正常小鼠、老年痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的老年痴呆诱导的小鼠模型的脑组织中乙酰化tau蛋白(tau-ack280)的表达水平(**p《0.01)。
68.图48示出了正常小鼠、老年痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的老年痴呆诱导的小鼠模型的脑组织中完整磷酸化tau蛋白(pt231)的表达水平(*p《0.05)。
69.图49示出了为了针对每个级分鉴定正常小鼠、老年痴呆诱导的小鼠模型和腹膜内地施用了adel-y01m抗体的老年痴呆诱导的小鼠模型的大脑皮层中的不溶性tau聚集体而执行的试验的结果。
70.图50示出了通过在对用乙酰化tau蛋白处理的供体细胞进行裂解后执行的蛋白质印迹试验鉴定出的血凝素(ha)、完整tau蛋白(tau5)和乙酰化tau蛋白(tau-ack280)的表达水平。
71.图51示出了通过在获得用乙酰化tau蛋白处理的供体细胞培养基后执行的蛋白质印迹试验鉴定出的血凝素(ha)、完整tau蛋白(tau5)和乙酰化tau蛋白(tau-ack280)的表达水平。
72.图52示出了通过在将用乙酰化tau蛋白处理的供体细胞培养物施加至神经细胞并在1小时或20小时后对神经细胞进行裂解之后执行的蛋白质印迹试验鉴定出的细胞内tau蛋白聚集体。
73.图53示出了通过在将用乙酰化tau蛋白处理的供体细胞培养物施加至神经细胞并在1小时或20小时后对神经细胞进行裂解之后执行的蛋白质印迹和免疫沉淀试验鉴定出的细胞内tau蛋白聚集体。
74.图54示出了通过在用蛋白片段k280-ac或其聚集体和adel-y01h01_v01抗体处理tau-rd-p301s fret生物传感器细胞之后执行的fret鉴定出的tau蛋白接种抑制效应(**p《0.01,***p《0.001)。
75.图55示出了通过在用来自阿尔茨海默氏病患者的十二烷基肌氨酸钠(sarkosyl)不溶性级分和用adel-y01h01_v01抗体处理tau-rd-p301s fret生物传感器细胞之后执行的荧光共振能量转移(fluorescence resonance energy transfer,fret)鉴定出的tau蛋白接种抑制效应(**p《0.01)。
76.图56示出了显示用抗at8抗体免疫染色的脑组织的照片,其中脑组织是在将来自阿尔茨海默氏病患者的十二烷基肌氨酸钠不溶性级分施用于tau-p301l痴呆小鼠的左海马中的ca1层中之后提取的(ipsi:同侧,contra:对侧)。
77.图57示出了显示用抗at8抗体免疫染色的脑组织的照片,其中脑组织是在将来自阿尔茨海默氏病患者的十二烷基肌氨酸钠不溶性级分施用于tau-p301l痴呆小鼠的左海马
中的ca1层中之后提取的(dg:齿状回,ec:内嗅皮层)。
78.图58和图59是显示用抗at8抗体免疫染色脑组织的程度的图,其中脑组织是在将来自阿尔茨海默氏病患者的十二烷基肌氨酸钠不溶性级分施用于tau-p301l痴呆小鼠的左海马中的ca1层中之后提取的(*p《0.05,**p《0.01)。
79.图60示出了为了鉴定在用igg或adel-y01m抗体处理乙酰化tau蛋白之后乙酰化tau蛋白聚集的变化而执行的硫黄素-t试验的结果。
80.图61示出了为了鉴定在用adel-y01m抗体处理tau蛋白(k18)、乙酰化tau蛋白(k18 p300)和聚集的乙酰化tau蛋白(k18 p300 肝素)之后聚集的乙酰化tau蛋白(tau-ack280)的量的变化而执行的试验的结果。
81.图62是显示在用乙酰化tau蛋白聚集体处理用igg或adel-y01m抗体处理过的小鼠来源的神经细胞之后获得的上清液中所包含的乳酸脱氢酶(ldh)的活性的图(***p《0.001)。
82.图63是显示在用乙酰化tau蛋白聚集体处理用igg或adel-y01m抗体处理过的小鼠来源的神经细胞之后获得的神经细胞的活力的图(*p《0.05,***p《0.001)。
83.图64是显示在用hilyte
tm
fluor 488标记的乙酰化tau蛋白聚集体处理用igg或adel-y01m抗体处理过的小鼠来源的小胶质细胞之后获得的小胶质细胞的hilyte
tm
fluor 488荧光的图。
具体实施方式
84.下文将详细描述本发明。
85.在本发明的一个方面中,提供了一种抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含:重链可变区(vh),所述重链可变区包含具有由seq id no:1表示的氨基酸序列的重链cdr1、具有由seq id no:2表示的氨基酸序列的重链cdr2和具有由seq id no:3表示的氨基酸序列的重链cdr3;和轻链可变区(vl),所述轻链可变区包含具有由seq id no:4表示的氨基酸序列的轻链cdr1、具有由seq id no:5表示的氨基酸序列的轻链cdr2和具有由seq id no:6表示的氨基酸序列的轻链cdr3。
86.如本文所用的术语“抗体”是指能结合抗原,从而干扰抗原的作用或消除抗原的免疫蛋白。有五种类型的抗体:igm、igd、igg、iga和ige,并且这些抗体分别含有由重链恒定区基因μ、δ、γ、α和ε产生的重链。在使用抗体的技术中,主要使用igg。igg具有四种同种型:igg1、igg2、igg3和igg4,并且它们的结构和功能特征可能不同。
87.igg形成由两个重链(约50kda)蛋白和两个轻链(约25kda)蛋白构成的y形稳定结构(分子量:约150kda)。在抗体中,轻链和重链由可变区和恒定区组成,所述可变区的氨基酸序列因抗体而异,所述恒定区的氨基酸序列在各抗体中相同。重链恒定区中有ch1、h(铰链)、ch2和ch3结构域。结构域中的每个结构域由两个β折叠组成,并且所述结构域通过分子内二硫键彼此连接。重链和轻链的两个可变区组合以形成抗原结合位点。抗原结合位点存在于两个y形臂中的每个y形臂上。能够结合抗原的部分被称为fab(抗体结合片段),并且不结合抗原的部分被称为fc(可结晶片段)。fab和fc通过柔性铰链区彼此连接。
88.如本文所用的术语“cdr”是指高变区,所述高变区是抗体的重链可变区和轻链可变区中的位点,并且其氨基酸序列因抗体而异,其中所述位点与抗原结合。在抗体的三维结
构中,cdr形成为抗体表面上的环,并且在环下,存在用于在结构上支撑cdr的构架区(framework region,fr)。重链中有三个环结构,轻链中有三个环结构,并且这六个区域环结构组合在一起以直接接触抗原。
89.重链可变区可包括选自由seq id no:7至seq id no:11组成的组的任何一个氨基酸序列,并且轻链可变区可包括选自由seq id no:12至seq id no:15组成的组的任何一个氨基酸序列。
90.此外,抗tau抗体或其抗原结合片段可以是选自以下组中的任何一者:
91.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:7表示的氨基酸序列,所述轻链可变区具有由seq id no:12表示的氨基酸序列;
92.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:8表示的氨基酸序列,所述轻链可变区具有由seq id no:13表示的氨基酸序列;
93.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:8表示的氨基酸序列,所述轻链可变区具有由seq id no:14表示的氨基酸序列;
94.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:8表示的氨基酸序列,所述轻链可变区具有由seq id no:15表示的氨基酸序列;
95.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:9表示的氨基酸序列,所述轻链可变区具有由seq id no:13表示的氨基酸序列;
96.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:9表示的氨基酸序列,所述轻链可变区具有由seq id no:14表示的氨基酸序列;
97.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:9表示的氨基酸序列,所述轻链可变区具有由seq id no:15表示的氨基酸序列;
98.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:10表示的氨基酸序列,所述轻链可变区具有由seq id no:13表示的氨基酸序列;
99.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:10表示的氨基酸序列,所述轻链可变区具有由seq id no:14表示的氨基酸序列;
100.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:10表示的氨基酸序列,所述轻链可变区具有由seq id no:15表示的氨基酸序列;
101.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:11表示的氨基酸序列,所述轻链可变区
具有由seq id no:13表示的氨基酸序列;
102.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:11表示的氨基酸序列,所述轻链可变区具有由seq id no:14表示的氨基酸序列;以及
103.抗tau抗体或其抗原结合片段,所述抗tau抗体或其抗原结合片段包含重链可变区和轻链可变区,所述重链可变区具有由seq id no:11表示的氨基酸序列,所述轻链可变区具有由seq id no:15表示的氨基酸序列。
104.在轻链可变区或重链可变区的cdr1、cdr2和cdr3相同的情况下,可以修饰其构架部分。特别地,构架部分的一部分的氨基酸序列可以被修饰以制备人源化抗体。
105.根据本发明的实施例的抗tau抗体的氨基酸序列和seq id no.汇总在下表1和表2中。
106.[表1]
[0107][0108]
[表2]
[0109]
[0110]
[0111]
[0112]
[0113][0114]
根据本发明的实施例的抗tau抗体的核苷酸序列汇总在下表3中。
[0115]
[表3]
[0116][0117]
[0118]
如本文所用的术语“adel-y01m”是指特异性结合蛋白片段的小鼠抗体,所述蛋白片段具有由seq id no:25表示的tau蛋白的氨基酸序列中的第275至第286个氨基酸序列区段,其中第280个氨基酸被乙酰化。此外,如本文所用的术语“adel-y01h”是指通过人源化adel-y01m抗体而获得的抗体。
[0119]
抗体的抗原结合片段可以是选自由以下项组成的组的任何一者:fab、scfv、f(ab')2、和fv。该片段是指除可结晶区(fc区)之外的抗原结合结构域,该可结晶区具有将与抗原结合引起的刺激传递到细胞、补体等的功能(效应子功能),并且该片段可包括第三代片段,例如单结构域抗体和微抗体。
[0120]
该片段的优点在于,它具有良好的进入血脑屏障的渗透率,因为该片段的大小小于完整结构的igg的大小,并且它因为可以在细菌中生产而具有低生产成本。此外,由于所述抗体片段缺乏fc,因此所述抗体片段用于不希望有将与抗原结合引起的刺激传递到细胞、补体等的功能的情况。由于该片段在人体内的半衰期短,因此该片段适合于在活体中进行诊断。然而,在构成抗体的氨基酸中,一些碱性、酸性或中性氨基酸被彼此取代的情况下,抗体本身固有的等电点(pi)可能改变。抗体等电点的这种变化可能导致例如抗体体内毒副作用降低或水溶性增加的变化。因此,在治疗性抗体的情况下,考虑到该治疗性抗体的亲和力或结构形式,可以使用完整结构的igg。
[0121]
抗tau抗体或其抗原结合片段的重链可变区可以具有包含选自seq id no:7至seq id no:11的任何一个氨基酸序列的重链可变区序列,或者它可以与所述重链可变区序列具有95%、97%、98%、或99%的同源性。
[0122]
抗tau抗体或其抗原结合片段的轻链可变区可以具有包含选自seq id no:12至seq id no:15的任何一个氨基酸序列的轻链可变区序列,或者它可以与所述轻链可变区序列具有至少95%、97%、98%、或99%的同源性。
[0123]
抗tau抗体或其抗原结合片段可以与包含选自seq id no:7至seq id no:11的任何一个氨基酸序列的重链可变区序列并且与包含选自seq id no:12至seq id no:15的任何一个氨基酸序列的轻链可变区序列具有至少95%、97%、98%、或99%的同源性。
[0124]
抗tau抗体可以通过用于制备单克隆抗体的已知技术容易地制备。单克隆抗体可以通过使用来自免疫动物的b淋巴细胞获得杂交瘤或通过使用噬菌体展示技术来制备。然而,用于制备单克隆抗体的方法不限于此。
[0125]
在本发明的一个实施方式中,通过制备b淋巴细胞作为杂交瘤细胞系可以容易地制备抗tau抗体的单克隆抗体,所述b淋巴细胞是通过向小鼠注射蛋白质片段(k280-ac)获得的,所述蛋白质片段具有seq id no:25的野生型tau蛋白质的氨基酸序列中的第275至第286个氨基酸序列区段,其中第280个氨基酸被乙酰化。
[0126]
在本发明的另一个方面中,提供了一种多核苷酸,所述多核苷酸编码抗tau抗体或其抗原结合片段。在本发明的另一个方面中,提供了一种多核苷酸,所述多核苷酸编码抗体的重链或轻链,所述抗体包含抗tau抗体或其抗原结合片段的重链可变区和轻链可变区。具体地,所述多核苷酸可包含选自由seq id no:16至seq id no:20组成的组的任何一个核苷酸序列和/或选自由seq id no:21至seq id no:24组成的组的任何一个核苷酸序列。
[0127]
多核苷酸可以选自下组中的任何一者:
[0128]
包含由seq id no:16表示的核苷酸序列和/或由seq id no:21表示的核苷酸序列
的多核苷酸;
[0129]
包含由seq id no:17表示的核苷酸序列和/或由seq id no:22表示的核苷酸序列的多核苷酸;
[0130]
包含由seq id no:17表示的核苷酸序列和/或由seq id no:23表示的核苷酸序列的多核苷酸;
[0131]
包含由seq id no:17表示的核苷酸序列和/或由seq id no:24表示的核苷酸序列的多核苷酸;
[0132]
包含由seq id no:18表示的核苷酸序列和/或由seq id no:22表示的核苷酸序列的多核苷酸;
[0133]
包含由seq id no:18表示的核苷酸序列和/或由seq id no:23表示的核苷酸序列的多核苷酸;
[0134]
包含由seq id no:18表示的核苷酸序列和/或由seq id no:24表示的核苷酸序列的多核苷酸;
[0135]
包含由seq id no:19表示的核苷酸序列和/或由seq id no:22表示的核苷酸序列的多核苷酸;
[0136]
包含由seq id no:19表示的核苷酸序列和/或由seq id no:23表示的核苷酸序列的多核苷酸;
[0137]
包含由seq id no:19表示的核苷酸序列和/或由seq id no:24表示的核苷酸序列的多核苷酸;
[0138]
包含由seq id no:20表示的核苷酸序列和/或由seq id no:22表示的核苷酸序列的多核苷酸;
[0139]
包含由seq id no:20表示的核苷酸序列和/或由seq id no:23表示的核苷酸序列的多核苷酸;以及
[0140]
包含由seq id no:20表示的核苷酸序列和/或由seq id no:24表示的核苷酸序列的多核苷酸。
[0141]
多核苷酸可以通过至少一个碱基的取代、缺失或插入或它们的组合进行修饰。在核苷酸序列通过化学合成制备的情况下,可以使用本领域众所周知的合成方法,例如在engles和uhlmann,angew chem inted engl.,37:73-127,1988中描述的那些方法。此类方法可以包括三酯法、亚磷酸酯法、亚磷酰胺法和磷酸氢盐法、pcr法和其他自动引物法、固体载体上的寡核苷酸合成法等。
[0142]
在本发明的又一方面中,提供了一种包含所述多核苷酸的表达载体。所述表达载体可以是质粒dna、噬菌体dna等,并且它还可以包括商业开发的质粒(puc18、pbad、pidtsamrt-amp等)、大肠杆菌(e.coli)来源的质粒(pyg601br322、pbr325、puc118、puc119等)、枯草芽孢杆菌(bacillus subtilis)来源的质粒(pub110、ptp5等)、酵母来源的质粒(yep13、yep24、ycp50等)、噬菌体dna(charon4a、charon21a、embl3、embl4、λgt10、λgt11、λzap等)、动物病毒载体(逆转录病毒、腺病毒、痘苗病毒等)、昆虫病毒载体(杆状病毒)等。在表达载体中,蛋白质的表达水平、修饰等根据宿主细胞而变化,因此优选选择和使用最适合该目的的宿主细胞。
[0143]
在本发明的又一方面中,提供了一种包含所述表达载体的宿主细胞。转化细胞的
宿主细胞可包括但不限于哺乳动物、植物、昆虫、真菌或细菌来源的细胞。作为哺乳动物细胞,可以使用cho细胞、f2n细胞、cso细胞、bhk细胞、bowes黑素瘤细胞、hela细胞、911细胞、at1080细胞、a549细胞、hek 293细胞、hek293t细胞等;然而,哺乳动物细胞不限于此。可以使用本领域技术人员已知的并且可以用作哺乳动物宿主细胞的任何细胞。
[0144]
此外,在表达载体被引入宿主细胞的情况下,可以使用以下方法:cacl2沉淀;hanahan的方法,其中将称为二甲基亚砜(dmso)的还原物质与cacl2沉淀组合使用以提高效率;电穿孔;磷酸钙沉淀;原生质体融合;使用碳化硅纤维进行搅动;农杆菌属(agrobacterium)介导的转化;peg介导的转化;硫酸葡聚糖;脂质转染胺;脱水/抑制介导的转化;等等。
[0145]
在本发明的又一方面中,提供了一种生产抗体或其抗原结合片段的方法,所述方法包括培养所述宿主细胞。具体而言,生产方法可以包括以下步骤:i)培养宿主细胞以获得培养物,以及ii)从培养物中收集抗体或其抗原结合片段。
[0146]
培养宿主细胞的步骤可以使用本领域已知的方法执行。具体而言,培养可以以分批过程进行,或者以补料分批或重复补料分批过程连续进行。
[0147]
从培养物中收集抗体或其抗原结合片段的步骤可以使用本领域已知的方法执行。具体地,收集可以用包括离心、过滤、提取、喷雾、干燥、蒸发、沉淀、结晶、电泳、分级溶解(例如,硫酸铵沉淀)、色谱法(例如,离子交换、亲和力、疏水性或尺寸排阻色谱法)等的方法进行。
[0148]
在本发明的又一方面中,提供了一种保藏号为kctc14155bp的杂交瘤。保藏号为kctc14155bp的杂交瘤可以产生adel-y01m。对于adel-y01m,参考上述对抗tau抗体或其抗原结合片段的描述。在本发明的又一方面中,提供了一种用于预防或治疗退行性神经疾病的药物组合物,所述药物组合物包含所述抗tau抗体或其抗原结合片段作为活性成分。
[0149]
退行性神经疾病可能是tau蛋白介导的神经疾病。具体地,tau蛋白介导的神经疾病可为tau蛋白病、原发性年龄相关tau蛋白病、慢性创伤性脑病变、进行性核上麻痹、皮质基底节变性、额颞叶痴呆、lytico-bodig病、帕金森症、亚急性硬化性脑膜炎、铅毒性脑病、结节性硬化症、神经节神经胶质瘤、神经节细胞瘤、脑膜血管瘤病、亚急性硬化性全脑炎、哈勒沃登-施帕茨病或脂褐质沉积病。
[0150]
此外,所述tau蛋白病可能是阿尔茨海默氏病(ad)、进行性核上麻痹(psp)、皮质基底节变性(cbd)、皮克氏病(pid)、一组统称为17号染色体相关的额颞叶痴呆合并帕金森综合征(ftdp-17)的相关疾患、肌萎缩性脊髓侧索硬化症(als)、克罗伊茨费尔特-雅各布病(cjd)、拳击痴呆(dementia pugilitica,dp)、格斯特曼-斯特劳斯勒-申克病(disease,gssd)、路易体病、慢性创伤性脑病变(cte)或亨廷顿氏病。
[0151]
所述药物组合物可进一步包含一种或多种选自由药学上可接受的载体、稀释剂和佐剂组成的组的物质。用于药物组合物的合适载体是本领域技术人员已知的,并且可以包括但不限于蛋白质、糖等。载体可以是水性或非水性溶液、悬浮液和乳液。为非水溶液的载体的示例可包括丙二醇、聚乙二醇、食用油(例如橄榄油)和可注射的有机酯(例如油酸乙酯)。
[0152]
为水溶液的载体的示例可包括水、醇/水溶液、乳液、或包含盐水和缓冲介质的悬
浮液。用于肠胃外施用的载体的示例可包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸林格氏液或固定油。用于静脉内注射的载体的示例可包括电解质补充剂(诸如基于林格氏右旋糖的电解质补充剂)、液体和营养补充剂。可以另外存在防腐剂和其他添加剂(例如抗微生物剂、抗氧化剂、螯合剂和惰性气体)。优选的防腐剂可包括福尔马林、硫柳汞、新霉素、多粘菌素b和两性霉素b。
[0153]
所述药物组合物可进一步包含佐剂(免疫调节剂或免疫增强剂)。佐剂是指在接种后增强免疫反应和/或加速吸收率的化合物或混合物,并且它可以包括任何吸收促进剂。可接受的佐剂可包括但不限于弗氏完全佐剂、弗氏不完全佐剂、皂苷、矿物凝胶剂例如氢氧化铝、表面活性剂例如溶血卵磷脂、普朗尼克多元醇、聚阴离子、肽、油或烃乳液、钥孔血蓝蛋白、二硝基苯酚等。
[0154]
药物组合物可以通过选自由以下项组成的组的任何一种施用途径施用:脑内、脑室内、腹膜内、经皮、肌内、硬膜内、静脉内、皮下和鼻内施用途径,并且其优选通过脑内、脑室内、硬膜内或腹膜内途径施用。
[0155]
具体而言,脑内、脑室内或硬膜内施用可为有用的,因为不需要考虑脑血屏障(bbb)渗透的问题。此外,脑内施用可用于希望通过向大脑中的某一区域直接施用少量药物来了解该药物对该区域的影响的情况。脑室内施用是一种向脑室施用药物的方法,并且它可以用于希望知道该药物对整个大脑区域的影响的情况。此外,硬膜内施用是一种通过将针插入脊柱的下部部分中的两个椎骨之间的脊髓周围空间来将药物注射到椎管内的方法,并且它可以用于需要药物对大脑、脊髓或覆盖大脑或脊髓的组织层(脑膜)提供快速或局部影响的情况。
[0156]
根据本发明的一个实施方式,通过腹膜内施用和脑室内施用,根据本发明的抗体已经有效改善了痴呆诱导的动物模型中的运动功能和认知功能。
[0157]
所述药物组合物以医药上有效的量施用。如本文所用的术语“医药上有效的量”是指足以使药物组合物表现出治疗效果而不引起副作用或严重或过度免疫应答的量。有效量的水平可以根据各种因素而变化,所述各种因素包括待治疗的疾患、疾患的严重程度、特定化合物的活性、施用途径、蛋白质去除速率、治疗持续时间、与蛋白质联合或同时使用的药物、个体的年龄、体重、性别、饮食习惯、整体健康状况,以及医学领域已知的因素。
[0158]
所述药物组合物的剂量理想地考虑到患者的年龄、性别、状况、药物组合物的活性成分在体内的吸收程度、失活速率和联合使用的药物来确定。基于抗体或其抗原结合片段,药物组合物可以0.0001mg/kg(体重)至300mg/kg(体重)的量施用。
[0159]
在本发明的另一个方面中,提供了一种用于预防或治疗退行性神经疾病的方法,所述方法包括将抗tau抗体或其抗原结合片段施用于预期会发展出所述退行性神经疾病或已经发展出所述退行性神经疾病的个体的步骤。
[0160]
抗tau抗体或其抗原结合片段如上所述。
[0161]
抗tau抗体或其抗原结合片段的剂量根据患者的体重、年龄、性别、健康状况、饮食、施用时间、施用方法、排泄率和疾病严重程度而在其范围内变化。单次剂量可以按每天或每周计约0.001mg/kg至300mg/kg的量施用。有效量可由治疗患者的医生酌情决定。
[0162]
抗tau抗体或其抗原结合片段的有效量可以根据各种因素而变化,所述各种因素为例如患者的年龄、体重、症状的特征和程度、当前治疗的类型、治疗的次数、剂型和施用途
径,并且可以由相关领域的专家容易地确定。
[0163]
抗tau抗体或其抗原结合片段可以与上述药理学或生理学组分一起或顺序地施用,并且其也可以与另外的常规治疗剂联合施用,其中抗tau抗体或其抗原结合片段可以与常规治疗剂顺序地或同时地施用。这种施用可以是单次或多次施用。考虑到所有上述因素,重要的是施用的量是最小量并且允许最大效应而没有副作用,并且所述量可以由本领域技术人员容易地确定。
[0164]
在本发明的又一方面中,提供了一种用于诊断退行性神经疾病的组合物,所述组合物包含抗tau抗体或其抗原结合片段。抗tau抗体可以是结合经修饰的tau蛋白的抗体。抗体如上所述。
[0165]
特别地,已经确定tau蛋白的氨基酸序列中的第280个氨基酸的乙酰化导致了tau聚集和tau蛋白介导的神经疾病。抗tau抗体或其抗原结合片段结合表位,所述表位含有由seq id no:25表示的tau蛋白的氨基酸序列中的第278至第284个氨基酸,其中第280个氨基酸被乙酰化,并且因此抗tau抗体或抗原结合片段可用于更有效地诊断tau蛋白介导的神经疾病。
[0166]
在使用抗体的情况下,用于鉴定与其结合的经修饰的tau蛋白的量的测定包括但不限于蛋白质印迹、酶联免疫吸附测定(enzyme linked immunosorbent assay,elisa)、放射免疫测定(radioimmunoassay,ria)、放射免疫扩散、ouchterlony免疫扩散、火箭免疫电泳、免疫组织学染色、免疫沉淀测定、补体固定测定、荧光激活细胞分选仪(fluorescence activated cell sorter,facs)、蛋白质芯片法等。
[0167]
在本发明的又一方面中,提供了一种用于预防、治疗或诊断退行性神经疾病的试剂盒,所述试剂盒包含所述抗tau抗体或其抗原结合片段、所述多核苷酸、所述表达载体或所述宿主细胞。
[0168]
在本发明的又一方面中,提供了一种用于退行性神经疾病的诊断试剂盒,所述试剂盒包含抗tau抗体或其抗原结合片段。
[0169]
所述试剂盒可用于测量来自个体的样品中经修饰的tau蛋白的表达水平,从而诊断退行性神经疾病。此外,抗体以及包括一种或多种其他成分并适用于测定方法的组合物、溶液或装置可以包含在其中以测量经修饰的tau蛋白的表达水平。
[0170]
可以通过使用已知方法从个体分离样品。如本文所用的术语“样品”包括但不限于样品,例如组织、细胞、血液和血浆,它们中的每一者具有不同表达水平的经修饰的tau蛋白等。
[0171]
此外,测量蛋白质的步骤可以通过蛋白质印迹、elisa、放射免疫测定、放射免疫扩散、ouchterlony免疫扩散、火箭免疫电泳、免疫组织学染色、免疫沉淀测定、补体固定测定、facs或蛋白质芯片方法进行。然而,本发明不限于此。
[0172]
通过上述测定方法,可以将正常对照中形成的抗原-抗体复合物的量与个体中形成的抗原-抗体复合物的量进行比较,并确定tau蛋白介导的神经疾病。
[0173]
如本文所用的术语“抗原-抗体复合物”是指经修饰的tau蛋白与特异于其的抗体的缀合物,并且所形成的抗原-抗体复合物的量可以通过检测标记的信号大小来定量地测量。此类检测标记可选自由以下项组成的组:酶、荧光物质、配体、发光物质、微粒子、氧化还原分子和放射性同位素,但不一定局限于此。在使用酶作为检测标记的情况下,可用的酶包
括β-葡糖醛酸酶、β-d-葡糖苷酶、β-d-半乳糖苷酶、脲酶、过氧化物酶、碱性磷酸酶等。配体包括但不限于生物素衍生物等。
[0174]
在本发明的又一方面中,提供了抗tau抗体或其抗原结合片段用于预防或治疗退行性神经疾病的用途。
[0175]
在本发明的又一方面中,提供了抗tau抗体或其抗原结合片段用于制备用于预防或治疗退行性神经疾病的药物的用途。
[0176]
在下文中,将以举例方式详细描述本发明。然而,以下实施例仅用于说明本发明,并且本发明不限于此。
[0177]
i.经修饰的tau蛋白片段和针对其的抗体的制备
[0178]
制备实施例1.经修饰tau蛋白片段的制备
[0179]
为了制备经修饰的tau蛋白片段,在由441个氨基酸组成的tau蛋白(2n4r)的氨基酸序列中,选择在阿尔茨海默氏病的发病机理中起作用并对经tau基因修饰的小鼠模型的主动免疫表现出认知功能改善效应的tau蛋白片段。如图1所示,在位于微管结合结构域中的tau蛋白片段的氨基酸序列中,指定了由12个氨基酸组成的区段。
[0180]
具体而言,蛋白片段具有seq id no:25的野生型tau蛋白氨基酸序列中的第275至第286个氨基酸序列区段,其中第280个氨基酸被乙酰化,该蛋白片段被指定为k280-ac。k280-ac蛋白片段是通过请求peptron inc.生产该片段而生产的。
[0181]
此外,在n末端结合有钥孔血蓝蛋白(klh)的k280-ac蛋白片段是通过请求anygen inc.(nam-myeon,south korea)生产该蛋白片段而生产的。使用shimadzu hplc 10avp系统,在0.05%tfa中5%至65%乙腈的浓度梯度条件下纯化在n末端结合有klh的k280-ac蛋白片段(纯度为91.8%)。
[0182]
此外,重复结构域(rd)1、2、3和4的含有seq id no:25的野生型tau蛋白氨基酸序列中的第244至第372个氨基酸(seq id no:26)的蛋白片段被指定为k18。将含有编码k18蛋白片段的基因的载体转导到大肠杆菌细胞中以产生k18蛋白片段。
[0183]
具体地,k18蛋白片段如下生产。首先将pet-21b-tau(k18)表达载体(图2)转导到大肠杆菌bl21(de3)中,并在含有浓度为50μg/ml的氨苄青霉素的lb培养基中于37℃的温度下培养,直到在600nm波长下的光密度(o.d.)达到0.6至0.8。此后,执行用0.5mm浓度的iptg进行的处理,并将所得物在37℃的温度培养3小时,并在18℃的温度培养18小时。
°
[0184]
在18小时后,将所形成的单个菌落与起子培养物一起在5ml含有浓度为50μg/ml的氨苄青霉素的lb培养基中在37℃的温度和220rpm的条件下培养约16小时。将起子培养物以1:500的比率接种到锥形瓶中,在该锥形瓶中放置5l含有浓度为50μg/ml的氨苄青霉素的lb培养基,然后在37℃的温度下培养4小时。此后,将培养物以3,500rpm离心30分钟。然后,去除上清液,并将剩余的沉淀在-20℃的温度下冷冻。
[0185]
将冷冻沉淀物以25ml/g的速率重悬于裂解缓冲液(20mm tris-hcl,1mm苯甲基磺酰氟,ph 8.0)中。使用jy99-iidn超声波均化器在1,500w的条件下裂解细胞30分钟。此后,将产物在4℃的温度和15,000rpm的条件下离心20分钟,并将上清液用0.45μm过滤器过滤。
[0186]
将滤液滤过用缓冲液a(20mm tris-hcl,ph 8.0)平衡的5ml his-trap sp柱。为了去除非特异性结合,执行用5倍柱体积(cv)的缓冲液a进行的洗涤,然后用10cv的缓冲液b(20mm tris-hcl,ph 8.0,300mm nacl)以0m至1m nacl的浓度梯度执行洗脱。
[0187]
收集含有k18蛋白片段的级分,然后将所述级分滤过用缓冲液c(20mm tris-hcl,ph 8.0,300mm nacl,50mm咪唑)平衡的5ml hi-trap sp柱。为了去除非特异性结合,执行用10cv的缓冲液c进行的洗涤。此后,用20cv的缓冲液d(20mm tris-hcl,ph8.0,300mm nacl,100mm咪唑)执行洗脱。使用10kda分子量的离心过滤器浓缩含有纯化的k18蛋白片段的洗脱液。
[0188]
乙酰化的k18蛋白片段(ack18)是通过使含有(2-羟乙基)-1-哌嗪乙烷磺酸(hepes,10mm,ph 7.4)、50mm的nacl、1.5mm的mgcl2、0.5mm的二硫苏糖醇(dtt)、2.5mm的egta、0.1mm的edta的乙酰化缓冲液与8μm浓度的k18蛋白片段、125μm浓度的乙酰辅酶a和0.5μg的为乙酰转移酶的p300酶在30℃的温度反应3小时而制备的。
[0189]
k18蛋白片段的聚集体是通过在24℃的温度下将25μm浓度的k18蛋白片段溶于25mm的dtt溶液中达1小时,并在37℃的温度和700rpm的条件下使用eppendorf thermomixer c在(2-羟乙基)-1-哌嗪乙烷磺酸(hepes,10mm,ph 7.4)、nacl(100mm)、肝素(25mm)的溶液中搅动来制备的。
[0190]
制备实施例2.结合经修饰的tau蛋白片段的抗体的制备
[0191]
制备特异性结合实施例1中制备的k280-ac蛋白片段的抗体是通过请求韩国小鼠单克隆抗体开发公司abfrontier生产该抗体而生产的。通过将k280-ac蛋白片段作为抗原注射到小鼠中而获得的b淋巴细胞是作为杂交瘤细胞生产的。此后,通过elisa筛选产生特异性结合k280-ac蛋白片段的抗体的细胞系。此外,韩国大学的抗体开发研究人员进行了噬菌体展示文库筛选,以开发特异性结合k280-ac蛋白片段的抗体。
[0192]
结果,最终选择出了一种小鼠杂交瘤细胞系(小鼠杂交瘤细胞系),并且通过噬菌体展示文库筛选选择的候选物被排除,因为它们产生的抗体具有比小鼠杂交瘤细胞系更低的亲和力。通过蛋白质印迹和elisa,体外检查由小鼠杂交瘤细胞系产生的抗体与k280-ac蛋白片段的结合。
[0193]
结果,鉴定出从#15e5杂交瘤细胞系(克隆#1)产生的抗体是特异性结合k280-ac蛋白片段的抗体(图3和图4)。最终选择由#15e5杂交瘤细胞系产生的抗体并命名为adel-y01m。
[0194]
从这种小鼠抗体开始,使用常规已知技术生产人源化抗体,所述常规已知技术包括抗体可变区分析、cdr研究、分子建模、人种系抗体分析、cdr移植和基因测序,并且这些人源化抗体被命名为adel-y01h(v01至v10)。
[0195]
另一方面,#15e5杂交瘤细胞系于2020年3月18日保藏在韩国典型培养物保藏中心(kctc),并且其被指定的微生物保藏号为kctc14155bp。
[0196]
实验例1.抗原特异性结合的鉴定
[0197]
为了鉴定在制备实施例2中制备的adel-y01m抗体与乙酰化tau蛋白的特异性结合,将野生型tau蛋白和其中第280个氨基酸赖氨酸被丙氨酸取代的tau蛋白(tau k280a)在体外乙酰化。在此,野生型tau蛋白和tau k280a蛋白的乙酰化是以与制备实施例1中乙酰化k18蛋白片段的制备方法相同的方式执行的。然后,通过蛋白质印迹检查adel-y01m抗体的抗原-抗体特异性结合反应。
[0198]
首先,通过布拉德福测定测量野生型tau蛋白和tau k280a蛋白的浓度。将蛋白质中的每种蛋白质与4x样品缓冲液(60mm tris-hcl[ph 6.8]、2%w/v sds、25%v/v甘油、
life sciences,south korea的实验动物室中与c57bl/6小鼠反交5代。然后,在无特定病原体(specific pathogen free,spe)条件下饲养小鼠。
[0212]
实验实施例3.痴呆小鼠模型的特征的鉴定
[0213]
如与正常小鼠相比,实验中使用的tau-p301l痴呆小鼠模型表现出随着老化,脑组织中tau蛋白的积累的差异。使用制备实施例2中制备的adel-y01m抗体进行免疫印迹。
[0214]
从正常小鼠和tau-p301l痴呆小鼠中提取脑,然后通过来自脑组织的十二烷基肌氨酸钠级分分离可溶性蛋白质和不溶性蛋白质。将脑样品用ra缓冲液b(100mm mes,0.75m nacl,1mm egta,0.5mm mgso4,2mm dtt,ph 6.8 蛋白酶/磷酸酶抑制剂)匀浆化。将样品在冰上孵育20分钟,并于4℃下以9,000rpm离心20分钟。在离心后,收集上清液(可溶性蛋白质)。将沉淀物用提取缓冲液(1%十二烷基肌氨酸钠、10mm tris、10%蔗糖、0.85m nacl、1mm egta,ph 7.4)匀浆化。将样品在室温下孵育1小时,并于4℃以13,000rpm离心20分钟。在离心后,收集上清液(tau聚集体)。以与实验实施例1相同的方式对分离的蛋白质进行蛋白质印迹。
[0215]
结果,发现12月龄的痴呆小鼠模型表现出脑组织中乙酰化tau蛋白的数量增加。特别地,鉴定出4月龄的痴呆小鼠模型表现出与正常小鼠相似的tau蛋白表达水平,而表现出严重痴呆症状的12月龄的痴呆小鼠模型表现出与正常小鼠相比约2倍的tau蛋白表达水平(图9)。
[0216]
实验实施例4.由adel-y01m抗体引起的行为改善效应的鉴定:脑室内施用
[0217]
为了鉴定由adel-y01m抗体引起的治疗效应,根据图10所示的实验方案,使用渗透泵将adel-y01m抗体施用于在制备实施例3中制备的tau-p301l痴呆小鼠的侧脑室。
[0218]
实验实施例4.1.通过筑巢试验鉴定行为改善效应
[0219]
执行能够鉴定小鼠的多模态脑功能的筑巢试验。
[0220]
具体而言,将饲养小鼠的笼子中的三分之二的褥草取出,并将四层无菌棉(5cm
×
5cm)放入笼子中。使一只小鼠进入一个笼子。第二天早上,分析巢的完成度。
[0221]
根据巢完成情况的得分是通过将其分为1至5分来计算的。对于所提供的无菌棉维持在90%或更高,或者几乎不被接触的情况,将该情况计算为1分;并且对于无菌棉维持在约50%至90%并且部分被撕裂的情况,将该情况计算为2分。对于无菌棉被撕裂50%或更高并散布在笼子周围的情况,将该情况计算为3分;并且对于无菌棉被撕裂90%或更高并聚集在笼子侧面的情况,将该情况计算为4分。对于无菌棉完全被撕裂且在笼子侧面形成完整巢状的情况,将该情况计算为5分。
[0222]
结果,鉴定出与正常小鼠相比,tau-p301l痴呆小鼠表现出建筑得分降低约60%,并且已经施用了adel-y01m抗体的痴呆小鼠(tau-p301l-adel-y01m)表现出与正常小鼠相似的建筑评分(图11)。
[0223]
实验实施例4.2.通过y迷宫试验鉴定行为改善效应
[0224]
执行y迷宫试验以鉴定认知功能的恢复。y迷宫试验是一项鉴定短期记忆能力的实验。具体而言,将a区、b区和c区设置在y形盒中,并允许小鼠在b区被阻断的状态下自由移动5分钟。一小时后,消除b区被阻断的状态,并在所有区都开放的状态下观察小鼠的运动5分钟。
[0225]
结果,在tau-p301l小鼠的情况下,停留在a区或c区中所花费的时间为100秒或更
短,此与正常小鼠相比减少了约50%。另一方面,在已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的情况下,停留在a区或c区中所花费的时间为约150秒,此与正常小鼠相似。根据这些结果中,可以鉴定出tau-p301l-adel-y01m痴呆小鼠的短期记忆能力得以恢复(图12)。
[0226]
实验实施例4.3.通过水迷宫试验鉴定行为改善效应
[0227]
执行水下迷宫试验以评估小鼠的学习和记忆能力。对于用于水下迷宫试验的设备和程序,使用asan institute for life sciences的实验动物室所拥有的行为设备。具体来说,水下迷宫试验耗费了总共5天。将小鼠在放置了平台和平台位置视觉提示的状态下训练4天。
[0228]
学习是通过以下方式进行的:在一个有平台的游泳池(直径1.4m,深度45cm)中装水(29
±
0.5℃)至约26.5cm的深度,然后加入1.5l全脂奶粉使水变浑浊,使得小鼠只需要提示就能记住平台。然后,使小鼠适应自由游泳60秒,并允许在平台上休息1分钟。该实验执行总共12次,其中在三个不同的起始位置进行了4组。在每次测试结束时,给予30秒的休息时间。在一组结束时,给予30到45分钟的休息时间。
[0229]
在学习4天后,在第5天执行测试。在用于评估的实验中,没有放置平台,并且测量在已经放置平台的区域中停留的次数,以便仅使用提示来鉴定小鼠是否很好地访问了平台位置。此外,允许小鼠在一分钟内到达已经放置平台的位置。如果小鼠未能在一分钟内到达平台位置,则将小鼠移出游泳池。
[0230]
首先,测量小鼠在4天学习期间找到平台所花费的时间。结果,在tau-p301l小鼠的情况下,在4天期间找到平台所花费的时间为20秒或更长。另一方面,在正常小鼠和已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的情况下,从第2天开始,找到平台所花费的时间减少至20秒或更短(图13)。
[0231]
此外,在第5天,对停留在已经放置平台的nw区中所花费的时间执行评估。结果,鉴定出tau-p301l小鼠在nw区中停留10秒或更短,而正常小鼠和已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠在nw区中停留20秒或更短(图14)。
[0232]
实验实施例4.4.通过握力试验鉴定行为改善效应
[0233]
执行握力试验以鉴定小鼠的肌肉力量。对于实验中使用的铁捆(iron bundle),使用asan institute for life sciences所拥有的行为设备。在此,将重40g的铁捆用于铁捆。通过尾巴末端抓住制备实施例3中制备的小鼠,将小鼠的前脚放在40g铁捆上,使小鼠能够抓握该铁捆。然后,在尾巴被抓住的状态下,将小鼠提升至约30cm的高度。测量直到小鼠抓不住铁捆的时间,并针对相应的小鼠进行比较。
[0234]
结果,正常小鼠表现出20秒或更短的抓取强度测量时间,而tau-p301l痴呆小鼠表现出5秒或更短的抓取强度测量时间。相反,在已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的情况下,抓取强度测量时间为20秒或更长,此比正常小鼠更长(图15)。根据这些结果,鉴定出已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的运动能力得以恢复。
[0235]
实验实施例5.adel-y01m抗体的行为改善效应的鉴定:腹膜内施用
[0236]
为了鉴定adel-y01m抗体的治疗功效,根据图16所示的实验方案,将adel-y01m抗体腹膜内地施用于制备实施例3中制备的tau-p301l痴呆小鼠3个月。
[0237]
实验实施例5.1.通过筑巢试验鉴定行为改善效应
[0238]
以与实验实施例4.1相同的方式执行能够鉴定小鼠的多模态脑功能的筑巢试验。
[0239]
结果,鉴定出与正常小鼠相比,tau-p301l痴呆小鼠表现出建筑得分降低约60%,并且已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠表现出与正常小鼠相似的建筑得分(图17)。
[0240]
实验实施例5.2.通过y迷宫试验鉴定行为改善效应
[0241]
以与实验例4.2相同的方式执行y迷宫试验,以鉴定认知功能的恢复。结果,在tau-p301l小鼠的情况下,停留在a区或c区中所花费的时间为约80秒,此与正常小鼠相比减少了约50%。另一方面,在已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的情况下,停留在a区或c区中所花费的时间为约110秒,此与正常小鼠相似。根据这些结果,可以鉴定出tau-p301l-adel-y01m痴呆小鼠的短期记忆能力得以恢复(图18)。
[0242]
实验实施例5.3.通过水迷宫试验鉴定行为改善效应
[0243]
以与实验4.3相同的方式执行水下迷宫测试。测量小鼠在4天学习期间找到平台所花费的时间。结果,在tau-p301l小鼠的情况下,在4天期间找到平台所花费的时间为20秒或更短。另一方面,在正常小鼠和已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的情况下,从第3天开始,找到平台所花费的时间减少至15秒或更短(图19)。
[0244]
此外,在第5天,对停留在已经放置平台的nw区中所花费的时间执行评估。结果,鉴定出tau-p301l小鼠在nw区中停留20秒或更短,而正常小鼠和已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠在nw区中停留约25秒(图20)。
[0245]
实验实施例6.adel-y01m抗体与小鼠组织中表达的经修饰的tau蛋白之间的特异性结合的鉴定i
[0246]
使用igg和adel-y01m抗体对正常小鼠和制备实施例3中制备的tau-p301l痴呆小鼠的大脑皮层和海马组织进行免疫沉淀(ip)和蛋白质印迹。
[0247]
首先,通过向蒸馏水中添加1%tx-100、100mm nacl和50mm hepes,并将ph调节至ph 7.4来制备样品缓冲液。随后,使用样品缓冲液再悬浮正常小鼠和tau-p301l痴呆小鼠的大脑皮层和海马组织,从而获得再悬浮的样品。用igg或adel-y01m抗体处理获得的样品中的每个样品,并使反应进行24小时。然后,用100μl的蛋白g-琼脂糖珠粒(ge healthcare life sciences)处理样品,并使反应在4℃下进行过夜。第二天,在4℃下以6,000rpm执行离心1分钟以收集样品,并用含有0.1%triton x-100的pbs执行洗涤三次。将样品用1x样品缓冲液处理,并进行蛋白质印迹。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用igg、adel-y01m抗体和hrp标记的抗小鼠igg抗体。
[0248]
结果,鉴定出在tau-p301l痴呆小鼠的大脑皮层和海马组织中,adel-y01m抗体与第280个氨基酸赖氨酸被乙酰化的tau蛋白(tau-ack280)之间存在特异性结合反应。此外,根据这些结果,鉴定出adel-y01m抗体与体内脑组织中表达的经修饰的tau蛋白良好结合(图21)。
[0249]
实验实施例7.adel-y01m抗体与人组织中表达的经修饰的tau蛋白结合的鉴定ii
[0250]
为了鉴定adel-y01m抗体与人脑组织中表达的经修饰的tau蛋白之间的特异性结合,使用adel-y01m抗体对正常老年人和阿尔茨海默氏病患者的脑组织中的颞皮层进行免疫组织化学染色。
[0251]
首先,将正常老年人和阿尔茨海默氏病患者的脑组织中的每个颞皮层切片并附着至载玻片。脑组织由netherlands brain bank提供。将切片用1x pbs洗涤,并用含有0.1%triton x-100的1x pbs在室温下执行渗透10分钟。然后,将切片洗涤并在室温下用含有3%bsa的pbs封闭1小时。将切片用1x pbs洗涤,并于4℃与adel-y01m抗体反应过夜。
[0252]
第二天,对于二氨基联苯胺(dab)染色,将通过与一抗反应过夜获得的切片用1x pbs洗涤。将切片与作为二抗的生物素化的抗小鼠igg抗体(vector laboratories,california,usa)在室温下反应1小时。将切片用1x pbs洗涤,用亲和素-生物素-过氧化物酶复合物(vector laboratories,california,usa)处理,并进行反应。使脑组织切片在dab溶液中反应10分钟,然后用1x pbs洗涤。将切片安装在加拿大香脂(sigma-aldrich)上。使用蔡司显微镜(carl zeiss,oberkochen,germany)对切片进行成像,并使用axiovision成像系统对图像进行处理。
[0253]
结果,在正常老年人的颞皮层中没有观察到adel-y01m抗体的染色,而在阿尔茨海默氏病患者的颞皮层中观察到了adel-y01m抗体的染色。此外,根据这些结果,鉴定出adel-y01m抗体与体内脑组织中表达的经修饰的tau蛋白良好结合(图22)。
[0254]
此外,通过蛋白质印迹分析正常老年人和阿尔茨海默氏病患者的脑组织。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗tau5抗体(invitrogen,ahb0042)、抗乙酰基-k280抗体(anaspec,as-56077)、抗β-淀粉样抗体(covance,sig-39300)、抗gapdh抗体(millipore,mab374)和hrp标记的抗人igg抗体。
[0255]
结果,与正常老年人的脑组织相比,在阿尔茨海默氏病患者的脑组织中观察到完整tau蛋白、乙酰化tau蛋白和β-淀粉样蛋白的表达水平升高(图23a)。特别地,在阿尔茨海默氏病患者的脑组织中观察到了约3倍多的乙酰化tau蛋白(tau-ack280)(图23b)。
[0256]
实验实施例8.脑室内地施用adel-y01m抗体后tau蛋白病缓解效应的鉴定
[0257]
为了鉴定施用adel-y01m抗体后的tau蛋白病缓解效应,提取已经脑室内地施用了igg或adel-y01m抗体的tau-p301l痴呆小鼠和正常小鼠的脑组织,并通过蛋白质印迹检查完整tau蛋白(tau5)、乙酰化tau蛋白(tau-ack280)和通过磷酸化tau蛋白的氨基酸序列中的第396个氨基酸丝氨酸而获得的tau(ser396)的表达水平。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗tau5抗体(invitrogen,ahb0042)、抗pser396抗体(thermo,44-752g)、抗乙酰基-k280抗体(anaspec,as-56077)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。
[0258]
结果,鉴定出完整tau蛋白、乙酰化tau蛋白和磷酸化tau蛋白在已经脑室内地施用了igg的tau-p301l痴呆小鼠的脑组织中以比正常小鼠的脑组织中更高的量存在。另一方面,与已经脑室内地施用了igg的tau-p301l痴呆小鼠的脑组织中相比,已经脑室内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中完整tau蛋白、乙酰化tau蛋白和磷酸化tau蛋白以更低的量存在(图24至图27)。
[0259]
此外,执行免疫组织化学染色以鉴定通过磷酸化tau蛋白的氨基酸序列中的第202个氨基酸丝氨酸和第205个氨基酸苏氨酸而获得的tau蛋白(pser202/pthr205)和磷酸化tau(pt231)在小鼠的脑组织中的表达水平。在此,以与实验实施例7中相同的方式执行免疫组织化学染色,并且使用抗at8抗体(thermo,mn1020)和抗pt231抗体(thermo,mn1040)作为一抗。
[0260]
结果,与正常小鼠的脑组织相比,在已经脑室内地施用了igg的tau-p301l痴呆小鼠的脑组织中观察到了升高表达水平的磷酸化tau蛋白。另一方面,与已经脑室内地施用了igg的tau-p301l痴呆小鼠的脑组织相比,在已经脑室内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中观察到了降低表达水平的磷酸化tau蛋白(图28和图29)。
[0261]
实验实施例9.腹膜内地施用adel-y01m抗体后tau蛋白病缓解效应的鉴定
[0262]
为了鉴定在施用adel-y01m抗体后的tau蛋白病缓解效应,提取已以50mg/kg的量腹膜内地施用了igg或adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠和正常小鼠的脑组织,并通过半变性蛋白质印迹检查完整tau蛋白(tau5)、乙酰化tau和磷酸化tau(pt231)的表达水平。在此,以与实验实施例1中的蛋白质印迹相同的方式执行半变性蛋白质印迹,不同之处在于将小鼠脑组织与不含β-巯基乙醇的2x laemmli样品缓冲液混合。此外,还使用了抗tau5抗体(invitrogen,ahb0042)、抗pt231抗体(thermo,mn1040)、抗乙酰-k280抗体(anaspec,as-56077)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。
[0263]
结果,鉴定出与正常小鼠的脑组织中相比,在已腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织中完整tau蛋白、磷酸化tau蛋白和乙酰化tau蛋白的寡聚形式以更高的量存在。另一方面,与已腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织中相比,在已腹膜内地施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的脑组织中,完整tau蛋白、磷酸化tau蛋白和乙酰化tau蛋白以明显更低的量存在(图30至图33)。
[0264]
实验实施例10.由adel-y01m抗体:脑室内施用引起的突触改善效应的鉴定
[0265]
为了鉴定在施用adel-y01m抗体后的突触改善效应,提取已经以50mg/kg的量脑室内地施用了igg或adel-y01m抗体的tau-p301l痴呆小鼠和正常小鼠的脑组织,并对突触相关蛋白执行蛋白质印迹。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗psd95抗体(abcam,ab2723)、抗突触蛋白-1抗体(chemicon,mab355)、抗β-肌动蛋白抗体(sigma,a5441)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。
[0266]
结果,与正常小鼠的脑组织相比,在已经脑室内地施用了igg的tau-p301l痴呆小鼠的脑组织中观察到了升高表达水平的psd59和突触蛋白-1。另一方面,与已经脑室内地施用了igg的tau-p301l痴呆小鼠的脑组织相比,在已经脑室内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中观察到了降低表达水平的psd59和突触蛋白-1(图34至图36)。
[0267]
实验实施例11.由adel-y01m抗体:腹膜内施用引起的突触改善效应的鉴定
[0268]
为了鉴定在施用adel-y01m抗体后的突触改善小于,提取已经以50mg/kg的量腹膜内地施用了igg或adel-y01m抗体的tau-p301l痴呆小鼠和正常小鼠的脑组织,并对突触相关蛋白执行蛋白质印迹。在此,以与实验实施例10相同的方式执行蛋白质印迹。
[0269]
结果,与正常小鼠的脑组织相比,在已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织中观察到了升高表达水平的psd59和突触蛋白-1。另一方面,与已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织相比,在已经腹膜内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中观察到了降低表达水平的psd59和突触蛋白-1(图37至图39)。
[0270]
实验实施例12.在腹膜内地施用adel-y01m抗体后adel-y01m抗体穿透入脑组织中及其与抗原结合的鉴定
[0271]
为了鉴定在腹膜内地施用adel-y01m抗体后脑组织中的抗体分布,对已经以50mg/kg的量腹膜内地施用了adel-y01m抗体的tau-p301l痴呆小鼠和正常小鼠进行生理盐水心脏灌注。然后,从其提取脑组织并用蛋白-g琼脂糖凝胶(pgs)进行免疫沉淀。此后,使用抗小鼠igg抗体执行蛋白质印迹。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗tau5抗体(invitrogen,ahb0042)、抗乙酰基-k280抗体(anaspec,as-56077)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。
[0272]
结果,在已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织中没有检测到抗体。另一方面,鉴定出抗体存在于已经腹膜内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中(图40)。
[0273]
实验实施例13.由adel-y01m抗体在老年痴呆小鼠模型中:腹膜内施用引起的行为改善效应的鉴定
[0274]
为了鉴定adel-y01m抗体的治疗效应,以与制备实施例3中相同的方式,使用14月龄的老年小鼠制备老年痴呆小鼠模型。使用所述老年痴呆小鼠模型,根据图41所示的实验方案向其中施用制备实施例2中制备的adel-y01m抗体。
[0275]
实验实施例13.1.通过筑巢试验鉴定行为改善效应
[0276]
以与实验实施例4.1相同的方式执行能够鉴定小鼠的多模态脑功能的筑巢试验。
[0277]
结果,鉴定出与正常小鼠相比,tau-p301l痴呆小鼠表现出建筑得分降低约60%,并且已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠表现出与正常小鼠相似的建筑得分(图42)。
[0278]
实验实施例13.2.通过y迷宫试验鉴定行为改善效应
[0279]
以与实验例4.2相同的方式执行y迷宫试验,以鉴定认知功能的恢复。
[0280]
结果,在tau-p301l小鼠的情况下,停留在a区或c区中所花费的时间为约80秒,此与正常小鼠相比减少了约25%。另一方面,在已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠的情况下,停留在a区或c区中所花费的时间为约120秒,此与正常小鼠相似。根据这些结果,可以鉴定出tau-p301l-adel-y01m痴呆小鼠的短期记忆能力得以恢复(图43)。
[0281]
实验实施例13.3.通过水迷宫试验鉴定行为改善效应
[0282]
以与实验4.3相同的方式执行水下迷宫测试。
[0283]
因此,在第5天,对停留在已经放置平台的nw区中所花费的时间执行评估。结果,鉴定出tau-p301l小鼠在nw区中停留10秒或更短,而正常小鼠和已经施用了adel-y01m抗体的tau-p301l-adel-y01m痴呆小鼠在nw区中停留25秒或更长(图44)。
[0284]
实验实施例14.由adel-y01m抗体在老年痴呆小鼠模型中:腹膜内施用引起的tau蛋白病缓解效应的鉴定
[0285]
为了鉴定在施用adel-y01m抗体后的tau蛋白病缓解效应,提取已以50mg/kg的量腹膜内地施用了igg或adel-y01m抗体的老年tau-p301l痴呆小鼠和正常小鼠的脑组织,并通过蛋白质印迹检查完整tau蛋白(tau5)、乙酰化tau蛋白(tau-ack280)和磷酸化tau(pt231)的表达水平。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗tau5抗体(invitrogen,ahb0042)、抗pt231抗体(thermo,mn1040)、抗乙酰基-k280抗体(anaspec,as-56077)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。
[0286]
结果,在已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织中观察到了升高表达水平的完整tau蛋白、磷酸化tau蛋白和乙酰化tau蛋白的寡聚形式。另一方面,与已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织相比,在已经腹膜内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中观察到了显著降低表达水平的完整tau蛋白、磷酸化tau蛋白和乙酰化tau蛋白(图45至图48)。
[0287]
此外,提取已经以50mg/kg的量腹膜内地施用了igg或adel-y01m抗体的老年tau-p301l痴呆小鼠和正常小鼠的脑组织,并且使用甲酸从其中部分分离出脑皮质组织。在脑皮质组织中,通过半变性蛋白质印迹检查不溶性tau聚集体。在此,以与实验实施例9中相同的方式执行半变性蛋白质印迹。
[0288]
结果,在已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织中观察到了不溶性tau聚集体增加。另一方面,与已经腹膜内地施用了igg的tau-p301l痴呆小鼠的脑组织相比,在已经腹膜内地施用了adel-y01m抗体的tau-p301l痴呆小鼠的脑组织中观察到不溶性tau聚集体显著减少(图49)。
[0289]
iii.抗tau抗体的tau接种抑制效应的鉴定
[0290]
实验实施例15.tau聚集的鉴定和乙酰化tau蛋白的接种
[0291]
首先,使野生型tau蛋白(tau)在体外与乙酰转移酶p300酶反应。用已经与p300反应的乙酰化的tau蛋白(tau-k280-ac)处理所培养的神经细胞。为了鉴定乙酰化tau蛋白是否诱导细胞内聚集,执行用乙酰化tau蛋白或野生型tau蛋白进行的处理,并且当1小时或20小时已经过去时,使用抗ha抗体(sigma-aldrich,编号11867423001)对供体细胞裂解物执行蛋白质印迹。
[0292]
在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗tau5抗体(invitrogen,ahb0042)、抗乙酰基-k280抗体(anaspec,as-56077)、抗β-肌动蛋白抗体(sigma,a5441)、抗ha抗体(sigma,编号11867423001)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。结果,在用乙酰化tau蛋白处理的供体细胞裂解物中观察到完整tau蛋白(tau5)和乙酰化tau蛋白(tau-ack280)的聚集增加(图50)。
[0293]
此外,为了鉴定细胞分泌出的tau蛋白的量是否改变,使用抗ha抗体(sigma-aldrich,编号11867423001)对供体细胞培养基进行免疫沉淀,然后执行蛋白质印迹。
[0294]
具体而言,将供体细胞培养基以13,000rpm离心1分钟,以去除细胞碎片。然后,用蛋白g-琼脂糖珠粒(ge healthcare life sciences,piscataway,nj,usa)处理供体细胞培养基,并使其在4℃下反应1小时。随后,执行用1μl的抗ha抗体进行的处理,并使反应在4℃下进行过夜。第二天,向其中添加蛋白g琼脂糖珠粒,并使反应在4℃下进行1小时。然后,在4℃下以6,000rpm离心1分钟以收集样品。将样品中的每个样品用含0.1%triton x-100的pbs洗涤两次。将样品用样品缓冲液处理,然后执行蛋白质印迹。在此,以与针对供体细胞裂解物执行的相同的方式执行蛋白质印迹。
[0295]
结果,在用乙酰化tau蛋白处理过的供体细胞培养基中观察到完整tau蛋白(tau5)和乙酰化tau蛋白(tau-ack280)的量增加(图51)。
[0296]
此外,用供体细胞培养基处理其他神经细胞(受体细胞),并且当1小时或20小时已经过去时,收集受体细胞裂解物。使用tau抗体对每个样品执行蛋白质印迹。在此,以与实验实施例1中相同的方式执行蛋白质印迹,并且使用抗tau5抗体(invitrogen,ahb0042)、抗乙
酰基-k280抗体(anaspec,as-56077)、抗β-肌动蛋白抗体(sigma,a5441)、抗ha抗体(sigma,编号11867423001)和hrp标记的抗小鼠igg抗体(bioxcell,be0083)。
[0297]
结果,在用乙酰化tau蛋白处理过的供体细胞(tau-ac-ha)的培养基处理的受体细胞的裂解物中观察到了tau蛋白聚集体(图52和图53)。
[0298]
实验实施例16.由adel y01h抗体:体外引起的tau接种抑制效应的鉴定
[0299]
为了鉴定由adel-y01h01_v01抗体引起的体外tau接种抑制效应,将k280-ac蛋白片段(mac)、其聚集体(aac)或阿尔茨海默氏病患者的脑组织中的十二烷基肌氨酸钠不溶性级分施用于tau-fret稳定细胞系统,并测量tau接种水平。向经tau接种的细胞分别施用igg和adel-y01h01_v01抗体。为此执行对比分析。
[0300]
首先,如下制备待用于处理细胞的k280-ac蛋白片段聚集体。将浓度为25μm的k280-ac蛋白质片段在24℃的温度下溶解于25mm的dtt溶液中1小时,并且在37℃的温度下700rpm的条件下使用eppendorf thermomixer c在搅拌下将所得产物溶解于含有(2-羟乙基)-1-哌嗪乙烷磺酸(hepes,10mm,ph 7.4)、nacl(100mm)和肝素(25mm)的溶液中。通过这样做,制备出了k280-ac蛋白质片段的聚集体。
[0301]
此后,将hek293 tau rd p301s-fret生物传感器(atcc crl-3275)以3.5
×
104个细胞/孔的量分配到96孔板中。在18小时后,鉴定出每个孔的约60%是否包被有hek 293tau rd p301s-fret生物传感器。然后,将8.75μl的opti-mem、1.25μl的lipofectamine 2000(invitrogen)和k280-ac蛋白片段、其聚集体、或十二烷基肌氨酸钠不溶级分混合,并使混合物在室温下反应20分钟。此后,将每个孔用混合物处理,然后在37℃的温度下执行孵育24小时。然后,使用(bmg labtech)仪器执行荧光波长分析。
[0302]
结果,在施用adel-y01h01_v01抗体的情况下,用k280-ac蛋白片段处理过的细胞显示出降低的整合fret密度;并且在施用adel-y01h01_v01抗体的情况下,用k280-ac蛋白片段的聚集体处理过的细胞也表现出降低的整合fret密度(图54)。此外,在施用adel-y01h抗体的情况下,用阿尔茨海默氏病患者的脑组织中的十二烷基肌氨酸钠不溶性级分处理过的细胞显示出降低的整合fret密度(图55)。根据这些结果,鉴定出在施用adel-y01h01_v01抗体的情况下,tau接种被抑制。
[0303]
实验实施例17.由adel-y01m抗体:体内引起的tau接种抑制效应的鉴定
[0304]
为了鉴定由adel-y01m抗体引起的体内tau接种抑制效应,在将来自阿尔茨海默氏病患者的十二烷基肌氨酸钠不溶性级分施用于在制备实施例3中产生的tau-p301l痴呆小鼠的左海马中的ca1层中之前2周开始已经静脉内地注射了igg或adel-y01m抗体。将十二烷基肌氨酸钠不溶性级分施用于tau-p301l痴呆小鼠的左海马中的ca1层。随后,以牺牲每只小鼠为代价提取出脑组织,然后切片冷冻。用抗at8抗体对脑切片进行免疫组织学染色,并检查tau接种水平。
[0305]
具体而言,对来自处于braak iv期的阿尔茨海默病患者的脑组织中的十二烷基肌氨酸钠不溶性片段(3μl,3.3μg/μl)进行超声处理,并将其注射到6月龄的tau-p301l痴呆小鼠的左海马中的ca1层(前-后:-1.9mm,内-外:1.5mm,左侧:-1.8mm)中。从施用十二烷基肌氨酸钠不溶性片段前2周开始已经以20mg/kg/周的量向tau-p301l痴呆小鼠静脉内注射igg或adel-y01m抗体;并且从施用十二烷基肌氨酸钠不溶性片段的那周至第12周,每周一次向所述小鼠静脉内注射igg或adel-y01m抗体。在此,使用10μl玻璃注射器(hamilton,0.49mm,
reno,nv)以0.2μl/min的速率注射十二烷基肌氨酸钠不溶性片段,并且在取出针之前等待5分钟之后再取出针以防止回流。在12周后,以牺牲每只小鼠为代价提取脑组织,并使用leica cm1860切成30μm厚的冷冻切片。
[0306]
对于免疫组织学染色,将脑切片中的每个脑切片用缓冲液a(1%ngs、0.2%triton x-100和30%h2o2、以及pbs)洗涤。将脑切片用含有1%ngs和0.2%triton x-100、以及igg或adel-y01m抗体的pbs处理,并使其在4℃反应过夜。将脑切片用pbs溶液洗涤几次,然后在室温下与二抗(vector laboratories)反应1小时。此后,使用vectastain abc试剂盒(vector laboratories)对脑切片进行免疫染色,并且免疫染色是根据制造商的手册执行的。使用imagej软件(nih,bethesda,md)对经染色的脑切片进行分析,并对包含海马的三个脑切片进行量化。对于用抗at8抗体染色的神经细胞,由三个盲测者用实验中使用的脑切片执行测量,并以特定阈值水平执行定量分析。使用7只已经施用了igg的tau-p301l痴呆小鼠和8只已经施用了adel-y01m抗体的tau-p301l痴呆小鼠中的bregma-1.75与bregma-2.25之间的三个脑切片进行分析。使用t检验进行统计分析。
[0307]
结果,对于已经施用了igg的tau-p301l痴呆小鼠,在与已经施用了患者的不溶性片段一侧相反的大脑区域(皮质、海马)中强烈观察到了神经细胞体的染色。另一方面,对于已经施用了adel-y01m抗体的tau-p301l痴呆小鼠,在海马和皮层中观察到了染色减少(图56至图59)。
[0308]
实验实施例18.由adel-y01m/adel-y01h抗体引起的tau聚集和接种抑制效应的鉴定
[0309]
为了鉴定由adel-y01m抗体引起的tau聚集抑制效应,执行体外tau聚集测定。将体外产生的k18蛋白片段通过与1.5μg p300和1mm乙酰辅酶a在30℃的温度反应3小时进行乙酰化。此后,使单体k18蛋白片段与25μm的乙酰化k18蛋白片段(k18-p301l)在室温下反应1小时。然后,将产物用25mm肝素57、hepes(10mm,ph 7.4)和nacl(100mm)处理,并在700rpm的条件下搅拌以诱导tau蛋白的聚集。然后,使用adel-y01m抗体,通过蛋白质印迹和硫黄素-t测定,分析其tau聚集和接种抑制效应。通过硫黄素-t分析鉴定出,与乙酰化tau蛋白聚集的情况相比,在执行用adel-y01h抗体进行的处理的情况下,乙酰化tau蛋白的聚集被抑制。
[0310]
首先,对于原纤化反应,在通过在100mm乙酸钠缓冲液(ph7.0)中添加浓度为2mm的肝素(sigma-aldrich)和dtt而获得的溶液中在37℃孵育10m至20m乙酰化tau蛋白(2n4r)。向每个孔中添加蛋白质和tht溶液(以1:1的比率)。在450nm(激发)和510nm(发射)波长下,使用(bmg labtech,ortenberg,germany)测量不同时间点处的tht荧光分析。
[0311]
用乙酰化蛋白质的聚集体处理所培养的小鼠神经细胞,并执行蛋白质印迹以鉴定结果。
[0312]
对于实验,将原代大脑皮层神经元(div10)用3μg/ml的浓度的单体k18-p301l、聚集的k18-p301l或乙酰化的k18-p301l处理24小时。在k18蛋白处理之前,用3μg/ml的adel-y01m抗体预处理神经元30分钟。
[0313]
结果,看出许多tau聚集体进入神经细胞并诱导内在tau蛋白的聚集;然而,鉴定出在用adel-y01m抗体同时处理的情况下,此类现象减少(图60和图61)。
[0314]
实验实施例19.由adel-y01m抗体引起的神经细胞保护效应的鉴定
[0315]
为了鉴定由adel-y01m抗体引起的神经细胞保护效应,首先从胚胎时期期间的小鼠脑中分离出大脑皮质神经细胞。具体而言,以牺牲16日龄小鼠为代价提取脑组织,并从中分离出大脑皮层。此后,在不含钙和镁的汉克平衡盐溶液(hank's balanced salt solution,hbss)中解剖大脑皮层组织,并在37℃下在0.125%胰蛋白酶溶液中孵育15分钟。通过用含有20%胎牛血清的杜氏改良伊格尔培养基(dulbecco's modified eagle's medium,dmem)处理使胰蛋白酶失活,并使用移液管粉碎大脑皮层组织。将所得细胞悬浮液在补充有b27补充剂(gibcobrl)的nb培养基(神经基础培养基)中稀释,并分配到包被有50μg/ml的聚-d-赖氨酸(sigma)和1μg/ml的层粘连蛋白(gibcobrl)的平板上。将神经细胞在37℃和5%co2的条件下培养10天。然后,将所培养的神经细胞用3μg/ml的乙酰化k18蛋白片段聚集体和igg或adel-y01m抗体处理,并使其反应24小时。
[0316]
在24小时后,收集上清液,并使用细胞毒性检测试剂盒(ldh,roche applied sciences)进行分析。作为用于量化细胞死亡的比色测定,使用了一种测量乳酸脱氢酶(lactate dehydrogenase,ldh)的活性的方法,所述ldh被从受损的神经细胞的胞质溶胶中释放到上清液中。使用tecan 200仪器测量490nm波长处的吸光度。结果以与阴性对照(空白)相比的细胞活力百分比表示。
[0317]
此外,使用mtt(噻唑蓝四唑鎓溴化物,sigma-aldrich,st.louis,mo,usa)还原测定来测量细胞活力。使用200仪器测量540nm波长处的吸光度,并将结果以与阴性对照(空白)相比的百分比表示。
[0318]
此外,结果是在两个独立培养物和6个孔的条件下获得的,并且所有值都表示为平均值
±
平均值的标准偏差。使用tukey多重比较检验的单因素方差分析进行统计分析。
[0319]
结果,如图62所示,在经igg处理的神经细胞中观察到了高ldh活性。另一方面,与经igg处理的神经细胞相比,在经adel-y01m抗体处理的神经细胞中观察到ldh活性降低。此外,如图63所示,在经igg处理的神经细胞中观察到了活力的极大降低。另一方面,与经igg处理的神经细胞相比,在经adel-y01m抗体处理的神经细胞中观察到了显著增加的活力。根据这些结果,鉴定出adel-y01m抗体具有针对由乙酰化tau蛋白聚集引起的神经细胞损伤的保护效应。
[0320]
实验实施例20.由adel-y01m抗体引起的小胶质细胞吞噬作用促进效应的鉴定
[0321]
为了鉴定由adel-y01m抗体引起的小胶质细胞吞噬作用促进效应,首先从2日龄至3日龄小鼠的大脑皮层中分离出原代小胶质细胞,并根据mcdonald dr等人,j neurosci.1997;17:2284-94中描述的方法进行培养。
[0322]
此后,为了分析小胶质细胞吞噬作用,根据制造商的说明,用hilyte
tm
fluor 488标记乙酰化的k18蛋白片段。为了聚集hilyte
tm
fluor 488标记的乙酰化k18蛋白质,将蛋白质分别在37℃下在含有肝素(sigma-aldrich,st.louis,mo,usa)和2mm dtt的100mm乙酸钠缓冲液(ph 7.0)中孵育,从而诱导其聚集。
[0323]
将小胶质细胞以5
×
104个细胞/孔分配在12孔板中,然后使乙酰化k18蛋白片段的聚集体(3μg/ml)在37℃下反应2小时。在用乙酰化k18蛋白片段的聚集体处理前30分钟,用浓度为4.5μg/ml的igg或adel-y01m抗体执行预处理。为了分析吞噬作用,通过用胰蛋白酶处理分离细胞,然后用1%多聚甲醛(pfa)固定。对于流式细胞术,执行使用含有200μl的2%胎牛血清的hbss溶液进行的处理,并使用facscanto
tm
ii(bd biosciences)仪器和488荧光
过滤器执行分析。
[0324]
结果,与经igg处理的小胶质细胞相比,在经adel-y01m抗体处理的小胶质细胞中观察到了被促进的吞噬作用(图64)。
[0325]
统计分析
[0326]
使用graphpad软件(graphpad prism v7.0和graphpad prism v8.0,graphpad software,san diego,ca,usa)执行统计分析。通过单因素方差分析(tukey事后检验)和学生t检验分析数据。p值小于0.05被认为是显著的。
[0327]
【保藏号】
[0328]
保藏机构的名称:韩国典型培养物保藏中心(kctc)
[0329]
保藏号:kctc14155bp
[0330]
保藏日期:2020年3月18日
[0331]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
