一种检测恶性血液病ikzf家族基因突变的引物组合及方法
技术领域
1.本发明涉及生物医药技术领域,具体是一种检测恶性血液病ikzf家族基因突变的引物组合及方法。
背景技术:
2.ikzf家族由若干具有锌指结构的转录调控蛋白组成,其n末端锌指结构具有dna结合功能,而c末端锌指结构用于ikzf家族成员之间的相互识别并结合形成同源或异源二聚体。ikzf家族成员主要包括ikaros、helios、aiolos、eos和pegasus,分别由ikzf1-5基因编码。ikzf1和ikzf2在淋系细胞的增殖和分化调控中起重要作用。同时,研究表明ikzf1和ikzf2的异构体在白血病的发生和发展中具有重要作用。ik-6是指ikzf13-6外显子缺失,是至今发现的在白血病发病机制中最重要的ikzf1异构体,是目前公认的一种高危预后标记。 ikzf2是调节性t细胞的标志基因,在肿瘤微环境中起重要作用,其基因突变与肿瘤转移、治疗方案选择及预后有密切相关性。ikzf3编码的aiolos蛋白,在淋巴细胞的分化发育中起着至关重要的作用。ikzf3突变在b细胞恶性肿瘤、慢性淋巴细胞白血病的发生发展中起关键作用。ikzf4和ikzf5也是重要的血细胞发育基因,在血液肿瘤细胞中表达量高。其基因突变不仅与肿瘤发生发展有关,还与血小板减少症的病理生理关系密切,提示其基因突变可指导患者预后分层及临床治疗选择。目前有研究报道,ikzf家族基因在急性白血病和骨髓增生异常综合征患者中突变比例较其他恶性血液病更高,且与患者预后相关,被认为是疾病的驱动因素。然而,目前只有ikzf1基因突变用于临床某些恶性血液病的检测和分型。因此,研发新方法全面检测ikzf家族5个成员在恶性血液病中的突变特征和分布,对其临床分型、预后判断及治疗方案选择等方面具有非常重要的意义。
3.传统的形态学结合流式免疫分型已不能满足精准医疗时代对恶性血液病患者诊断的需求。随着高通量测序技术的发展,发现了越来越多的与恶性血液病相关的分子学异常。携带这些分子学异常的患者往往临床治疗困难,易复发,预后差。早期识别新靶点进行精准个体化治疗成为今后治疗方向。但是,目前只有ikzf1突变检测包含在某些白血病高通量测序检测组套中,缺乏完整ikzf 家族5个成员基因突变的高通量检测方法。因此迫切需要开发针对ikzf家族基因突变更加全面、高效、简便的检测新方法,早期识别该家族基因分子学异常,有望为患者提供更精准的个体化治疗、改善预后和生存,有极大的临床价值和应用前景。
4.多重pcr技术可以在一个pcr反应体系里加入多对引物进行扩增,结合高通量测序技术,可用于待检测位点扩增后的测序。在一个pcr反应体系里加入多对待检测位点引物可以大大缩减工作量和试剂成本,同时又可满足临床希望全面、准确、快速地获取检测结果的需求,真正做到对恶性血液病患者进行精准、高效的高危亚型筛查。然而,在一个pcr反应体系里加入多对引物势必会增大引物二聚体形成的概率,导致检测效率的降低。因此,多重pcr引物及其组合的设计和优化是该技术的重点和难点,引物越多,设计难度越大。鉴于以上难点,本发明将针对ikzf1-5基因设计引物及其组合并优化,以适应临床检测特点和需
求。
技术实现要素:
5.本发明的目的在于提供一种检测恶性血液病ikzf家族基因突变的引物组合及方法,解决恶性血液病患者目前ikzf基因突变检测不能全面覆盖ikzf1-5 基因、检测困难、耗时、敏感性和精准性低等瓶颈技术问题,基于多重pcr结合高通量测序技术的引物组合和方法,用于检测恶性血液病患者ikzf1-5基因突变;方法中的引物及其组合经过多次优化,特异性、敏感性和精准性高;该技术应用于恶性血液病患者ikzf家族基因突变的检测,发挥指导临床精准分型诊断、早期筛查高危亚型、预后评估和个体化靶点治疗的重要作用。
6.本发明的目的可以通过以下技术方案实现:
7.一种检测恶性血液病ikzf家族基因突变的引物组合,包括ikzf1-5基因外显子测序的71对引物,分为两个引物池,36对引物组成第一个引物池m1,35 对引物组成第二个引物池m2。
8.进一步地,所述m1引物池序列包括m1-1f~m1-36f和m1-1r~m1-36r,m2 引物池序列包括m2-1f~m2-35f和m2-1r~m2-35r。
9.引物组合检测ikzf家族基因突变的方法,步骤如下:
10.一、恶性血液病患者单个核细胞的分离
11.1.1将采血管配平后置于低速离心机中,2500rpm
×
5min。离心后缓慢吸弃上层血浆,用无菌生理盐水将剩下的血细胞稀释至5ml,充分吹打混匀;
12.1.2取15ml离心管,标记患者姓名后加入5ml人淋巴细胞分离液,再沿管壁缓慢将骨髓或外周血稀释液滴加于淋巴细胞分离液之上,形成分层,避免两者混合;
13.1.3采用密度梯度离心法,将离心管置于低速离心机中(注意配平),2000rpm
ꢀ×
20min;离心后管中液体分为三层,上层清亮层为稀释的血浆和血小板,中间白膜层为单个核细胞,下层红色层为粒细胞和红细胞;
14.1.4缓慢吸取中间单个核细胞层,放置于另一标记患者姓名的洁净离心管中,加入10ml无菌生理盐水吹打混匀后置于低速离心机离心,2000rpm
×
5min,弃上清;
15.1.5用1ml无菌生理盐水重悬洗涤后的细胞团块,在高倍显微镜下用细胞计数板计数,计算总细胞量(细胞计数液为1%的冰醋酸,20μl细胞悬液加入到380μl的1%冰醋酸中吹打混匀,相当于稀释20倍;吸20μl加入到细胞计数板,镜下计数16个格子里的细胞数n,则细胞总量为n
×
10000
×
20);
16.1.6将细胞悬液稀释到1
×
107个单个核细胞/ml;1.5ml ep管中分装细胞悬液,每管1ml;配平后高速(8000rpm)瞬时离心,小心吸弃上清,勿触及管底细胞沉淀。在管壁标注好编号和患者姓名。
17.二、细胞基因组dna的提取
18.dna提取纯化所用试剂购自qiagen公司(qiaamp dna blood mini kit)试剂盒,方法为硅膜吸附法,具体如下:
19.2.1将分离得到的5
×
106个恶性血液病患者单个核细胞溶解于200μl pbs 中,于管底加入20μl蛋白酶k(试剂盒提供,按使用说明配制,4℃保存);
20.2.2缓慢加入200μl油状裂解液al,震荡混匀后低速瞬离;
21.2.3 56℃水浴20min,待油状混合液变澄清,擦净外壁液体后低速瞬离,以将黏附在内壁和管盖的液体离心至管底;
22.2.4加入200μl无水乙醇,颠倒混匀,低速瞬离,除去管壁液体;
23.2.5将步骤2.4所得的混合液小心转移至qiaamp mini吸附柱中(吸附柱置于试剂盒提供的2ml收集管上),盖好管盖,做好标记,高速离心12000rpm
ꢀ×
3min,丢弃收集管及滤液;
24.2.6吸附柱放入新的收集管(试剂盒提供)中,在吸附柱中加入500μl缓冲液aw1(按产品说明书加入无水乙醇混匀),盖好管盖并离心,12000rpm
×
3min,丢弃收集管及滤液;
25.2.7吸附柱放入新的收集管(试剂盒提供)中,加入500μl缓冲液aw2(按产品说明书加入无水乙醇混匀),盖好管盖并离心,12000rpm
×
3min,丢弃收集管及滤液;
26.2.8将吸附柱置于自备的清洁无菌1.5ml ep管中,打开吸附柱管盖,离心12000rpm
×
3min,使乙醇充分挥发,丢弃ep管及滤液;
27.2.9将吸附柱置于自备的清洁无菌1.5ml ep管中,悬空滴加100μl洗脱缓冲液ae,将ae滴加在吸附柱的吸附膜中间部位,室温孵育3min以充分洗脱吸附膜中的dna,离心12000rpm
×
3min,此时ep管中的滤液即为基因组dna 溶液;
28.2.10为提高dna的收集效率,重复步骤2.9,将ep管中收集到的dna溶液返回加入吸附柱中,小心加在吸附柱的吸附膜中间部位,室温孵育3min以充分溶解吸附膜中的dna,离心12000rpm
×
3min,再次收集dna溶液;
29.2.11使用nanodrop one微量紫外可见分光光度计检测基因组dna的浓度和纯度,od260/280比值在1.8-2.0间的dna质量符合要求,可用于本发明dna 文库的构建以及高通量测序。
30.三、dna文库构建,测序
31.3.1ikzf1-5基因外显子pcr扩增子序列
32.所检测的71个扩增子信息如下表:
33.34.[0035][0036]
针对ikzf1-5基因外显子序列设计引物,引物合成由上海生工公司完成。由于引物数量多,为避免形成引物二聚体影响扩增效率,将设计好的引物分为2 个引物池(m1和m2),其中m1为36对引物,m2为35对引物,引物具体序列信息如下表:
[0037]
[0038]
[0039]
[0040]
[0041]
[0042][0043]
3.2准备并定量pcr扩增模板
[0044]
使用美国life technologies公司qubit dsdna hs assay kit,货号q32850 检测pcr反应dna模板浓度,保证每个反应体系加入20-60ng dna。
[0045]
3.2.1将试剂盒置于室温;
[0046]
3.2.2取试剂盒中dsdna hs reagent(组份a),按1:200用buffer(组份 b)稀释,配成工作液,现配现用;1μl组份a 199μl组份b;
[0047]
3.2.3向分析管中加入配制的工作液190μl;
[0048]
3.2.4在分析管中分别加入dsdna standard#1、standard#2和稀释10倍的 dsdna样本,每管10μl,正确标记;
[0049]
3.2.5室温避光孵育2分钟;
[0050]
3.2.6检测样本浓度。
[0051]
3.3基因特异性pcr
[0052]
pcr扩增反应体系为(所用试剂为生工公司的高通量测序文库构建试剂盒):
[0053][0054][0055]
panel a/b的反应体系要分开配制;基因组纯度及质量非常重要,如果提取的dna有杂质或者降解严重,会导致扩增效率急剧降低。
[0056]
混匀,panel a/b分别置于pcr仪上,运行以下反应程序:
[0057][0058]
3.4回收第一轮扩增产物
[0059]
3.4.1提前半小时将agencourt ampure xp磁珠置于室温中,充分轻柔混匀,以活化磁珠;
[0060]
3.4.2加入25μl磁珠(1.0倍体积)与25μl反应液(步骤3.3中pcr产物)混合,轻柔吹吸10次混匀,室温孵育5分钟。准备80%乙醇(乙醇与nuclease-free水体积比为4:1);
[0061]
3.4.3将ep管放置在磁力架上5min至液体澄清,小心吸弃上清,切勿吸到管壁上的磁珠;
[0062]
3.4.4将ep管保持在磁力架上,沿管壁加入200μl 80%乙醇(现配现用) 室温放置30秒,弃上清,切勿吸到管壁上的磁珠;
[0063]
3.4.5重复上一步用80%乙醇洗一次;
[0064]
3.4.6将ep管保持在磁力架上干燥2-5min,观察磁珠表面不再反光即可,切勿过度干燥;
[0065]
3.4.7将ep管从磁力架上取下,加入30μl nuclease-free水,轻柔吹打混匀,室温放置2min,再将ep管放置在磁力架上至液体澄清;
[0066]
3.4.8小心吸取25μl上清至新pcr管,切勿吸到管壁上的磁珠,做好标记。
[0067]
3.5qubit 3.0定量
[0068]
使用qubit dsdna hs assay kit对回收产物定量,具体同步骤3.2。
[0069]
3.6接头连接(所用试剂为生工公司的高通量测序试剂盒)
[0070]
配制第二轮pcr反应体系(分panel a/b):
[0071]
试剂体积2x indexing pcr master mix210μli5-primer接头(10um)1μli7-primer接头(10um)1μl纯化pcr产物30ngnuclease-free水补足至30μl总体积30μl
[0072]
接头由上海生工公司合成,具体序列为:
[0073]
序号i5-primer接头i7-primer接头1agcgctagccgcggtt
2gatatcgattataacc3cgcagacgggacttgg4tatgagtaaagtccaa5aggtgcgtatccactg6gaacatacgcttgtca7acatagcgcaagctag8gtgcgatatggatcga9ccaacagaagttcagg10ttggtgaggacctgaa
[0074]
panel a/b的反应体系要分开配制。此pcr接头的引物有两种,分别是i5index和i7 index,每个引物有数字编号,对于不同的样品,需要组合使用,而同一样本的panel a及panel b需使用同一组合。同一批不同样品的index组合不能重复,否则会导致数据无法拆分。
[0075]
3.7.混匀后快速离心,置于pcr仪上,运行以下反应:
[0076][0077][0078]
3.8文库纯化
[0079]
3.8.1提前半小时将agencourt ampure xp磁珠置于室温中,充分轻柔混匀,以活化磁珠;
[0080]
3.8.2加入22.5μl磁珠(0.9倍体积)与25μl反应液(步骤3.7中pcr 产物)混合,轻柔吹吸10次混匀,室温孵育5分钟;
[0081]
3.8.3将ep管放置在磁力架上5min至液体澄清,小心吸弃上清,切勿吸到管壁上的磁珠;
[0082]
3.8.4将ep管保持在磁力架上,沿管壁加入200μl 80%乙醇(现配现用) 室温放置30秒,弃上清,切勿吸到管壁上的磁珠;
[0083]
3.8.5重复上一步用80%乙醇洗一次;
[0084]
3.8.6将ep管保持在磁力架上干燥2-5min,观察磁珠表面不再反光即可,切勿过度干燥;
[0085]
3.8.7将ep管从磁力架上取下,加入30μl nuclease-free水,轻柔吹打混匀,室温放置2min,再将ep管放置在磁力架上至液体澄清;
[0086]
3.8.8吸取25μl上清至新pcr管,切勿吸到管壁上的磁珠。
[0087]
3.9qubit定量产物浓度
[0088]
使用qubit dsdna hs assay kit对回收产物定量,具体同步骤3.2。
[0089]
3.10送测序
[0090]
完成上述步骤后,获得的产物即是测序用的文库。不同样品之间等摩尔量混合后,即可进行illumina测序,同一批不同样品的index组合不能重复,会导致数据无法拆分。
[0091]
本发明的有益效果:
[0092]
本发明引物组合有效解决了既往恶性血液病患者ikzf家族基因突变筛查方法繁琐、耗时、不规范等问题;临床一次采血即可达到检测要求,使用本发明能及时、准确地应用于临床恶性血液病患者ikzf家族基因突变的检测,便于对临床患者预后进行指导。
附图说明
[0093]
下面结合附图对本发明作进一步的说明。
[0094]
图1是高通量测序结果质控图;
[0095]
图2是高通量测序结果质控图;
[0096]
图3是高通量测序结果质控图;
[0097]
图4是高通量测序结果质控图;
[0098]
图5是高通量测序结果质控图;
[0099]
图6是高通量测序结果质控图;
[0100]
图7是高通量测序结果质控图;
[0101]
图8是高通量测序结果质控图;
[0102]
图9是高通量测序结果质控图。
具体实施方式
[0103]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
[0104]
实施例1
[0105]
通过检测一例临床患者的样本来验证本发明所述方法的特异性、敏感性和精准性。该患者是一例难治性急性髓系白血病m2患者,检测标本为该患者初诊治疗前骨髓。
[0106]
具体检测方法如下:
[0107]
1、采用密度梯度离心法分离得到病人的白血病细胞,使用天津灏洋公司的人外周血淋巴细胞分离液,操作方法见说明书。
[0108]
2、提取核酸:dna的提取建议使用qiagen公司的qiaamp dna blood minikit试剂盒,操作方法见说明书。
[0109]
3、基因突变的检测方法的操作步骤如下:
[0110]
使用qubit试剂盒定量该患者dna浓度为10.5ng/μl。panel a/b分别加入 dna模板3μl,按照技术方案3.3配制第一步pcr反应体系,运行第一步pcr 反应后进行磁珠纯化,选用1.0倍(25μl)agencourt ampure xp磁珠。纯化后再次进行qubit试剂盒定量,测得第一步pcr反应产物浓度分别为panel a54.6ng/μl、panel b 50.2ng/μl,分别稀释至30ng/μl进行第二步pcr反应。选用i5-primer接头1及i7-primer接头1,按照技术方案3.6配制第二步
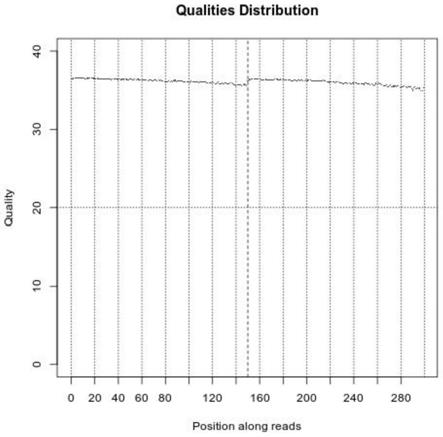
pcr反应体系及运行程序。所得pcr产物选用0.9倍(22.5μl)agencourt ampure xp 磁珠进行纯化,qubit定量第二步pcr产物,浓度分别为panel a 27.2ng/μl、 panel b 26.6ng/μl,各取3.68μl、3.76μl进行混合,以上步骤完成后进行高通量测序,测序结果质控见图1-3,提示测序结果合格。分析测序数据发现该患者存在ikzf1:c.a476g,p.n159s突变,突变频率为15.4%。
[0111]
4、此实例表明本发明提供的引物组合和方法能够全面、敏感的检测恶性血液病患者ikzf家族基因突变,精准检测出本例急性髓系白血病患者存在ikzf1p.n159s突变,操作可行性和结果可信度高。
[0112]
5、临床价值:该例患者经标准诱导化疗方案治疗后未达缓解,再次进行挽救治疗方案化疗,仍然没有获得缓解,确诊2个月后死亡,为一例难治性高危患者。应用本发明提供的引物组合和方法对该患者治疗前骨髓标本进行检测,发现存在ikzf1 p.n159s突变,与其临床预后差符合,表明应用本方法可以早期发现高危亚型,有助于尽早进行个体化治疗。
[0113]
实施例2
[0114]
通过检测一例临床患者的样本来验证本发明所述方法的特异性、敏感性和精准性。该患者是一例初发急性淋巴细胞白血病患者。检测标本为初诊治疗前骨髓。
[0115]
具体检测方法如下:
[0116]
1、采用密度梯度离心法分离得到病人的白血病细胞,建议使用天津灏洋公司的人外周血淋巴细胞分离液,操作方法见说明书所述步骤。
[0117]
2、提取核酸:dna的提取建议使用qiagen公司的qiaamp dna blood minikit试剂盒,操作方法见说明书。
[0118]
3、基因突变的检测方法按以上技术方案中的步骤操作。使用qubit试剂盒定量该患者dna浓度为10.2ng/μl。panel a/b分别加入dna模板3μl,按照技术方案3.3配制第一步pcr反应体系,运行第一步pcr反应后进行磁珠纯化,选用1.0倍(25μl)agencourt ampure xp磁珠。纯化后再次进行qubit试剂盒定量,测得第一步pcr反应产物浓度分别为panel a 59ng/μl、panel b 56.2ng/ μl,分别稀释至30ng/μl进行第二步pcr反应。选用i5-primer接头1及 i7-primer接头2,按照技术方案3.6配制第二步pcr反应体系及运行程序。所得 pcr产物选用0.9倍(22.5μl)agencourt ampure xp磁珠进行纯化,qubit定量第二步pcr产物,浓度分别为panel a 18.9ng/μl、panel b 23.6ng/μl,各取5.29μl、4.24μl进行混合,以上步骤完成后进行高通量测序,测序结果质控见图4-6,提示测序结果合格。分析测序数据发现该患者存在ikzf2:c.a278g, p.n93s突变,突变频率为52.6%。
[0119]
4、由此可见本发明提供的引物组合和方法能够全面、敏感检测恶性血液病患者ikzf家族基因突变,精准检测出该例急性淋巴细胞白血病患者存在ikzf2p.n93s突变,操作可行性和结果可信度高。
[0120]
5、临床价值:该患者为费城染色体阳性急性淋巴细胞白血病,初诊治疗前骨髓标本检测发现ikzf2 p.n93s突变,治疗方案选择靶向治疗联合个体化诱导化疗方案,一个疗程获得完全缓解,提示本发明对指导临床个体化治疗具有重要临床意义和价值。
[0121]
实施例3
[0122]
通过检测一例临床患者的样本进一步验证本发明所述方法的特异性、敏感性和精准性。该患者是一例初发ph阴性急性淋巴细胞白血病的患者。检测标本为初诊治疗前骨髓。
[0123]
具体检测方法如下:
[0124]
1、采用密度梯度离心法分离得到病人的白血病细胞,建议使用天津灏洋公司的人外周血淋巴细胞分离液,操作方法见说明书所述步骤。
[0125]
2、提取核酸:dna的提取建议使用qiagen公司的qiaamp dna blood minikit试剂盒,操作方法见说明书。
[0126]
3、基因突变的检测方法按以上技术方案中的步骤操作。使用qubit试剂盒定量该患者dna浓度为1.9ng/μl。panel a/b分别加入dna模板7μl,按照技术方案3.3配制第一步pcr反应体系,运行第一步pcr反应后进行磁珠纯化,选用1.0倍(25μl)agencourt ampure xp磁珠。纯化后再次进行qubit试剂盒定量,测得第一步pcr反应产物浓度分别为panel a 16.5ng/μl、panel b 13ng/ μl,分别加1.8μl、2.3μl进行第二步pcr反应。选用i5-primer接头4及 i7-primer接头7,按照技术方案3.6配制第二步pcr反应体系及运行程序。所得 pcr产物选用0.9倍(22.5μl)agencourt ampure xp磁珠进行纯化,qubit定量第二步pcr产物,浓度分别为panel a 13ng/μl、panel b 25.4ng/μl,各取 7.69μl、3.94μl进行混合,以上步骤完成后进行高通量测序,测序结果质控见图7-9,提示测序结果合格。分析测序数据发现该患者存在ikzf1: c.a476c:p.n159t突变,突变频率为36.82%。
[0127]
4、此实例显示本发明提供的引物组合和方法能够全面、敏感检测恶性血液病患者ikzf家族基因突变,精准检测出该急性淋巴细胞白血病患者存在ikzf1p.n159t突变,操作可行性和结果可信度高。
[0128]
5、临床价值:该患者为费城染色体阴性急性淋巴细胞白血病,巩固化疗阶段患者复发,再次诱导化疗没有获得缓解,患者死亡。应用本发明在该患者治疗前骨髓标本中发现ikzf1 p.n159t突变,表明本发明对预后评估和早期发现高危亚型具有临床指导价值。
[0129]
以上论述和实例表明,本发明提供的方法可以全面、精准、快速检测各种恶性血液病患者在疾病不同阶段是否存在ikzf家族基因(ikzf1-5)突变、精准突变位点和频数,弥补了现有ikzf基因突变检测方法的局限性、不完整性,填补了ikzf全部家族基因突变检测方法的空白,对指导临床分型诊断、早期筛查高危亚型、预后评估和指导个体化治疗,具有重要的临床实用价值和应用前景。
[0130]
在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
[0131]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。