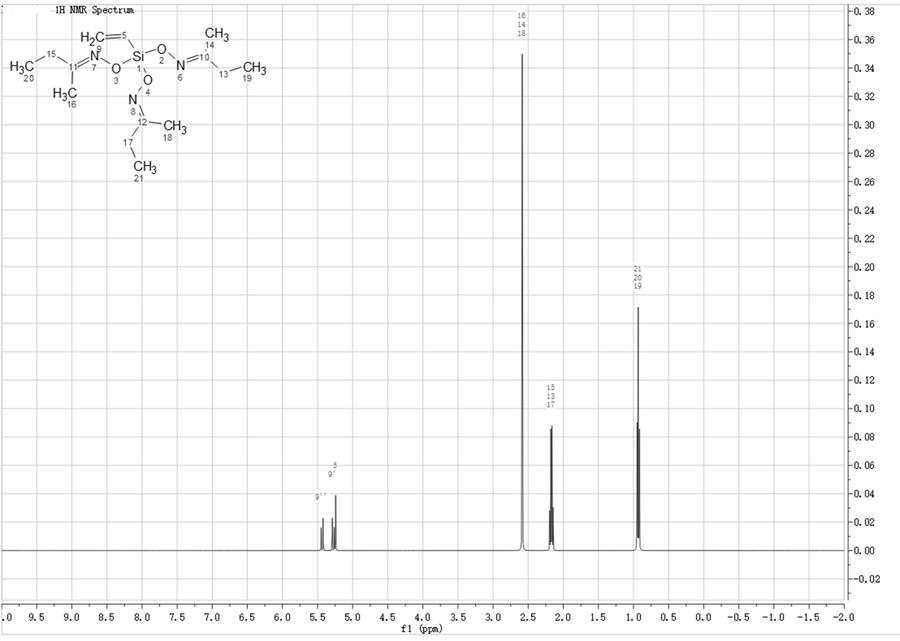
1.本发明属于功能纳米材料和生物检测领域,具体涉及一种用于肿瘤微小核酸标志物检测的表面增强拉曼散射(sers)检测试剂盒及其制备方法与应用。
背景技术:
2.近年来,我国肿瘤的发病率呈逐年上升和年轻化趋势,是仅次于心脑血管疾病的第二段致使疾病。肿瘤通常起病隐匿,早发现、早诊断、早治疗是提高存活率的重要措施。因此,迫切需要在检测技术和方法学上取得突破。以胃癌为例,胃癌是全世界范围内发病率最高的癌症之一,严重威胁着公众的生命健康。据报道,胃癌是全球第四大最常见的癌症,也是全球癌症相关死亡的第三大常见原因。目前,内镜活检仍是胃癌临床诊断的金标准。然而,作为一种侵入性方法,它给患者造成了很大的痛苦,其诊断的准确性依赖于内科医生的技能和经验。肿瘤分子诊断是指以核酸或蛋白为核心的分子生物学诊断技术,是进行肿瘤早期诊断的重要方法。通过检测与肿瘤发生相关的生物大分子,进行肿瘤发生的预测、诊断。肿瘤标志物是指由恶性肿瘤产生或由肿瘤刺激宿主细胞产生,可反映恶性肿瘤的发生、发展及对抗肿瘤治疗反应的物质。其在细胞中表达水平的高低或在体液中含量的变化与肿瘤的发生、发展与转化密切相关。肿瘤标志物是肿瘤分子诊断重要的检测对象之一。micrornas(mirnas)是由19-25个核苷酸组成的非编码小rna分子,通过抑制和/或降解mrna来调控基因表达。研究表明,mirna表达的失调往往与疾病的发生发展密切相关。此外,越来越多的证据表明mirna可以作为包括胃癌在内的各种肿瘤类型的生物标志物。
3.传统的mirna检测方法包括northern印迹法、微阵列和实时聚合酶链反应(rt-pcr),其中以pcr为基础的检测技术是主要的检测方法,然而pcr技术对于引物设计要求高,扩增过程易产生非特异性而导致假阳性结果,检测较为耗时,通常需要2小时以上,操作复杂,需要在专门实验室由专业技术人员完成。这些问题限制了其广泛、便捷应用。表面增强拉曼散射(sers)因其超灵敏,可实现单个分子水平检测,样品用量少,检测无破坏性,以及可现场即时检测等优点,被认为是一种极具潜力的分子检测技术。针对传统基于pcr的核酸检测技术的不足,需要开发一种用于肿瘤微小核酸(mirna)标志物检测的表面增强拉曼散射(sers)检测试剂盒,制备及应用简单,检测无需扩增和专业技术人员操作,检测快速、灵敏度高、特异性好。
技术实现要素:
4.发明目的:针对当前肿瘤分子检测对于微小核酸标志物快速灵敏测定的重大需求,以及现有以pcr为基础的核酸检测技术在检测特异性、时效性、便携操作性等方面的不足,本发明公开了一种用于非疾病诊断目的的肿瘤微小核酸(mirna)标志物检测的表面增强拉曼散射(sers)检测试剂盒及其制备方法与应用。
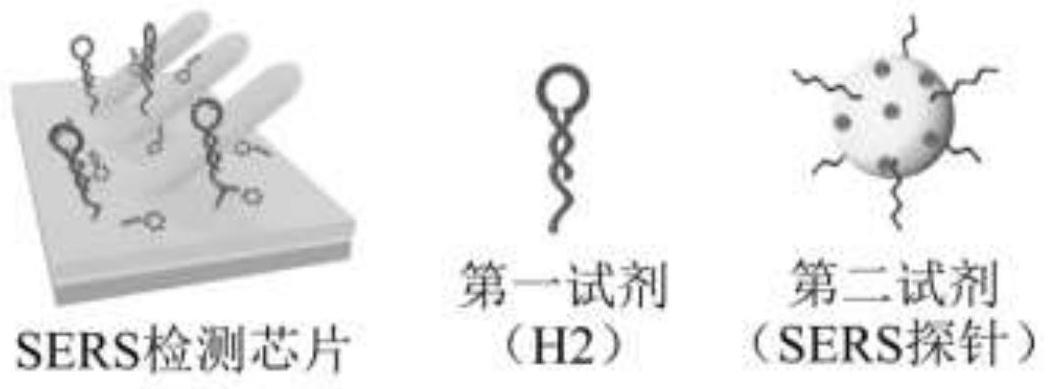
5.该sers检测试剂盒包括sers检测芯片、第一试剂、第二试剂三部分。其中sers检测
芯片通过在银纳米棒阵列基片表面修饰发夹型dna单链制备得到,第一试剂为核苷酸序列特殊设计的发夹型dna单链,第二试剂为sers探针即修饰有核酸探针链的金纳米球。
6.本发明公开的肿瘤微小核酸(mirna)标志物检测的表面增强拉曼散射(sers)检测试剂盒制备简单、检测无需扩增和专业技术人员操作,检测快速(50分钟)、灵敏度高(检测限达到阿摩尔每升(10copies/μl)量级)、特异性好(能识别单个碱基差异),可通过修改核酸探针的碱基序列,检测包括胃癌在内的各种肿瘤类型的生物标志物,为肿瘤生物标志物检测提供了一种普适技术,并且可实现在血清等复杂环境中多种核酸生物标志物的一体化检测,有效提升检测的特异性与准确性。相比现有的pcr技术具有显著技术优势,在肿瘤分子检测和早期诊断等领域具有突出的应用优势。
7.为了解决上述技术问题,本发明采用以下技术方案:
8.用于肿瘤微小核酸(mirna)标志物检测的表面增强拉曼散射(sers)检测试剂盒包括sers检测芯片、第一试剂、第二试剂三部分。
9.所述的肿瘤是胃癌。
10.其中sers检测芯片通过在银纳米棒阵列基片表面修饰发夹型dna单链制备得到;
11.第一试剂为核苷酸序列特殊设计的发夹型dna单链;
12.第二试剂为sers探针即修饰有核酸探针链的金纳米球。
13.具体来说,所述sers检测芯片为表面修饰有发夹型dna单链h1的银纳米棒阵列基片;
14.所述第一试剂为发夹型dna单链h2;
15.所述第二试剂为配合基片使用的sers探针;
16.所述sers探针为表面修饰探针单链p和拉曼分子5,5'-二硫代双(2-硝基苯甲酸)(dtnb)的金纳米颗粒。
17.在一些实施方式中,所述银纳米棒阵列采用真空电子束蒸发镀膜技术制备,并在其表面用pdms膜制备4
×
10阵列型小孔,孔径4mm,深度1mm。
18.所述金纳米颗粒(aunp)粒径为15~100nm。作为优选地,所述金纳米颗粒粒径为15nm。
19.在一些实施方式中,所述发夹型dna单链h1碱基序列如seq id no:2所示,所述发夹型dna单链h2的碱基序列如seq id no:3所示,所述探针单链p的碱基序列如seq id no:4所示。
20.在一些实施方式中,所述第二试剂浓度为1~100nm,作为优选地,所述第二试剂浓度为2.3nm。具体地,在合成第二试剂的过程中,金纳米颗粒(aunp)的量为500μl2.3nm,探针单链p是10μl 50μm,经离心提纯后定容到75μl即得。
21.在一些实施方式中,所述sers检测芯片为表面修饰有发夹型dna单链h1-199a的银纳米棒阵列基片;
22.所述第一试剂为发夹型dna单链h2-199a;
23.所述第二试剂为配合基片使用的sers探针,所述sers探针为表面修饰探针单链p-199a和拉曼分子4-巯基苯甲酸(4-mba)的金纳米颗粒。
24.在一些实施方式中,所述sers检测芯片为表面修饰有发夹型dna单链h1-100的银纳米棒阵列基片;
25.所述第一试剂为发夹型dna单链h2-100;
26.所述第二试剂为配合基片使用的sers探针,所述sers探针为表面修饰探针单链p-100和拉曼分子2-巯基苯并(2-mbt)的金纳米颗粒。
27.其中,所述sers探针分别修饰拉曼分子dtnb、4-mba和2-mbt,所述拉曼分子为本领域常规的拉曼报告物,包括但不限于dtnb、4-mba和2-mbt等拉曼报告物。
28.在一些实施方式中,所述发夹型dna单链h1-199a碱基序列如seq id no:6所示,所述发夹型dna单链h2-199a的碱基序列如seq id no:7所示,所述探针单链p-199a的碱基序列如seq id no:8所示;所述发夹型dna单链h1-100碱基序列如seq id no:10所示,所述发夹型dna单链h2-100的碱基序列如seq id no:11所示,所述探针单链p-100的碱基序列如seq id no:12所示。
29.上述用于肿瘤微小核酸标志物检测的表面增强拉曼散射(sers)检测试剂盒的制备方法,包括以下步骤:
30.1)sers检测芯片制备:
31.(1)制备银纳米棒阵列并用超纯水多次冲洗;
32.(2)将发夹型dna单链h1退火处理(加热95℃放置5~10分钟后于冰水浴中降温至25℃)后取发夹型dna单链h1与tcep溶液(三羧乙基膦溶液)以摩尔比1:100到1:1000混合置于25℃恒温混匀仪中反应;
33.(3)将银纳米棒阵列和20μl 500nm发夹型dna单链h1溶液共培养(培养条件:25~37℃,60~80%湿度环境中静置3~5小时),发夹型dna单链h1通过巯基与银形成共价键而固定在银纳米棒阵列表面;
34.(4)使用反应缓冲液清洗基片后,将20μl 1mm 6-巯基己醇(mch)滴加至上述基片表面置于25℃恒温混匀仪中反应10分钟;
35.(5)依次用反应缓冲液和超纯水多次清洗基片,得到sers检测芯片。
36.2)第一试剂:根据发夹型dna单链h1设计并合成的发夹型dna单链h2即为第一试剂。
37.3)第二试剂即sers探针的制备:
38.(1)将探针单链p与tcep溶液((三羧乙基膦溶液))以摩尔比1:100~1:1000混合置于25℃恒温混匀仪中反应;
39.(2)将10μl 50μm探针单链p与500μl 2.3nm aunp溶液混合于0.5
×
tbe溶液中,并于25℃温度下300rpm培养过夜;
40.(3)每隔30分钟分4次缓慢加入5、10、15和20μl的2m nacl溶液至混合物中(nacl的最终浓度为200mm),在25℃300rpm的条件下共培养过夜;
41.(4)加入10μl 100μm的拉曼分子dtnb反应3小时;
42.(5)最后通过离心去除上清液,用0.5
×
tbe溶液分散离心沉积物并定容至75μl,即得到第二试剂。
43.其中,所述步骤1)中的发夹型dna单链h1的浓度为0.5~2μm,所述第一试剂的浓度为5~20μm。
44.上述用于肿瘤微小核酸标志物检测的表面增强拉曼散射(sers)检测试剂盒的应用如下(以检测胃癌微小核酸标志物mirna-378为例,核苷酸序列如seq id no:1所示):
45.1)将第一试剂、第二试剂和含有不同浓度的目标mirna-378的样品溶液混合,滴加至sers检测芯片表面共培养;mirna-378浓度范围为10am~1nm。
46.2)用超纯水清洗芯片多次后进行sers测试,得到不同浓度目标mirna-378对应的sers光谱及其特征信号强度值,以目标mirna-378浓度的对数为横坐标,以sers特征峰强度值为纵坐标,得到sers检测试剂盒的工作曲线,根据工作曲线计算sers检测试剂盒检测mirna-378的检测限。
47.3)将待检测样品与第一试剂、第二试剂混合后滴加至sers检测芯片表面共培养,用超纯水清洗芯片多次后进行sers测试,得到sers光谱及其特征信号强度值,根据工作曲线计算得到待检测样品中目标mirna-378的浓度。
48.其中,所述步骤1)和3)中共培养条件为在25~37℃,300rpm的恒温混匀仪中最优培养(检测)时间为50分钟。
49.检测另外两种胃癌相关的微小核酸标志物mirna-199a-3p和mirna-100,核苷酸序列分别如seq id no:5和seq id no:9所示。
50.本发明的检测原理(以检测胃癌微小核酸标志物mirna-378为例):
51.发夹型dna单链h1通过巯基与银形成共价键而固定在银纳米棒阵列表面,然后将6-巯基己醇(mch)滴加至上述基片表面进行封闭,减少基片非特异性吸附,即可得到sers检测芯片。
52.在目标mirna-378(t)存在下,sers检测芯片上固定的h1被mirna-378触发打开,形成t-h1双链。借助第一试剂,即发夹型dna单链h2,触发t-h1双链发生催化发夹自组装(cha)反应,在sers检测芯片表面形成若干h1-h2双链,同时伴随mirna-378的释放,供循环使用。
53.在sers检测芯片上同时加入第一试剂和第二试剂后,第二试剂上的探针单链p与h1-h2双链的粘性末端杂交,将sers探针捕获至sers检测芯片上。
54.最后,通过测试sers检测芯片上sers探针的拉曼信号,实现对于胃癌微小核酸标志物mirna-378的快速、特异性及高灵敏检测。
55.有益效果:本发明与现有以pcr为基础的核酸检测技术相比,具有以下优点:
56.本发明公开了一种用于肿瘤微小核酸标志物检测的表面增强拉曼散射(sers)检测试剂盒及其制备方法与应用。该sers检测试剂盒包括sers检测芯片、第一试剂、第二试剂三部分。其中sers检测芯片通过在银纳米棒阵列基片表面修饰发夹型dna单链制备得到,第一试剂为核苷酸序列特殊设计的发夹型dna单链,第二试剂为sers探针即修饰有核酸探针链的金纳米球。
57.本发明公开的肿瘤微小核酸(mirna)标志物检测的表面增强拉曼散射(sers)检测试剂盒制备简单、检测无需扩增和专业技术人员操作,检测快速(50分钟)、灵敏度高(检测限达到阿摩尔每升(10copies/μl)量级)、特异性好(能识别单个碱基差异),可通过修改核酸探针的碱基序列,检测包括胃癌在内的各种肿瘤类型的生物标志物,为肿瘤生物标志物检测提供了一种普适技术,并且可实现在血清等复杂环境中多种核酸生物标志物的一体化检测,有效提升检测的特异性与准确性。相比现有的pcr技术具有显著技术优势,在肿瘤分子检测和早期诊断等领域具有突出的应用优势。
附图说明
58.图1是用于胃癌微小核酸标志物mirna-378检测的sers检测试剂盒制备示意图;
59.图2是实施例1sers检测芯片表面固定发夹型dna单链h1浓度优化实验;图2a是sers检测芯片表面固定不同浓度发夹型dna单链h1获得的sers光谱图;图2b是图2a中各谱线在1330cm-1
拉曼位移处所对应的sers峰强度;
60.图3是实施例1sers检测芯片表面6-巯基己醇(mch)封闭不同时间获得的sers强度;
61.图4是实施例1sers检测试剂盒检测mirna-378的最优培养(检测)时间优化实验;图4a是sers检测试剂盒检测mirna-378的不同培养(检测)时间对应的sers光谱图;图4b是图4a中各谱线在1330cm-1
拉曼位移处所对应的sers峰强度;
62.图5是实施例1sers检测试剂盒检测不同浓度mirna-378的工作曲线;图5a是sers检测试剂盒检测不同浓度mirna-378对应的sers光谱图;图5b是图5a中各谱线在1330cm-1
拉曼位移处所对应的sers峰强度;
63.图6是实施例1sers检测试剂盒检测mirna-378的特异性表征;图6a是sers检测试剂盒检测mirna-378、单碱基错配(sm)、两碱基错配(dm)、三碱基错配(tm)及完全错配样品的sers光谱图;图6b是图6a中各谱线在1330cm-1
拉曼位移处所对应的sers峰强度;
64.图7是实施例1sers检测试剂盒检测mirna-378的均一性表征;
65.图8是实施例2sers检测试剂盒检测不同浓度mirna-199a-3p的工作曲线;图8a是sers检测试剂盒检测不同浓度mirna-199a-3p对应的sers光谱图;图8b是图8a中各谱线在1078cm-1
拉曼位移处所对应的sers峰强度;
66.图9是实施例3sers检测试剂盒检测不同浓度mirna-100的工作曲线;图9a是sers检测试剂盒检测不同浓度mirna-100对应的sers光谱图;图9b是图9a中各谱线在1395cm-1
拉曼位移处所对应的sers峰强度。
具体实施方式
67.以下结合具体实施例对本发明作进一步说明,但本发明的内容并不限于所举的实施例。
68.以胃癌微小核酸mirna-378检测为例,本发明所使用的dna碱基序列片段均为人工合成得到,均由生工生物工程(上海)股份有限公司合成。sm,dm,tm中加粗部分为错配碱基。
69.1、以下实施例中的待检测mirna-378的核酸碱基序列为:
70.mirna-378:5
’‑
act gga ctt gga gtc aga agg-3’71.2、以下实施例中发夹型dna单链h1、h2和探针单链p碱基序列为:
72.h1:5
’‑
sh-(ch2)
6-ttt ttt ttt ttt ttt ttt ttt ttt ttt tcc ttc tga ctc caa gtc cag tca gaa gga act agc act gga ctt gga gt-3’73.h2:5
’‑
gtc cag tgc tag ttc ctt ctg act gga ctt gga cac aga agg aac tag ccg act caa gag cac-3’74.p:5
’‑
sh-(ch2)
6-ttt ttt ttt gtg ctc ttg agt cg-3’75.3、以下实施例中的待检测mirna-199a-3p、发夹型dna单链h1-199a、h2-199a和探针单链p-199a碱基序列为:
76.mirna-199a-3p:5
’‑
aca gta gtc tgc aca ttg gtt a-3’77.h1-199a:5
’‑
sh-(ch2)
6-ttt ttt ttt ttt ttt ttt ttt ttt ttt tta acc aat gtg cag act act gta ttg gtt agc tat aac agt agt ctg cac-3’78.h2-199a:5
’‑
cta ctg tta tag cta acc aat aca gta gtc tgc tga ttg gtt agc tat agg cta cgg aga tcc-3’79.p-199a:5
’‑
sh-(ch2)
6-ttt ttt ttt gga tct ccg tag cc-3’80.4、以下实施例中的待检测mirna-100、发夹型dna单链h1-100、h2-100和探针单链p-100碱基序列为:
81.mirna-100:5
’‑
aac ccg tag atc cga act tgt g-3’82.h1-100:5
’‑
sh-(ch2)
6-ttt ttt ttt ttt ttt ttt ttt ttt ttt tca caa gtt cgg atc tac ggg tta act tgt gac tag caa ccc gta gat ccg-3’83.h2-100:5
’‑
acg ggt tgc tag tca caa gtt aac ccg tag atc gca act tgt gac tag cct gga tcc ctg aat-3’84.p-100:5
’‑
sh-(ch2)
6-ttt ttt ttt att cag gga tcc ag-3’85.5、针对胃癌微小核酸标志物mirna-378检测的特异性实验对应的单碱基错配(sm)、两碱基错配(dm)、三碱基错配(tm)及完全错配(mirna-21和mirna-106a)的核酸碱基序列为:
86.单碱基错配序列(sm):5
’‑
act gga ctt gga gtc aga tgg-3’87.两碱基错配序列(dm):5
’‑
aca gga ctt gga gtc aga tgg-3’88.三碱基错配序列(tm):5
’‑
aca gga ctt cga gtc aga tgg-3’89.完全错配序列(mirna-21):5
’‑
tag ctt atc aga ctg atg ttg a-3’90.完全错配序列(mirna-106a):5
’‑
aaa agt gct tac agt gca ggt ag-3’91.6、以下实施例中银纳米棒阵列采用真空电子束蒸发镀膜技术制备,并在其表面用pdms膜制备4
×
10阵列型小孔,孔径4mm,深度1mm。
92.实施例1用于肿瘤微小核酸标志物检测的表面增强拉曼散射(sers)检测试剂盒的制备
93.试剂盒包含三部分,如图1所示:sers检测芯片、第一试剂和第二试剂(即sers探针)。
94.一、sers检测芯片制备及反应条件考察
95.1、sers检测芯片制备
96.(1)制备银纳米棒阵列并用超纯水多次冲洗;
97.(2)将发夹型dna单链h1退火处理(加热95℃放置5~10分钟后于冰水浴中降温至25℃)后取发夹型dna单链h1与tcep溶液(三羧乙基膦溶液)以摩尔比1:100到1:1000混合置于25℃恒温混匀仪中反应;
98.(3)将银纳米棒阵列和20μl 100nm或者500nm发夹型dna单链h1溶液共培养(培养条件:25~37℃,60~80%湿度环境中静置3~5小时),发夹型dna单链h1通过巯基与银形成共价键而固定在银纳米棒阵列表面;
99.(4)使用反应缓冲液(tm缓冲液:20mm tris和50mm mgcl2,ph 8.0)清洗基片后,将20μl 1mm 6-巯基己醇(mch)滴加至上述基片表面置于25℃恒温混匀仪中反应10分钟;
mirna-378混合于20μl反应缓冲液中,置于25℃300rpm恒温混匀仪中分别反应5、10、20、40、45、50、55和60分钟后,使用反应缓冲液(tm缓冲液)和超纯水清洗小孔并进行sers检测,测试得到sers光谱图,参见图4,可见,在h1最佳浓度及mch最佳封闭时间的条件下,通过检测培养了5~60min不同时段后检测芯片的sers信号,观察到在0~50min内,sers强度逐渐增强,并在共培养50min时sers信号达到最大饱和值,表明50min是最佳的mirna-378检测时间。
116.五、sers检测试剂盒检测mirna-378的工作曲线及检测限
117.将2μl 10μm第一试剂、15μl第二试剂和2μl含有不同浓度的目标mirna-378(10am~1nm)的样品溶液混合,滴加至sers检测芯片表面上,在25℃300rpm恒温混匀仪中培养50分钟后,依次使用反应缓冲液(tm缓冲液)和超纯水多次清洗小孔。自然风干后在sers检测芯片上进行sers测试(拉曼测试条件:扫描时间1s,激光功率1%,物镜放大倍率20x,累计次数1次,激发光波长785nm),得到sers光谱及其特征信号强度值,以目标mirna-378浓度的对数为横坐标,以sers探针的特征峰强度值为纵坐标做出工作曲线,根据工作曲线计算sers检测试剂盒检测mirna-378的检测限。图5a是检测含有不同浓度mirna-378所得的sers光谱,图5b是其各谱线在1330cm-1
处所对应的sers峰强度。对于检测mirna-378,得到工作曲线为i
1330
=578
×
log(c
mirna-378
) 14055(r2=0.974),通过计算检测限为24.75am。
118.六、sers检测试剂盒检测mirna-378的特异性表征
119.将目标mirna-378稀释到100pm,将单碱基错配(sm)、两碱基错配(dm)、三碱基错配(tm)及完全错配(mirna-21和mirna-106a)样品稀释到1nm,并将没有添加任何额外生物分子的反应缓冲液用作空白对照。取2μl 10μm第一试剂、15μl第二试剂分别和2μl 100pm mirna-378,2μl 1nm错配样品(包括sm、dm、tm、mirna-21和mirna-106a)和空白样品(反应缓冲液)混合。将上述混合溶液滴加至sers检测芯片表面上,在25℃300rpm恒温混匀仪中培养50分钟后,依次使用反应缓冲液和超纯水清洗小孔。自然风干后在sers检测芯片上进行sers测试,得到sers光谱及其特征峰强度值。图6a是检测不同生物分子样品的sers光谱,图6b是其谱线在1330cm-1
处所对应的sers峰强度。所制备的sers检测试剂盒可以较好的区分目标样品与错配样品,这表明sers检测试剂盒具有良好的特异性与可靠性。
120.七、sers检测试剂盒检测mirna-378的均一性表征
121.在上述实施例1制备的sers检测芯片上加入2μl 10μm第一试剂、15μl第二试剂和2μl 1nm mirna-378的混合溶液于25℃300rpm恒温混匀仪中反应50分钟后使用反应缓冲液和超纯水冲洗干净,记录sers检测芯片上50个随机点的sers信号来研究表面修饰有发夹型dna单链的银纳米棒阵列基片的均一性。图7是记录的50个随机点在1330cm-1
处所对应的sers峰强度。对应于mirna-378检测的50个随机点的sers峰强度的相对标准偏差(rsd)很小(rsd=5.62%),这表明所提出的sers检测试剂盒检测mirna-378具有良好的均一性。
122.实施例2sers检测试剂盒检测mirna-199a-3p的工作曲线及检测限
123.将2μl 10μm第一试剂、15μl第二试剂和2μl含有不同浓度的目标mirna-199a-3p(10am~1nm)的样品溶液混合,滴加至sers检测芯片表面上,在25℃300rpm恒温混匀仪中培养50分钟后,依次使用反应缓冲液(tm缓冲液)和超纯水多次清洗小孔。自然风干后在sers检测芯片上进行sers测试(拉曼测试条件:扫描时间1s,激光功率1%,物镜放大倍率20x,累计次数1次,激发光波长785nm),得到sers光谱及其特征信号强度值,以目标mirna-199a-3p
浓度的对数为横坐标,以sers探针的特征峰强度值为纵坐标做出工作曲线,根据工作曲线计算sers检测试剂盒检测mirna-199a-3p的检测限。图8a是检测含有不同浓度mirna-199a-3p所得的sers光谱,图8b是其各谱线在1078cm-1
处所对应的sers峰强度。对于检测mirna-199a-3p,得到工作曲线为i
1078
=403
×
log(c
mirna-199a-3p
) 11550(r2=0.988),通过计算检测限为68.98am。
124.实施例3sers检测试剂盒检测mirna-100的工作曲线及检测限
125.将2μl 10μm第一试剂、15μl第二试剂和2μl含有不同浓度的目标mirna-100(10am~1nm)的样品溶液混合,滴加至sers检测芯片表面上,在25℃300rpm恒温混匀仪中培养50分钟后,依次使用反应缓冲液(tm缓冲液)和超纯水多次清洗小孔。自然风干后在sers检测芯片上进行sers测试(拉曼测试条件:扫描时间1s,激光功率1%,物镜放大倍率20x,累计次数1次,激发光波长785nm),得到sers光谱及其特征信号强度值,以目标mirna-100浓度的对数为横坐标,以sers探针的特征峰强度值为纵坐标做出工作曲线,根据工作曲线计算sers检测试剂盒检测mirna-100的检测限。图9a是检测含有不同浓度mirna-100所得的sers光谱,图9b是其各谱线在1395cm-1
处所对应的sers峰强度。对于检测mirna-100,得到工作曲线为i
1395
=960
×
log(c
mirna-100
) 20731(r2=0.998),通过计算检测限为24.00am。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。