一种稳定的大分子i型重组胶原蛋白及其用途
技术领域
1.本发明属于生物技术领域,涉及一种新型的基因工程重组胶原蛋白及其用途。
背景技术:
2.胶原蛋白是一种生物高分子蛋白,是动物结缔组织中的主要成分,也是哺乳动物体内含量最多、分布最广的功能性蛋白,占蛋白质总量的25%~ 30%。胶原蛋白与组织的形成、成熟、细胞间信息的传递以及关节润滑、伤口愈合、钙化作用、血液凝固和衰老等有着密切的关系,是生物科技产业最关键的原材料之一,在医学材料、化妆品、食品工业中均有广泛应用。
3.天然的人胶原蛋白来源受限,目前工业上使用的天然胶原蛋白主要是通过酸、碱或者酶法提取动物的皮肤或骨骼中的胶原蛋白,其主要来源为动物结缔组织。但从动物组织中提取的胶原蛋白存在动物源疾病等风险,同时大规模的制备对供给侧的动物饲养造成巨大的压力。
4.随着基因工程技术的广泛应用,通过采用合适的工程菌株(大肠杆菌、毕赤酵母等)外源性表达人胶原蛋白,成功地解决了人胶原蛋白大规模制备的瓶颈问题。但是,利用工程菌株例如毕赤酵母基因工程菌株表达人胶原蛋白时,人胶原蛋白会在发酵、纯化及保存过程中发生降解,这增加了生产成本,并且影响了这种方法生产的人胶原蛋白的性能。
5.推测人胶原蛋白发生降解的原因可能是其氨基酸序列中含有较多的易发生水解的位点。因此,技术人员通过选择来自天然人胶原蛋白的短氨基酸序列进行重复来构建重组胶原蛋白,以期回避易发生水解的位点,从而提高胶原蛋白的稳定性,同时还能保持天然人胶原蛋白的优良性能。但是,通过来自天然人胶原蛋白的短氨基酸序列重复构建的重组胶原蛋白,其氨基酸组成及分布都相对单调,理论上讲,这会造成其表面的电荷负载大,整体不容易达到稳定的平衡状态,因而在水溶液中容易水解、变性,且存在短氨基酸序列重复单元越短、重复次数越多,重组胶原蛋白分子在水溶液中越不稳定的倾向。
6.可以尝试通过对来自天然胶原蛋白的短氨基酸序列进行突变并以此作为重复单元,从而获得更耐降解的重组胶原蛋白。但是,这样通过突变改造得到的重组胶原蛋白与天然人胶原蛋白的同源性降低,可能出现免疫原性问题,因而不适合应用于需与人体长期接触的生物材料。
7.另一方面,组织工程材料例如皮下填充剂等是人胶原蛋白的一个重要应用方向,作为组织工程材料,要求胶原蛋白具有良好的力学强度和在水溶液中的稳定性(可在水溶液中长期保存)。一般而言,胶原蛋白的分子量越大,其力学强度就越好,而其在水溶液中的稳定性越差,对于通过来自天然人胶原蛋白的短氨基酸序列重复构建的重组胶原蛋白而言更是如此。
8.天然人胶原蛋白的每条链的分子量约为110-130kd,从实用性的观点出发,技术人员普遍认为适合替代天然人胶原蛋白用作组织工程材料的胶原蛋白的分子量需要达到100kd以上。然而,正如前述,天然的人胶原蛋白来源受限,动物源胶原蛋白存在传播疾病的
风险,基因工程表达的人胶原蛋白容易在发酵、纯化及保存过程中发生降解,通过来自天然人胶原蛋白的短氨基酸序列重复构建的重组胶原蛋白在水溶液中不稳定,而通过突变改造得到的重组胶原蛋白又存在免疫原性问题,因此,如何获得适合替代天然人胶原蛋白用作组织工程材料的胶原蛋白成为本技术领域的限制性问题。
技术实现要素:
9.为了解决现有技术中存在的上述技术问题,发明人进行了深入研究。发明人首先对通过来自天然人胶原蛋白的短氨基酸序列重复构建的重组胶原蛋白进行了技术文献调研,选取了现有技术中的一些来自天然人i型胶原蛋白(应用最广泛的组织工程材料)的短氨基酸序列,然后分别将这些短氨基酸序列作为重复单元,构建不同分子量的重组胶原蛋白,考察这些重组胶原蛋白在水溶液中长期保存的稳定性,以期获得能够在水溶液中长期稳定保存且能够满足作为组织工程材料的力学强度要求的大分子量(100kd以上)重组胶原蛋白。
10.上述研究的结果是,发明人意外发现,通过将来自天然的人i型胶原蛋白的一段十五肽(g a p g a p g s q g a p g l q)进行75~110次重复而得到的重组i型胶原蛋白具有异常优异的稳定性。具体体现在:(1)尽管其重复单元的长度是发明人测试的所有重组胶原蛋白中最短的,但其在水溶液中的稳定性是最好的;而通常认为,重复单元越短,氨基酸组成及分布就越单调,由此构建的重组胶原蛋白的表面电荷负载越大,越不容易达到稳定的平衡状态,因而更易水解。(2)其甚至比将该十五肽进行52次或62次或72次重复而得到的重组i型胶原蛋白更加稳定,而通常认为,重复次数越多,分子量越大,重组胶原蛋白的表面电荷负载越大,越不容易达到稳定的平衡状态,因而更易水解。
11.基于上述发现,发明人完成了本发明。即本发明包括:
12.1.一种大分子i型重组胶原蛋白,其由来自天然人i型胶原蛋白的短氨基酸序列作为重复单元进行多次重复而构成,其中,所述短氨基酸序列如 seq id no.:1(g a p g a p g s q g a p g l q)所示,重复次数为75~110次。
13.2.根据项1所述的大分子i型重组胶原蛋白,其中,所述重复次数为 80~105次,优选82~102次。
14.3.根据项1所述的大分子i型重组胶原蛋白,其分子量为120kd以上。
15.4.根据项1所述的大分子i型重组胶原蛋白,其还带有使其易于纯化的标签。
16.5.根据项4所述的大分子i型重组胶原蛋白,其中,所述标签为his标签、flag标签或c-myc标签。
17.6.根据项1~5中任一项所述的大分子i型重组胶原蛋白作为组织工程材料的用途。
18.7.根据项6所述的用途,其中,所述组织工程材料选自皮下填充剂、人工骨、人工皮肤、口腔可吸收生物膜、骨植入剂、血管支架、细胞间质支架和胶原蛋白海绵。
19.8.根据项1~5中任一项所述的大分子i型重组胶原蛋白作为皮下填充剂、人工骨、人工皮肤、口腔可吸收生物膜、骨植入剂、血管支架、细胞间质支架或胶原蛋白海绵的用途。
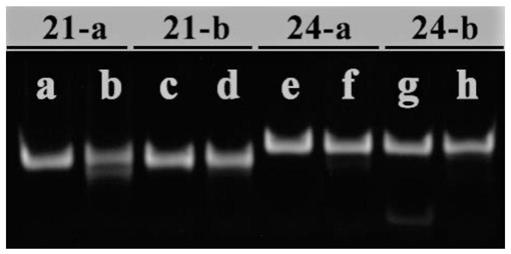
20.9.一种胶原蛋白水溶液,其包含项1~5中任一项所述的大分子i型重组胶原蛋白。
21.10.根据项9所述的胶原蛋白水溶液,其已于室温保存了3个月以上、优选6个月以
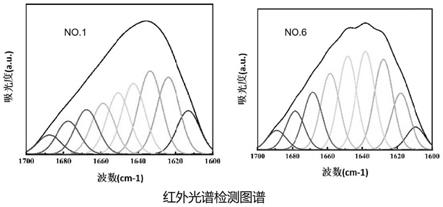
上、更优选12个月以上;或者已于4℃保存了12个月以上、优选24个月以上、更优选36个月以上。
22.关于本发明的大分子i型重组胶原蛋白具有异常优异的稳定性的原因,发明人正在进行更为深入的研究。初步的研究结果表明,这可能是因为:
23.以某一氨基酸序列作为重复片段进行重复的重组胶原,其稳定性与表面电荷密切相关,而表面电荷与氨基酸组成及蛋白的空间结构相关联,达到某一特定的重复次数后刚好形成了某一空间结构,使得表面荷载处于平衡或近平衡的状态,因此会表现出异常稳定的状态。发明人刚好找到了该15个氨基酸重复序列胶原蛋白处于荷载平衡的范围,因而本发明的大分子i型重组胶原蛋白具有异常优异的稳定性。
附图说明
24.图1为实施例1制备的部分i型重组胶原蛋白的sds-page电泳图。对照蛋白以 no.4、6、7、10为例。
25.图2为实施例2制备的部分测试样本放置12个月后的hplc图。对照蛋白以no. 4、7、10、13为例。
26.图3为no.1和no.6的i型重组胶原蛋白的红外光谱图。
27.图4为no.1和no.6的i型重组胶原蛋白的拉曼光谱图。
具体实施方式
28.以下将通过具体的实施例对本发明进行详细地描述。需要特别指出的是,这些描述仅仅是示例性的描述,并不构成对本发明范围的限制。
29.一般性说明:具体实施方式中所用到的酶全部从takara公司购买,质粒dna抽提试剂盒和dna凝胶回收试剂盒均购自北京索莱宝公司,基因重组试剂盒(reorganization kits)购自天根生物,具体操作完全按照试剂盒的说明进行。
30.实施例1.利用酵母表达系统制备各种i型重组胶原蛋白
31.1、酵母表达菌株的构建
32.构建了分别表达表1所示的no.1~18的i型重组胶原蛋白的酵母表达菌株。具体操作是:根据毕赤酵母密码子偏好优化后,通过全基因合成的方式合成对应的目标基因,并在基因的两端分别添加snab i和not i酶切位点,以 snabi和noti酶对目标基因进行双酶切,与同样经snab i和not i酶酶切的 ppic9k在t4连接酶的作用下进行连接,16℃连接过夜后,转入top10感受态细胞,涂布氨苄抗性平板,挑取阳性转化子,提取质粒后用saci进行线性化后,电击转入毕赤酵母gs115感受态细胞中,以g418抗性平板筛选多拷贝转化子,即为i型重组胶原蛋白的表达菌株。
33.表1各酵母表达菌株表达的i型重组胶原蛋白
34.no.重复单元重复次数分子量(kd)1g a p g a p g s q g a p g l q82102.192同上92114.653同上102127.124同上5264.8
5同上6277.276同上7289.737gskgdtgakgepgpvgvqgppgpageegkrgargep35116.328同上3099.79同上40132.9310gergdlgpqgiagqrgvvgergfpgergvq38123.7411同上33108.6612同上43138.8313gergdlgpqgiagqr92137.3114同上82122.3815同上102152.2316同上72107.4717同上6292.5418同上5277.62
35.2、目标蛋白的诱导表达
[0036] (1)挑取酵母表达菌株的单菌落加入到5ml ypd液体培养基中(1%酵母提取物,2%蛋白胨和2%葡萄糖),30℃,200rpm培养过夜进行活化;
[0037] (2)以1%的接种量接种于100ml的bmgy液体培养基,30℃, 200rpm培养至od
600
=6.0~9.0;
[0038] (3)在1500g离心力作用下,25℃离心6min收集菌体,并将其悬浮于200ml bmmy液体培养基中,使其起始浓度为od
600
=1.0,在30℃, 200rpm条件下培养;
[0039] (4)每隔24h加甲醇,终浓度为0.5~1.0%,进行诱导表达;
[0040] (5)诱导72h,取培养液在12000rpm条件下离心2min,取上清液。
[0041]
3、i型重组胶原蛋白制备
[0042]
将发酵制备的上清液经过30kd超滤膜超滤浓缩后,采用cm离子交换柱进行柱分离,以35%的nacl溶液进行洗脱,收集洗脱液,脱盐浓缩后冻干即为i型重组胶原蛋白制备。取0.1g冻干粉融入100ml生理盐水中,充分溶解后上sds-page凝胶电泳,进行分子量大小及蛋白电泳纯度的确认。
[0043]
结果显示构建的18株表达菌均能成功的表达目标蛋白,经分离纯化后制备的蛋白电泳纯度均在99%以上,电泳结果如图1所示。
[0044]
实施例2:各种i型重组胶原蛋白在水溶液中的稳定性实验
[0045]
a实验材料
[0046]
实验所用材料为实施例1中制备的i型重组胶原蛋白no.1~-18。
[0047]
b实验方法
[0048]
将a中的实验材料用ddh2o配置成蛋白浓度为1mg/ml的蛋白溶液,在超净工作台中用0.22μm的无菌滤器过滤后分装到无菌离心管中密封,置于25℃
±
2℃的条件下,分别于0个月、6个月、12个月取样,每次取样3 管,检测蛋白纯度(高效液相色谱法测定蛋白纯度),根据纯度变化判定蛋白的稳定性。
[0049]
c实验结果
[0050]
测试结果如下表:
[0051]
表2重组胶原蛋白溶液12个月稳定性测试结果(纯度,%)
[0052]
no.第0个月第6个月第12个月199.9299.4899.05299.9399.0898.23399.8898.5097.37499.8693.4480.12599.9390.2178.23699.8589.2572.22799.8991.1773.02899.8994.1480.34999.9089.3369.111099.7988.3170.011199.8891.3475.441299.8786.3462.231399.9178.3358.471499.9480.3463.131599.8973.3450.111699.8684.1968.331799.7887.3570.231899.9089.4573.33
[0053]
通常认为,(1)分子量相同或相近的重组胶原蛋白,重复单元越短,氨基酸组成及分布就越单调,表面电荷负载越大,越不容易达到稳定的平衡状态,因而更易水解;(2)相同重复单元的重组胶原蛋白,重复次数越多,分子量越大,重组胶原蛋白的表面电荷负载越大,越不容易达到稳定的平衡状态,因而更易水解。
[0054]
但是,由表2可知,本发明的i型重组胶原蛋白(no.1~3)表现出异常优异的水溶液中稳定性,其在水溶液中放置12个月,纯度仍可高达97%以上(参见图2a~g)。
[0055]
实施例3:i型重组胶原蛋白no.1~3具有反常的水溶液中稳定性的原因初探 1)红外光谱测定
[0056]
将表1中no.1和no.6的重组胶原蛋白分别配制成溶液后,进行红外光谱测定,用bruker opus7.2对光谱数据进行傅里叶退卷积,截取 1700~1600cm-1
波段光谱数据,用peakfit v4.12进行二阶导分峰拟合处理,将处理后的数据用orgin作图得到二级结构分布,并计算二级结构的相对含量。两种蛋白的二级结构比较结果如表3及图3所示。
[0057]
表3红外光谱测定的no.1和no.6的重组胶原蛋白的二级结构
[0058] β-sheet/%random/%α-helix/%β-turn/%r^2no.145.9527.3410.5616.140.9998no.634.0134.7413.7917.450.9995
[0059]
2)拉曼光谱测定
[0060]
将表1中no.1和no.6的重组胶原蛋白分别配制成溶液后,进行拉曼光谱测定,用
thermofisher omnic9.2对光谱数据进行平滑基线校正处理,截取1700~1600cm-1
波段光谱数据,用peakfit v4.12进行二阶导分峰拟合处理,将处理后的数据用orgin作图得到二级结构分布,并计算二级结构的相对含量。两种蛋白的二级结构比较结果如表4及图4所示。
[0061]
表4拉曼光谱测定的no.1和no.6的重组胶原蛋白的二级结构
[0062] β-sheet/%random/%α-helix/%β-turn/%r^2no.137.9635.7813.0813.180.9983no.627.3526.0217.0429.580.9966
[0063]
从实施例3的测定结果可以看出,重复单元相同但重复次数不同的重组胶原蛋白在二级结构上存在较大差异,这也暗示两者的三级结构存在差异。可以推测no.1~3的i型重组胶原蛋白的空间结构使其表面电荷更为平衡,从而表现出良好的水溶液中的稳定性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。