1.本发明属于农业技术领域,具体涉及一种同时检测六种水稻病毒的试剂盒及其应用。
背景技术:
2.水稻(oryza sativa l.)是世界上一半人口的主食来源。水稻病毒病作为农业生产上的重要病害之一,在我国、日本、韩国、印度、菲律宾、越南等国家以及非洲水稻产区普遍发生(uehara-ichiki et al.,2013a)。水稻病毒不仅仅侵染水稻,还侵染玉米,小麦等禾本科植物,寄主范围广;其次,水稻新老病毒轮番发生,新的病毒不断被发现,老的病毒潜伏发生,由于水稻抗病毒免疫品种缺乏,水稻病毒病尚不能有效彻底的控制,始终威胁着农业生产,带来了极大的安全隐患并造成重大的经济损失。
3.目前世界报道的水稻病毒有17种,在我国发生过的有12种之多。当前在生产上能够采到的有水稻条纹病毒(rice stripe virus,rsv)、水稻草状矮化病毒(rice grassy stunt virus, rgsv)、水稻矮缩病毒(rice dwarf virus,rdv)、水稻锯齿叶矮缩病毒(rice ragged stunt virus, rrsv)、水稻黑条矮缩病毒(rice black-streaked dwarf virus,rbsdv)、南方水稻黑条矮缩病毒(southern rice black-streaked dwarf virus,srbsdv)、水稻瘤矮病毒(rice gall dwarf virus, rgdv)和水稻条纹花叶病毒(rice stripe mosaic virus,rsmv)等8种水稻病毒病害。这些水稻病毒的感染大多会引起水稻植株的矮化,分蘖增多,叶色浓绿卷曲,叶片僵直等相似的病害症状,然而,当同一水稻植株上出现多种不同症状表现时,很难通过病害症状来进行诊断。
4.在南方水稻产区rdv、rsv、srbsdv、rrsv、rgsv、rbsdv常年发生混合侵染,早期侵染症状相似,这极其容易导致病毒的误诊。快速精准诊断对于有效预防和控制侵染初期的病害流行具有重要意义,如果出现判断错误,很有可能影响生产实践,因此有必要建立一种可快速高效精准检测多种病毒的pcr体系。每种水稻病毒都包含一个dsrna或ssrna 基因组。rdv、srbsdv、rbsdv和rrsv包含10-12个片段的dsrna(hibino,1996),rsv 和rgsv包含4-6条ssrna基因组,其病毒的序列同源性均有差异。srbsdv和rbsdv是同源性最高的,它们最保守的成分(片段1,2和10)有78.5%
–
79.2%相似度(wang et al.,2010)。其他几种病毒基因组与srbsdv和rbsdv的基因组有显著差异。因此,根据这些病毒的基因组序列差异设计每种病毒的特异引物,建立一种同时检测这6种病毒的方法,对于监测传毒介体带毒、病害流行等生产实践具有重要意义。
技术实现要素:
5.本发明的目的是提供一种同时检测六种水稻病毒的试剂盒及其应用。
6.为了实现上述目的,本发明采用以下技术方案:
7.一种同时检测六种水稻病毒的试剂盒,包括:用于检测水稻锯齿叶矮缩病毒rrsv的引物组、用于检测水稻条纹病毒rsv的引物组、用于检测水稻矮缩病毒rdv的引物组、用于
检测南方水稻黑条矮缩病毒srbsdv的引物组、用于检测水稻黑条矮缩病毒rbsdv的引物组、用于检测水稻草状矮化病毒rgsv的引物组;
8.所述用于检测水稻锯齿叶矮缩病毒rrsv的引物组如下:
9.rrsv cp(p8)-f cggagagagataacgcttgg
10.rrsv cp(p8)-r cacagtaataaccgcacgct;
11.所述用于检测水稻条纹病毒rsv的引物组如下:
12.rsv cp(pc3)-f ggctgtggactcttctgacc
13.rsv cp(pc3)-r ttgtcagaccacgctccttc;
14.所述用于检测水稻矮缩病毒rdv的引物组如下:
15.rdv cp(p8)-f tgtatgagcgccaaaatgcg
16.rdv cp(p8)-r ccaccaccaagtgagaacga;
17.所述用于检测南方水稻黑条矮缩病毒srbsdv的引物组如下:
18.srbsdv cp(p10)-f cacacttctgtctcacttcaactctct
19.srbsdv cp(p10)-r cttacgcaacgatgaacctttctctat;
20.所述用于检测水稻黑条矮缩病毒rbsdv的引物组如下:
21.rbsdv cp(p10)-f gaaggaaacattactttgaagccc
22.rbsdv cp(p10)-r cgctcaacacttcgccaat;
23.所述用于检测水稻草状矮化病毒rgsv的引物组如下:
24.rgsv cp(pc5)-f attgagacccattagtaccgttg
25.rgsv cp(pc5)-r agagcagtttcctgtagtcccca。
26.进一步地,上述试剂盒还包括:onestep rt/taq mix、5
×
reaction buffer和depc-ddh2o。
27.采用上述试剂盒同时检测六种水稻病毒的方法,包括以下步骤:
28.步骤1,提取水稻叶片总rna;
29.步骤2,以步骤1提取的水稻叶片总rna为模板,采用权利要求1所述的试剂盒对其进行rt-pcr扩增;
30.步骤3,对步骤2的pcr扩增产物进行琼脂糖凝胶电泳检测;
31.结果判断标准如下:在100~250bp之间出现条带则存在水稻条纹病毒rsv;在250~500bp 之间,接近250bp出现条带则存在水稻草状矮化病毒rgsv,接近500bp左右出现条带则存在水稻矮缩病毒rdv;在500~750bp之间出现条带则存在水稻锯齿叶矮缩病毒rrsv;靠近 750bp出现条带则存在水稻黑条矮缩病毒;靠近1000bp出现条带则存在南方水稻黑条矮缩病毒srbsdv。
32.进一步地,步骤2中的rt-pcr扩增体系包括:onestep rt/taq mix 0.75μl、5
×
reactionbuffer 4μl,模板量为1μg,0.3μm rsv引物0.6μl,0.2μm rdv引物0.4μl,0.25μm rgsv 引物0.3μl,0.2μm rrsv引物0.4μl,0.3μm rbsdv引物0.6μl,0.1μm srbsdv引物0.2μl, depc-ddh2o补足至20μl。
33.进一步地,步骤2中rt-pcr扩增条件为:
34.反转录反应条件:50℃,30min;
35.rt-pcr反应条件:预变性,94℃,2min;变性,94℃,30s;退火,58℃,30s;延伸, 72
℃,1min;重复变性、退火和延伸30个循环;终延伸,72℃,10min。
36.本发明的试剂盒可以方便快捷可靠的同时检测6种水稻病毒,既节省了检测成本,又可快速得到结果,减少工作量,可进行细致而深入的病毒病学研究,为更好的研究水稻田间病害的发病和传毒介体的带毒率,为病害的测报和防控提供了有利抓手,为大规模突发性病毒病暴发时病因的溯源打下了良好的技术基础,具有广阔的应用前景。
附图说明
37.图1为6种水稻病毒特异性引物扩增pcr产物的凝胶电泳图谱。其中: dna maker;1:rsv;3:rgsv;5:rdv;7:rrsv;9:rbsdv;11:srbsdv;2、4、6、8、10、12 为阴性对照。
38.图2为6种病毒检测引物浓度优化结果。其中:dna maker;0.2、0.3、 0.4、0.5、0.6分别对应病毒检测引物加入的体积量(μl)。
39.图3为退火温度的优化结果。其中:dna maker;54、56、58、60分别对应不同的退火温度。
40.图4为onestep rt/taq mix用量的优化结果。其中:dna maker;0.75、 1.0、1.25、1.5分别对应不同的onestep rt/taq mix的用量。
41.图5为pcr检测的灵敏度与稳定性结果。其中:dna maker;泳道1、2,泳道3、4,泳道5、6,泳道7、8分别对应混合模板的稀释倍数。
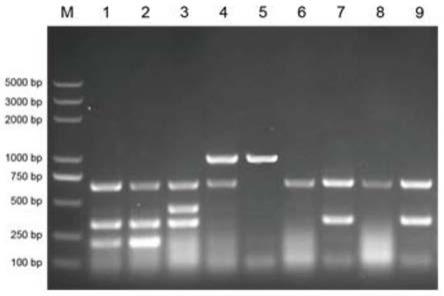
42.图6为田间样品的检测结果。其中:m:dna maker;1-9:混合侵染的田间水稻病毒样品。
具体实施方式
43.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.本发明所采用的材料、试剂如下:
45.1、材料:感染rdv、rsv、srbsdv、rrsv、rgsv和rbsdv的水稻样品,以及健康水稻样品,由福建农林大学媒介病毒研究中心实验田采得。
46.2、主要试剂:植物总rna提取试剂盒购自omega-biotek公司(ezna total rna kit 1; r6834-02)试剂盒;toyobo高效率逆转录revertra ace试剂盒(trt-101);genstart公司 starscript ii一步法rt-pcr试剂盒(a215),所有引物合成自福州尚亚生物技术有限公司。
47.实施例1
48.1、水稻叶片总rna的提取
49.6种水稻病毒样本、混合侵染样本以及健康水稻样本的总rna提取参照omega-biotek 公司的植物总rna提取试剂盒(r6834-02)的操作步骤进行:0.1g水稻叶片用液氮研磨成粉末后转入1.5ml无rnase的离心管,每1ml buffer rcl加20μl巯基乙醇,每个样本中加500μl buffer rcl,涡旋震荡混匀后,55℃温育3min,离心(12000rpm,5min,4℃),将上清
液转移到dna吸附柱上,离心(12000rpm,2min,4℃)后吸取液体转移到无rnase污染的 1.5ml离心管中,加入相同体积的rcb(约450μl),上下轻轻震荡混匀,将混合溶液移到 rna吸附柱上,离心(10000rpm,1min,4℃),用rwf 400μl洗一次(10000rpm,1min, 4℃),弃滤液;dnase i消化,每个样加75μl消化液(dna消化酶1.5μl,73.5μl dna digestbuffer),静置30min;再用rwf 400μl洗一次(10000rpm,1min,4℃),弃滤液,加入700μl wash buffer ll,离心(10000rpm,1min,4℃),弃滤液,加入500μl rna wash buffer ll,离心(10000rpm,1min,4℃),再以1000rpm离心rna mini column,2min后晾干后,转入新的无rnase污染的1.5ml离心管,加入50μl的depc-h2o,12000rpm速度离心1min,滤液(rna)储存在-80℃冰箱保存备用。
50.2、一步法rt-pcr
51.以上述提取的rna为模板使用genstar的一步法rt-pcr试剂盒,按说明书推荐的反应体系:rna模板1μg,上游引物(10μm)0.4μl;下游引物(10μm)0.4μl;5
×
reaction buffer 4μl;one step rt/taq mix 1.5μl;用depc-ddh2o补足至20μl;反转录反应条件:50℃,30min; rt-pcr反应条件:预变性,94℃,2min;变性,94℃,30s;退火,58℃,30s;延伸,72℃, 1min;(重复变性、退火和延伸30个循环);终延伸,72℃,10min。
52.3、引物的设计与筛选
53.从美国国家生物技术信息中心(ncbi)检索到6种水稻病毒rrsv、rsv、rdv、srbsdv、 rbsdv、rgsv的外壳蛋白(cp)的基因序列,应用primer premier 5.0软件进行引物设计,并使用oligo程序分析每个引物组是否存在二级结构以及3'端配对的可能性。在此基础上,根据一步法多重rt-pcr方法的检测原理,尽量在相近的退火温度下一次完成多个目标片段的扩增,筛选tm值较为相近的6种水稻病毒的检测引物,所有的引物在福州尚亚生物技术有限公司合成(表1)。
54.表1多重rt-pcr检测引物
[0055][0056]
以6种水稻病毒rrsv、rsv、rdv、srbsdv、rbsdv、rgsv的cp基因序列为模板设计了的一系列检测引物(表1),经过试验筛选最终每种病毒选择了1对特异性强的检测引物(表2),并且在1.5%琼脂糖凝胶中能够明确区分不同水稻病毒的扩增产物,如图1所示,其中rrsv为600bp;rsv为212bp;rdv为433bp;srbsdv为973bp;rbsdv为808bp; rgsv为300bp;阴性对照组未产生扩增产物,上述pcr产物均通过了sanger测序并确认。证实了表2列出的检测引物符合一步法多重rt-pcr的检测规则。
[0057]
表2 6种水稻病毒的检测引物筛选结果
[0058][0059]
4、单重rt-pcr对6种水稻病毒引物浓度的优化
[0060]
除引物浓度分不同的梯度外,其他组分按照试剂盒推荐用量,即模板量1μg、reactionbuffer 4μl、onestep rt/taq mix 1.5μl,退火温度为58℃,根据预实验,6种水稻病毒检测引物浓度设置4个梯度,rsv和rbsdv检测引物加量分别为0.3、0.4、0.5、0.6μl,rdv、 rrsv、rgsv和srbsdv检测引物加量分别为0.2、0.3、0.4、0.5μl,pcr程序结束后,从图2可以看到,当rsv检测引物加量在0.3μl时目的扩增条带几乎不可见,随着引物浓度的提升,条带亮度逐渐清晰(图2a),最终选取病毒检测引物加量为0.6μl(终浓度为0.3μm) 作为最适的rsv检测用量。
[0061]
如上说述,检测rdv的引物加量梯度分别为0.2、0.3、0.4、0.5μl,pcr程序结束后,从凝胶电泳图中可以看到不同浓度梯度下均可以明显扩增出rdv目的条带,最终选取病毒检测引物加量为0.4μl(终浓度为0.2μm)作为最适的rdv检测用量(图2b)。
[0062]
检测rgsv的引物加量梯度分别为0.2、0.3、0.4、0.5μl,从凝胶电泳图(图2c)中可以看到随着引物浓度的提升,条带亮度逐渐清晰,最终选取病毒检测引物加量为0.5μl(终浓度为0.25μm)作为最适的rgsv检测用量。
[0063]
检测rrsv的引物加量梯度分别为0.2、0.3、0.4、0.5μl,从凝胶电泳图(图2d)中可以看到当检测引物加量为0.4μl时病毒的特异扩增条带明亮且清晰,最终选取病毒检测引物加量为0.4μl(终浓度为0.2μm)作为最适的rrsv检测用量。
[0064]
检测rbsdv的引物加量梯度分别为0.3、0.4、0.5、0.6μl,pcr程序结束后,从凝胶电泳图中可以看到不同浓度梯度下均可以明显扩增出rbsdv目的条带,随着引物浓度的提升,条带亮度越清晰(图2e),最终选取病毒检测引物加量为0.6μl(终浓度为0.3μm)作为最适的rbsdv检测用量。
[0065]
检测srbsdv的引物加量梯度分别为0.2、0.3、0.4、0.5μl,pcr程序结束后,从图2f 中可以看到在所选病毒引物浓度范围内都可以明显扩增出srbsdv目的条带,并且在该范围内扩增效果相较于其他五种引物扩增效果明显较好,最终选取病毒检测引物加量为0.2μl(终浓度为0.1μm)作为最适的srbsdv检测用量。
[0066]
5、单重rt-pcr下对6种水稻病毒引物退火温度的优化
[0067]
在模板量、reaction buffer、onestep rt/taq mix的用量按照试剂盒推荐用量不
更改的情况下,本实施例进一步摸索pcr反应的最佳退火温度。据此,在rt-pcr反应中设计了一系列的梯度退火温度(分别为54、56、58、60℃),并选用上述已明确的最适上下游引物浓度进行pcr反应。rt-pcr反应程序如下:rna反转录50℃,30min;预变性94℃,2min;(94℃变性,30s;退火温度设置4个梯度,30s,延伸72℃,1min)35个循环;终延伸72℃,10min。凝胶电泳后如图3结果显示,6个不同病毒的pcr产物均被有效地扩增,且大小正确。4个不同梯度的退火温度对扩增效果影响不大,说明退火温度在设定的范围内引物特异性良好,考虑到提高退火温度是抑制引物自身连接的有效手段,为了尽量避免引物混合后的意外情况发生,减少引物之间的相互影响,因此确定58℃为随后的pcr扩增的最终退火温度。
[0068]
6、onestep rt/taq mix用量的优化
[0069]
酶的价格昂贵,为了节约酶的用量,在确保扩增效果的前提下,对本发明onestep rt/taqmix的用量进行优化,在使用过程中注意到,减少酶的用量同样可以扩增出病毒的特异条带。在明确上下游引物浓度和退火温度的前提下进一步对onestep rt/taq mix用量进行优化,为了确保扩增效果,减少不必要的失误,确定试剂盒推荐用量的一半为最低浓度(0.75μl),设置了4个梯度加量分别为0.75、1.0、1.25、1.5μl,pcr程序结束后凝胶电泳结果如图4所示, 4个梯度酶用量都可以扩增出6种病毒的特异性片段,并且随着酶的浓度提高并没有显著提高扩增效果,也就是说onestep rt/taq mix用量在试剂盒推荐的用量一半的情况下也可以获得相同的扩增效率,使得节约更多的实验经费成本。因此在保证扩增效果的前提下,本发明最终确定onestep rt/taq mix的用量在0.75μl为最终加量。
[0070]
7、多重一步法rt-pcr的灵敏度与稳定性分析
[0071]
将分别感染rsv、rdv、rrsv、rgsv、rbsdv、srbsdv的水稻植株提取rna,并按照等量体积混合,同时混合6种病毒特异性检测引物(终浓度分别为rsv 0.3μm;rdv 0.2μm;rgsv 0.25μm;rrsv 0.2μm;rbsdv 0.3μm;srbsdv 0.1μm)。按照多重一步法 rt-pcr的程序对病毒检测的灵敏度与稳定性进行分析,退火温度设置为58℃,延伸时间为 1min,其余反应参数按照推荐设置,结果如图5所示,在混合rna模板稀释1-4倍的前提下,多重一步法rt-pcr均能够稳定精确的检测出六条大小不一且易于区分的病毒扩增条带。说明多重一步法rt-pcr的灵敏度与稳定性符合实验预期。
[0072]
实施例2
[0073]
本实施例对田间采集的病毒侵染的水稻样品进行rna提取,并对多重一步法rt-pcr的实际应用进行生产实践,结果如6显示,不管是一种病毒还是多种病毒的复合侵染,该反应体系(多重一步法rt-pcr)均可以解析对应病毒的侵染数据,并且病毒特异性扩增效果明显,进一步证实了该检测方法的可靠性和实用性。
[0074]
基于上述实施例,本发明最终确定了多重一步法rt-pcr检测水稻病毒的最佳反应体系: 6种病毒特异性检测引物的终浓度分别为rsv 0.3μm(引物加量0.6μl),rdv 0.2μm(引物加量0.4μl),rgsv 0.25μm(引物加量0.3μl),rrsv 0.2μm(引物加量0.4μl),rbsdv 0.3μm (引物加量0.6μl),srbsdv 0.1μm(引物加量0.2μl);onestep rt/taq mix用量为0.75μl; 5
×
reaction buffer为4μl;模板量为1μg,退火温度为58℃,最后depc-ddh2o补足至20μl。延伸时间为1min,其他反应参数按试剂盒推荐设置。
[0075]
本发明中的多重rt-pcr是在同一体系中进行多位点扩增,虽是在单重rt-pcr的基础上进行了改进,但并不是简单的混合,实验过程中引物设计是影响扩增效果的关键因素,
这 6种水稻病毒中有的病毒的外壳蛋白基因高度保守,例如rbsdv和srbsdv,针对保守基因进行设计引物,要避免引物之间的同源性和引物二聚体形成等,进而保证引物的特异性扩增,在灵敏度和稳定性方面要接近单重rt-pcr检测,还要保证扩增片段之间有相近的扩增效率,这需要保持相近的退火温度,本发明的实验设计均有效的规避了这些情况的发生。
[0076]
另一方面,多重rt-pcr的结果会出现多个大小不同的扩增片段,但是得到的电泳条带要便于区分不同的水稻病毒,因此要保证相邻大小的条带要有一定的差异分布,而且在maker 的参照下容易估算出片段大小。本发明中所使用的maker指示条带为:100、250、500、750、 1000、2000、3000、5000bp,rsv特异性扩增的目标条带在100~250bp之间;rgsv和rdv 在250~500bp之间,其中rgsv接近250bp,rdv接近500bp;rrsv在500~750bp之间; rbsdb靠近750bp;srbsdv靠近1000bp。各个水稻病毒的特异性扩增条带很容易区分,符合预期检测效果。
[0077]
多重一步法rt-pcr检测可以方便快捷可靠的同时检测6种水稻病毒,既节省了检测成本,又可快速得到结果,减少工作量,可进行细致而深入的病毒病学研究,为更好的研究水稻田间病害的发病和传毒介体的带毒率,为病害的测报和防控提供了有利抓手,为大规模突发性病毒病暴发时病因的溯源打下了良好的技术基础,具有广阔的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。