一种酶包埋的zif-8/dna纳米复合探针及其制备方法和应用
技术领域
1.本发明属于生物探针技术领域,具体涉及一种酶包埋的zif-8/dna纳米复合探针及其制备方法和应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.三磷酸腺苷(atp)被称为生物体内的主要能量货币,通过与二磷酸腺苷的相互转化可以实现能量的储存和释放。传统的atp分析方法有高效液相色谱法、质谱法、同位素追踪法和生物发光法。然而,它们中的大多数因需要繁琐的样品制备或缺乏稳定性和可重复性而受到限制。
4.现有的一种酶辅助方法,在酶递送到细胞需要对细胞进行固定和脱水,这可能导致细胞损伤或死亡。此外,在复杂的细胞环境中,这些酶可能被一些蛋白酶攻击,导致其失去活性。
技术实现要素:
5.针对上述现有技术中存在的问题,本发明的目的是提供一种酶包埋的zif-8/dna纳米复合探针及其制备方法和应用。
6.为了解决以上技术问题,本发明的技术方案为:
7.第一方面,一种酶包埋的zif-8/dna纳米复合探针,包括,金属有机框架材料zif-8、dna聚合酶和核酸内切酶和dna探针,dna聚合酶和核酸内切酶包埋在zif-8的内部,dna探针吸附在zif-8的表面;
8.所述dna探针为识别探针rp和信号探针mb;识别探针rp是发夹状的dna探针,所述识别探针rp包括适配体序列和切割酶的识别位点、模板序列,信号探针mb与识别探针rp的部分聚合产物的序列碱基互补。
9.所述纳米复合探针表面为负zeta电位,晶体结构与zif-8相同。
10.本发明利用金属有机框架作为载体用于向细胞内进行递送。zif-8具有比表面积大、多孔结构、表面电荷性和ph响应性,由于具有独特的孔结构和可调的孔尺寸,所以能够包埋dna聚合酶和核酸内切酶蛋白,表面通过静电吸附dna探针。由于zn
2
离子和咪唑在低ph值下配位较弱,zif-8骨架在酸性条件下会快速坍塌,所以在进入细胞后会被降解。
11.本发明提出的一种纳米复合探针,结合双循环的级联聚合切刻反应,用于atp的灵敏检测和活细胞成像。将功能化的dna(识别探针rp和信号探针mb)通过静电相互作用吸附到预埋有聚合酶和切刻酶的zif-8表面。其中,识别探针是经过精心设计的,包含有atp的适体序列用于识别,两个酶切位点,和两段模板序列用于放大。当探针被细胞内化后,纳米复合探针被降解,释放预埋的酶和吸附的功能dna。在atp的存在下,识别探针和atp特异性绑
定,触发双循环的级联聚合切刻反应,产生增强的荧光信号用于atp的检测。
12.第二方面,上述酶包埋的zif-8/dna纳米复合探针的制备方法,所述方法为:
13.将模型蛋白、dna聚合酶、核酸内切酶同时与2-甲基咪唑(2-mim)水溶液混合孵育,然后加入锌盐反应得到包埋蛋白的金属有机框架;
14.包埋蛋白的金属有机框架与识别探针rp、信号探针mb混合孵育得到纳米复合探针。
15.第三方面,上述酶包埋的zif-8/dna纳米复合探针在体外或细胞内atp检测中的应用。
16.第四方面,一种检测细胞内atp的方法,所述方法为:将纳米复合探针与细胞混合孵育。具体的实现了atp在人类癌细胞(hela、a549和mcf-7细胞)中的成像。由寡霉素或ca
2
诱导的atp在hela细胞中的表达水平变化也可以被有效监测。此外,在体外实现了对atp的灵敏定量检测,检测限为7.7nm。
17.第五方面,一种检测体外atp的方法,所述方法为:将纳米复合探针与atp溶液混合孵育。
18.本发明一个或多个技术方案具有以下有益效果:
19.本发明提出了一种酶包埋的zif-8/dna纳米复合探针可以用于细胞内或体外的检测atp。尤其是细胞内进行检测,能够解决将酶递送到细胞并保持酶活性的问题,避免酶受到一些蛋白酶的攻击导致失去活性的问题。利用金属有机框架作为载体,解决了将酶递送到细胞内,需要对细胞进行固定和脱水,可能会导致细胞损伤或死亡的问题。
20.本发明构建了一种酶包埋的zif-8/dna纳米复合探针用于atp的灵敏检测和活细胞成像。利用zif-8作为载体,将酶和功能化的dna共递送进细胞。得益于双循环的级联扩增策略,实现了对atp的灵敏检测,检测限低至7.7nm。此外,成功实现了活细胞中atp的灵敏检测,并监测atp水平的变化。这些结果表明,这种酶包埋的zif-8/dna纳米复合探针将成为atp相关的生物医学研究的一个有前途的工具。
附图说明
21.构成本发明的一部分的说明书附图用来提供对本技术的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
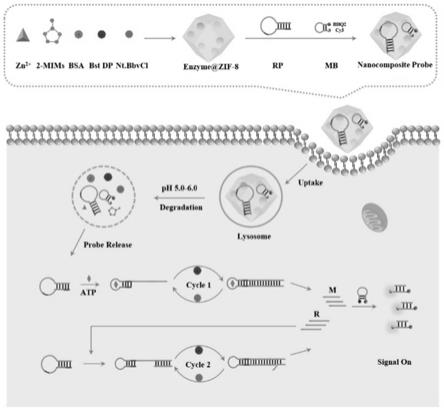
22.图1为酶包埋的zif-8/dna纳米复合探针用于atp的活细胞成像和灵敏检测的原理图。
23.图2为不同纳米颗粒的tem表征;(a)zif-8nps;(b)bsa@zif-8nps;(c)bsa@zif-8/dna nps。
24.图3为纳米颗粒的zeta(a)和pxrd(b)表征。
25.图4为蛋白在ph7.4和ph5.5的释放效率。
26.图5为不加酶和加入在纳米颗粒中释放酶时的荧光图谱。
27.图6为加入atp和不加atp时体系的荧光强度。
28.图7为双循环级联聚合切刻反应的灵敏度考察图;(a)双循环级联聚合切刻反应在不同atp浓度下的荧光光谱。(b)f-f0的值随atp浓度的变化而变化。
29.图8为诱导剂与atp的特异性结合的选择性图。
30.图9为用不同浓度(30、40、50、60、70、80μg ml-1
)的bsa bst dp nt.bbvci@zif-8 nps处理不同时间(0、4、8、12、24h)后hela细胞的细胞毒性检测结果图。
31.图10为hela细胞与fitc-bsa@zif-8/cy5-rp nps孵育4h后的clsm成像图。
32.图11为细胞成像和荧光强度图,(a)hela细胞的clsm成像:(a)bsa bst dp nt.bbvci@zif-8nps/rp mb;(b)bsa@zif-8nps/rp mb;(c)bsa bst dp@zif-8 nps/rp mb;(d)bsa nt.bbvci@zif-8nps/rp mb。(b)相应的cy3荧光强度。
33.图12为细胞成像和荧光强度图,(a)用(a)寡霉素、(b)对照组和(c)ca
2
处理的hela细胞的成像。(b)相应cy3的荧光强度。
34.图13为a549细胞和mcf-7细胞中atp的clsm成像图。
具体实施方式
35.应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
36.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
37.第一方面,一种酶包埋的zif-8/dna纳米复合探针,包括,金属有机框架材料zif-8、dna聚合酶和核酸内切酶和dna探针,dna聚合酶和核酸内切酶包埋在zif-8的内部,dna探针吸附在zif-8的表面;
38.所述dna探针为识别探针rp和信号探针mb;识别探针rp是发夹状的dna探针,所述识别探针rp包括适配体序列和切割酶的识别位点、模板序列,信号探针mb与识别探针rp的部分聚合产物的序列碱基互补。
39.所述纳米复合探针表面为负zeta电位,晶体结构与zif-8相同。
40.在本发明的一些实施方式中,识别探针rp包括修饰荧光基团的探针rp,探针rp如seq id no.1所示。进一步,5'端连接的荧光基团。在本发明中,对荧光基团不做限制,在一个具体实施例中,荧光基团为cy5。
41.在本发明的一些实施方式中,信号探针mb如seq id no.2所示,进一步,在3'端连接的淬灭基团,5'端连接的荧光基团。本发明中,对猝灭基团和荧光基团不做限制,在一个具体实施例中,淬灭基团为bhq2,荧光基团为cy3。。
42.目标物atp和rp特异性结合,形成rp-atp复合物。在dna聚合酶和在核酸内切酶辅助下,以rp-atp复合物的3’末端作为引物,引发初级聚合切刻反应,得到两种产物r和m,产物r作为引物引发次级的聚合切刻反应,产物m与信号探针mb碱基互补配对杂交。在一个具体实施例中,dna聚合酶为bst 3.0dna聚合酶(bst dp),核酸内切酶为切刻内切酶(nt.bbvci)。
43.在本发明的一些实施方式中,zif-8内包埋的蛋白质还包括模型蛋白。模型蛋白为牛血清白蛋白(bsa)
44.第二方面,上述酶包埋的zif-8/dna纳米复合探针的制备方法,所述方法为:
45.将模型蛋白、dna聚合酶、核酸内切酶同时与2-甲基咪唑(2-mim)水溶液混合孵育,然后加入锌盐反应得到包埋蛋白的金属有机框架(bsa bst dp nt.bbvci@zif-8nps);
46.包埋蛋白的金属有机框架与识别探针rp、信号探针mb混合孵育得到纳米复合探针(bsa bst dp nt.bbvci@zif-8/rp mb nps)。
47.在本发明的一些实施方式中,蛋白与2-甲基咪唑(2-mim)水溶液混合孵育的温度为25-35℃,孵育时间为25-35min。
48.在本发明的一些实施方式中,加入锌盐后反应的时间为5-15min。
49.第三方面,上述酶包埋的zif-8/dna纳米复合探针在体外或细胞内atp检测中的应用。
50.第四方面,一种检测细胞内atp的方法,所述方法为:将纳米复合探针与细胞混合孵育。纳米复合探针进入到细胞中,然后与atp进行作用,启动级联聚合切刻反应的基础上产生荧光,然后可以进行细胞内atp的成像,能够监测细胞中atp水平的变化。
51.第五方面,一种检测体外atp的方法,所述方法为:将纳米复合探针与atp溶液混合孵育。在体外进行检测atp的方法通过实验证实具有可行性。
52.zif-8nps也表示金属有机框架zif-8,zif-8nps表示的是纳米颗粒的zif-8。
53.实验部分
54.1、实验试剂
55.所有的dna寡核苷酸序列(序列在表1中列出)、三磷酸腺苷(atp)、三磷酸尿苷(utp)、三磷酸胞苷(ctp)、三磷酸鸟苷(gtp)、三磷酸脱氧核苷酸(dntps)、寡霉素、牛血清白蛋白(bsa)、fitc标记的bsa均购自上海生工生物技术有限公司。六水合硝酸锌(zn(no3)26h2o)和2-甲基咪唑(2-mim)在sigma aldrich购买。bst 3.0dna聚合酶(bst dp)和核酸内切酶(nt.bbvci)购自new england biolabs。实验所需的细胞培养试剂购买于biological industries。所有的化学制剂都没有经过进一步提纯就被使用。所有水溶液的制备都使用了millipore milli-q水净化系统生产的电阻率为18.25mωcm-1
的超纯水。
56.表1实验所用到的寡核苷酸序列。
[0057][0058]
如表1中所示,rp中的gctgagg和gctgagg表示切刻酶nt.bbvci的识别序列,acctgggggagtattgcggaggaaggt表示atp的适体序列。
[0059]
2、仪器
[0060]
所制备的样品的尺寸和形态是通过透射电子显微镜(tem,jem-1011,jeol,日本)获得的。zeta电位由zeta sizer nano zs90(malvern,英国)获得。粉末x射线衍射(pxrd)是用x'pert3 powder&xrk-900衍射仪(panalytical,anton paar)在cu kα辐射(2θ=5-50
°
)下分析纳米粒子的相纯度。荧光发射光谱是用日立f-7000荧光分光光度计(日立,日本)收集的。细胞的共聚焦激光扫描显微镜(clsm)图像是使用leica tcs sp8共聚焦显微镜(leica,德国),用63
×
油镜拍摄。
[0061]
3、proteins@zif-8的合成
[0062]
首先,在剧烈搅拌下,将0.5mg模型蛋白牛血清白蛋白(bsa)溶于2-mim(2.8mmol,0.9ml)水溶液中,并在30℃下孵育30分钟。随后将0.1ml六水合硝酸锌(0.04mmol)水溶液加入上述混合物中10分钟。最后,在3000rpm下离心25分钟,收集该混合物。得到的bsa@zif-8nps用乙醇洗涤三次,并在真空下冻干。对于级联聚合切刻反应体系,bsa(0.5mg)被bst 3.0dna聚合酶(bst dp,0.0039毫克mg)、核酸内切酶(nt.bbvci,0.0068mg)和bsa(0.4893mg)三蛋白混合物代替,其他制备程序相同。最后,对得到的bsa bst dp nt.bbvci@zif-8nps进行称重,以确定合成产品的数量。对于纯zif-8nps,在搅拌下将2-mim(2.8mmol,0.9ml)水溶液中加入六水合硝酸锌(0.04mmol,0.1ml)。然后,将反应混合物在30℃下搅拌10分钟。最后,经过离心、洗涤和冻干,得到了纯的zif-8nps。所有的nps在细胞外实验时分散在水中,在细胞内研究时分散在培养基中。
[0063]
4、体外检测atp
[0064]
浓度为2.0μm rp和mb分别在95℃下加热5分钟,形成发夹结构。随后,将2.0μl rp、3.0μl mb、3.0μl 10
×
cutsmart缓冲液、3.0μl nacl(1.0m)、2.4u bst dp、4.0u nt.bbvci、2.0μldntps(10mm)、不同浓度的atp和一定量的灭菌水混合,形成50μl反应体系。在37℃孵育1小时后,测量其荧光强度。
[0065]
5、细胞孵育
[0066]
hela、a549和mcf-7细胞用dmem培养基孵育,其中培养液中混有10%胎牛血清和1%抗生素青霉素/链霉素。所有细胞均在含有5%co2和95%空气的环境中在37℃孵育。
[0067]
6、细胞成像
[0068]
首先,建立荧光成像方法,验证zif-8共递送蛋白质和dna探针的能力。用标记fitc的bsa合成的纳米颗粒与cy5标记的识别探针(cy5-rp)共同培养1小时,得到bsa-fitc@zif-8/cy5-rp nps。然后与hela细胞孵育4小时。纳米颗粒的浓度为60μg ml-1
。用pbs洗涤三次后,对hela细胞进行共聚焦激光扫描显微镜(clsm)成像。
[0069]
该放大策略的步骤如下:首先制备纳米复合探针,将bsa bst dp nt.bbvci@zif-8nps与rp和mb共孵育制备bsa bst dp nt.bbvci@zif-8/rp mb nps。由于bst dp的活性需要mg
2
,所有的细胞都用mg
2
(10mm)和卡西霉素(5.0μm)预处理30分钟。随后,将上述获得的纳米复合探针和dntps与细胞共同培养4h。最后,用共聚焦显微镜进行clsm成像。
[0070]
在atp表达水平实验中,将hela细胞分为三组。第一组与10μg ml-1
寡霉素处理以降低atp水平;第二组不做任何处理作为对照;第三组用5.0mm ca
2
处理以提高atp水平。随后,将三组细胞与纳米复合探针共培养4h。最后,进行共聚焦成像。
[0071]
7、细胞毒性
[0072]
将100μl hela细胞悬液(约5
×
103个细胞)分散到96孔板中并在培养箱中孵育过
夜。然后,用pbs清洗细胞,用含有不同浓度(30、40、50、60、70、80μg ml-1
)的bsa bst dp nt.bbvci@zif-8nps的新鲜培养液处理0、4、8、12、24h之后,加入mtt。4h后,丢弃含有mtt的上清液,加入二甲亚砜,在490nm出测量其吸光强度。
[0073]
结果与讨论
[0074]
1、原理
[0075]
所设计的用于atp检测和成像的原理如图1所示。首先,将功能化dna(rp和mb)吸附在预包埋bst dp和nt.bbvci的zif-8nps表面,构建一种新型纳米复合探针。rp是一个发夹状的dna探针,它嵌入了一个用于识别atp的适配体序列、两个切刻酶的识别位点和两个用于放大反应的模板序列。在没有atp的情况下,rp被自身锁定,背景信号可以被有效抑制。被细胞内化后,zif-8nps被生物降解,释放预埋的酶和吸附的功能dna。在atp的存在下,rp识别并与atp结合,导致rp的构象转变并释放锁定的模板序列。接着,rp-atp复合物的3'端作为引物,在酶的帮助下引发初级聚合切刻反应,产生了两种产物r和m。r作为新的引物引发次级的聚合切刻反应。最终,得到了大量的m与mb杂交,使荧光团和淬灭团分离,产生增强的荧光信号用于atp的检测和成像。
[0076]
2、zif-8的合成和表征
[0077]
首先制备了纯的纳米颗粒(zif-8nps)、包埋蛋白的纳米颗粒(bsa@zif-8nps)和吸附dna并包埋酶的纳米颗粒(bsa@zif-8/dna nps),并通过tem、zeta电位和pxrd对其进行了表征。如图2所示,bsa@zif-8nps的平均直径为83.2nm,这被认为是细胞摄取的完美尺寸。纯zif-8nps和bsa@zif-8/dna nps的平均尺寸分别为53.9和86.3nm。zeta电位分析表明,zif-8nps和bsa@zif-8nps表现出高度正电荷(图3的(a)图),这是因为zif-8nps的表面富含zn
2
。然而,在吸附了功能化的dna之后,zeta电位从正转为负。这一结果表明,功能化的dna很好地吸附在nps的表面。pxrd显示,纯zif-8nps的衍射峰与模拟的zif-8nps一致,表明所制备的zif-8nps是纯相的,且结晶良好(图3的(b)图)。bsa@zif-8nps和bsa@zif-8/dna nps显示了与纯zif-8相同的晶体结构,证明蛋白质的嵌入和dna的吸附并没有改变nps的晶体结构。这些结果表明,成功制备了zif-8nps并将酶预埋进zif-8nps,而且在其表面成功吸附了dna。
[0078]
接下来,探究了zif-8nps的ph分解特性。在ph7.4和ph5.5的tris-hcl缓冲液中处理fitc-bsa@zif-8nps。然后,通过测量荧光强度并计算获得蛋白的释放量。如图4所示,在ph7.4的中性条件下获得了不明显的释放,而在酸性条件下则观察到fitc-bsa的快速释放。蛋白质的释放在2小时内达到最大值,释放效率超过90%。这主要是由zif-8nps的降解引起的,因为金属-配体键在酸性条件下很容易水解,产生质子化的配体。
[0079]
然后,探究在纳米颗粒中释放出的bst dp和nt.bbvci是否存在活性。如图5所示,在没有bst dp和nt.bbvci的情况下,体系的荧光信号可忽略。当加入在纳米颗粒中释放的酶时,荧光强度明显增强。这一结果表明,从nps中释放出来的酶仍然具有催化活性,能够触发双循环级联聚合切刻反应,产生明显的荧光信号。
[0080]
通过荧光分析,研究了该策略对atp检测的可行性。从图6中可以看出,在没有atp的阴性对照中(红色曲线),荧光信号很弱,这是因为rp被茎环结构锁定,不能引发聚合切刻反应。在atp存在下,阳性样品的荧光强度急剧增强(黑色曲线)。这一结果表明,atp特异性地与rp结合,触发了扩增反应。随后,产生了大量的m与mb杂交,导致了cy3荧光的恢复。
[0081]
4、双循环级联聚合切刻反应的灵敏度考察
[0082]
通过测定不同浓度atp存在下样品的荧光,研究了该策略在最佳实验条件下的分析能力。图7的(a)图显示,随着atp浓度的增加,荧光强度逐渐增加,这表明信号输出能力高度依赖于atp浓度。图7的(b)图显示了f-f0与atp浓度的校准曲线。在30nm到100μm的范围内,净信号f-f0和atp浓度的对数之间获得了良好的线性关系(图7的(b)图,插入图)。线性回归方程为f-f0=531.6lgc
atp
910.6(r=0.9937)。根据三倍标准偏差的原则,检测限(lod)为7.7nm。灵敏度的提高应归功于双循环级联聚合切刻反应的高扩增效率。
[0083]
5、双循环级联聚合切刻反应的特异性考察
[0084]
这一策略的选择性取决于诱导剂与atp的特异性结合。为了评估该策略的选择性,在相同的条件下,对包括utp、gtp和ctp在内的几种类似分子进行了检测。如图8所示,与空白体系相比,加入类似分子后得到的荧光信号可以忽略不计。然而,加入目标atp后,阳性样品的荧光信号明显增强。结果表明,所提出的方法对atp具有良好的特异性。
[0085]
6、细胞内成像
[0086]
在进行细胞内实验之前,bsa bst dp nt.bbvci@zif-8nps的细胞毒性通过mtt实验进行了研究。如图9所示,当bsa bst dp nt.bbvci@zif-8nps的浓度≤70μg ml-1
时,与细胞孵育24h后,超过80%的细胞保持其生存能力,证明该纳米颗粒具有较低的毒性。随后,探究证明了纳米颗粒对蛋白和dna探针的共递送能力。如图10所示,细胞中出现了明显的绿色(fitc-bsa)和红色(rp-cy5)荧光,表明蛋白质和dna探针的成功传递。
[0087]
基于上述结果,我们对hela细胞中atp的成像进行了研究,以探讨该策略的可行性。用bsa bst dp nt.bbvci@zif-8/rp mb nps处理的hela细胞呈现明显的黄色荧光(图11)。这表明atp很好地与rp结合,启动了级联聚合切刻反应,产生了大量的单条dna链m,与mb杂交产生了荧光。然而,如果没有bst dp和nt.bbvci,或者没有bst dp、nt.bbvci中的一种,细胞显示的荧光可以忽略不计。这些结果表明,利用所构建的纳米复合探针可以用于细胞内atp的成像。
[0088]
为了证实扩增反应是由内源性atp特异性激活的,该纳米复合探针被用于成像细胞内atp水平的波动。ca
2
,一种atp诱导剂,可以激活脱氢酶以增加细胞内atp水平;寡霉素,atp抑制剂,能够抑制atp合成酶以减少atp水平。hela细胞分别用ca
2
和寡霉素处理,没有任何预处理的细胞作为对照。如图12的(a)图所示,与对照组细胞相比,用ca
2
处理的细胞获得了更亮的黄色荧光,而寡霉素处理的细胞的黄色荧光更弱。图12的(b)图显示,上述三组的荧光强度的分析与成像结果一致,这些结果证明了所提出的atp检测策略的高特异性,同时也验证了该策略能够监测活细胞中atp水平的变化。此外,作为主要的能量分子,atp存在于所有的活细胞中。为了探究该策略在其他细胞中的应用能力,我们在a549和mcf-7细胞中进行了atp的成像实验。如图13所示,两种类型的细胞都表现出明亮的黄色荧光。所有这些结果表明,这种方法是一种可靠和可行的细胞内atp成像工具。
[0089]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。