1.本发明属于生物技术领域,具体涉及一种新的环氧水解酶及其编码基因和应用。
背景技术:
2.半频哪醇重排(semi-pinocol rearrangement)在有机合成中能高效完成结构复杂、立体选择性高化合物的不对称合成,因此是一类非常重要的有机合成反应。在半频哪醇重排反应中,邻位迁移基团对环氧丙烷中碳的亲核反应具有很高的区域选择性和立体选择性,重排过程中往往形成手性季碳中心;重排后,通常形成含α-/β-羟基的羰基化合物,可进一步发生串联成环反应,生成结构多样、手性特异的化合物。基于亲电子碳和底物的结构不同,主要有四类半频哪醇重排用于合成结构复杂的天然产物。其中,iii型半频哪醇重排以2,3-环氧邻二醇多烯α-吡喃酮衍生物为底物,介导底物从c1到c3的2,3-迁移,生成具有立体特异性的2-季醛醇,可作为天然产物合成的优良前体。然而,化学合成领域仅开发了很少的路易斯酸型催化剂用于iii型半频哪醇重排反应,目前用于天然产物合成的仅有一种化学催化剂4-溴-2,6-二叔丁基苯氧化物,这极大限制了半频哪醇重排反应的应用。酶作为生物催化剂具有催化效率高、立体和区域选择性强、条件温和、环境友好等优点,因此,生物酶催化iii型半频哪醇重排反应在天然产物的生物合成中非常具有潜力。然而,到目前为止,催化iii型半频哪醇重排反应的酶在天然产物的生物合成中尚未见诸报道。
3.环氧水解酶(epoxide hydrolase,eh,ec3.3.2.3)是一类高效的生物催化剂,在手性药物中间体合成中具有广泛的应用。环氧水解酶能不对称催化合成高光学纯的手性化合物,具有催化效率高,且区域、立体选择性强的特点。该类酶的底物谱涵盖了多种环氧化合物,是手性药物合成中非常重要的生物催化剂,也是一种强有力的生物合成元件。
4.环氧水解酶广泛存在于植物、昆虫、哺乳动物以及微生物体内,在不同的生物体内发挥不同的生理功能。其中以哺乳动物来源的eh发现得最早,研究得最成熟,主要参与内源或外源毒性物质的分解代谢。植物eh来源比较丰富,陆续发现大豆、拟南芥、菠萝、土豆、绿豆和烟叶等常见植物中都有eh存在,它们主要参与角质的合成,并与某些胁迫反应(如干旱胁迫)相关。微生物的基因组能够编码多种类型的eh(可溶性eh、白三烯a4水解酶和微粒体eh等),它们在分解代谢自然环境中特定的碳源以及环境污染物的过程中发挥着重要的作用。由于微生物丰富的多样性、生长速度快、易于培养,酶的产量高等优点,目前eh最主要的来源还是微生物。在微生物中寻找新的ehs酶源是近年来国际上研究的热点。国内外已有大量关于产eh微生物的筛选、纯化及其基因克隆表达的文献报道(tetrahedron:asymmetry 1998,9:459-466)。目前在市场上已有来源于黑曲霉(aspergillus niger),放射土壤杆菌(agrobacterium radiobacter)和紫红红球菌(rhodococcus rhodochrous)的环氧水解酶制剂产品出售。尽管如此,可供选择的酶制剂种类仍然太少,底物作用范围有限,具有潜在应用价值的新型环氧水解酶仍然有待进一步开发。
技术实现要素:
5.有鉴于此,本发明提供了一种环氧水解酶及其编码基因和应用。该环氧水解酶为同时具有环氧水解和半频哪醇重排催化活性的双功能酶,包括:astd或mrvd。在具有抗乳腺癌活性的真菌毒素asteltoxin的生物合成中,该环氧水解酶高效催化环氧化物中间体水解并伴随催化半频哪醇重排反应,得到半缩醛产物asteltoxin t1。
6.为达到上述目的,本发明通过以下技术方案来实现:
7.本发明的第一个方面在于提供环氧水解酶astd或mrvd,其中,astd的氨基酸序列如seq id no.5所示,mrvd的氨基酸序列seq id no.7所示。
8.本发明的第二个方面在于提供编码上述环氧水解酶的基因astd或mrvd,其中,astd的核苷酸序列如seq id no.4所示,mrvd的核苷酸序列如seq id no.6所示。
9.本发明的第三个方面在于提供含有所述环氧水解酶基因astd或mrvd的重组表达载体。
10.就本发明的上述目的,所述重组表达载体为pfgl-aurap-astd或pfgl-aurap-mrvd质粒。
11.本发明的第四个方面在于提供含有高表达所述环氧水解酶astd或mrvd的基因工程菌。
12.就本发明的上述目的,所述的基因工程菌为齿梗孢霉(calcarisporium arbuscula)。
13.就本发明的上述目的,所述的基因工程菌为齿梗孢霉astd高表达菌株,菌株编号为m100,分类命名为齿梗孢霉菌(calcarisporium arbuscula),保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc),保藏编号为cgmcc no.20273,保藏日期为2020年9月21日。
14.就本发明的上述目的,所述的基因工程菌为齿梗孢霉mrvd高表达菌株,菌株编号为m101,分类命名为齿梗孢霉(calcarisporium arbuscula),保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc),保藏编号为cgmcc no.20272,保藏日期为2020年9月21日。
15.本发明的第五个方面在于提供上述环氧水解酶astd或mrvd的应用,包括:上述环氧水解酶astd或mrvd在催化半频哪醇重排反应中的应用,或者,上述环氧水解酶astd或mrvd在asteltoxin的生物合成中的应用。
16.就本发明的上述应用,所述环氧水解酶astd或mrvd在细胞体内高效催化环氧化物中间体水解,并伴随催化半频哪醇重排反应,得到半缩醛产物asteltoxin t1(化合物8)。
17.本发明的第六个方面在于提供上述基因工程菌的应用,包括:上述基因工程菌在催化半频哪醇重排反应中的应用,或者,上述基因工程菌在asteltoxin的生物合成中的应用。
18.就本发明的上述应用,所述基因工程菌中高表达的环氧水解酶astd或mrvd在细胞体内高效催化环氧化物中间体水解,并伴随催化半频哪醇重排反应,得到半缩醛产物asteltoxin t1(化合物8)。
19.本发明的环氧水解酶astd来自丝状真菌异冠裸胞壳。本发明通过基因组测序得到异冠裸胞壳的基因组序列草图,利用生物信息学分析鉴定到了包含asteltoxin(化合物1)
生物合成基因簇,其中含有环氧水解酶astd。利用分子生物学技术确定了环氧水解酶astd的氨基酸序列及编码其的基因序列。还利用ncbi数据库通过同源氨基酸序列比对找到了另一个环氧水解酶mrvd的基因序列及氨基酸序列。将环氧水解酶基因astd、mrvd分别与丝状真菌表达载体pfgl-aurap连接后转化齿梗孢霉δaurd缺失株,得到齿梗孢霉环氧水解酶astd高表达菌株或齿梗孢霉环氧水解酶mrvd高表达菌株,进而发现在上述基因工程菌的发酵产物中存在大量半缩醛产物asteltoxin t1(化合物8),进一步的研究分析认为:该酶在异源宿主中高效催化环氧化物中间体水解生成环氧邻二醇多烯α-吡喃酮底物,并伴随催化环氧邻二醇多烯α-吡喃酮的半频哪醇重排反应生成大量半缩醛产物asteltoxin t1(化合物8)。即,上述环氧水解酶astd或mrvd兼具环氧水解和半频哪醇重排催化活性的双功能。本发明涉及的酶可用于生物医药、生物化工等领域的半频哪醇重排反应并得到结构复杂的化合物,具有很大的应用价值。
20.相对于现有技术,本发明具有以下有益的技术效果:
21.本发明的环氧水解酶astd或mrvd兼具环氧水解和半频哪醇重排催化活性的双功能,能够用在具有抗乳腺癌活性的真菌毒素asteltoxin的生物合成中高效催化环氧化物中间体水解,并伴随催化半频哪醇重排反应,得到半缩醛产物asteltoxin t1(化合物8)。
22.基于本发明的环氧水解酶astd或mrvd可构建高表达astd或mrvd的基因工程丝状真菌,在细胞体内高效实现半频哪醇重排反应,并应用于制备大量天然产物asteltoxin t1(化合物8)。
23.本发明有助于定向进化实现高效广谱的半频哪醇重排,为新型生物催化剂的开发并实现手性特异性药物的高效绿色生物合成奠定基础,具有重要的应用前景。
24.生物保藏信息:
25.齿梗孢霉astd高表达菌株,菌株编号为m100,分类命名为齿梗孢霉(calcarisporium arbuscula),保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc),地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.20273,保藏日期为2020年9月21日。
26.齿梗孢霉mrvd高表达菌株,菌株编号为m101,分类命名为齿梗孢霉(calcarisporium arbuscula),保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc),地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.20272,保藏日期为2020年9月21日。
附图说明
27.图1为异冠裸胞壳中通过同源分析鉴定到的asteltoxin(化合物1)的生物合成基因簇。
28.图2为不同高表达的齿梗孢霉菌株发酵产物高效液相色谱检测结果对比。
29.图3为本发明的asteltoxin t1(化合物8)的1h nmr图谱
30.图4为本发明的asteltoxin t1(化合物8)的
13
c nmr图谱
31.图5为本发明的asteltoxin t1(化合物8)的dept135 nmr图谱
32.图6为本发明的asteltoxin t1(化合物8)的hsqc nmr图谱
33.图7为本发明的asteltoxin t1(化合物8)的cosy nmr图谱
34.图8为本发明的asteltoxin t1(化合物8)的hmbc nmr图谱
35.图9为本发明的asteltoxin t1(化合物8)的noesy nmr图谱
具体实施方式
36.本技术发明人经过广泛而深入的研究,以丝状真菌异冠裸胞壳(emericella variecolor nhl 2881)来源的真菌毒素asteltoxin(化合物1,其具有抗乳腺癌活性)为目标分子,采用微生物学、分子生物学、生物分析信息学、生物化学及有机化学相结合的方法研究其生物合成,首次鉴定了真菌毒素asteltoxin(化合物1)的生物合成基因簇,并且,发明人还首次发现了真菌毒素asteltoxin(化合物1)的生物合成途径。同时,通过对真菌毒素asteltoxin(化合物1)的生物合成机制的研究,揭示化合物1中2,8-二氧杂双环-[3.3.0]-辛烷(或双四氢呋喃)的独特化学结构形成的酶学机理,分离和鉴定了兼具环氧水解和半频哪醇重排催化活性的双功能酶astd,并通过同源氨基酸序列比对找到了另一个双功能酶mrvd。在此基础上,运用基因工程的原理,得到齿梗孢霉astd高表达菌株或齿梗孢霉mrvd高表达菌株,这些基因工程菌株的发酵产物中存在大量的半缩醛产物asteltoxin t1(化合物8),因此,可用于天然产物真菌毒素asteltoxin(化合物1)的大量合成。
[0037]
本发明中未注明具体技术或条件者,按照本领域内文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购得的常规产品。
[0038]
质粒、菌株以及培养基:
[0039]
本发明所涉及的bamhi消化的真菌高表达质粒pfgl-aurap,其构建方法具体请见申请号为201810129024.5的中国发明专利的公开文本(公开号为cn108265074a)中质粒pflg-aurap的制备(文献中pflg-aurap实际就是pfgl-aurap,其是基于农杆菌表达载体pfgl815n插入遗传霉素抗性基因neor以及来源于齿梗孢霉的启动子aurap得到的)。
[0040]
本发明所涉及的野生型异冠裸胞壳孢子(拉丁名为:emericella variecolor nhl 2881)购自荷兰cbs菌种保藏中心(编号cbs 668.82)。
[0041]
本发明所涉及的丝状真菌齿梗孢霉环氧水解酶缺失株(c.arbusculaδaurd)的构建方法具体请见:xu-ming mao等,efficient biosynthesis of fungal polyketides containing the dioxabicyclo-octane ring system,j.am.chem.soc.2015,137,11904-11907。
[0042]
马铃薯葡萄糖琼脂(pda)培养基配方(1l):pdb(potato dextrose broth,马铃薯葡萄糖肉汤)24g,琼脂粉20g;121℃灭菌20分钟。
[0043]
固体lb培养基配方(1l):胰蛋白胨10g,酵母提取物5g,氯化钠10g,琼脂粉20g;121℃灭菌20分钟。
[0044]
液体lb培养基配方(1l):胰蛋白胨10g、酵母提取物5g、氯化钠10g,蒸馏水1l;121℃灭菌20分钟。
[0045]
液体诱导培养基配方(1l):葡萄糖1.8g、甘油5ml、2-(n-吗啉代)乙烷磺酸8.53g(购自上海翊圣生物)、七水硫酸镁0.6g、氯化钠0.3g、二水氯化钙0.01g、硫酸亚铁0.001g、硝酸铵0.5g、ph4.8磷酸钾缓冲液0.8ml、微量元素5ml(含有:七水硫酸锌0.1g/l、五水硫酸铜0.1g/l、硼酸0.1g/l、一水硫酸锰0.1g/l、二水钼酸钠0.1g/l),ph调整到5.5。
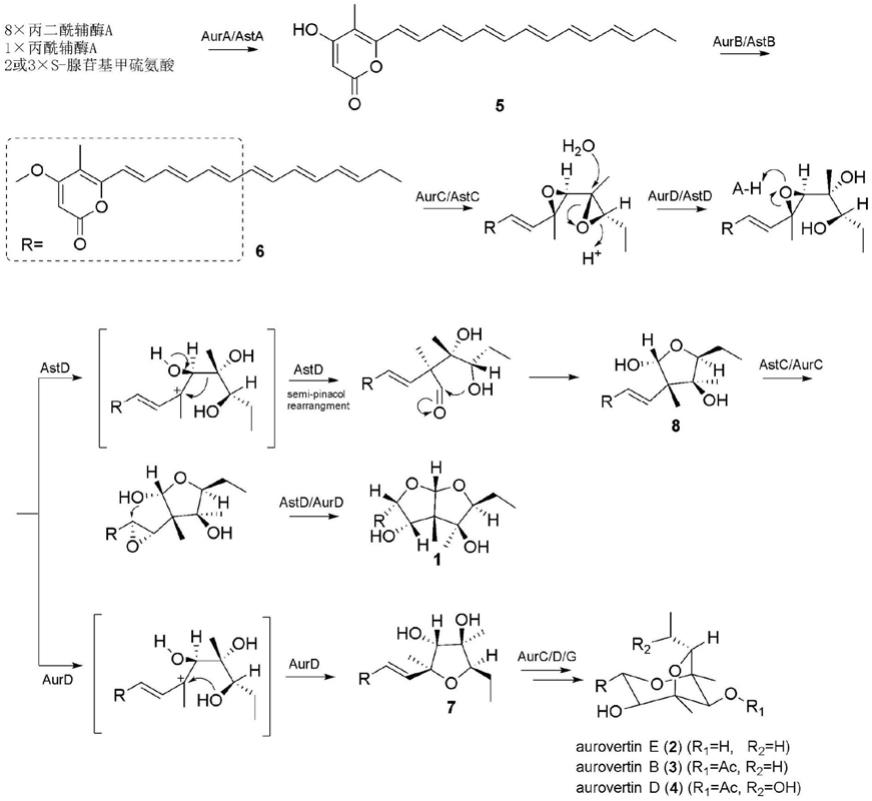
[0046]
固体诱导培养基配方(1l):1l液体诱导培养基、2g琼脂粉。
[0047]
抗性pda培养基(1l):1l的pda培养基,0.3mg孢噻肟钠和0.1g遗传霉素,购自sigma。
[0048]
以下将结合附图和具体实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明,而不应视为限定本发明的范围。
[0049]
1、asteltoxin生物合成基因簇的鉴定
[0050]
将野生型异冠裸胞壳孢子均匀涂布在马铃薯葡萄糖琼脂(pda)培养基上30℃培养5天,收集新鲜孢子后交由浙江天科高新技术发展有限公司(浙江省微生物研究所)提取基因组进行测序并完成基因组草图拼装。
[0051]
利用生物信息学技术(https://fungismash.secondarymetabolites.org/)对基因组进行注释,分析其中的次级代谢产物基因簇,并通过本地blast以结构类似天然产物aurovertin(来源于齿梗孢霉)、citreoviridin(来源于土曲霉)的生物合成基因簇进行同源性分析,寻找可能的asteltoxin基因簇,最终初步确定了真菌毒素asteltoxin(化合物1)的生物合成基因簇及簇内相关同源基因(如图1所示)。
[0052]
由图1可见,真菌毒素asteltoxin(化合物1)的生物合成基因簇包括:asta、astb、astc和astd,其中,asta用于编码聚酮合酶asta,astb用于编码甲基转移酶astb,astc用于编码单加氧酶astc,astd用于编码α/β-环氧水解酶astd。asta、astb、astc和astd的核苷酸序列分别如seq id no:1、seq id no:2、seq id no:3、seq id no:4所示。
[0053]
2、环氧水解酶astd的功能预测
[0054]
分析真菌毒素asteltoxin(化合物1)的分子结构式,推测其分子中2,8-二氧杂双环-[3.3.0]-辛烷(或双四氢呋喃)部分是通过末端多烯多次环氧化反应、随后的环氧化物水解并伴随c1到c3的2,3-迁移生成的,即,推测真菌毒素asteltoxin(化合物1)的生物合成途径中包含半频哪醇重排反应。
[0055]
进一步推测半频哪醇重排反应是在环氧化物被环氧水解酶水解生成环氧邻二醇多烯α-吡喃酮之后发生。结合酶的空间分布特异性和对底物选择性等多方面的全面考虑和分析,推测真菌毒素asteltoxin(化合物1)的生物合成中的半频哪醇重排反应很可能是由环氧水解酶astd介导的。α/β-环氧水解酶astd的氨基酸序列如seq id no:5所示,含有398个氨基酸。
[0056]
3、astd的同源基因的鉴定
[0057]
利用ncbi-blast(https://blast.ncbi.nlm.nih.gov/blast.cgi)在已公布的基因数据库中寻找asteltoxin生物合成中环氧水解酶astd的同源蛋白,发现罗伯茨绿僵菌(metarhizium robertsii)和金龟子绿僵菌(metarhizium anisopliae)中各有一个蛋白序列同源性达到67%的基因,进一步分析发现这两个基因编码的蛋白序列一致。
[0058]
其中,罗伯茨绿僵菌中astd的同源基因为mrvd,mrvd的核苷酸序列如seq id no:6所示,其编码的环氧水解酶mrvd的ncbi accession number:xp_007824469.1,mrvd的氨基酸序列如seq id no:7所示,含有384个氨基酸。
[0059]
由上海捷瑞生物工程有限公司通过化学法全合成了罗伯茨绿僵菌中astd的同源基因mrvd。
[0060]
4、asteltoxin生物合成机制推导
[0061]
进一步,推测了asteltoxin(化合物1)的生物合成途径。为了更清楚地说明化合物1中2,8-二氧杂双环-[3.3.0]-辛烷(或双四氢呋喃)的独特化学结构形成的酶学机理(即,由环氧水解酶astd介导的半频哪醇重排反应机制),在此将本发明推测的asteltoxin(化合物1)的生物合成途径与文献公开的aurovertin的合成途径进行了对比,并将对比结果在下式中进行了展示。
[0062][0063]
如上式所示,本发明推测的asteltoxin(化合物1)的生物合成途径如下:
[0064]
一系列前体物质经聚酮合酶asta催化生成多烯α-吡喃酮(化合物5),通过甲基转移酶astb催化生成甲基化的多烯α-吡喃酮(化合物6),再通过单加氧酶astc和α/β-环氧水解酶astd水解生成环氧邻二醇多烯α-吡喃酮中间体;
[0065]
与化合物2(aurovertin e)、化合物3(aurovertin b)、化合物4(aurovertin d)合成过程中由环氧水解酶aurd介导3位的羟基进攻6位的碳正离子生成四氢呋喃中间体(化合物7)有所不同的是,在asteltoxin(化合物1)的合成过程中,环氧邻二醇多烯α-吡喃酮底物发生了从c1到c3的2,3-迁移(iii型半频哪醇重排),并生成半缩醛中间体asteltoxin t1(化合物8);
[0066]
随后,与aurovertin类似,asteltoxin t1(化合物8)被进一步加氧、水解生成终产物asteltoxin(化合物1)。
[0067]
其中,aurovertin的生物合成基因簇中,编码环氧水解酶aurd的aurd基因,其核苷
酸序列如seq id no:8所示。
[0068]
5、asteltoxin生物合成机理的验证
[0069]
本发明通过将环氧水解酶astd和mrvd在齿梗孢霉中异源表达,得到了大量经半频哪醇重排反应后的天然产物asteltoxin t1,验证了环氧水解酶astd和mrvd催化半频哪醇重排反应的功能,说明催化半频哪醇重排酶在丝状真菌中可以合成asteltoxin t1(化合物8),进而验证了上述推测的asteltoxin(化合物1)的生物合成机理。具体说明如下:
[0070]
5.1齿梗孢霉体内astd或mrvd高表达的质粒构建
[0071]
在含5%大米和2%琼脂(购自上海生工生物工程)的固体lb培养基上涂布野生型异冠裸胞壳孢子,在30℃生长5天左右提取菌丝,用液氮研磨法配合trizol universal rna提取试剂盒(购自北京全式金生物)提取异冠裸胞壳总rna。然后用cdna合成试剂盒(购自大连宝生物)将rna反转录成cdna。
[0072]
以野生型异冠裸胞壳cdna为模版,通过第一引物对(seq id no:9和seq id no:10)pcr扩增astd;以合成的同源基因mrvd为模版,通过第二引物对(seq id no:11和seq id no:12)pcr扩增mrvd。同时,以齿梗孢霉cdna为模版,通过第三引物对(seq id no:13和seq id no:14)pcr扩增aurd。
[0073]
表1pcr扩增所用引物
[0074]
seq id no序列9cgaccacctaacaacatgcctcaatccgcaaaatac10gtcatccttgtaatcgagctgtctttccttctcc11cgaccacctaacaacatggctcaattaacaaaatac12gtcatccttgtaatcctttgtcttttgtttaggtcgc13cgaccacctaacaacatgcctcaatccacgaaatac14gtcatccttgtaatcttttgtcttttctttagcacg
[0075]
通过无缝克隆将上述扩增片段连入bamhi消化的真菌高表达质粒pfgl-aurap,分别得到pfgl-aurap-astd、pfgl-aurap-mrvd和pfgl-aurap-aurd三个质粒。
[0076]
5.2齿梗孢霉astd或mrvd高表达菌株的构建
[0077]
通过农杆菌eha105(购自上海唯地生物)转化丝状真菌齿梗孢霉环氧水解酶缺失株(c.arbusculaδaurd):
[0078]
首先,将已构建好的pfgl-aurap-astd质粒电转化入农杆菌eha105,将得到的农杆菌转化子接入含50μg/ml卡那霉素的液体lb培养基中过夜培养;然后,将培养好的农杆菌转接入液体诱导培养基中培养至od
600
≈0.6-0.8,再将诱导好的农杆菌与齿梗孢霉环氧水解酶缺失株孢子(c.arbusculaδaurd)以菌量数量比100:1的比例混合,涂布在铺有玻璃纸的固体诱导培养基上,25℃培养2天;最后,将培养好的混合菌连同玻璃纸直接转移到抗性pda培养基上,25℃培养7天,初步转化子长出。挑取初步转化子转接于抗性pda培养基,25℃培养,5天左右挑取长出的1号阳性转化子(即1号菌株)进行发酵产物验证。
[0079]
将pfgl-aurap-mrvd质粒替代pfgl-aurap-astd质粒,相同处理后,挑取长出的2号阳性转化子(即2号菌株)进行发酵产物验证。
[0080]
同样,将pfgl-aurap-aurd质粒替代pfgl-aurap-astd质粒,相同处理后,取长出的3号阳性转化子(即3号菌株)进行发酵产物验证。
[0081]
5.3齿梗孢霉astd或mrvd高表达菌株的发酵产物验证
[0082]
利用hplc对步骤5.2筛选出的1号菌株(齿梗孢霉astd高表达菌株,记为iiiδaurd-astd)的发酵产物进行验证(或检测)。
[0083]
利用hplc对步骤5.2筛选出的2号菌株(齿梗孢霉mrvd高表达菌株,记为ivδaurd-mrvd)的发酵产物进行验证(或检测)。
[0084]
利用hplc对步骤5.2筛选出的3号菌株(齿梗孢霉环氧水解酶aurd缺失株中高表达aurd菌株,记为vδaurd-aurd)的发酵产物进行验证(或检测)。
[0085]
为了进行对比,还利用高效液相色谱仪检测了野生型齿梗孢霉(记为i野生型)的发酵产物(发酵条件:在pda培养基中25℃培养5天)、齿梗孢霉环氧水解酶缺失株(记为iiδaurd)的发酵产物(发酵条件:在pda培养基中25℃培养5天)。
[0086]
利用hplc进行发酵产物验证(或利用hplc检测发酵产物)的过程如下:
[0087]
将待测菌株或发酵产物用含有10%甲醇的乙酸乙酯萃取,离心后吸取上层有机相,将有机相离心浓缩干燥成粗提物,然后加入100μl色谱级甲醇溶解粗提物,利用有机滤膜过滤后用高效液相色谱仪检测。
[0088]
检测条件为:色谱柱:xdb-c18,规格:5μm,4.6
×
150mm;流动相:a相:水 1
‰
甲酸,b相:乙腈 1
‰
甲酸;流动相体积比:0-30min:b相:a相=70:30-0:100;流速:1ml/min;检测波长:220nm-500nm全波长检测。
[0089]
hplc检测结果如图2所示。为了方便对照,图2还标出了化合物1、化合物2、化合物3、化合物4和化合物8所对应的特征峰,并给出了asteltoxin(化合物1)的标品(记为vi asteltoxin标品)hplc曲线。
[0090]
图2中,野生型齿梗孢霉(记为i野生型)的发酵产物包括有大量化合物4、化合物3和少量化合物2,齿梗孢霉环氧水解酶缺失株(记为iiδaurd)的发酵产物包括有化合物4和大量非特异性水解产物,1号菌株的发酵产物包括大量中间产物化合物8和少量的化合物1,同样,2号菌株的发酵产物也包括大量中间产物化合物8和少量的化合物1,而3号菌株的发酵产物包括大量化合物4。
[0091]
由图2可见,在齿梗孢霉环氧水解酶缺失株中,高表达aurd可使菌株恢复合成化合物4,而高表达astd或mrvd可生成大量中间产物化合物8和少量的化合物1。
[0092]
同时,将发酵产物验证正确的1号菌株(齿梗孢霉astd高表达菌株)扩大培养并进行生物保藏,命名为齿梗孢霉(calcarisporium arbuscula)m100(菌株编号为m100,分类命名为齿梗孢霉(calcarisporium arbuscula)),已于2020年9月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.20273。
[0093]
将发酵产物验证正确的2号菌株(齿梗孢霉mrvd高表达菌株)扩大培养并进行生物保藏,命名为齿梗孢霉(calcarisporium arbuscula)m101(菌株编号为m101,分类命名为齿梗孢霉(calcarisporium arbuscula)),已于2020年9月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.20272。
[0094]
5.4齿梗孢霉astd或mrvd高表达菌株发酵产物的纯化和结构鉴定
[0095]
将已经成功通过了发酵产物验证的上述齿梗孢霉环氧水解酶高表达菌株,包括齿
梗孢霉astd高表达菌株、齿梗孢霉mrvd高表达菌株,分别接种于1l马铃薯葡萄糖肉汤培养基(pdb)中,并在20cm培养皿中静置室温发酵2周左右。发酵完成后,分别收集4号菌株发酵产物和5号菌株发酵产物。
[0096]
将4号菌株发酵产物用200ml二氯甲烷反复浸润提取三次,旋蒸后得到约550mg浸膏。随后,用中低压制备色谱仪(购自美国combiflash公司)进行粗分,分离条件为:分离柱:18g硅胶预装柱;流动相:a相:二氯甲烷,b相:甲醇;流动相体积比:0-20min:b相:a相=95:5-0:100;流速:20ml/min;收集条件:收集紫外385nm信号峰。将收集的组分旋蒸后得到约80mg粗品。最后,在1mm厚制备型硅胶板上样40mg,展开剂为二氯甲烷:甲醇=20:1,在展缸中避光展开1.5小时左右,最后收集黄色条带,旋蒸后得到约8mg纯化的发酵产物化合物8。
[0097]
利用一维nmr核磁共振的氢谱(见附图3)、碳谱(见附图4),以及二维核磁共振dept135(见附图5)、hsqc(见附图6)、cosy(见附图7)、hmbc(见附图8)、noesy(见附图9),并参照化合物1的化学结构与手性,确定了发酵产物化合物8的化学结构,包括手性中心的绝对构型。发酵产物化合物8的化学结构正如前文所述的“4、asteltoxin生物合成机制推导”中所推测的生物合成线路图中的化合物8所示。即,验证了化合物8是:由双环氧中间体经过环氧开环生成环氧邻二醇多烯α吡喃酮中间体后,再经半频哪醇重排、羟醛缩合所生成的一个半缩醛产物。这说明asteltoxin(化合物1)的生物合成途径与前文所述的“4、asteltoxin生物合成机制推导”中推测的一样。
[0098]
在上述实施例中,aurd在齿梗孢霉环氧水解酶缺失株中高表达可使菌株恢复合成化合物4,说明aurd仅有催化环氧水解功能而无催化半频哪醇重排功能;astd在齿梗孢霉环氧水解酶缺失株中高表达,可高效催化半频哪醇重排得到大量的化合物8,说明astd具有催化环氧水解以及半频哪醇重排双功能。
[0099]
对5号菌株发酵产物采取与上述4号菌株发酵产物相同的纯化和结构鉴定的方法,得出与4号菌株发酵产物相同的结论,说明mrvd与astd具有相同的功能,都具有催化环氧水解以及半频哪醇重排双功能,mrvd在齿梗孢霉环氧水解酶缺失株中高表达,也可高效催化半频哪醇重排得到大量的化合物8,从而用于asteltoxin(化合物1)的生物合成。
[0100]
此外,astd与mrvd在齿梗孢霉中成功表达,也说明了其可应用在异源宿主中,说明该酶可实现异源表达并具备高效催化功能,有一定工业应用潜力。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
