高胆红素血症的治疗
1.本技术为国际申请日2015年4月27日、国际申请号pct/ep2015/059099于2016年10月20日进入中国国家阶段、申请号201580020784.7、发明名称“高胆红素血症的治疗”的分案申请。
技术领域
2.本发明涉及一种适用于治疗高胆红素血症(hyperbilirubinemia),特别是治疗克里格勒-纳贾尔综合征(crigler-najjar syndrome)的核酸序列。更特定来说,本发明的核酸序列是密码子优化的人ugt1a1编码序列。
背景技术:
3.克里格勒-纳贾尔综合征(cn)是一种由于缺乏胆红素udp-葡萄糖醛酸基转移酶同功酶1a1(ugt1a1)而伴有重度未结合高胆红素血症的常染色体隐性病症(omim#218800),所述同功酶由ugt1a1基因编码。cn在出生时的发病率是约1/1000000个体,从而使得cn成为一种超罕见疾病。当前针对cn的疗法依赖于用以防止血清胆红素水平升高的光线疗法。对于所述疾病的轻度形式(也称为ii型cn),苯巴比妥(phenobarbital)可用于减轻胆红素血症。然而,患者被潜在暴露于血液中的胆红素达到危急生命的峰值的风险下,并且肝移植仍然是唯一治愈性治疗。在疾病的最重度形式的情况下,疾病由于胆红素诱发的神经损害而具有致死性,除非从出生时开始施加光线疗法。尽管有疗法可用,但由于许多原因,cn仍然属于未满足的医学需要,所述原因包括光线疗法在生长期间丧失功效,由于光线疗法自身的限制(其需要每天持续进行10-12小时)所致的顺应性不良,以及随时间发生可能要求肝移植的病理性肝变化。
4.存在所述疾病的不同动物模型,包括天然存在的gunn大鼠和由位于意大利里雅斯特(trieste,italy)的icgeb的muro博士开发的所述疾病的更新的敲入小鼠模型,其携带gunn大鼠中存在的相同突变(bortolussi等,2012)。gunn大鼠呈现高血清胆红素水平,并且它们具有小脑发育不全;cn小鼠具有更加重度表型,如果不迅速地用光线疗法或基因疗法治疗,那么在出生之后不久即死亡(bortolussi等,2012)。
5.旨在开发针对cn的基于基因的疗法的先前研究显示使用递送至肝中的aav载体可实现治疗功效(bortolussi等,2012;seppen等,2006)。然而,对更高效治疗策略仍然存在需要。
6.吉尔伯特氏综合征(gilbert's syndrome或gs;omim#218800)是一种遗传肝病症,并且是胆红素增加的最常见遗传病因。它见于多达3-12%的人口中。gs也由ugt1a1基因中的突变引起。因此,旨在减轻高胆红素血症的治疗策略将也在治疗gs时被有利地执行。
技术实现要素:
7.本发明涉及一种源于人ugt1a1 cdna的密码子优化的ugt1a1编码序列。更特定来说,密码子优化的ugt1a1编码序列相较于野生型人编码序列seq id no:1具有增加的gc含
量和/或具有降低数目的可变开放阅读框。举例来说,相较于野生型人ugt1a1序列的序列,本发明的核酸序列导致ugt1a1序列中的gc含量增加至少2、3、4、5或10%。在一特定实施方式中,相较于野生型人ugt1a1序列的序列,本发明的核酸序列导致ugt1a1序列中的gc含量增加2、3、4或更优选地5%或10%(优选5%)。在一特定实施方式中,本发明的编码密码子优化的人ugt1a1蛋白的核酸序列与序列seq id no:2或seq id no:3“大致上同一”,即具有约70%同一性,更优选约80%同一性,甚至更优选约90%同一性,甚至更优选约95%同一性,甚至更优选约97%、98%或甚至99%同一性。在一特定实施方式中,本发明涉及一种编码密码子优化的人ugt1a1蛋白的核酸序列,其中所述核酸序列包括以seq id no:2或seq id no:3显示的序列。
8.有利的是,本发明的密码子优化的核酸提供改进的胆红素水平降低和/或降低的免疫原性。
9.本发明也涉及一种包含本发明的核酸序列的核酸构建体。核酸构建体可对应于包含本发明的核酸序列的表达盒,所述核酸序列可操作地连接于一种或多种表达控制序列或改进转基因的表达的其它序列。所述序列在本领域中是已知的,诸如启动子、增强子、内含子、多聚腺苷酸信号等。特定来说,表达盒可包括启动子。启动子可为遍在性启动子或组织特异性启动子,特别是肝特异性启动子。更特定来说,启动子是肝特异性启动子,诸如α-1抗胰蛋白酶(antitrypsin)启动子(haat)(seq id no:4)、转甲状腺素蛋白(transthyretin)启动子、白蛋白启动子、甲状腺素(thyroxine)结合球蛋白(tbg)启动子等。其它适用的肝特异性启动子在本领域中是已知的,例如冷泉港实验室(cold spring harbor laboratory)编译的肝特异性基因启动子数据库中所列的那些(http://rulai.cshl.edu/lspd/)。代表性遍在性启动子包括巨细胞病毒增强子/鸡β肌动蛋白(cag)启动子、巨细胞病毒增强子/启动子(cmv)、pgk启动子、sv40早期启动子等。在一特定实施方式中,使启动子与增强子序列诸如apoe控制区,诸如人apoe控制区(或人载脂蛋白e/c-i基因座,肝控制区hcr-1
–
genbank登记号u32510,以seq id no:11显示)关联。在一特定实施方式中,使增强子序列诸如apoe序列与肝特异性启动子诸如以上所列的那些,并且特别是诸如haat启动子关联。
10.在一特定实施方式中,核酸构建体包含内含子,特别是放置在启动子与编码序列之间的内含子。内含子可被引入以增加mrna稳定性和蛋白质产生。在一特定实施方式中,核酸构建体包含人β球蛋白b2(或hbb2)内含子、凝血因子ix(fix)内含子、sv40内含子或鸡β-球蛋白内含子。在一特定实施方式中,本发明的核酸构建体含有修饰的内含子(特别是修饰的hbb2或fix内含子),其被设计以降低见于所述内含子中的可变开放阅读框(arf)的数目或甚至完全移除可变开放阅读框(arf)。优选地,移除长度跨越超过50bp,并且具有与起始密码子同框的终止密码子的arf。可通过修饰内含子的序列来移除arf。举例来说,可通过核苷酸取代、插入或缺失的方式,优选通过核苷酸取代进行修饰。作为例证,可置换目标内含子的序列中存在的atg或gtg起始密码子中的一个或多个核苷酸,特别是一个核苷酸,从而产生非起始密码子。举例来说,在目标内含子的序列内,atg或gtg可被不是起始密码子的ctg置换。
11.用于核酸构建体中的经典hbb2内含子以seq id no:5显示。举例来说,这个hbb2内含子可通过消除所述内含子内的起始密码子(atg和gtg密码子)来修饰。在一特定实施方式中,包含在构建体中的修饰的hbb2内含子具有以seq id no:6显示的序列。用于核酸构建体
中的经典fix内含子源于人fix的第一内含子,并且以seq id no:7显示。fix内含子可通过消除所述内含子内的起始密码子(atg和gtg密码子)来修饰。在一特定实施方式中,包含在本发明的构建体中的修饰的fix内含子具有以seq id no:8显示的序列。用于核酸构建体中的经典鸡β球蛋白内含子以seq id no:9显示。鸡β球蛋白内含子可通过消除所述内含子内的起始密码子(atg和gtg密码子)来修饰。在一特定实施方式中,包含在本发明的构建体中的修饰的鸡β球蛋白内含子具有以seq id no:10显示的序列。
12.本发明者已显示所述修饰的内含子,特别是修饰的hbb2或fix内含子具有有利性质,并且可显著改进转基因的表达。此外,通过降低本发明的构建体内包括的内含子内的arf的数目,据信构建体免疫原性也得以降低。
13.因此,本发明也涉及一种意图用于表达盒中、并且被修饰以增加放置在所述盒中的转基因的表达效率的内含子。特定来说,本发明涉及一种源于已知内含子,但其中arf的数目已被降低,或其中arf已被完全移除的修饰的内含子。在一特定实施方式中,本发明涉及一种具有降低数目的arf或不具有arf的修饰的hbb2内含子。在另一特定实施方式中,修饰的hbb2内含子是以seq id no:6显示的内含子。在另一实施方式中,本发明涉及一种具有降低数目的arf或不具有arf的修饰的fix内含子。在另一特定实施方式中,修饰的fix内含子是以seq id no:8显示的内含子。在另一实施方式中,本发明涉及一种具有降低数目的arf或不具有arf的修饰的鸡β-球蛋白内含子。在另一特定实施方式中,修饰的鸡β-球蛋白内含子是以seq id no:10显示的内含子。本发明的另一方面涉及包含本发明的修饰的内含子的核酸构建体、载体诸如病毒载体(特别是aav载体)和细胞。核酸构建体可包括额外的表达控制序列诸如启动子和/或增强子,诸如本文所述的那些和其它。如本文公开的修饰的内含子使放置在核酸构建体中的转基因诸如目标基因(如治疗性基因)的表达效率增加。在本发明的这个方面的情形下,“治疗性基因”通常是指编码适用于治疗病理性病状的治疗性蛋白质的基因。治疗性基因在表达时对它存在于其中的细胞或组织或对基因表达所处的患者赋予有益作用。有益作用的实例包括改善病状或疾病的征象或症状,预防或抑制病状或疾病,或给予所需特征。治疗性基因包括部分或完全修正患者的遗传缺陷的基因。特定来说,治疗性基因可为(不限于)编码在基因疗法中适用于减轻缺陷的蛋白质的核酸序列,所述缺陷由所述蛋白质在受试者的细胞或组织中缺失、缺损或未达到最优水平所引起。因此,本发明涉及用于基因疗法中的包含本发明的修饰的内含子,以及进一步包含目标治疗性基因的核酸构建体、载体诸如病毒载体(特别是aav载体)和细胞。本发明可一般地应用于对可通过在受试者的细胞或组织中表达治疗性基因来治疗的任何疾病的疗法。这些疾病包括例如增生性疾病(癌症、肿瘤、发育不良等)、感染性疾病;病毒性疾病(例如由乙型或丙型肝炎病毒、hiv、疱疹、逆转录病毒等诱发)、遗传疾病(囊性纤维化、肌营养不良蛋白聚糖病变、肌病变诸如杜兴肌肉肌病变(duchenne muscular myopathy);肌管性肌病变;血友病;镰状细胞性贫血、镰状细胞病、范康尼氏贫血(fanconi’s anemia);糖尿病;肌萎缩性侧索硬化、运动神经元疾病诸如脊髓性肌肉萎缩、脊髓延髓性肌肉萎缩或恰克
–
马利
–
杜斯病(charcot
–
marie
–
tooth disease);关节炎;重度联合免疫缺陷(诸如rs-scid、ada-scid或x-scid)、维斯科特
–
奥尔德里奇综合征(wiskott
–
aldrich syndrome)、x染色体关联的血小板减少症、x染色体关联的先天性嗜中性白细胞减少症、慢性肉芽肿病等)、心血管疾病(再狭窄、缺血、血脂异常、纯合性家族性高胆固醇血症等)、或神经疾病(精神病学疾病、神经退行性疾病诸
如帕金森氏病(parkinson's)或阿尔茨海默氏病(alzheimer's)、亨廷顿氏病成瘾性(例如对烟草、酒精或药物)、癫痫、卡纳万氏病(canavan’s disease)、肾上腺脑白质营养不良等)、眼病,诸如色素性视网膜炎、利伯先天性黑朦(leber congenital amaurosis)、利伯遗传性视神经病变(leber hereditary optic neuropathy)、施塔加特病(stargardt disease);溶酶体贮积病,诸如圣斐理伯综合征(san filippo);高胆红素血症,诸如i或ii型cn或吉尔伯特氏综合征、蓬佩病(pompe disease)等。如上所提及,以及如以下公开内容中所进一步展开,为实现转基因诸如治疗性基因在接受宿主细胞中的表达,优选地使它可操作地连接于它自身的启动子或异源性启动子。许多适合启动子在本领域中是已知的,对其的选择取决于由治疗性基因编码的产物的所需表达水平;是否需要组成性表达、细胞特异性表达抑或组织特异性表达等。当目标基因是如上定义的治疗性基因时,包含修饰的内含子的核酸构建体、包含所述核酸构建体的载体或包含所述构建体或所述载体的细胞可进一步用于基因或细胞疗法中。
14.在一特定实施方式中,本发明的核酸构建体是以5'至3'方向包含任选前置有增强子的启动子、本发明的密码子优化的ugt1a1编码序列和多聚腺苷酸化信号的表达盒。在一特定实施方式中,本发明的核酸构建体是以5'至3'方向包含任选前置有增强子(诸如apoe控制区)的启动子、内含子(特别是如上定义的内含子)、本发明的密码子优化的ugt1a1编码序列和多聚腺苷酸化信号的表达盒。在另一特定实施方式中,本发明的核酸构建体是以5'至3'方向包含增强子诸如apoe控制区、启动子、内含子(特别是如上定义的内含子)、本发明的密码子优化的ugt1a1编码序列和多聚腺苷酸化信号的表达盒。
15.本发明也涉及一种包含如本文公开的核酸序列的载体。特定来说,本发明的载体是适用于基因疗法中的载体。举例来说,载体可为质粒载体。更特定来说,载体是靶向肝组织或细胞的适于基因疗法的病毒载体。在这个情况下,本发明的核酸构建体也含有如本领域中熟知的适于产生高效病毒载体的序列。在另一特定实施方式中,病毒载体是aav载体,诸如适于转导肝组织或细胞的aav载体,更特别是aav-1、aav-2、aav-5、aav-6、aav-7、aav-8、aav-9、aav-rh10、aav-rh74、aav-dj等载体;或逆转录病毒载体,诸如慢病毒载体。在另一实施方式中,aav载体包含是单链或自身互补型双链的基因组。优选地,对于实施本发明,aav基因组是单链。如本领域中所知,视考虑供使用的特定病毒载体而定,适合序列将被引入本发明的核酸构建体中以获得功能性病毒载体。适合序列包括用于aav载体的aav itr或用于慢病毒载体的ltr。因此,本发明也涉及一种在各侧都由itr或ltr侧接的如上所述的表达盒。
16.在一特别优选实施方式中,本发明涉及一种在单链基因组或双链自身互补型基因组(例如单链基因组)中包含本发明的核酸构建体的aav载体。在一特定实施方式中,核酸构建体包含以seq id no:2或seq id no:3显示的序列。在一个实施方式中,aav载体是aav8载体。在另一特定实施方式中,使所述核酸可操作地连接于启动子,尤其是遍在性启动子或肝特异性启动子。根据一特定变化实施方式,启动子是遍在性启动子,诸如巨细胞病毒增强子/鸡β肌动蛋白(cag)启动子、巨细胞病毒增强子/启动子(cmv)、pgk启动子和sv40早期启动子。在一特定变化形式中,遍在性启动子是cag启动子。根据另一变化形式,启动子是肝特异性启动子,诸如α-1抗胰蛋白酶启动子(haat)、转甲状腺素蛋白启动子、白蛋白启动子和甲状腺素结合球蛋白(tbg)启动子。在一特定变化形式中,肝特异性启动子是seq id no:4
的haat肝特异性启动子。在另一特定实施方式中,被包含至本发明的aav载体的基因组中的核酸构建体进一步包含如上所述的内含子,诸如放置在启动子与编码ugt1a1蛋白的核酸序列之间的内含子。可包括在引入aav载体基因组内的核酸构建体内的代表性内含子包括(不限于)人β球蛋白b2(或hbb2)内含子、fix内含子和鸡β-球蛋白内含子。aav载体的基因组内的所述内含子可为经典(或未修饰的)内含子或修饰的内含子,其被设计以降低所述内含子内的可变开放阅读框(arf)的数目或甚至完全移除可变开放阅读框(arf)。以上充分描述了可用于实施其中本发明的核酸被引入aav载体内的这个实施方式的修饰的和未修饰的内含子。在一特定实施方式中,本发明的aav载体(特别是aav8载体)在它的基因组内包括修饰的(或优化的)内含子,诸如seq id no:7的修饰的hbb2内含子、seq id no:8的修饰的fix内含子和seq id no:10的修饰的鸡β-球蛋白内含子。
17.本发明也涉及一种用本发明的核酸序列转化的细胞,例如肝细胞。可通过在有需要的受试者的肝中或血流中注射来将本发明的细胞递送至所述受试者中。在一特定实施方式中,本发明涉及将本发明的核酸序列引入肝细胞中,特别是待治疗的受试者的肝细胞中,以及将核酸已被引入其中的所述肝细胞施用至受试者。
18.本发明也提供一种包含选自本发明的核酸、本发明的载体或本发明的细胞的活性剂与可药用载体组合的药物组合物。
19.本发明也涉及一种用于治疗由ugt1a1基因中的突变引起的高胆红素血症的方法,其包括将本发明的核酸、载体、药物组合物或细胞递送至有需要的受试者中的步骤。在一特定实施方式中,高胆红素血症是i或ii型cn综合征或吉尔伯特综合征。
20.本发明也涉及用作药剂的本发明的核酸、载体、药物组合物或细胞。
21.本发明也涉及用于治疗由ugt1a1基因中的突变引起的高胆红素血症的方法中,特别是治疗i或ii型cn综合征或吉尔伯特综合征的方法中的本发明的核酸、载体、药物组合物或细胞。
22.本发明进一步涉及本发明的核酸、载体、药物组合物或细胞制造适用于治疗由ugt1a1基因中的突变引起的高胆红素血症,特别是治疗i或ii型cn综合征或吉尔伯特综合征的药剂的用途。
附图说明
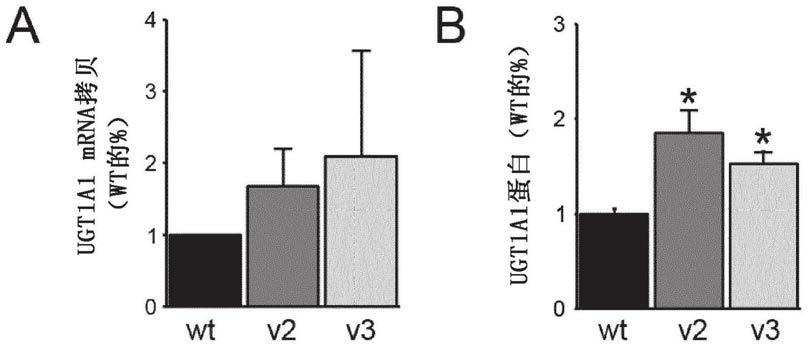
23.图1包括显示在用表达野生型ugt1a1或两个密码子优化的ugt1a1序列的质粒转染的huh-7细胞中观察的信使rna水平(图a)和通过western印迹对相同样品中的ugt1a1蛋白的定量(图b)的图。
24.图2包括显示不同内含子优化在荧光素酶表达方面的作用(图a)和hbb2优化对ugt1a1 rna和蛋白质表达水平的影响(图b)的图。
25.图3是western印迹凝胶的照片,其显示从含有密码子优化的ugt1a1编码序列以及含有野生型(ugt1a1 2.0)或优化(ugt1a1 2.1)hbb2内含子的2个载体的ugt1a1蛋白的表达。
26.图4是对野生型ugt1a1(a)和密码子优化的ugt1a1 v2.1(b)载体内可变阅读框(arf)的电子分析的图示。
27.图5是显示在不同大鼠品系中注射密码子优化的ugt1a1载体或pbs之后每周测量
的总胆红素(tb)水平的图。
28.图6是显示在不同大鼠品系中注射较低剂量的密码子优化的ugt1a1载体(相较于图5中报道的数据)或pbs之后每周测量的总胆红素(tb)水平的图。
29.图7包括(a)显示在注射3种ugt1a1载体之后每周测量的总胆红素(tb)水平的图(相较于图8中报道的数据);(b)从用3种载体治疗的大鼠获得的肝提取物的western印迹的照片和它们的相对定量;和(c)呈现持续注射之后4个月对aav8-v2.1 ugt1a1在雄性动物与雌性动物两者中的功效的长期评估的图。
30.图8是显示不同构建体在克里格勒-纳贾尔综合征的小鼠模型中修正重度高胆红素血症的能力(总胆红素,表示为mg/dl)的图。对未治疗动物(untr)加以报道。
具体实施方式
31.术语“ugt1a1”是指以seq id no:1显示的野生型智人udp-糖基转移酶1家族1多肽a(ugt1a1)cdna(登记号nm_000463.2,即人ugt1a1的mrna的cds的参照序列;omim参照号191740)。
32.术语“密码子优化”意指使表现人偏倚性(即在人基因中常见,但在其它哺乳动物基因或非哺乳动物基因中不常见)的密码子变为不表现人偏倚性的同义密码子(编码相同氨基酸的密码子)。因此,密码子变化不导致编码的蛋白质中任何氨基酸变化。
33.以seq id no:2或seq id no:3显示的序列,特别是以seq id no:2显示的序列是本发明的密码子优化的核酸序列的优选实施方式。
34.seq id no:2和seq id no:3中由密码子优化产生的dna序列变化分别导致ugt1a1序列中的gc含量增加约5%和约10%。
35.本发明也涵盖一种编码密码子优化的人ugt1a1蛋白的本发明的核酸序列,其与序列seq id no:2或seq id no:3“大致上同一”,即具有约70%同一性,更优选约80%同一性,甚至更优选约90%同一性,甚至更优选约95%同一性,甚至更优选约97%、98%或甚至99%同一性。
[0036]“同一”是指两个核酸分子之间的序列同一性。当两个比较序列中的某一位置均由相同碱基占据时,例如如果两个dna分子各自之中的某一位置由腺嘌呤占据,那么分子在那个位置处是同一的。两个序列之间的同一性百分比是由两个序列共有的匹配位置的数目除以比较位置的数目x 100的函数。举例来说,如果在两个序列中有6/10位置是匹配的,那么两个序列是60%同一的。通常,比较是在使两个序列对准以产生最大同一性时作出。为本领域技术人员所知的各种生物信息学工具可用于比对核酸序列,所述工具诸如blast或fasta。
[0037]
如应用于本发明的密码子优化的ugt1a1编码序列或修饰的内含子的术语“降低的免疫原性”意指相较于野生型cdna或其它ugt1a1cdna变体,这个密码子优化的基因或修饰的内含子在内含子或编码序列或两者中包含降低数目的潜在可变开放阅读框(或arf),由此限制特别是由编码的mrna获得的潜在翻译蛋白质副产物的数目。特定来说,被减少的arf是长度跨越超过50bp,并且具有与起始密码子同框的终止密码子的那些。
[0038]
在本发明的情形下,术语“基因疗法”是指对受试者的治疗,其涉及出于治疗疾病的目的将基因/核酸递送至个体的细胞中。通常使用也称为载体的递送载体来实现基因的
递送。病毒和非病毒载体可用于将基因递送至患者的细胞中。特别优选的是aav载体,特别是aav8载体。
[0039]
应了解本发明的核酸可包括一个或多个通常位于分子的3'-末端的多聚腺苷酸化信号。
[0040]
用于递送本发明的核酸的优选载体是病毒载体,诸如逆转录病毒载体,例如慢病毒载体;或非病原性细小病毒,更优选是aav载体。人细小病毒腺相关病毒(aav)是一种天然复制缺陷性的依赖性病毒,其能够整合至受感染细胞的基因组中以产生潜伏性感染。最后一个性质在哺乳动物病毒之中似乎是独特的,因为整合发生在人基因组中称为aavs1,位于染色体19(19q13.3-qter)上的特定位点处。
[0041]
因此,aav已作为用于人基因疗法的潜在载体引起极大关注。在所述病毒的有利性质之中的是它缺乏与任何人疾病的关联,它感染分裂细胞与非分裂细胞两者的能力,以及有广泛范围的源于不同组织的可被感染的细胞系。
[0042]
在从人或非人灵长类动物(nhp)分离并充分表征的aav的各血清型之中,人血清型2是首个被开发为基因转移载体的aav。其它当前使用的aav血清型包括aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh10、aavrh74和aavdj等。此外,非天然工程改造变体和嵌合aav也可为适用的。
[0043]
可使用常规分子生物学技术工程改造aav病毒,从而使得有可能优化这些粒子以达成细胞特异性递送核酸序列,使免疫原性最小,调谐稳定性和粒子寿命,高效降解,准确递送至核。
[0044]
合乎需要的用于装配成载体的aav片段包括cap蛋白(包括vp1、vp2、vp3和高变区)、rep蛋白(包括rep 78、rep 68、rep 52和rep 40)和编码这些蛋白的序列。这些片段可易于用于多种载体系统和宿主细胞中。
[0045]
缺乏rep蛋白的基于aav的重组载体以低效能整合至宿主的基因组中,并且主要以可在靶标细胞中持续多年的稳定环状游离体形式存在。
[0046]
作为对使用aav天然血清型的替代,在本发明的情形下可使用人工aav血清型,包括(不限于)具有非天然存在的衣壳蛋白的aav。所述人工衣壳可通过任何适合技术,使用所选aav序列(例如vp1衣壳蛋白的片段)与可从不同所选aav血清型、相同aav血清型的非连续部分、非aav病毒来源或非病毒来源获得的异源性序列组合来产生。人工aav血清型可为(不限于)嵌合aav衣壳、重组aav衣壳或“人源化”aav衣壳。
[0047]
因此,本发明涉及一种包含是密码子优化的ugt1a1编码序列的本发明的核酸的aav载体。在本发明的情形下,aav载体包含能够转导目标靶标细胞特别是肝细胞的aav衣壳。根据一特定实施方式,aav载体具有aav-1、aav-2、aav-5、aav-6、aav-7、aav-8、aav-9、aav-rh10、aav-rh74、aav-dj等血清型。在另一特定实施方式中,aav载体是假型载体,即它的基因组和衣壳源于不同血清型的aav。举例来说,假型aav载体可为基因组源于aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aavrh10、aavrh74或aavdj血清型,并且衣壳源于另一血清型的载体。举例来说,假型载体的基因组可源于aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav10、aavrh10、aavrh74或aavdj血清型,并且它的衣壳源于aav8或aav9血清型,特别是源于aav8血清型。
[0048]
在另一实施方式中,衣壳是修饰的衣壳。在本发明的情形下,“修饰的衣壳”可为嵌
合衣壳或包含一种或多种源于一种或多种野生型aav vp衣壳蛋白的变异vp衣壳蛋白的衣壳。
[0049]
在一特定实施方式中,aav载体是嵌合载体,即它的衣壳包含源于至少两种不同aav血清型的vp衣壳蛋白,或包含至少一种将源于至少两种aav血清型的vp蛋白区域或结构域组合的嵌合vp蛋白。适用于转导肝细胞的所述嵌合aav载体的实例描述于shen等,molecular therapy,2007中以及tenney等,virology,2014中。举例来说,嵌合aav载体可由组合aav8衣壳序列与aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav9、aav10、aavrh10、aavrh74或aavdj血清型的序列来获得。在另一实施方式中,aav载体的衣壳包含一种或多种变异vp衣壳蛋白,诸如wo2015013313中所述的那些,特别是rhm4-1、rhm15-1、rhm15-2、rhm15-3/rhm15-5、rhm15-4和rhm15-6衣壳变体,其呈现高的向肝性。
[0050]
在另一实施方式中,修饰的衣壳也可由通过易出错pcr和/或肽插入(例如如bartel等,2011中所述)而插入的衣壳修饰来获得。此外,衣壳变体可包括单氨基酸变化,诸如酪氨酸突变体(例如如zhong等,2008中所述)。
[0051]
此外,aav载体的基因组可为单链基因组或自身互补型双链基因组(mccarty等,gene therapy,2003)。通过从一个aav末端重复序列缺失末端解离位点(trs)来产生自身互补型双链aav载体。复制性基因组是野生型aav基因组的长度的一半的这些修饰的载体具有包装dna二聚体的倾向。在一优选实施方式中,在实施本发明时应用的aav载体具有单链基因组,并且进一步优选包含aav8、aav2或aav5衣壳,更优选包含aav8衣壳。
[0052]
除以下在实施例中体现的特定递送系统之外,各种递送系统也是已知的,并且可用于施用本发明的核酸,例如囊封在脂质体、微粒、微胶囊中、能够表达密码子优化的ugt1a1编码序列的重组细胞、受体介导的胞吞、构建治疗性核酸作为逆转录病毒载体或其它载体的一部分等。施用核酸的方法包括但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。本发明的核酸序列无论是否被载体化都可通过任何适宜途径,例如通过输注或团式注射,通过经上皮或粘膜皮肤衬里(例如口腔粘膜、直肠粘膜和肠粘膜等)进行吸收来施用,并且可连同其它生物活性剂一起施用。施用可为全身性的或局部的。此外,可合乎需要的是通过任何适合途径将本发明的药物组合物引入受试者的肝中。此外,裸露dna诸如小环和转座子可用于递送慢病毒载体。另外,基因编辑技术诸如锌指核酸酶、兆碱基大范围核酸酶、talen和crispr也可用于递送本发明的编码序列。
[0053]
在一特定实施方式中,可合乎需要的是将本发明的药物组合物局部施用至需要治疗的区域,即肝。这可例如借助于植入物来实现,所述植入物为多孔、无孔或凝胶状材料,包括膜(诸如硅橡胶膜)或纤维。
[0054]
在另一实施方式中,本发明的核酸可于囊泡特别是脂质体中递送。
[0055]
在另一实施方式中,本发明的核酸可于控制释放系统中递送。
[0056]
本发明也提供包含本发明的核酸或本发明的载体或本发明的细胞的药物组合物。所述组合物包含治疗有效量的治疗剂(本发明的核酸、载体或细胞)和可药用载体。在一特定实施方式中,术语“可药用”意指由联邦政府或州政府的管理机构核准或列于美国或欧洲药典或其它通常认可的药典中以在动物和人中使用。术语“载体”是指治疗剂与其一起施用的稀释剂、佐剂、赋形剂或媒介物。所述药物载体可为无菌液体,诸如水和油,包括石油、动物、植物或合成来源的那些,诸如花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组
合物时,水是优选载体。盐水溶液和水性右旋糖和甘油溶液也可用作液体载体,特别是用于可注射溶液。适合药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、硬脂酸钠、甘油单硬脂酸酯、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、水、乙醇等。
[0057]
必要时,组合物也可含有少量湿润剂或乳化剂或ph缓冲剂。这些组合物可采用溶液、混悬液、乳液、片剂、丸剂、胶囊、粉剂、持续释放制剂等形式。口服制剂可包括标准载体,诸如医药级甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。适合药物载体的实例描述于由e.w.martin所著的"remington's pharmaceutical sciences"中。所述组合物将含有治疗有效量的优选呈纯化形式的治疗剂以及适量载体以便提供用于适当施用至受试者的形式。在一特定实施方式中,将本发明的核酸、载体或细胞配制成包含磷酸盐缓冲盐水并补充有0.25%人血清白蛋白的组合物。在另一特定实施方式中,将本发明的核酸、载体或细胞配制成包含林格乳酸盐溶液(ringer lactate)和非离子表面活性剂诸如普洛尼克f68(pluronic f68)的组合物,以总组合物的重量计,所述非离子表面活性剂在0.01-0.0001%的最终浓度下,诸如在0.001%的浓度下。制剂可进一步包含血清白蛋白,特别是人血清白蛋白,诸如0.25%的人血清白蛋白。用于储存或施用的其它适当制剂在本领域中是已知的,特别是从wo 2005/118792或allay等,2011得知。
[0058]
在一优选实施方式中,根据常规程序将组合物配制成适合于静脉内施用至人类的药物组合物。通常,用于静脉内施用的组合物是于无菌等张水性缓冲液中的溶液。必要时,组合物也可包括增溶剂和局部麻醉剂诸如利多卡因(lignocaine)以减轻注射部位处的疼痛。
[0059]
可通过标准临床技术来确定本发明的治疗剂(即核酸、载体或细胞)的将有效治疗cn综合征的量。此外,体内和/或体外测定可任选地用于帮助预测最优剂量范围。待用于制剂中的精确剂量也将取决于施用途径以及疾病的严重性,并且应根据从业者的判断和各患者的情况来决定。施用至有需要的受试者的核酸、载体或细胞的剂量将基于若干因素而变化,所述因素包括(不限于)施用途径、治疗的特定疾病、受试者的年龄或为达到所需治疗作用所必需的表达水平。本领域技术人员可易于基于其在本领域中的知识来确定基于这些因素和其它因素所需的剂量范围。在包括将病毒载体诸如aav载体施用至受试者的治疗的情况下,载体的典型剂量是每千克体重至少1x108个载体基因组(vg/kg),诸如至少1x109vg/kg、至少1x10
10
vg/kg、至少1x10
11
vg/kg、至少1x10
12
vg/kg至少1x10
13
vg/kg或至少1x10
14
vg/kg。
[0060]
范围:在整篇本公开中,本发明的各个方面可以以范围形式呈现。应了解,以范围形式进行的描述仅为方便和简洁起见,并且不应解释为刚性限制本发明的范围。因此,对范围的描述应视为已明确公开所有可能的子范围以及在那个范围内的个别数值。举例来说,对诸如1至6的范围的描述应视为已明确公开子范围诸如1至3、1至4、1至5、2至4、2至6、3至6等,以及在那个范围内的单个数值例如1、2、2.7、3、4、5、5.3和6。无论范围的宽度如何,这都适用。
[0061]
本文引用的各个和每个专利、专利申请和公布的公开内容都据此以引用的方式整体并入本文。
[0062]
在不进一步描述下,据信本领域普通技术人员可使用先前描述和以下说明性实施例制备和利用本发明化合物以及实施要求保护的方法。
[0063]
实施例
[0064]
通过参照以下实验实施例和附图来进一步详述本发明。这些实施例仅出于说明的目的提供,并且不意图具有限制性。
[0065]
材料和方法
[0066]
密码子优化和aav载体构建:
[0067]
ugt1a1经受根据若干不同算法的密码子优化。另外,在整个构建体中实施对隐蔽转录起始位点的移除。将所得构建体引入表达质粒中,或包装至aav血清型8载体中,并且在体外和在体内(大鼠和小鼠)测试效价。
[0068]
以下缩写在整个这个实验部分中用于这些构建体:
[0069]-wt.0:野生型ugt1a1转基因和野生型hbb2内含子(seq id no:5);
[0070]-wt:野生型ugt1a1转基因和移除了一些arf的优化形式的hbb2内含子(seq id no:6);
[0071]-v2(或v2.0):包含密码子优化的ugt1a1转基因形式2.0(seq id no:2)和野生型hbb2内含子(seq id no:5);
[0072]-v2.1:包含密码子优化的ugt1a1转基因形式2.0(seq id no:2)和移除了一些arf的优化形式的hbb2内含子(seq id no:6);
[0073]-v3:包含密码子优化的ugt1a1转基因形式3(seq id no:3)以及移除了一些arf的优化形式的hbb2内含子(seq id no:6)。
[0074]-aav8-haat-wtugt1a1:含有wt构建体的aav8载体,在haat启动子的控制下,野生型ugt1a1转基因;
[0075]-aav8-haat-cougt1a1v2:含有v2构建体的aav8载体,在haat启动子的控制下;
[0076]-aav8-haat-cougt1a1v2.1:含有v2.1构建体的aav8载体,在haat启动子的控制下;
[0077]-aav8-haat-cougt1a1v3:含有v3构建体的aav8载体,在haat启动子的控制下,野生型。
[0078]
体外测定:
[0079]
将人肝细胞细胞系huh7在0、5000(5)、10000(10)或25000(25)的递增感染复数(moi)下转导,或用指示的质粒载体和阳离子脂质体(lipofectamine)转染。在转导之后48小时,将细胞收集、裂解,并且制备微粒体提取物并上样于western印迹上,其中针对人ugt1的多克隆抗体用于检测蛋白质。组成性表达的蛋白质钙联结蛋白(calnexin)用作上样对照。
[0080]
用于微粒体制备的细胞的一部分已被用于用三唑提取mrna。提取的mrna已用dna酶处理,逆转录,并且通过用对ugt1a1序列具有特异性的寡核苷酸引物进行rt-pcr加以分析。对人血清碱性磷酸酶具有特异性的寡核苷酸引物已被用于归一化。
[0081]
电子分析:
[0082]
已用存在于vectornti软件(life technologies)中的orf分析工具对两个ugt1a1序列的编码链进行可变阅读框(arf)分析。利用对真核细胞典型的起始位点和终止位点(分别是atg作为起始位点以及taa tga tag作为终止位点)。arf在它们的长度跨越超过50bp,并且它们具有与起始密码子同框的终止密码子时被考虑。
[0083]
动物:
[0084]
呈现ugt1a1基因缺陷的gunn大鼠在6-8周龄时用载体注射。通过尾部静脉以0.5ml体积递送载体。每周收集血清样品以监测总胆红素(tb)的水平。未治疗的受影响动物和野生型或健康同窝仔畜用作对照。
[0085]
先前已产生处于c57bl/6背景下的ugt1突变小鼠(bortolussi等,2012)。野生型同窝仔畜用作对照。舍饲小鼠,并且根据机构指导方针和由当地伦理委员会和相关管理机关核准的实验程序,在充分考虑关于动物实验的eu指令2010/63/eu下加以处理。将ugt1a基因中的遗传突变转移至fvb/nj小鼠品系中。用于这个研究中的动物是在分别与c57bl/6小鼠和fvb/nj回交超过9次之后获得的至少99.8%c57bl/6小鼠或fvb/nj遗传背景。使小鼠保持在温度控制的环境中,采用12/12小时光照
–
黑暗循环。它们接受随意取用的标准食物膳食和水。在出生之后第2天(p2)腹膜内注射载体,并且在注射载体之后4周测定胆红素水平。
[0086]
aav剂量:
[0087]
施用的载体的剂量指示在图例中。
[0088]
大鼠的血清制备:
[0089]
每周通过在眶后窦中穿刺来将血液样品收集于干燥注射器中。在4℃下在8000rpm下离心血液,等分并冷冻在-20℃下。
[0090]
小鼠的血浆制备:
[0091]
在于突变和野生型同窝仔畜中注射之后4周时,通过心脏穿刺来将血液样品收集于edta收集注射器中。在2500rpm下离心血液,收集血浆,等分并冷冻在-80℃下。所有程序都在暗光下进行以避免胆红素降解。
[0092]
大鼠的胆红素测定:
[0093]
如由制造商所述,使用胆红素测定试剂盒(abnova,参照号ka1614)进行血清总胆红素测定。我们使用50μl体积的血清进行分析。通过使用多板读取器(perkinelmer enspire)获得在530nm下的吸光值。
[0094]
小鼠的胆红素测定:
[0095]
如由制造商所述,在进行以下微小修改下,使用直接和总胆红素试剂盒(bq kits,san diego,ca)进行血浆总胆红素测定:将反应按比例缩小,并且以最终体积300μl(而非6000μl),仅用10μl血浆进行反应。3种商业胆红素参照标准物(对照血清i、对照血清ii和胆红素校准物,diazyme laboratories,poway,ca,usa)在各组分析中作为品质对照加以包括。通过使用多板读取器(perkin elmer envision板读取器,walthman,ma,usa)获得在560nm下的吸光值。
[0096]
对肝提取物的western印迹:
[0097]
已使从用3种载体中的1种注射的动物获得的被快速冷冻的肝快速均质化。匀浆已用于微粒体制备。接着将微粒体提取物上样于western印迹上,其中针对人ugt1的多克隆抗体用于检测蛋白质。将蛋白质条带定量。
[0098]
结果
[0099]
产生密码子优化形式的人ugt1a1编码序列并引入表达质粒中。已将两个优化ugt1a1编码序列(v2和v3序列)和野生型序列转染于huh-7细胞中。获得的结果报道于图1中。这个实验显示两个密码子优化的序列比野生型序列在人细胞中更高效地体外翻译。
[0100]
在图2图a中显示通过用在haat启动子的转录控制下表达荧光素酶的质粒转染而在huh-7细胞中产生的荧光素酶水平。不同内含子序列已被克隆在荧光素酶编码序列的5’。它们中的两个即hbb2和fix内含子通过移除序列中的arf而得以优化,所述移除通过置换在所述内含子的野生型序列中鉴定的atg密码子中的一个核苷酸进行。优化的构建体在肝细胞系中的表达指示在两种情况下从内含子序列移除arf均使荧光素酶体外表达增加,其中优化的hbb2内含子是特别有效力的。在图b中,比较两个均在haat启动子的转录控制下表达ugt1a1的质粒。v2.0含有野生型hbb2内含子,而v2.1含有优化形式。显示的数据指示v2.1质粒比v2.0表达多50%的ugt1a1,而mrna水平无任何增加。
[0101]
在体外测试密码子优化的ugt1a1形式2.0和2.1aav8载体(分别是ugt1a1 2.0和ugt1a1 2.1)。ugt1a1 2.0载体和ugt1a1 2.1载体的不同之处仅在于以下事实:它们分别含有野生型hbb2内含子(seq id no:5)或其中已移除arf的修饰的hbb2内含子(seq id no:6)。获得的结果报道于图3中。这个实验显示密码子优化的ugt1a1载体形式2.1比2.0形式在人细胞中在体外更有效力。
[0102]
图4显示对野生型ugt1a1(a)和密码子优化的ugt1a1v2.1(b)载体内可变阅读框(arf)的电子分析的结果。相较于野生型序列,v2.1载体仅具有有限数目的arf,并且相对于启动子主要呈相反方向。此外,在图4中,我们可见通常存在于hbb2内含子(在a中表示的野生型ugt1a1构建体中使用)中的arf9和arf10已从引入ugt1a1v2.1优化载体中的seq id no:6的修饰的hbb2内含子移除。
[0103]
接着,在5x10
12
vg/kg的剂量下施用密码子优化的aav8-haat-cougt1a1v2.1载体。已在6周龄纯合性gunn大鼠(ugt1a1-/-)中进行载体的尾部静脉注射。在图5的图中显示在注射之后以及在pbs注射的野生型(wt,灰线)、杂合性(ugt1a1 /-,点线)和纯合性(黑线)gunn大鼠中每周测量的总胆红素(tb)水平。所有数据都表示为平均值
±
se。注射密码子优化的载体导致疾病表型得以完全修正。
[0104]
也在5x10
11
vg/kg的剂量下施用aav8-haat-ugt1a1v2.1载体。通过在6周龄纯合性gunn大鼠(ugt1a1-/-)中进行尾部静脉注射来施用载体。在图6的图中显示在注射之后以及在pbs注射的野生型(wt,灰线)、杂合性(ugt1a1 /-,点线)和纯合性(黑线)gunn大鼠中每周测量的总胆红素(tb)水平。所有数据都表示为平均值
±
se。注射密码子优化的载体导致疾病表型得以完全修正。
[0105]
在5x10
11
vg/kg的剂量下进一步施用2种密码子优化的(v2.1和v3)载体和野生型aav8-haat-ugt1a1载体。已在6周龄纯合性gunn大鼠(ugt1a1-/-)中进行载体的尾部静脉注射。在图7a的图中显示在注射之后每周测量的总胆红素(tb)水平。所有数据都表示为平均值
±
se。如图7图a中所示,注射3种载体导致疾病表型得以完全修正。在注射之后2个月,将动物处死,并且通过western印迹来定量肝匀浆中的ugt1a1蛋白水平。在图b中显示用对ugt1a1蛋白具有特异性的抗体获得的western印迹的照片。对条带的定量显示用aav8-haat-cougt1a1v2.1治疗的大鼠中的ugt1a1蛋白的数量增加,即使差异由于在不同动物中观察的表达水平的高可变性而不显著。
[0106]
已在用5x10
12
vg/kg的aav8-v2.1 ugt1a1载体注射的2月龄gunn大鼠中评估长期功效。在注射之后4个月,在雄性大鼠中,血液中的平均胆红素水平是1.75mg/dl(在d0时的初始水平:7.49,降低77%),并且在雌性大鼠中是0.85mg/dl(在d0时的初始水平:6.15mg/dl,
降低86%)。相较于pastore等人使用不同构建体报道雌性大鼠中仅降低基线胆红素水平的50%的先前研究,指示对表型的长期修正的这个结果是特别惊人的。总之,显示的数据指示应用于aav8-haat-cougt1a1v2.1的本发明方法产生的载体相较于被开发来治愈cn的其它载体具有更好体内功效。
[0107]
我们也在克里格勒-纳贾尔综合征的小鼠模型中测试对总胆红素的修正功效。图8是显示在注射后1个月时总胆红素(tb)水平的图。在出生之后第2天(p2),用3e10 vg/小鼠的剂量注射动物。
[0108]
用15天光线疗法保持存活的未治疗的受影响动物用作对照(untr(pt))。
[0109]
这个实验显示在所有载体中,2.1形式的载体产生最高tb修正水平。所有数据都表示为平均值
±
sd。各点表示单个动物。
[0110]
参考文献
[0111]
allay等,hum gene ther.2011年5月;22(5):595-604
[0112]
bartel等,front microbiol.2011年10月4日;2:204
[0113]
bortolussi等,faseb j.2012年3月;26(3):1052-63
[0114]
mccarty等,gene ther.2003年12月;10(26):2112-8
[0115]
pastore等,mol ther.2013年5月;第21卷;增刊1;s192-3(摘要编号499)
[0116]
seppen等,mol ther.2006年6月;13(6):1085-92
[0117]
shen等,mol ther.2007年11月;15(11):1955-62
[0118]
tenney等,virology.2014年4月;454-455:227-36
[0119]
zhong等,proc natl acad sci u s a.2008年6月3日;105(22):7827-32。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。