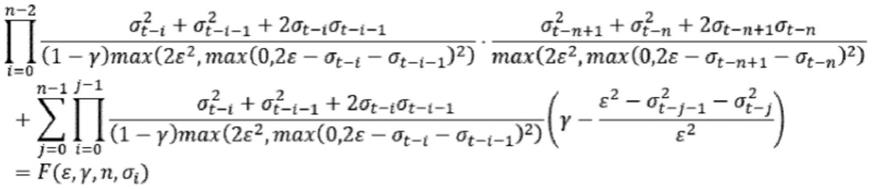
一种用于检测微囊藻毒素-lr的试纸检测方法
技术领域
1.本发明属于生物传感器及环境监测领域,具体涉及一种用于检测微囊藻毒素-lr的试纸检测方法。
背景技术:
2.随着水体富营养化的逐步加剧,蓝藻水华和赤潮的发生逐步增加。越来越多的水源受到蓝藻水华的次生代谢产物-微囊藻毒素(mcs)的污染,对水体环境和人群健康构成巨大的威胁。而微囊藻毒素-lr(mc-lr)是其中最普遍、最具毒性的微囊藻毒素同源物,能够强烈抑制蛋白磷酸酶的活性,还是强烈的肝脏肿瘤促进剂。考虑到其强毒性,中国生活饮用水卫生标准(gb 5749-2006)的颁布,将饮用水中微囊藻毒素含量限制为1μg/l。因此,在水环境中监测mc-lr对环境安全与人体健康至关重要。
3.检测mc-lr的传统方法包括高效液相色谱法(hplc)、液相色谱与质谱联用(lc-ms)、酶联免疫吸附试验(elisa)、蛋白磷酸酶抑制试验(ppia)、以及光学和电化学传感器。hplc-ms虽然有较高的灵敏度和特异性,但是其需要庞大而昂贵的机器设备,这对现场检测mc-lr造成了一定的阻碍。elisa和ppia虽然利用了酶的特异性,然而其需要多步骤冗长的检测过程。电化学传感器虽然有极灵敏的检测效果,但是需要合适的电极材料以及适宜的电极修饰。光学传感器操作简单,但是也受到了灵敏度和特异性的限制。
4.通过查阅文献知道,原核生物已经开发出一种成簇规则间隔短回文重复序列(crispr)的适应性免疫系统。过去的几年里,crispr-cas9酶经过各种重新设计,引起了基因编辑热潮。而crispr-cas12a是一种新的rna引导的核酸酶,正在成为基因编辑最常用的工具,其对dna识别的特异性、灵敏性和可编程性在分子诊断领域备受关注,做为一些强大诊断工具的核心,其有望解决生物传感器在灵敏度和特异性等方面的问题。
5.传统的抗原-抗体反应灵敏度、特异性均好,但是蛋白质做为探针分子容易变性,而且价格昂贵,适配体由dna分子构成,经selex富集筛选,可以具有与抗原-抗体相匹敌的灵敏度,同时更易合成,稳定性更好。所以我们在生物传感器的基础上,结合dna适配体的特异性、酶的特异性,构建出一种操作简单同时高灵敏度的mc-lr检测平台,同时通过对信号链的设计,利用侧向流动试纸条直接检测mc-lr,操作简单,省去现场检测时机器设备带来的不便。
技术实现要素:
6.有鉴于此,本发明提供一种用于检测微囊藻毒素-lr的试纸检测方法,该试纸检测方法通过构建一种可用于现场检测微囊藻毒素-lr的磁珠-dna探针,并通过crispr-cas12a进行信号识别和放大,从而实现水样监测,该法具有高特异性和灵敏性,并且成本低廉,操作步骤简便。
7.本发明提供了一种用于检测微囊藻毒素-lr的试纸检测方法,包括以下步骤:
8.s1.将适配体aptamer和互补链blocker加入tamg缓冲液中混合摇匀得反应液,将
所述反应液95℃加热5min,然后逐渐冷却至4℃,形成dna双链probe;
9.所述适配体aptamer的序列如seq no.1所示,所述适配体aptamer的一端修饰有生物素biotin,所述互补链blocker的序列如seq no.2所示;
10.s2.将链霉亲和素磁珠溶液分散在2
×
b&w缓冲溶液中,加入所述dna双链probe,室温孵育1h后,磁分离收集获得磁珠-dna探针,以1
×
pbs缓冲溶液漂洗待用;
11.s3.用40℃的pbs冲洗磁珠-dna探针以减少背景信号,将磁珠-dna探针与待检测水样混合,恒温孵育,然后进行磁分离,留上清;所述恒温孵育的温度为36℃-38℃,所述恒温孵育的时间为1.5-3h;
12.s4.将cas12a溶液和crrna溶液加入第一缓冲液中,37℃恒温孵育10min后,加入第二缓冲液和所述上清,37℃孵育20min后,加入reporter溶液,37℃孵育20min;所述第一缓冲液和所述第二缓冲液均为10
×
nebuffer 2.1缓冲液;
13.crrna的序列如seq no.3所示;
14.所述信号链reporter一端为荧光素fam,另一端为生物素biotin;
15.s5.将步骤s4孵育得到的溶液用无菌水稀释后插入检测试纸检测,根据检测结果判断所述待测水样中是否存在mc-lr。
16.进一步的,步骤s1中,所述反应液中,适配体aptamer的浓度为1v/v%,互补链blocker的浓度为1v/v%。
17.进一步的,步骤s2中,链霉亲和素磁珠溶液、2
×
b&w缓冲溶液和dna双链probe的体积比为1:50:50,其中,所述链霉亲和素磁珠溶液的浓度为30mg/ml。
18.进一步的,步骤s3中,所述恒温孵育的温度为38℃,所述恒温孵育的时间为2h。
19.进一步的,步骤s4中,cas12a溶液和crrna溶液浓度为1μm,体积比为1:2。其中,cas12a溶液、crrna溶液、第一缓冲液、第二缓冲液、上清和reporter溶液的体积比优选为2:4:0.7:9.3:84:1,reporter溶液的浓度为100μm。
20.进一步的,步骤s5中,所述稀释的稀释倍数为20倍。
21.进一步的,步骤s5中,所述检测试纸包括c线和t线,所述c线包埋链霉亲和素,所述t线包埋二抗。
22.进一步的,所述根据检测结果判断所述待测水样中是否存在mc-lr具体为:根据所述检测试纸的t线是否显色来检测mc-lr的存在,若t线显示为红色,则说明所述待测水样中存在mc-lr。检测的检测限为0.001μg/l。
23.上述检测方法中,1
×
pbs缓冲液、tamg缓冲液、2
×
b&w缓冲液和10
×
nebuffer 2.1缓冲液的优选配比如下:
[0024]1×
pbs缓冲液(ph为7.2-7.4)中,nacl的浓度为136.89mm;kcl的浓度为2.67mm;na2hpo4的浓度为8.10mm;kh2po4的浓度为1.76mm。
[0025]
tamg缓冲液(ph为8.0)中,tris的浓度为45mm;mgcl2的浓度为7.6mm。
[0026]2×
b&w缓冲液(ph为7.5)中,tris-hcl的浓度为10mm;edta的浓度为1mm;nacl的浓度为2.0m。
[0027]
10
×
nebuffer 2.1缓冲液(ph为7.9)中,nacl的浓度为500mm;tris-hcl的浓度为100mm;mgcl2的浓度为100mm;bsa的浓度为100μg/ml。
[0028]
所述的核酸序列如下:
(1.76mm),ph值为7.2-7.4
[0043]
tamg缓冲液为tris(45mm);mgcl2(7.6mm),用乙酸将其ph调节至8.0。
[0044]2×
b&w缓冲液为tris-hcl(10mm);edta(1mm);nacl(2.0m),ph值为7.5。
[0045]
10
×
nebuffer 2.1缓冲液为nacl(500mm);tris-hcl(100mm);mgcl2(100mm);bsa(100μg/ml),ph值为7.9。
[0046]
链霉亲和素磁珠溶液为将磁珠是分散在保存液里得到,链霉亲和素磁珠的浓度为30mg/ml;保存液为包含20%乙醇的pbs。
[0047]
下面结合具体实施例进一步阐述本发明的技术方案。
[0048]
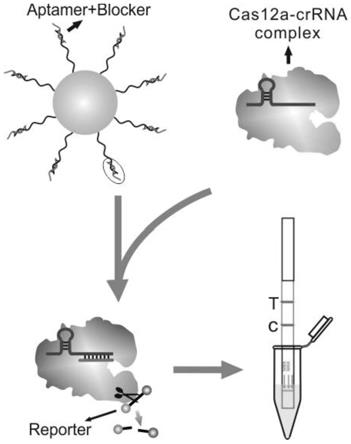
图1为本发明提供的试纸检测方法工作机制示意图。aptamer能够与blocker通过部分碱基配对结合成dna双链probe。磁珠-dna传感器是由dna双链probe偶联在磁珠表面构成,当mc-lr存在时,dna双链probe中的blocker链与mc-lr竞争结合aptamer,进而释放blocker链,释放的blocker链来激活cas12a-crrna(即crrna导向的cas12a,其中,crrna用来特异性识别blocker链),cas12a核酸酶被激活后,可非特异性切断信号链reporter链,使biotin与fam从一条dna链上分开,产生游离的fam基团。
[0049]
用检测试纸(jy0301,cas12/13专用核酸检测试纸条,购自沃博生物)检测是否有游离的fam基团产生。检测试纸的构成如图2所示,其中最底部的部分
①
是吸收区域,用来吸收报告液;部分
②
是结合区域,包埋有抗fam抗体包被的胶体金纳米颗粒;部分
③
是c线区域,为质控线,包埋有链霉亲和素;部分
④
是t线区域,为检测线,包埋有二抗。
[0050]
在将试纸条放入cas12a孵育的报告液后,溶液沿着试纸条带迁移,fam基团先与被抗fam抗体包被的胶体金纳米颗粒偶联。如果reporter链未被切开,随着胶体金纳米颗粒迁移,该偶联物另一端的biotin会和c线包埋的链霉亲和素结合,使金纳米颗粒停留在c线显红色;如果reporter链被切开,该偶联物不会在c线停留,而是和t线包埋的二抗结合,使金纳米颗粒停留在t线显红色。信号可以在五分钟内肉眼读出。在一定浓度范围内,通过观察t线是否显色来检测mc-lr的存在。
[0051]
实施例1:磁珠-dna探针的构建
[0052]
a)将1μl 100μm的aptamer和1μl 100μμ的blocker,在98μl tamg缓冲液中混合摇匀得反应液。将反应液95℃加热5min,然后逐渐冷却至4℃,形成dna双链probe。
[0053]
b)将2μl链霉亲和素磁珠溶液分散在100μl2
×
b&w缓冲溶液中,加入100μl probe室温孵育1h后,磁分离收集磁珠。用100μl pbs缓冲液洗涤5次,获得磁珠-dna探针。
[0054]
实施例2:磁珠-dna探针与mc-lr不同孵育时间对检测效果的影响
[0055]
(1)将实施例1得到的全部磁珠-dna探针用40℃的pbs溶液冲洗以减少背景信号。
[0056]
(2)将清洗后的磁珠-dna探针与84μl 1
×
pbs稀释的0.1μg/l的mc-lr标准溶液混合。38℃孵育不同时间(0.1,0.5,1,1.5,2,2.5,3h)后进行磁分离,留上清。
[0057]
(3)加2μl 1μm的cas12a、4μl 1μm的crrna以及0.7μl的10
×
nebuffer 2.1缓冲液,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1缓冲液以及84μl步骤(2)得到的上清,37℃孵育20min后,加入1μl 100μm的reporter溶液,再37℃孵育20min,然后进行荧光光谱测试,取光谱峰值。
[0058]
以磁珠-dna探针与mc-lr孵育的时间为横坐标,以测得的荧光强度为纵坐标,作磁珠-dna探针与mc-lr不同孵育时间下激活cas12a产生的荧光强度变化示意图。如图3,随着
孵育时间从0.1h增加到1.5h,荧光强度急剧增加,荧光强度在2h后趋于稳定。可见,孵育时间为2h时,检测效果最好。
[0059]
实施例3:磁珠-dna探针与mc-lr不同孵育温度对检测效果的影响
[0060]
(1)将实施例1得到的全部磁珠-dna探针用40℃的pbs溶液冲洗以减少背景信号。
[0061]
(2)将清洗后的磁珠-dna探针与84μl1
×
pbs稀释的0.1μg/l的mc-lr标准溶液混合,将磁珠-dna探针与84μl 1
×
pbs缓冲液混合得到的混合溶液做为阴性对照,不同温度(32,34,36,38,40℃)下孵育2h后进行磁分离,留上清。
[0062]
(3)加2μl1μm的cas12a、4μl 1μm的crrna以及0.7μl的10
×
nebuffer 2.1,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1以及84μl步骤(2)得到的上清,37℃孵育20min后,加入1μl 100μm的reporter链,再37℃孵育20min,进行荧光光谱测试,取光谱峰值。
[0063]
以磁珠-dna探针与mc-lr孵育的温度为横坐标,以测得的荧光强度为纵坐标,磁珠-dna探针与含mc-lr水样的在不同孵育温度后,激活cas12a产生的荧光强度柱状图。如图4,在较低的孵育温度下,磁珠-dna探针中的核酸适配体与mc-lr之间的相互作用较弱或者反应较慢,不能有效替代blocker链,因此得到较低的荧光强度。随着孵育温度增加,荧光强度相应增加。然而,在40℃时,由于dna双链probe在高温下的不稳定性,阴性对照组的荧光强度也增加了。因此,磁珠-dna探针与mc-lr孵育的温度选择38℃为最佳。
[0064]
实施例4:crispr-cas12a系统中cas12a-crrna复合物浓度对检测效果的影响
[0065]
该实施例中,cas12a溶液和crrna溶液的浓度为1μm。
[0066]
(1)将实施例1得到的全部磁珠-dna探针用40℃的pbs溶液冲洗以减少背景信号。
[0067]
(2)将清洗后的磁珠-dna探针与84μl 1
×
pbs稀释的0.1μg/l的mc-lr标准溶液混合。38℃下孵育2h后进行磁分离,留上清。
[0068]
(3)分别将0.5μl cas12a与1μl crrna(对应浓度为5nm的cas12a-crrna复合物),1μl cas12a与2μl crrna(对应浓度为10nm的cas12a-crrna复合物),2μl cas12a与4μl crrna(对应浓度为20nm的cas12a-crrna复合物),4μl cas12a与8μl crrna(对应浓度为40nm的cas12a-crrna复合物),6μl cas12a与12μl crrna(对应浓度为60nm的cas12a-crrna复合物),以及0.7μl的10
×
nebuffer2.1,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1以及84μl步骤(2)得到的上清,37℃孵育20min后,加入1μl100μm的reporter链,再37℃孵育20min。进行荧光光谱测试,取光谱峰值。
[0069]
以cas12a-crrna复合物浓度为横坐标,以测得的荧光强度为纵坐标,作不同cas12a-crrna复合物浓度对应的荧光图谱强度示意图。如图5,我们发现荧光强度在增加,到20nm(2μlcas12a与4μl crrna)之后,变化就不明显了。因此,采用浓度为的20nm cas12a-crrna复合物进行后续的检测可达最佳效果。
[0070]
实施例5:crispr-cas12a系统中blocker链浓度和孵育时间的影响(crispr-cas12a系统中cas12a-crrna复合物浓度为20nm)
[0071]
加2μl的cas12a、4μl的crrna以及0.7μl的10
×
nebuffer 2.1,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1以及84μl不同浓度(500pm,100pm,50pm)的blocker链,37℃孵育20min后,加入1μl 100μm的reporter链,37℃孵育(5,10,15,20,25min)。将孵育后的溶液进行荧光光谱测试,取光谱峰值。
[0072]
以加入reporter链后孵育的时间为横坐标,以测得的荧光强度为纵坐标,做不同
浓度blocker链和孵育不同时间cas12a切割效果的荧光图谱强度示意图,如图6,发现荧光强度随着blocker浓度升高而升高;随着孵育时间增加而升高。
[0073]
实施例7:用试纸条对mc-lr进行检测
[0074]
(1)将1μl 100μm的aptamer和1μl 100μμ的blocker,在98μl tamg缓冲液中混合摇匀。将混合物95℃加热5min,然后逐渐冷却至4℃,形成dna双链probe。
[0075]
(2)将2μl链霉亲和素磁珠溶液分散在100μl 2
×
b&w缓冲溶液中,加入100μl probe室温孵育1h后,磁分离收集磁珠。用pbs(100μl)洗涤5次,获得磁珠-dna探针。
[0076]
(3)用40℃的pbs冲洗磁珠-dna探针以减少背景信号。
[0077]
(4)将磁珠-dna探针与1
×
pbs稀释的84μl不同浓度(1,0.1,5
×
10-2
,1
×
10-2
,5
×
10-3
,1
×
10-3
μg/l)的mc-lr标准溶液混合。38℃孵育2h后进行磁分离,留上清。
[0078]
(5)加2μl 1μm的cas12a、4μl 1μm的crrna以及0.7μl的10
×
nebuffer 2.1,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1以及84μl步骤(4)得到的上清,37℃孵育20min后,加入1μl 100μm的reporter溶液,再37℃孵育(20、40、60min)。
[0079]
(6)将(5)孵育后的溶液用无菌水稀释20倍,插入试纸条,观察c线与t线是否变红。
[0080]
图7a为加入reporter链后孵育20min的不同浓度mc-lr的试纸条图。
[0081]
图7b为加入reporter链后孵育40min的不同浓度mc-lr的试纸条图。
[0082]
图7c为加入reporter链后孵育60min的不同浓度mc-lr的试纸条图。
[0083]
如图7c,在加入reporter链后孵育60min,10-3
μg/l mc-lr对应的试纸条t线也有略微变红,表明有mc-lr存在,该传感器对mc-lr的检测限度可以达到0.001μg/l。
[0084]
实施例8:抗干扰与特异性评估
[0085]
(1)将1μl 100μm的aptamer和1μl 100μμ的blocker,在98μl tamg缓冲液中混合摇匀。将混合物95℃加热5min,然后逐渐冷却至4℃,形成dna双链probe。
[0086]
(2)将2μl链霉亲和素磁珠溶液分散在100μl 2
×
b&w缓冲溶液中,加入100μl probe室温孵育1h后,磁分离收集磁珠。用pbs(100μl)洗涤5次,获得磁珠-dna探针。
[0087]
(3)用40℃的pbs冲洗磁珠-dna探针以减少背景信号。
[0088]
(4)将磁珠-dna探针与1
×
pbs稀释的84μl(1mm caso4,1mm cucl2,1mm fecl3,1mm kcl,1mm nahco3,1mm na2so4,100mg/l的bsa,1g/l庆大霉素硫酸盐,0.1μg/l mc-rr)混合。将磁珠-dna探针与1
×
pbs稀释的84μl 0.1μg/l的mc-lr标准溶液混合做为阳性对照。38℃孵育2h后进行磁分离,留上清。
[0089]
(5)加2μl 1μm的cas12a、4μl 1μm的crrna以及0.7μl的10
×
nebuffer 2.1,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1以及84μl步骤(4)得到的上清,37℃孵育20min后,加入1μl 100μm的reporter链,再37℃孵育60min。
[0090]
(6)将(5)孵育后的溶液用无菌水稀释20倍,插入试纸条,观察c线与t线是否变红。
[0091]
图8为加入不同干扰物质的抗干扰和特异性试纸条图。可以看出只有mc-lr存在的情况下试纸条t线才会显红色,该传感器对mc-lr的检测具有很好的特异性和抗干扰能力。
[0092]
实施例9:真实水样检测
[0093]
为了确认该生物传感器是否能在真实水样下运行,真实水样分别取自长江江水,将1ml水样先通过0.45μm水系滤膜,加入0.11ml 10
×
pbs,与真实水样混合。混匀后即可直接使用,无需进一步处理。考虑到真实水样内mc-lr比较低,采用加样回收法,验证可行性,
加入不同量的mc-lr,得到含mc-lr浓度为0,1,0.1,0.01和0.001μg/l的真实水样。
[0094]
(1)将1μl100μm的aptamer和1μl 100μμ的blocker,在98μl tamg缓冲液中混合摇匀。将混合物95℃加热5min,然后逐渐冷却至4℃,形成dna双链probe。
[0095]
(2)将2μl链霉亲和素磁珠溶液分散在100μl 2
×
b&w缓冲溶液中,加入100μl probe室温孵育1h后,磁分离收集磁珠。用pbs(100μl)洗涤5次,获得磁珠-dna探针。
[0096]
(3)用40℃的pbs冲洗磁珠-dna探针以减少背景信号。
[0097]
(4)将磁珠-dna探针与含不同浓度mc-lr的水样混合。38℃孵育2h后进行磁分离,留上清。
[0098]
(5)加2μl 1μm的cas12a、4μl 1μm的crrna以及0.7μl的10
×
nebuffer 2.1,37℃孵育10min后,加入9.3μl的10
×
nebuffer 2.1以及84μl步骤(4)得到的上清,37℃孵育20min后,加入1μl 100μm的reporter链,再37℃孵育60min。
[0099]
(6)将(5)孵育后的溶液用无菌水稀释20倍,插入试纸条,观察c线与t线是否变红。
[0100]
图9为真实水样中检测不同浓度mc-lr的试纸条图。可以看出在真实水样中本发明提供的试纸检测方法可以很好地运行。
[0101]
本发明通过dna适配体的互补链与mc-lr的竞争结合,实现检测物质的转换,以及crispr-cas12a系统对dna识别的高灵敏度和特异性,实现生物传感器的高特异性和灵敏性,并且成本低廉;dna分子传感器上用于偶联磁珠和特异性识别mc-lr的aptamer也可被替换成其他需要检测的物质的适配体,扩大了生物传感器的检测范围。
[0102]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。