一种通过清除野生型p53蛋白促进atg5-atg12共轭增强细胞自噬的应用
技术领域
1.本发明涉及生物医药领域,具体涉及一种通过清除p53蛋白促进atg5-atg12共轭增强细胞自噬的应用。
背景技术:
2.细胞自噬(autophagy)是细胞内的重要过程,在真核生物的进化过程中高度保守,能够通过降解细胞自身的组分进行物质周转。除了正常的营养代谢作用,细胞自噬还可将细胞中一些损坏的细胞器或蛋白吞噬入双层膜结构的自噬小泡中,然后与溶酶体(动物)融合形成自噬溶酶体,清除细胞中损坏的细胞器或蛋白。目前发现细胞自噬在机体适应饥饿、应对感染的免疫应答、防治肿瘤与神经退行性疾病中发挥重要作用,并且细胞自噬关键基因的缺失或突变会导致新出生的小鼠无法度过饥饿期而死亡,在包括癌症、神经系统疾病等多种疾病中都发现细胞自噬存在缺陷。
3.在细胞自噬过程中,atg12系统发挥十分重要的作用。atg12是一种泛素样蛋白,与泛素类似,通过其c端的甘氨酸的羟基与底物共价结合。atg12以atp依赖的方式被atg7 (e1-like)激活,其c端甘氨酸通过高能硫酯键与atg7的活性位点半胱氨酸结合。随后,atg12被转移到atg10 (e2-like)上形成另一个硫酯中间体。atg12最终通过异肽键与atg5中的受体赖氨酸结合。这个复合物帮助确定自噬体形成的膜点,然后atg6l-atg5/atg12作为e3-like enzyme催化泛素样自噬蛋白atg8与pe(磷脂酰乙醇胺)的共轭反应。atg8的共轭形式存在于自噬膜上,并通过atg4(s)的解共轭循环。由此可见atg5-atg12共轭的形成对细胞自噬的发生与运转及其重要,细胞以及动物实验也证实:atg5或atg12基因缺失后细胞自噬过程严重受阻,这两种基因敲除小鼠均由于细胞自噬缺陷而在出生后死亡。
4.p53是重要的转录因子,在超过一半的人类肿瘤中出现突变或缺失。p53在细胞周期调节、细胞凋亡和dna修复等方面发挥着重要作用,被认为是一种关键的肿瘤抑制因子。许多研究已经表明p53的生物学作用除了防止肿瘤的形成和发展,还涉及到许多其他方面。p53在细胞自噬中的功能由其细胞水平以及定位的严格控制,既可以是自噬的激活因子,也可以是自噬的抑制因子。当营养耗尽或缺氧时,p53通过抑制mtor信号激活自噬;或者,p53可以与死亡相关蛋白相互作用激酶1 (dapk1),作用于稳定细胞核p53以及其他功能,包括激活关键的自噬介质beclin-1。然而,在正常的生理应激条件下,p53是抑制自噬体形成的,但其具体的抑制机制不清楚。
技术实现要素:
5.为填补上述机理空白,本技术利用清除野生型p53蛋白促进atg5-atg12共轭增强细胞自噬。首先利用转染鉴定出p53蛋白在细胞中与atg12结合并抑制细胞自噬,即p53蛋白通过结合atg12抑制atg5-atg12共轭形成,最终导致细胞自噬受阻;然后利用清除p53蛋白促进或增强细胞自噬水平。
6.本发明目的是申请一种通过清除野生型p53蛋白促进atg5-atg12共轭增强细胞自噬的应用,其特征在于,清除p53包括降低p53蛋白表达、沉默p53蛋白表达以及敲除p53基因。
7.本发明的一个方面是提供促进atg5-atg12共轭的试剂增强细胞自噬中的应用。在一个具体的实施例中,所述的促进atg5-atg12共轭的试剂为消除或降低p53蛋白表达或功能的试剂。在一个具体的实施例中,所述消除或降低p53蛋白表达或功能的试剂够降低p53蛋白表达、沉默p53蛋白表达、降低p53蛋白活性或者是敲除p53的基因;在一个具体的实施例中,所述的降低p53的表达的试剂为反义核酸、抑制性转录因子;在另外一个具体的实施例中,所述的降低p53蛋白活性的试剂包括特异性结合p53的抗体;在另外一个具体的实施例中,所述的敲除p53基因的试剂包括talen、zfn、crispr-cas9相关试剂。
8.本发明的第二个方面是提供一种基因敲除小鼠模型在研究atg5-atg12共轭中的应用,所述的小鼠为p53基因敲除小鼠;在一个具体的实施例中,所在p53基因敲除与gfp-lc3小鼠杂交构建能够可视化观察细胞自噬形成的小鼠模型;在另外一个具体的实施例中,小鼠模型中的atg5-atg12共轭被显著升高,细胞自噬水平也被提高。
9.本发明的第三个方面提供野生型p53基因或蛋白在抑制atg5-atg12共轭中的应用;在一个具体的实施例中,所述的抑制atg5-atg12共轭还抑制了细胞的自噬。
10.本发明具有的技术效果为:(1) 本技术首次证明了野生型p53能直接与atg12结合;(2) 本技术明确了野生型p53通过与atg12结合,抑制了atg5-atg12共轭的形成;(3) 本技术利用p53基因敲除小鼠与gfp-lc3小鼠杂交构建能够可视化观察细胞自噬形成的小鼠模型,证实在细胞内清除p53后能够增强细胞自噬水平,清除野生型p53或抑制p53与atg12结合是一种潜在的增强细胞自噬药物应用策略。
附图说明
11.图1免疫沉淀技术检测flag-p53与细胞自噬通路中关键分子的相互作用情况。
12.图2免疫沉淀技术检测内源p53蛋白与atg12的相互作用。
13.图3 gst pull-down 实验验证p53与atg12直接互作。
14.图4 细胞内过表达p53抑制atg5-atg12共轭。
15.图5 构建体外atg5-atg12共轭自发生体系。
16.图6 在体外系统中证实p53蛋白抑制atg5-atg12共轭。
17.图7 小鼠组织中p53蛋白水平升高抑制atg5-atg12共轭。
18.图8 构建gfp-lc3
/
;p53
/
与gfp-lc3
/
;p53-/-小鼠模型后分离mef细胞通过荧光检测饥饿后的细胞自噬水平。
19.图9 构建gfp-lc3
/
;p53
/
与gfp-lc3
/
;p53-/-小鼠模型后分离mef细胞通过荧光检测阻断自噬流后的细胞自噬累积水平。
20.图10 剖腹产获得同时出生的gfp-lc3
/
;p53
/
与gfp-lc3
/
;p53-/-小鼠,监测不同饥饿时间点肝脏的细胞自噬水平。
21.图11 western blot 检测出生后饥饿6h的p53
/
与p53-/-小鼠的肝脏、肺脏的atg5-atg12共轭水平。
22.图12ihc检测出生后饥饿6h的p53
/
与p53-/-小鼠的肝脏的atg5-atg12共轭水平。
具体实施方式
23.以下通过参考示范性实施例,本发明的目的和功能以及用于实现这些目的和功能的方法将得以阐明。然而,本发明并不受限于以下所公开的示范性实施例;可以通过不同形式来对其加以实现。说明书的实质仅仅是帮助相关领域技术人员综合理解本发明的具体细节。
24.实施例1p53与细胞自噬通路中关键分子的相互作用为确证p53与自噬通路中关键分子的相互作用,选择购自atcc的hek293t过表达野生型flag-p53质粒载体和自噬通路中关键分子表达质粒(myc标签以及ha标签表达载体质粒),通过免疫共沉淀技术检测相互作用情况。
25.其中蛋白质免疫共沉淀方法的实施步骤为:1.收集已共转染质粒36hrs的细胞(t25培养瓶);2.预冷pbs洗2次,3000rpm离心3min;3.加600μl裂解液(裂解液中加入蛋白酶抑制剂、磷酸酶抑制剂,根据具体实验需求选择hepes裂解液或者ripa裂解液),冰上裂解10min后超声破碎细胞(功率30w,时间3min,开1s、关1.5s),12000rpm离心10min后吸取上清备用;4.取上清60μl作为总细胞lysate备用,其余上清加入1μgflag抗体,4℃旋转混合器上孵育3hrs(内源蛋白相互作用,需进行预清除,即加入20μlprotein-a/g-agarosebeads,4℃旋转混合器上孵育3hrs,离心后取上清,加入3μg内源抗体,4℃旋转混合器上孵育6hrs);5.加入40μl裂解液预处理后的protein-a/g-agarosebeads,4℃旋转混合器上孵育8hrs;6.1000rpm4℃离心3min,细胞裂解液洗涤3次,每次在4℃旋转混合器旋转洗10min;7.洗好的agarosebeads中吸去上清,加入40μl裂解液和50μl2
×
loadingbuffer,混匀后100℃沸水煮15min,备用;8.蛋白样品进行免疫印迹检测。
[0026] westernblot实验实施步骤:1.细胞裂解液样品制备:a.吸干培养板中的细胞培养液,pbs轻轻摇晃洗2次;b.吸干pbs洗液,加入细胞裂解液,加入等体积的的2
×
loadingbuffer,混匀将细胞完全裂解后转移到ep管,沸水中煮15min后备用;2.sds-page电泳(10%浓度sds-page胶)分离蛋白,先90v电压跑30min后140v电压跑至溴酚蓝至底部1cm停止电泳;3.尼龙膜(也称nc膜,9cm/6cm)和滤纸浸泡入电转缓冲液几分钟;4.按照滤纸-膜-胶-滤纸的顺序将夹板放入电转槽中,150ma冰上电转2h;5.断开电源,取出夹板,将nc膜切出目的条带,tbst洗1次后封闭;6.tbst-5%脱脂奶粉封闭液封闭,室温封闭1hr;
7.封闭后一抗4℃过夜,回收一抗,tbst洗膜3次,每次10min,加入二抗,室温孵育1hr,tbst洗膜3次,每次10min;8.显色反应:ecl发光试剂a.b液等体积混合后加到nc膜上,反应3min后吸去发光液,于暗室中曝光,观察westernblot结果。
[0027]
实验发现野生型p53与细胞自噬通路中的atg12存在相互作用(图1),并且这一相互作用分别在细胞内用内源抗体免疫共沉淀(图2)以及在细胞外用原核表达蛋白免疫共沉淀(图3)实验的到验证。
[0028] 实施例2p53抑制atg5-atg12共轭在获取p53与atg12存在相互作用后,首先通过转染将野生型p53在细胞内过表达,检测atg5-atg12共轭体的水平,发现在细胞中过表达野生型p53蛋白抑制了atg5-atg12共轭体的形成(图4)。具体的实施步骤为:1.细胞转染24h后,吸干培养板中的细胞培养液,pbs轻轻摇晃洗2次;2.吸干pbs洗液,加入细胞裂解液,加入等体积的2
×
loadingbuffer,混匀将细胞完全裂解后转移到ep管,沸水中煮15min后sds-page电泳分析;进一步在细胞外环境构建atg5-atg12共轭发生体系,加入纯化出来的p53蛋白,检测后发现在细胞外的反应体系中加入p53蛋白,atg5-atg12共轭体形成的量减少。说明野生型p53能通过直接结合atg12抑制atg5-atg12共轭体的形成。具体的实施步骤为:1.体外表达并纯化野生型p53蛋白;2.构建细胞外atg5-atg12共轭发生体系a.准备4瓶293t细胞,分别转染myc-atg10 myc-atg7、flag-atg12、gfp-atg5、gfp空,24hrs后收取细胞,预冷pbs洗2次,3000rpm离心3min;b.hepes裂解液裂解细胞,冰上裂解10min后超声破碎细胞(功率30w,时间3min,开1s、关1.5s),12000rpm离心10min后吸取上清备用;c.将myc-atg10 myc-atg7、flag-atg12上清各自分成2份,分别与gfp-atg5和gfp空上清混合组成反应体系,在反应体系中按1:20加入mgatpsolution(r&dsystems,b-20)以及dtt(终浓度为1mm),37℃摇床缓慢摇动反应1hr,加入等体积2
×
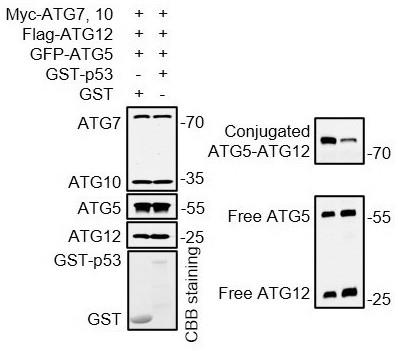
loadingbuffer,混匀,沸水中煮15min后sds-page电泳分析;结果显示,加入gfp-atg5细胞裂解液反应组能够发生atg5-atg12共轭,而加入gfp细胞裂解液反应组无法发生共轭,说明体外atg5-atg12共轭反应体系构建成功(图5)。
[0029]
3.按以上构建成功的反应体系以及反应条件,作以下2个反应组:(1)myc-atg10 myc-atg7 flag-atg12 gst-p53;(2)myc-atg10 myc-atg7 flag-atg12 gst;37℃摇床缓慢摇动反应1hr,加入等体积2
×
loadingbuffer,混匀,沸水中煮15min后sds-page电泳分析;结果显示,加入gst-p53反应组发生atg5-atg12共轭的水平显著减少,说明在细胞外的反应体系中加入p53,有效抑制了atg5-atg12的共轭形成(图6)。
[0030] 实施例3p53在小鼠体内抑制细胞自噬由于在生理条件下细胞自噬的发生需要在进行饥饿诱导,因此采用小鼠出生后饥饿的组织样品进行检测。为了验证p53在体内对细胞自噬的影响,取p53高表达的饥饿6hrs的新生小鼠组织,提取组织细胞蛋白,检测atg5-atg12共轭水平,发现小鼠组织中高表达
p53后,细胞内atg5-atg12共轭水平显著降低(图7);而p53基因敲除小鼠组织中atg5-atg12共轭水平显著升高(图8、图9)。图9标尺为50 μm。具体实施步骤如下:一、组织裂解液样品制备与分析1. 分离新生饥饿后小鼠的器官组织;2. 切取50 mg组织,加入500 μl ripa裂解液(裂解液中加入蛋白酶抑制剂、磷酸酶抑制剂),若单个器官不足50 mg,按50 mg/500 μl裂解液等比例调整裂解液体积;3. 加入钢珠,在组织振荡器上振荡裂解组织,4 ℃旋转混合器上旋转30 min 使组织充分裂解,12000 rpm离心10 min后吸取上清,加入等体积的2
×
loading buffer,沸水中煮15 min后sds-page电泳检测atg5-atg12共轭水平。
[0031]
二、免疫组化分析1. 脱蜡。将组织芯片在60℃烘箱中中放置60 min,使组织与载玻片紧密贴合,以免脱片;而后分别用二甲苯ⅰ、ⅱ、ⅲ各浸泡10 min,共30 min。
[0032]
2. 水化。将切片分别浸入无水酒精ⅰ、ⅱ各5 min,然后分别按顺序在95%、90%、80%、70%的乙醇中浸泡5 min。
[0033]
3. pbs浸洗2次,每次5 min。
[0034]
4. 阻断。用3% 浓度的双氧水孵育10 min,以阻断内源性过氧化物酶的活性。
[0035]
5. pbs浸洗2次,每次5 min。
[0036]
6. 抗原修复。将片子浸入0.01 m枸橼酸缓冲液(ph 6.0)中,用高压锅煮沸15-20 min,自然冷却20 min后,用冷水浸泡缸子,加速缓冲液冷却至室温。
[0037]
7. pbs冲洗3次,每次5 min。
[0038]
8. 封闭。滴加山羊血清封闭液,室温孵育30 min,用滤纸吸去多余的液体。
[0039]
9. 一抗孵育。滴加需要检测的配置好的一抗50μl (atg12, ab155589),4℃过夜,第二天取出来后在37℃复温45 min。
[0040]
10. pbs浸洗2次,每次5 min。
[0041]
11. 二抗孵育。滴加含辣根过氧化物酶标记的二抗40~50μl,室温静置1h;12. pbs冲洗2-3次,每次5 min。
[0042]
13. 滴加sp液,室温孵育30 min。
[0043]
14. pbs浸洗2次,每次5 min。
[0044]
15. dab显色。dab显色(显色时间依具体情况而定,在显微镜下观察掌握染色程度,避免背景颜色过深)。
[0045]
16. 终止。显色结束后,立即用自来水冲洗10 min,终止显色反应。
[0046]
17. 复染。苏木素复染2 min,而后用盐酸酒精分化。
[0047]
18. 自来水冲洗10 min。
[0048]
19. 按常规步骤脱水、透明、封片。
[0049]
为进一步证实p53在体内抑制细胞自噬,将gfp-lc3转基因小鼠与p53 ko小鼠进行杂交构建gfp-lc3
/
;p53
/
与gfp-lc3
/
;p53-/-小鼠模型用以研究p53对细胞自噬的作用。利用小鼠的胚胎成纤维细胞进行实验,发现不论是通过饥饿诱导细胞自噬发生,还是加入细胞自噬阻断剂chloroquine,在小鼠体内敲除p53基因后细胞自噬水平均显著升高(图10、图11)。此外,在组织水平上,取出生后饥饿0 hrs、6 hrs、12 hrs、18 hrs、24 hrs的gfp-lc3
min;5. 吸掉dapi液,加入1 ml pbs
‑ꢀ
glycerol(按1:1体积比配置)没过细胞,上机(nikon a1r si storm)拍摄分析。
[0052]
小鼠组织lc3荧光检测需要对小鼠进行不同时间饥饿处理后取组织样检测,具体实施步骤为:1. gfp-lc3
/
;p53
/-小鼠自交后怀孕的母鼠在第18天注射孕酮(sigma, v900699)阻止其自然分娩,24小时后通过剖腹产获取同一时间出生的小鼠。获取小鼠后,卵黄囊用于基因型鉴定,小鼠于30℃温箱条件下进行饥饿诱导细胞自噬发生;2. 用4% 多聚甲醛(paraformaldehyde, pfa)对饥饿0 hrs、6 hrs、12 hrs、18 hrs、24 hrs 后gfp-lc3
/
;p53
/
与gfp-lc3
/
;p53-/-小鼠进行进行灌注,取小鼠肝脏组织进行冰冻切片(切片厚度为6μm)处理;3. 实验时将冰冻切片从-80℃中取出,于室温条件下复温,pbs浸洗2次每次10 min;4. 吸干pbs洗液,加入1 ml 4%多聚甲醛(paraformaldehyde, pfa)室温固定20 min;5. 弃去多聚甲醛,pbs洗2次,gfp-lc3
/
;p53
/
与gfp-lc3
/
;p53-/-组织细胞中lc3蛋白自带绿色荧光标签,因此不用孵育一抗以及二抗,直接加入dapi染核液,室温静置15 min;6. 吸掉dapi液,加入2 μl 防荧光淬灭封片剂,盖上盖玻片,晾干后上机(nikon a1r si storm)拍摄分析。
[0053]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
