作为kif18a抑制剂的吡啶衍生物
1.本发明涉及药物试剂领域,更具体地,涉及用于调节kif18a的化合物和组合物以及用于管理细胞增殖和治疗癌症的用途和方法。
背景技术:
2.癌症是折磨人类最普遍的疾病之一,并且是世界范围内的主要死亡原因。在努力寻找针对许多不同癌症中的一种或更多种的有效治疗或治愈中,在过去的几十年中,许多小组已经投入大量的时间、精力和财力。然而,迄今为止,在可用的癌症治疗和疗法中,只有少数提供相当程度的成功。
3.癌症的特征通常在于不受调节的细胞增殖。对细胞途径负责的一个或更多个基因(通过细胞周期和中心体循环控制增殖的进展)的损坏可以引起细胞增殖的正常调节丧失。这些失调的基因可以编码各种肿瘤抑制物或癌基因蛋白,它们参与一系列事件,导致未经检查的细胞周期进展和细胞增殖。各种激酶和驱动蛋白已经被鉴定在正常分裂的细胞和癌细胞的细胞周期和有丝分裂调节和进展中起关键作用。
4.驱动蛋白是在细胞分裂和细胞内囊泡和细胞器运输中起重要作用的分子马达。有丝分裂驱动蛋白在纺锤体组件、染色体分离、中心体分离和动力学的多个方面起作用(在o.rath和f.kozielski,nature review cancer[自然癌症综述],12:527-39,2012中评述的)。基于所谓的“马达结构域”内的序列同源性,人驱动蛋白被分类为14个亚家族,该结构域atp酶活性驱动沿着微管(mt)单向运动。这些蛋白质的非马达结构域负责货物附接;“货物”可以包括各种不同的膜状细胞器、信号转导支架系统和染色体中的任何一种。驱动蛋白使用atp水解能量来沿着极化微管移动货物。因此,驱动蛋白通常被称为“正端”或“负端”定向马达。
[0005]
kif18a基因属于驱动蛋白-8亚家族并且是一个正端定向马达。kif18a被认为影响着丝粒微管的正端的动力学以控制正确的染色体定位和纺锤体张力。人kif18a的耗尽在hela宫颈癌细胞中导致更长的纺锤体,在中期增加的染色体振荡(chromosome oscillation)以及有丝分裂纺锤体组装检查点的激活(mi mayr等人,current biology[当代生物学]17,488-98,2007)。kif18a似乎是癌症治疗的可行靶标。kif18a在多种类型的癌症中过表达,包括但不限于结肠癌、乳腺癌、肺癌、胰腺癌、前列腺癌、膀胱癌、头癌、颈癌、子宫颈癌和卵巢癌。此外,在癌细胞系中,基因缺失或敲除或者kif18a抑制影响有丝分裂纺锤体装置。特别地,已发现抑制kif18a来诱导有丝分裂细胞停滞,这是一种已知的弱点,其可以通过凋亡、有丝分裂灾变或多相驱动致死性或分裂间期中有丝分裂滑脱后的死亡来促进有丝分裂细胞死亡。因此,对寻找kif18a蛋白的抑制剂存在着强烈的兴趣。
[0006]
因此,kif18a atp酶活性的抑制是一种有前途的开发新的抗癌剂的方法。
技术实现要素:
[0007]
本发明的一个方面是一类新的化合物,所述化合物单独地或与微管形成结合复合物来调节kif18a蛋白,用以治疗kif18a介导的病症和/或疾病,包括癌症、炎症或纤毛病理
学。
[0008]
本发明提供的化合物具有基于mt的kif18a调节活性,特别地,具有kif18a抑制活性。为此,本发明还提供了这些化合物及其药学上可接受的盐在制备和制造用于治疗性、预防性、急性或慢性治疗kif18a介导的疾病和障碍(包括但不限于癌症)的药物组合物或药物中的用途。因此,本发明的化合物可用于制造抗癌药物。本发明还提供了用于制备式i化合物的方法,以及在此类方法中可用的中间体。
[0009]
在实施例1中,本发明提供了一种式(i)化合物:
[0010][0011]
或其任何药学上可接受的盐,其中:
[0012]
x1为n或-cr3;
[0013]
x2为n或-cr4;
[0014]
x3为n或-cr1;
[0015]
其中x1、x2和x3中只有一个是n;
[0016]
r1为基团-z-r
12
;其中z不存在、为-c
0-4
烷基-nr
11-c
0-4
烷基-、-c
0-4
烷基-(c=o)-、-c
0-4
烷基-(c=o)nr
11-、-c-((c=o)-o-r
11
)
2-、-c
0-4
烷基-(c=o)-o-、-c
0-4
烷基-o-、-c
0-4
烷基-nr
11
(c=o)-、-c
0-4
烷基-nr
11
so
2-c
0-4
烷基-、-c
0-4
烷基-s-、-c
0-4
烷基-s(=o)-、-c
0-4
烷基-so
2-、-nr
11-c
0-4
烷基-o-、-c
0-4
烷基-s(=o)(=n
(ch3)2)-、-c=n(oh)-、或-n=s(=o)《,
[0017]
r2为基团-y-r
13
,其中y不存在、为-c
0-4
烷基-s-c
0-4
烷基-、-c
0-4
烷基-s=o-c
0-4
烷基-、-c
0-4
烷基-so
2-c
0-4
烷基、-so2nr
13c-c
0-4
烷基-、-so2n(c
1-4
烷基)-、-so2n(c
1-4
烷基-o-c
1-4
烷基)-、-c
0-4
烷基-s(=o)(=nh)-、-c
0-4
烷基-(c=o)-、-c
0-4
烷基-(c=o)-o-、-c
0-4
烷基-(c=o)nr
13c-、-nr
13c-、-o-c
0-4
烷基-、-n=s(=o)《、或-nr
13c-so
2-c
0-4
烷基-;
[0018]
r3为h、卤基、c
1-4
烷基、或c
1-4
卤代烷基;
[0019]
r4为h、卤基、c
1-8
烷基、或c
1-4
卤代烷基;
[0020]
r5为h、卤基、c
1-8
烷基、或c
1-4
卤代烷基;
[0021]
r6为h、卤基、cn、c
1-8
烷基、-o-c
1-8
烷基、c
0-4
烷基-(c=o)-nh-c
0-4
烷基、c
1-4
卤代烷基、-c
0-4
烷基-so2nh-c
0-4
烷基、-c
0-4
烷基-so2n(ch3)-c
0-4
烷基、或r
6a
;
[0022]
r7为h、卤基、cn、c
1-8
烷基、c
1-4
卤代烷基、-o-c
1-8
烷基、或r
7a
;
[0023]
或者可替代地,r2和r7可以与它们各自附接的碳原子组合形成与苯环稠合的饱和的、部分饱和的、不饱和的5元或6元单环;其中所述3元、4元、5元、6元单环含有0、1、2或3个n原子和0或1个选自o和s的原子,并且进一步地,其中所述5元或6元单环被选自以下的0、1、2或3个基团取代:f、cl、br、c
1-6
烷基、c
1-4
卤代烷基、-ora、-oc
1-4
卤代烷基、cn、-nrara、或氧代;
[0024]r6a
和r
7a
各自在每种情况下独立地选自由以下组成的组:含有0、1、2或3个n原子和0或1个选自o和s的原子的饱和的、部分饱和的或不饱和的3元、4元、5元、6元或7元单环或者
6元、7元、8元、9元、10元、11元或12元双环,其被选自以下的0、1、2或3个基团取代:f、cl、br、cn、c
1-6
烷基、c
1-4
卤代烷基、-oc
1-4
卤代烷基、-c(=o)rb、-c
0-6
烷基-c(=o)nrara、-c(=nra)nrara、-oc(=o)rb、-oc(=o)nrara、-oc
2-6
烷基nrara、-oc
2-6
烷基ora、-sra、-s(=o)rb、-s(=o)2rb、-s(=o)2nrara、-n(ra)c(=o)ra、-n(ra)c(=o)orb、-n(ra)c(=o)nrara、-n(ra)c(=nra)nrara、-n(ra)s(=o)2rb、-n(ra)s(=o)2nrara、-nrac
1-6
烷基nrara、-nrac
1-6
烷基ora、-c
0-6
烷基nrara、-c
0-6
烷基ora、-c
1-6
烷基n(ra)c(=o)rb、-c
1-6
烷基oc(=o)rb、-c
0-6
烷基c(=o)ora、和氧代;
[0025]
r8为h、卤基、c
1-4
烷基、或c
1-4
卤代烷基;
[0026]
l为-(c=o)-nr
10-或-nr
10-(c=o)-;
[0027]
r9为h、卤基、c
1-8
烷基、或c
1-4
卤代烷基;
[0028]r10
为h或c
1-4
烷基;
[0029]rx
选自h、选自h、
[0030]rxa
、r
xb
、r
xc
、r
xd
、r
xe
、r
xf
、r
xg
、r
xh
、r
xi
、r
xj
、r
xk
和r
xl
中的每一个为h、卤基、r
xm
、或r
xn
;
[0031]
或者可替代地,r
xa
和r
xb
对、r
xc
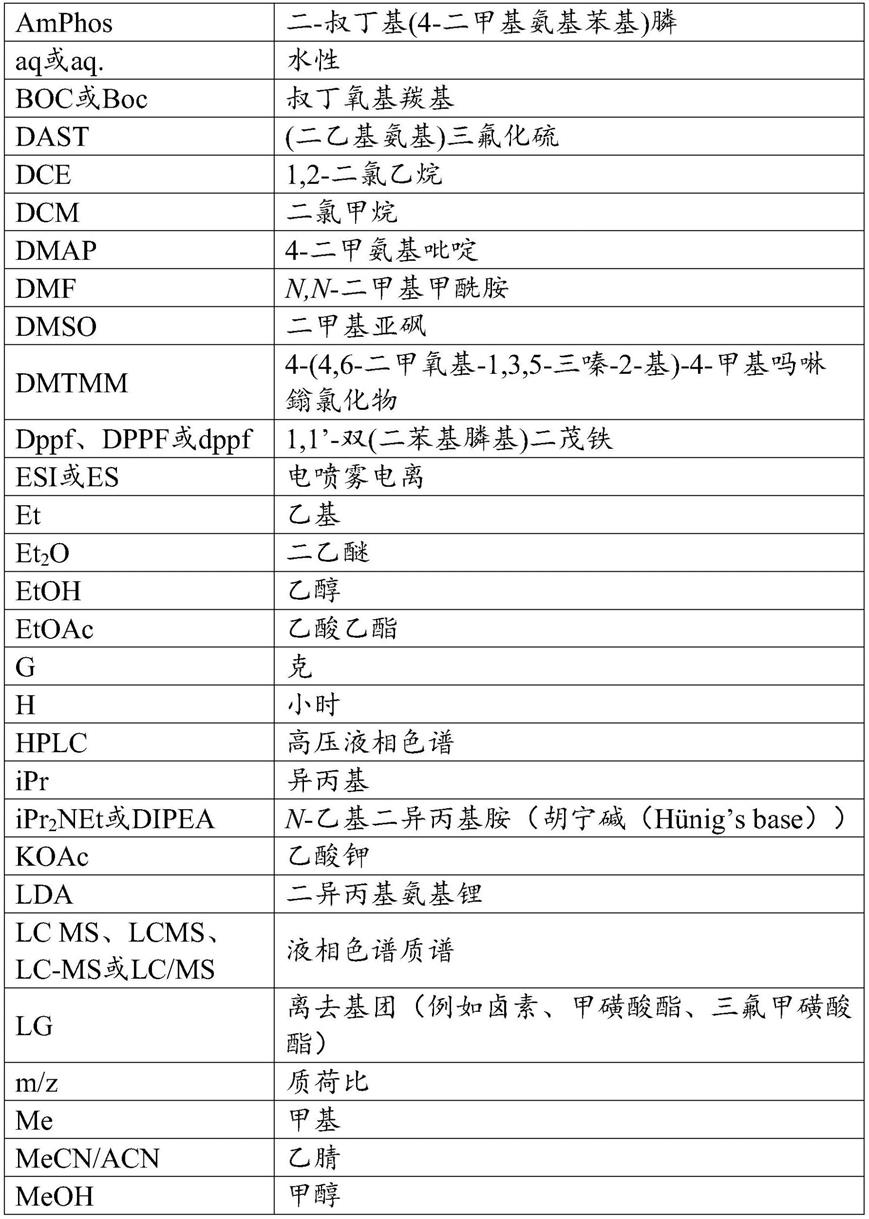
和r
xd
对、r
xe
和r
xf
对、r
xg
和r
xh
对、r
xi
和r
xj
对、以及r
xk
和r
xl
对中的每一个可以独立地与它们各自附接的碳原子组合以形成螺接到氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基或氮杂环庚烷基环的饱和的或部分饱和的3元、4元、5元、6元单环;其中所述3元、4元、5元、6元单环含有0个n、o和s原子,并且进一步地,其中所述3元、4元、5元、6元单环被选自以下的0、1、2或3个基团取代:f、cl、br、c
1-6
烷基、c
1-4
卤代烷基、-ora、-oc
1-4
卤代烷基、cn、-nrara、或氧代;
[0032]
或者又可替代地,r
xa
和r
xb
对、r
xc
和r
xd
对、r
xe
和r
xf
对、r
xg
和r
xh
对、r
xi
和r
xj
对、以及r
xk
和r
xl
对中的每一个可以独立地组合形成双键;
[0033]
当r
xa
、r
xb
、r
xc
、r
xd
、r
xe
、r
xf
、r
xg
、r
xh
、r
xi
、r
xj
、r
xk
和r
xl
均为h时,则基团z-r
12
为-nr
11-r
12
并且基团-y-r
13
为c
0-4
烷基-s(=o)
2-r
13
或-so2nr
13c-c
0-4
烷基-r
13
;
[0034]
当l为-nr
10-(c=o)-并且x1为n时;或当l为-(c=o)-nr
10-并且x2为n时;则r
x
为
其中可替代地,r
xa
和r
xb
中的每一个可以与它们各自附接的碳原子组合形成螺接到哌啶基环的环丙基、环丁基或环戊基环;
[0035]r11
和r
13c
各自独立地为h或c
1-8
烷基;
[0036]r12
为h、卤基、cn、-oh、r
12a
、或r
12b
;
[0037]r13
为h、卤基、cn、r
13a
或r
13b
;
[0038]rxm
和r
12a
和r
13a
中的每一个在每种情况下独立地选自由以下组成的组:含有0、1、2或3个n原子和0或1个选自o和s的原子的饱和的、部分饱和的或不饱和的3元、4元、5元、6元或7元单环或者5元、6元、7元、8元、9元、10元、11元或12元双环,其被选自以下的0、1、2、3或4个基团取代:f、cl、br、c
1-6
烷基、c
1-4
卤代烷基、-ora、-oc
1-4
卤代烷基、cn、-c(=o)rb、-c(=o)ora、-c(=o)nrara、-c(=nra)nrara、-oc(=o)rb、-oc(=o)nrara、-oc
2-6
烷基nrara、-oc
2-6
烷基ora、-sra、-s(=o)rb、-s(=o)2rb、-s(=o)2nrara、-nrara、-n(ra)c(=o)rb、-n(ra)c(=o)orb、-n(ra)c(=o)nrara、-n(ra)c(=nra)nrara、-n(ra)s(=o)2rb、-n(ra)s(=o)2nrara、-nrac
2-6
烷基nrara、-nrac
2-6
烷基ora、-c
1-6
烷基nrara、-c
1-6
烷基ora、-c
1-6
烷基n(ra)c(=o)rb、-c
1-6
烷基oc(=o)rb、-c
1-6
烷基c(=o)nrara、-c
1-6
烷基c(=o)ora、氧代、或饱和的、部分饱和的或不饱和的3元、4元或5元单环;
[0039]rxn
、r
12b
和r
13b
中的每一个在每种情况下独立地选自由以下组成的组:被选自f、cl、br、-ch2f、-chf2、-cf3、-c(=o)ora、-c
0-6
烷基ora、-oc
1-4
卤代烷基、cn、nh2、nh(ch3)、n(ch3)2、-(c=o)nra、-nra(c=o)c
0-4
烷基、-s(=o)2ra、或饱和的、部分饱和的或不饱和的3元、4元或5元单环的0、1、2、3、4或5个基团取代的c
1-6
烷基;
[0040]
ra在每种情况下独立地为h或rb;并且
[0041]
rb在每种情况下独立地为c
1-6
烷基、苯基或苄基,其中所述c
1-6
烷基被选自以下的0、1、2或3个取代基取代:卤基、-oh、-oc
1-4
烷基、-nh2、-nhc
1-4
烷基、-oc(=o)c
1-4
烷基、或-n(c
1-4
烷基)c
1-4
烷基;并且所述苯基或苄基被选自以下的0、1、2或3个取代基取代:卤基、c
1-4
烷基、c
1-3
卤代烷基、-oh、-oc
1-4
烷基、-nh2、-nhc
1-4
烷基、-oc(=o)c
1-4
烷基、或-n(c
1-4
烷基)c
1-4
烷基。
[0042]
在实施例2中,本发明提供了化合物,其中r
x
选自h、
[0043]
其中r
xa
、r
xb
、r
xc
、和r
xd
中的每一个为h、卤基、r
xm
、或r
xn
;
[0044]
或者可替代地,r
xa
和r
xb
对、以及r
xc
和r
xd
对中的每一个可以独立地与它们各自附接的碳原子组合以形成螺接到吡咯烷基、哌啶基、或吗啉基环的饱和的或部分饱和的3元、4元、5元、6元单环;其中所述3元、4元、5元、6元单环含有0个n、o和s原子,并且进一步地,其中所述3元、4元、5元、6元单环被选自以下的0、1、2或3个基团取代:f、cl、br、c
1-6
烷基、c
1-4
卤代烷基、-ora、-oc
1-4
卤代烷基、cn、-nrara、或氧代;
[0045]
或者又可替代地,r
xa
和r
xb
对或r
xc
和r
xd
对中的每一个可以独立地组合形成双键。
[0046]
在实施例3中,本发明提供了化合物,其中r
x
为
[0047]
在实施例4中,本发明提供了化合物,其中r
x
为
[0048]
在实施例5中,本发明提供了化合物,其中r
x
为
[0049]
在实施例6中,本发明提供了化合物,其中r
xa
、r
xb
、r
xc
、和r
xd
中的每一个选自:
[0050]
a)h、f、cl、甲基、乙基、丙基、异丙基、-ch2f、-chf2、-cf3或环丙基;或者
[0051]
b)可替代地,r
xa
和r
xb
对、以及r
xc
和r
xd
对中的每一个可以独立地与它们各自附接的碳原子组合以形成环丙基环、环丁基环或环戊基环,其中每个环螺接至吡咯烷基、哌啶基或吗啉基环;并且其中每个所述环被选自以下的0、1、2或3个基团取代:f、cl、br、c
1-6
烷基、c
1-4
卤代烷基或甲氧基;或者
[0052]
c)可替代地,r
xa
和r
xb
对或r
xc
和r
xd
对中的每一个可以独立地组合形成》c=ch或》c=ch-ch3;并且
[0053]
其中r
xe
、r
xf
、r
xg
、r
xh
、r
xi
、r
xj
、r
xk
和r
xl
中的每一个为h、f、或甲基。
[0054]
在实施例7中,本发明提供了化合物,其中l为-nr
10-(c=o)-。
[0055]
在实施例8中,本发明提供了化合物,其中l为-(c=o)-nr
10-。
[0056]
在实施例9中,本发明提供了化合物,其中l为-nr
10-(c=o);x1为-cr4;x2为n;并且x3为-cr1;具有式(ia):
[0057]
在子实施例9a中,本发明提供了具有式(ia-1)的化合物:
[0058][0059]
在实施例10中,本发明提供了化合物,其中l为-(c=o)-nr
10-;x1为-cr4;x2为n;并且x3为-cr1;具有式(ib):
[0060][0061]
在子实施例10a中,本发明提供了具有式(ib-1)的化合物:
[0062][0063]
在实施例11中,本发明提供了化合物,其中l为-nr
10-(c=o);x1为-n;x2为-cr3;并且x3为-cr1;具有式(ic):
[0064][0065]
在子实施例11a中,本发明提供了具有式(ic-1)的化合物:
[0066][0067]
在实施例12中,本发明提供了化合物,其中l为-(c=o)-nr
10-;x1为-n;x2为-cr3;并且x3为-cr1;具有式(id):
[0068][0069]
在子实施例12a中,本发明提供了具有式(id-1)的化合物:
[0070][0071]
在实施例13中,本发明提供了化合物,其中l为-nr
10-(c=o);x1为-cr4;x2为-cr3;并且x3为n;具有式(ie):
[0072][0073]
在实施例14中,本发明提供了化合物,其中l为-(c=o)-nr
10-;x1为-cr4;x2为-cr3;并且x3为n;具有式(if):
och3、-nh2、-nh(ch3)、氧代、环丙基或环丁基;或者
[0092]
c)r
13b
选自被选自f、cl、br、-oh、-cf3、环丙基或环丁基的0、1、2、3、4或5个基团取代的c
1-6
烷基。
[0093]
在实施例24中,本发明提供了化合物,其中r
13a
选自:环丙基、环丁基、环戊基、环己基、咪唑基、咪唑烷基、噁唑基、苯基、吡咯烷基、吡唑基、吗啉基、硫代吗啉基、哌啶基、氮杂环丁烷基、呋喃基、四氢呋喃基、四氢吡喃基、噻唑基、噁二唑基、四唑基、吡啶基、
[0094]
其各自独立地被选自以下的0、1、2或3个基团取代:f、cl、甲基、乙基、异丙基、chf2、cf3、ch2cf3、-och3、-ch2ch2och3、或氧代。
[0095]
在实施例25中,本发明提供了化合物,其中r
13b
选自:甲基、乙基、异丙基、异丁基、叔丁基或新戊基,其各自独立地被选自以下的0、1、2或3个基团取代:f、cf3、oh、或环丙基。
[0096]
在实施例26中,本发明提供了化合物,其中r2为基团-y-r
13
,其中y不存在、为-so
2-、或-so2nh-;并且r
13
为叔丁基,或r
13a
选自环丙基、环丁基、环戊基、吗啉基或哌啶基,其中每个所述r
13a
被选自以下的0、1、2或3个基团取代:f、cl、br、甲基、或cf3。
[0097]
在实施例27中,本发明提供了化合物,其中r2为基团-y-r
13
,其中y为-so
2-,并且r
13
为环丙基、环丁基、环戊基、吗啉基或哌啶基,其各自被0、1、2或3个甲基基团取代。
[0098]
在实施例28中,本发明提供了化合物,其中r3为h、f或甲基。
[0099]
在实施例29中,本发明提供了化合物,其中r4为h、f、cl、环丙基、-(c=o)ch3或cf3。
[0100]
在实施例30中,本发明提供了化合物,其中r4为h。
[0101]
在实施例31中,本发明提供了化合物,其中r5为h。
[0102]
在实施例32中,本发明提供了化合物,其中r6为h、f、br、甲基、cn、甲氧基、环丙基、-(c=o)nh2、-cf3、呋喃基、吡啶基、吗啉基,或-so2nhc(ch3)3。
[0103]
在实施例33中,本发明提供了化合物,其中r6为h或f。
[0104]
在实施例34中,本发明提供了化合物,其中r7为h、f、br、cl、cn、甲基、甲氧基、环丙基,或r2和r7可以与它们各自附接的碳原子组合以形成基团:
[0105]
在实施例35中,本发明提供了化合物,其中r7为h、f或甲基。
[0106]
在实施例36中,本发明提供了化合物,其中r8为h、f或甲基。
[0107]
在实施例37中,本发明提供了化合物,其中r8为h。
[0108]
在实施例38中,本发明提供了化合物,其中r9为h。
[0109]
在实施例39中,本发明提供了化合物,其中r
10
为h。
[0110]
在实施例40中,本发明提供了化合物或其任何药学上可接受的盐,选自:
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122][0123]
在实施例41中,本发明提供了化合物或其任何药学上可接受的盐,选自:
[0124]
[0125]
[0126]
[0127]
kif18a/pathology;(2)nagahara,m.等人,“kinesin 18a expression:clinical relevance to colorectal cancer progression[驱动蛋白18a表达:与大肠癌进展的临床相关性]”,int.j.cancer[国际癌症]:129,2543-2552(2011)vc 2011uic;和(3)yu,y.等人,“the role of kinesin family proteins in tumorigenesis and progression-potential biomarkers and molecular targets for cancer therapy[驱动蛋白家族蛋白在肿瘤发生和发展中的作用-潜在的生物标志物和分子靶标的癌症治疗]”,cancer[癌症]2010;116:5150-60。vc 2010american cancer society[美国癌症协会]。
[0136]
在实施例45中,本发明提供了一种用于在受试者中减小实体瘤大小的方法,所述方法包括向有需要的受试者施用治疗有效量的根据实施例1-41的化合物或根据实施例42的组合物。
[0137]
在实施例46中,本发明提供了一种用于在受试者中治疗细胞增殖障碍的方法,所述方法包括向有需要的受试者施用治疗有效量的根据实施例1-41的化合物或根据实施例42的组合物。
[0138]
在实施例47中,本发明提供了一种用于在细胞中抑制kif18a的方法,所述方法包括使所述细胞与根据实施例1-41的化合物或其药学上可接受的盐或根据实施例42的组合物接触。
[0139]
本发明的又另一个方面是制备一类新的化合物或其药学上可接受的盐的方法,可用于单独地或与微管形成结合复合物来调节kif18a蛋白。
[0140]
在实施例48中,本发明提供了一种用于制备如本文所述的式(i)化合物的方法。
[0141]
在实施例49中,本发明提供了一种在制备如本文所述的式(i)化合物的方法中使用的中间体化合物。
具体实施方式
[0142]
本发明包括本发明的所有药学上可接受的同位素标记的化合物,其中一个或多个原子被具有相同原子数但原子质量或质量数不同于自然界通常发现的原子质量或质量数的原子替代。
[0143]
适用于包含在本发明的化合物中的同位素的实例包括但不限于,氢的同位素,例如2h和3h;碳的同位素,例如
11
c、
13
c和
14
c;氯的同位素,例如
38
cl;氟的同位素,例如
18
f;碘的同位素,例如
123
i和
125
i;氮的同位素,例如
13
n和
15
n;氧的同位素,例如
15
o、
17
o和
18
o;磷的同位素,例如
32
p和硫的同位素,例如
35
s。
[0144]
本发明的某些同位素标记的化合物,例如并入放射性同位素的化合物可用于药物和/或底物组织分布研究中。鉴于易于掺入以及即用的检测方式,放射性同位素氚(即3h)和碳-14(即
14
c)尤其可用于这个目的。
[0145]
用较重同位素(例如氘,即2h)取代可以提供源自较高代谢稳定性的某些治疗优势(例如,延长的体内半衰期或降低的剂量要求),并且因此在一些情况下是优选的。
[0146]
用正电子发射同位素,诸如
11
c、
18
f、
15
o及
13
n取代可用于正电子发射断层扫描(pet)研究中以检查底物受体占有率。
[0147]
本发明的同位素标记的化合物一般可以通过本领域技术人员已知的常规技术,或通过所附实例及制备中所描述的方法类似的方法,使用适当同位素标记的试剂代替先前采
用的未标记的试剂来制备。
[0148]
根据本发明的药学上可接受的溶剂合物包括其中结晶溶剂可经同位素取代的那些,例如d2o、d
6-丙酮、d
6-dmso。
[0149]
本发明的特定实施例包括以下实例中示例的化合物以及它们的药学上可接受的盐、复合物、溶剂化物、多晶型物、立体异构体、代谢物、前药及其其他衍生物。
[0150]
除非另有说明,以下定义适用于本说明书和权利要求书中出现的术语:
[0151]“c
α-β
烷基”意指在支链或线性关系或这三者的任意组合中包含最小α个和最大β个碳原子的烷基,其中α和β表示整数。在该部分中描述的烷基还可以含有一个或两个双键或三键。名称c0烷基指示直接键。c
1-6
烷基的实例包括但不限于以下:
[0152][0153]
单独或以组合的“苯并基团”意指二价基团c4h4=,其中一个表示是-ch=ch-ch=ch-,当邻位附接到另一环时形成苯状环——例如四氢萘、吲哚等。
[0154]
术语“氧代”和“硫代”分别表示=o(如羰基)和=s(如硫代羰基)。
[0155]“卤代”或“卤素”意指选自f、cl、br和i的卤素原子。
[0156]“c
α-β
卤代烷基”意指如上所述的烷基,其中,任意数量(至少一个)的附接到烷基链的氢原子被f、cl、br或i替代。
[0157]
n(ra)ra基团等包括其中两个ra基团一起形成环(任选地包含n、o或s原子)的取代基,并且包括以下基团,例如:
[0158][0159]
基团n(c
α-β
烷基)c
α-β
烷基(其中α和β是如上文定义的)包括其中两个c
α-β
烷基基因一起形成环(任选地包含n、o或s原子)的取代基,并且包括以下基团,例如:
[0160][0161]“双环”意指具有两个连接环的基团。双环可以为碳环(所有环原子为碳原子)或杂环(除了碳原子之外,环原子包括例如1、2或3个杂原子,例如n、o或s)。这两个环可以都是脂肪族的(例如萘烷和降冰片烷),或可以是芳香族(例如萘),或脂肪族和芳香族的组合(例如四氢化萘)。
[0162]
双环包括:
[0163]
(a)螺环化合物,其中两个环只共享一个单原子(螺原子,其通常为季碳)。螺环化合物的实例包括但不限于:
[0164]
[0165]
(b)稠合的双环化合物,其中两个环共享两个相邻原子。换句话说,环共享一个共价键,即桥头原子直接连接(例如α-崖柏烯和萘烷)。稠合的双环的实例包括但不限于:
[0166][0167][0168]
以及
[0169]
(c)桥联的双环化合物,其中两个环共享三个或更多个原子,通过包含至少一个原子的桥将两个桥头原子隔开。例如,降冰片烷,也称为双环[2.2.1]庚烷,可以被认为是一对环戊烷环,每个环共享它们的五个碳原子中的三个。桥联的双环的实例包括但不限于:
[0170][0171]
除非另有说明,“碳环”或“碳环的”意指本身或与其他术语组合包含的环,表示“c
α-β
烷基”的环状形式。碳环的实例包括环戊基、环己基、1-环己烯基、3-环己烯基、环庚基、亚环丁基、亚环己基等。
[0172]“杂环”或“杂环的”意指包含至少一个碳原子和至少一个选自n、o和s的其他原子的环。可在权利要求书中出现的杂环的实例包括但不限于以下:
[0173]
[0174][0175]“药学上可接受的盐”意指通过常规方式制备的盐,并且是本领域技术人员众所周知的。“药学上可接受的盐”包括无机和有机酸的碱性盐,所述无机和有机酸包括但不限于盐酸、氢溴酸、硫酸、磷酸、甲磺酸、乙磺酸、苹果酸、乙酸、草酸、酒石酸、柠檬酸、乳酸、富马酸、琥珀酸、马来酸、水杨酸、苯甲酸、苯乙酸、扁桃酸等。当本发明的化合物包含酸性官能团如羧基时,然后羧基的合适的药学上可接受的阳离子对是本领域技术人员众所周知的,并且包括碱金属、碱土金属、铵、季铵阳离子等。对于另外的“药学上可接受的盐”的实例,参见下文和berge等人,j.pharm.sci.[药学科学期刊]66:1(1977)。
[0176]“饱和的、部分饱和的或不饱和的”包括被氢饱和的取代基、完全被氢不饱和的取代基和部分被氢饱和的取代基。
[0177]“离去基团”通常是指容易被亲核试剂置换的基团,例如胺、硫醇或醇亲核试剂。此类离去基团是本领域众所周知的。此类离去基团的实例包括但不限于n-羟基琥珀酰亚胺、n-羟基苯并三唑、卤化物、三氟甲磺酸酯、甲苯磺酸酯等。优选的离去基团在适当时在本文中指出。
[0178]“保护基团”通常是指本领域众所周知的基团,其用于防止所选反应性基团例如羧基、氨基、羟基、巯基等发生不期望的反应,例如亲核、亲电、氧化、还原等。优选的保护基团在适当时在本文中指出。氨基保护基团的实例包括但不限于芳烷基、经取代的芳烷基、环烯基烷基和经取代的环烯烷基、烯丙基、经取代的烯丙基、酰基、烷氧基羰基、芳烷氧基羰基、
甲硅烷基等。芳烷基的实例包括但不限于苄基、邻-甲基苄基、三苯甲基和二苯甲基,其可以任选地被卤素、烷基、烷氧基、羟基、硝基、酰基氨基、酰基等以及盐(如磷盐和铵盐)取代。芳基的实例包括苯基、萘基、茚满基、蒽基、9-(9-苯基芴基)、菲基、杜烯基等。环烯基烷基或经取代的环烯基烷基基团的实例优选地具有6至10个碳原子,包括但不限于环己烯基甲基等。合适的酰基、烷氧基羰基和芳烷氧基羰基包括苄氧基羰基、叔丁氧基羰基、异丁氧羰基、苯甲酰基、经取代的苯甲酰基、丁酰基、乙酰基、三氟乙酰基、三氯乙酰基、邻苯二甲酰基等。保护基团的混合物可以用于保护同一氨基,如伯氨基可以被芳烷基和芳烷氧羰基二者保护。氨基保护基团还可以与它们所附接的氮形成杂环,例如,1,2-双(亚甲基)苯、邻苯二甲酰亚胺基、琥珀酰亚胺基、马来酰亚胺基等,并且其中这些杂环基团可以进一步包含邻接的芳基和环烷基环。此外,杂环基团可以是单-、二-或三-取代的,如硝基邻苯二甲酰亚胺基。氨基也可以通过形成加成盐(如盐酸盐、对甲苯磺酸、三氟乙酸等)防止不希望的反应,如氧化。许多氨基保护基团也适用于保护羧基、羟基和巯基。例如,芳烷基。烷基也是适用于保护羟基和巯基的基团,如叔丁基。
[0179]
甲硅烷基保护基团是任选地被一个或更多个烷基、芳基和芳烷基取代的硅原子。合适的甲硅烷基保护基团包括但不限于三甲基甲硅烷基、三乙基甲硅烷基、三异丙基甲硅烷基、叔丁基二甲基甲硅烷基、二甲基苯基甲硅烷基、1,2-双(二甲基甲硅烷基)苯、1,2-双(二甲基甲硅烷基)乙烷和二苯基甲基甲硅烷基。氨基的甲硅烷基化提供了单-或二-甲硅烷基氨基。氨基醇化合物的甲硅烷基化可以导致n,n,o-三甲硅烷基衍生物。从甲硅烷基醚官能除去甲硅烷基官能容易通过用例如金属氢氧化物或氟化铵试剂的处理来完成,其作为单独的反应步骤或在与醇基团反应期间原位进行。合适的甲硅烷基化剂为例如三甲基甲硅烷基氯化物、叔丁基-二甲基甲硅烷基氯化物、苯基二甲基甲硅烷基氯化物、二苯基甲基甲硅烷基氯化物或其与咪唑或dmf的组合产物。用于胺的甲硅烷基化并除去甲硅烷基保护基团的方法是本领域技术人员众所周知的。用于从相应氨基酸、氨基酸酰胺或氨基酸酯制备这些胺衍生物的方法也是有机化学领域技术人员众所周知的,包括氨基酸/氨基酸酯或氨基醇化学。
[0180]
保护基团在不会影响分子剩余部分的条件下被除去。这些方法是本领域众所周知的,并且包括酸水解、氢解等。优选的方法涉及除去保护基团,例如通过利用在合适的溶剂系统(如醇、乙酸等或其混合物)中的钯碳氢解除去苄氧基羰基。叔丁氧基羰基保护基团可以利用在合适的溶剂系统(例如二噁烷或二氯甲烷)中的无机或有机酸(例如hcl或三氟乙酸)除去。所得的氨基盐可以容易地被中和以得到游离胺。羧基保护基团(例如甲基、乙基、苄基、叔丁基、4-甲氧基苯基甲基等)可以在本领域技术人员众所周知的水解和氢解条件下被除去。
[0181]
应注意,本发明的化合物可以含有可以互变异构形式存在的基团,例如环状和非环状的脒和胍基、经杂原子取代的杂芳基(y'=o、s、nr)等,其在以下实例中说明:
[0182][0183]
尽管本文命名、描述、显示和/或要求保护一种形式,但是所有互变异构形式都旨在固有地包括在此名称、描述、显示和/或要求保护中。
[0184]
本发明还考虑了本发明的化合物的前药。前药是活性或非活性化合物,其在将前药施用到患者后通过体内生理作用如水解、代谢等而被化学修饰成本发明化合物。涉及制备和使用前药的适用性和技术是本领域技术人员众所周知的。对于涉及酯的前药的一般性讨论,参见svensson和tunek,drug metabolism reviews[药物代谢综述]165(1988)和bundgaard,design of prodrugs[前药设计],elsevier(1985)。掩蔽的羧酸根阴离子的实例包括多种酯,如烷基(例如甲基、乙基)、环烷基(例如环己基)、芳烷基(例如苄基、对甲氧基苄基)和烷基羰基氧基烷基(例如新戊酰氧基甲基)。胺已被掩蔽为经芳基羰氧基甲基取代的衍生物,其在体内被酯酶裂解,释放出游离的药物和甲醛(bungaard j.med.chem.[药物化学杂志]2503(1989))。同样,含有酸性nh基团(如咪唑、酰亚胺、吲哚等)的药物已被n-酰氧基甲基掩蔽(bundgaard design of prodrugs[前药设计],elsevier(1985))。羟基已被掩蔽为酯和醚。ep 039,051(sloan和little,4/11/81)公开了曼尼希碱异羟肟酸前药、其制备和用途。
[0185]
本说明书和权利要求书包含使用“选自
……
和
……”
和“为
……
或
……”
语言的种类列表(有时称为马库什组)。当在本技术中使用该语言时,除非另有说明,否则意指包括该组作为整体,或其任何单个成员,或其任何子组。该语言的使用仅出于速记目的,并不意指以任何方式限制根据需要除去单个要素或子组。
[0186]
药物组合物、给药及施用途径
[0187]
本文还提供了药物组合物,这些药物组合物包含如本文所披露的化合物以及药学上可接受的赋形剂,例如稀释剂或载体。适用于本发明中的化合物及药物组合物包括可以按有效量施用该化合物以实现其预定目的的那些化合物及药物组合物。以下将更详细地描述该化合物的施用。
[0188]
适合药物配制品可以由技术人员根据施用途径及所需剂量决定。参见例如,remington’s pharmaceutical sciences[雷明顿药物科学],1435-712(第18版,宾夕法尼亚州伊斯顿市马克出版公司(mack publishing co),1990)。配制品可以影响所施用的药剂的物理状态、稳定性、或体内释放速率及体内清除速率。取决于施用途径,可以根据体重、体
表面积或器官大小来计算适合剂量。本领域普通技术人员在不进行过度实验的情况下,尤其根据本文所公开的剂量信息和测定以及可通过动物或人类临床试验获得的药物代谢动力学数据,以常规方式做出确定适当治疗剂量所需的计算的进一步精化。
[0189]
短语“药学上可接受的”或“药理学上可接受的”是指在施用至动物或人类时不产生不良反应、过敏反应或其他不利反应的分子实体和组合物。如本文所用,“药学上可接受”包括任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。此类赋形剂用于药学活性物质的使用是本领域所熟知的。除非任何常规介质或药剂与治疗组合物不相容,否则考虑将其用于治疗组合物中。还可以将补充性活性成分掺入组合物中。在示例性实施例中,配制品可以包含玉米糖浆固体、高油酸红花油、椰子油、大豆油、l-亮氨酸、磷酸三钙、l-酪氨酸、l-脯氨酸、乙酸l-赖氨酸、datem(乳化剂)、l-谷氨酰胺、l-缬氨酸、磷酸氢二钾、l-异亮氨酸、l-精氨酸、l-丙氨酸、甘氨酸、l-天冬酰胺一水合物、l-丝氨酸、柠檬酸钾、l-苏氨酸、柠檬酸钠、氯化镁、l-组氨酸、l-甲硫氨酸、抗坏血酸、碳酸钙、l-谷氨酸、l-胱氨酸二盐酸盐、l-色氨酸、l-天冬氨酸、氯化胆碱、牛磺酸、m-肌醇、硫酸亚铁、抗坏血酸棕榈酸酯、硫酸锌、l-肉碱、α-生育酚乙酸酯、氯化钠、烟酰胺、混合生育酚、泛酸钙、硫酸酮、氯化硫胺素盐酸盐、维生素a棕榈酸酯、硫酸锰、核黄素、盐酸吡哆辛、叶酸、β-胡萝卜素、碘化钾、叶绿醌、生物素、硒酸钠、氯化铬、钼酸钠、维生素d3和氰钴胺。
[0190]
化合物可以作为药学上可接受的盐存在于药物组合物中。如本文所用,“药学上可接受的盐”包括例如碱加成盐和酸加成盐。
[0191]
药学上可接受的碱加成盐可以用金属或胺(例如碱金属和碱土金属或有机胺)来形成。化合物的药学上可接受的盐也可以用药学上可接受的阳离子来制备。适合的药学上可接受的阳离子是本领域技术人员所熟知的并且包括碱金属阳离子、碱土金属阳离子、铵阳离子和季铵阳离子。碳酸盐或碳酸氢盐也是可能的。用作阳离子的金属的实例是钠、钾、镁、铵、钙或三价铁等。适合的胺的实例包括异丙胺、三甲胺、组氨酸、n,n'-二苄基乙二胺、氯普鲁卡因、胆碱、二乙醇胺、二环己胺、乙二胺、n-甲基葡糖胺和普鲁卡因。
[0192]
药学上可接受的酸加成盐包括无机酸盐或有机酸盐。适合的酸盐的实例包括盐酸盐、甲酸盐、乙酸盐、柠檬酸盐、水杨酸盐、硝酸盐、磷酸盐。其他适合的药学上可接受的盐是本领域技术人员所熟知的并且包括例如甲酸、乙酸、柠檬酸、草酸、酒石酸或扁桃酸、盐酸、氢溴酸、硫酸或磷酸的盐;与有机甲酸、磺酸、硫代酸或膦酸或n-取代的氨基磺酸,例如乙酸、三氟乙酸(tfa)、丙酸、乙醇酸、琥珀酸、马来酸、羟基马来酸、甲基马来酸、富马酸、苹果酸、酒石酸、乳酸、草酸、葡糖酸、葡糖二酸、葡糖醛酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、水杨酸、4-氨基水杨酸、2-苯氧基苯甲酸、2-乙酰氧基苯甲酸、扑酸、烟酸或异烟酸的盐;以及与氨基酸,例如在自然界中参与蛋白质合成的20种α氨基酸,例如谷氨酸或天冬氨酸的盐,以及与苯乙酸、甲磺酸、乙磺酸、2-羟基乙磺酸、乙烷1,2-二磺酸、苯磺酸、4-甲基苯磺酸、萘2-磺酸、萘1,5-二磺酸、2-磷酸甘油酸或3-磷酸甘油酸、葡萄糖6-磷酸、n-环己基氨基磺酸(用于环己氨基磺酸盐的形成)的盐,或与其他酸性有机化合物,例如抗坏血酸的盐。
[0193]
含有本文所披露的化合物的药物组合物能以常规方式来制造,例如通过常规混合、溶解、造粒、糖衣丸制备、磨细、乳化、囊封、捕集或冻干方法。适当的配制品取决于所选的施用途径。
[0194]
对于口服施用,可以通过将本文所披露的化合物与本领域熟知的药学上可接受的
赋形剂(例如载剂)组合来容易地配制适合的组合物。此类赋形剂和载剂使得能将本发明化合物配制为片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液等,以供要治疗的患者口服摄食。用于口服使用的药物制剂可以通过以下方式来获得:向如本文所披露的化合物添加固体赋形剂,任选地研磨所得混合物,并且在添加适合的辅助剂后(如果需要)加工颗粒混合物,获得片剂或糖衣丸核心。适合的赋形剂包括例如填充剂和纤维素制剂。如果需要,可以添加崩解剂。用于各种类型的配制品的药学上可接受的成分是熟知的,并且可以是例如用于各种配制品类型的粘合剂(例如,天然或合成聚合物)、润滑剂、表面活性剂、甜味剂和矫味剂、包衣材料、防腐剂、染料、增稠剂、辅助剂、抗微生物剂、抗氧化剂和载体。
[0195]
在口服施用治疗有效量的本文所披露的化合物时,组合物通常呈固体(例如,片剂、胶囊、丸剂、粉末或糖锭)或液体配制品(例如,水性悬浮液、溶液、酏剂或糖浆)的形式。
[0196]
在以片剂形式施用时,组合物可以另外含有功能性固体和/或固体载体,例如明胶或辅助剂。片剂、胶囊和粉末可以含有约1%至约95%化合物,并且优选地约15%至约90%化合物。
[0197]
在以液体或悬浮液形式施用时,可以添加功能性液体和/或液体载体,例如水、石油或动物或植物来源的油。组合物的液体形式可以进一步含有生理盐水溶液、糖醇溶液、右旋糖或其他糖溶液或二醇。在以液体或悬浮液形式施用时,组合物可以含有以重量计约0.5%至约90%的本文所披露的化合物,并且优选地约1%至约50%的本文所披露的化合物。在预期的一个实施例中,液体载体是非水性的或基本上非水性的。对于以液体形式施用,组合物可以作为快速溶解的固体配制品来供应,用于在即将施用前溶解或悬浮。
[0198]
在通过静脉内、经皮肤或皮下注射施用治疗有效量的本文所披露的化合物时,组合物呈无热原、肠胃外可接受的水溶液的形式。此类肠胃外可接受的溶液的制备应充分考虑ph、等渗性、稳定性等并且是在本领域技术范围的。除了本文所披露的化合物以外,用于静脉内、经皮肤或皮下注射的优选组合物通常含有等渗媒剂。此类组合物可以经制备用于作为游离碱或药理学上可接受的盐于水中的与表面活性剂(例如羟丙基纤维素)适当混合的溶液来施用。还可以在甘油、液体聚乙二醇及其混合物中以及在油中制备分散液。在普通的储存和使用条件下,这些制剂可以任选地含有防腐剂以防止微生物生长。
[0199]
可注射组合物可以包括无菌水性溶液、悬浮液或分散液,以及用于临时制备无菌可注射溶液、悬浮液或分散液的无菌粉末。在所有实施例中,所述形式必须是无菌的,并且流动性必须达到存在易可注射性的程度。其必须在制造和储存条件下稳定,并且必须通过任选地包括防腐剂来抵抗微生物(例如细菌和真菌)的污染作用。载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇等)、其适合的混合物、以及植物油。在考虑到的一个实施例中,载体是非水性的或基本上非水性的。适当流动性可以例如通过以下方式来保持:通过使用包衣,例如卵磷脂;在分散液的实施例中通过保持化合物的所需粒径;以及通过使用表面活性剂。对微生物作用的防止可以通过各种抗细菌剂和抗真菌剂来实现,例如对羟苯甲酸酯、氯丁醇、酚、山梨酸、硫柳汞等。在许多实施例中,包括等渗剂(例如,糖或氯化钠)将是优选的。可注射组合物的延长吸收可以通过在组合物中使用吸收延迟剂(例如,单硬脂酸铝和明胶)来实现。
[0200]
无菌可注射溶液通过以下方式来制备:将活性化合物以所需量掺入视需要含有上文所列举的各种其他成分的适当溶剂中,随后过滤灭菌。通常,分散液通过以下方式来制
备:将各种经灭菌活性成分和来自上文所列举的那些的其他所需成分掺入无菌媒剂中,所述媒剂含有基础分散介质。在用于制备无菌可注射溶液的无菌粉末的实施例中,优选的制备方法是真空干燥和冷冻干燥技术,其产生活性成分加来自其预先经无菌过滤的溶液的任何所需的其他成分的粉末。
[0201]
还可以制备缓慢释放或持续释放配制品,以实现在胃肠道中与体液接触的活性化合物的受控释放,并且在血浆中提供基本上恒定且有效的活性化合物水平。例如,可以通过溶解、扩散和离子交换中的一种或多种来控制释放。另外,缓慢释放方法可以通过胃肠道内的可饱和通路或限制通路促进吸收。例如,出于这个目的,可以将化合物包埋于生物可降解聚合物、水溶性聚合物或二者的混合物以及任选地适合的表面活性剂的聚合物基质中。在这种情况下,包埋可以意指在聚合物基质中掺入微粒。还通过经由已知的分散液或乳液包衣技术囊封经分散的微粒或经乳化的微滴来获得受控释放配制品。
[0202]
对于通过吸入施用,本发明的化合物便捷地以气溶胶喷雾呈递的形式从加压包装或雾化器使用适合的推进剂来递送。在加压气溶胶的实施例中,可以通过提供阀来确定剂量单位,以递送经计量的量。用于吸入器或吹入器中的例如明胶的胶囊和药筒可以经配制含有化合物与适合的粉末基质(例如乳糖或淀粉)的粉末混合物。
[0203]
本文所披露的化合物可以经配制用于通过注射(例如,通过推注或连续输注)肠胃外施用。注射用配制品能以单位剂型(例如,于安瓿中或于多剂量容器中)呈现,并添加有防腐剂。组合物可以采取例如以下等形式:于油性或水性媒剂中的悬浮液、溶液或乳液,并且可以含有配制剂,例如悬浮剂、稳定剂和/或分散剂。
[0204]
用于肠胃外施用的药物配制品包括呈水溶性形式的化合物的水溶液。另外,可以将化合物的悬浮液制备为适当的油性注射悬浮液。适合的亲脂性溶剂或媒剂包括脂肪油或合成脂肪酸酯。水性注射悬浮液可以含有提高悬浮液粘度的物质。任选地,悬浮液还可以含有适合的稳定剂或提高化合物的溶解度并允许制备高度浓缩的溶液的试剂。可替代地,本发明组合物可以呈粉末形式以供在使用前用适合的媒剂(例如,无菌无热原水)构造。
[0205]
本文所披露的化合物还可以配制于直肠组合物中,例如栓剂或滞留型灌肠剂(例如,含有常规栓剂基质)。除了先前所述的配制品以外,还可以将化合物配制为长效制剂。此类长效配制品可以通过植入(例如,皮下或肌内)或通过肌内注射来施用。因此,例如,化合物可以用适合的聚合或疏水材料(例如,作为可接受的油中的乳液)或离子交换树脂,或作为微溶衍生物(例如,作为微溶盐)来配制。
[0206]
特别地,本文所披露的化合物能以含有赋形剂(例如淀粉或乳糖)的片剂的形式,或以单独的或与赋形剂混合的胶囊或珠囊(ovule),或以含有矫味剂或着色剂的酏剂或悬浮液的形式,口服、经颊或舌下施用。此类液体制剂可以用药学上可接受的添加剂(例如悬浮剂)来制备。还可以肠胃外注射化合物,例如静脉内、肌内、皮下或冠状动脉内。对于肠胃外施用,化合物最佳地以无菌水溶液的形式来使用,所述无菌水溶液可以含有其他物质,例如盐或糖醇(例如甘露醇)或葡萄糖,以使溶液与血液等渗。
[0207]
对于兽用,本文所披露的化合物根据正规兽医实践作为适合地可接受的配制品来施用。兽医可以容易地确定对于特定动物最适合的给药方案和施用途径。
[0208]
在一些实施例中,可以将用于使用如本文所披露的化合物(单独的或与传统地用于治疗这种疾病的另一种药剂或干预组合的)治疗kif18a相关障碍的所有所需组分包装至
剂盒中。具体地,本发明提供了用于疾病的治疗干预的剂盒,该剂盒包含经包装的成套药物,包括本文所披露的化合物以及用于制备所述药物的可递送形式的缓冲液和其他组分;和/或用于递送此类药物的装置;和/或用于与本文所披露的化合物的组合疗法的任何药剂;和/或与药物一起包装的疾病治疗说明书。说明书可以固定于任何可触摸介质中,例如印刷纸张、或计算机可读取的磁性或光学介质、或参考远程计算机数据源(例如可通过互联网访问的万维网网页)的说明。
[0209]“治疗有效量”意指有效治疗或预防所治疗受试者的已有症状的发展或减轻已有症状的量。尤其根据本文所提供的详细公开,有效量的确定完全在本领域技术人员的能力范围内。通常,“治疗有效剂量”是指导致实现所需效果的化合物的量。例如,在一个优选实施例中,本文所披露的化合物的治疗有效量使kif18a活性相较于对照组降低至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%或至少90%。
[0210]
所施用的化合物的量可以取决于所治疗的受试者、受试者的年龄、健康状况、性别和体重、并行治疗(如果有)的种类、病情的严重程度、所需效果的性质、治疗的方式和频率以及开处方医师的判断。给药频率还可以取决于对动脉氧分压的药效学作用。虽然个体需求不同,但化合物的有效量的最佳范围的确定是在本领域技术范围的。此类剂量能以单一剂量来施用,或者可以将其分为多个剂量。
[0211]
当在本文中使用时,术语“癌症”和“癌性的”是指或描述在哺乳动物中通常以不受调节的细胞生长为特征的生理病症。癌症的实例包括但不限于癌、淋巴瘤、肉瘤、母细胞瘤和白血病。此类癌症的更具体实例包括鳞状细胞癌、肺癌、胰腺癌、子宫颈癌、膀胱癌、肝癌、乳腺癌、结肠癌以及头颈癌、卵巢癌和子宫内膜癌。尽管如本文所使用,术语“癌症”不限于该疾病的任一特定形式,但是认为本发明的方法对于发现伴有不受调节的kif18a水平或依赖于kif18a的癌症特别有效,kif18a用于哺乳动物中的正确进行染色体分离和存活。
[0212]
如本文所使用,术语“治疗(treat、treating和treatment)”是指疗法,包括但不限于治愈性疗法、预防性疗法和预防疗法。预防性治疗通常包括完全预防个体疾病的发作或延迟个体障碍的临床前明显阶段的发作。
[0213]
如本文所使用,术语“患者”、“受试者”或“哺乳动物”是指任何“患者”、“受试者”或“哺乳动物”,包括人、牛、马、狗和猫。在本发明的一个实施例中,哺乳动物为人。
[0214]
术语“包括/包含”意指开放式的,包括所指出的一个或更多个组分,但不排除其他要素。
[0215]
术语“式i”包括任何子式。
[0216]
使用kif18a抑制剂的方法
[0217]
本披露提供了一般性具有基于mt的kif18a调节活性,特别是具有抑制活性的化合物。在本发明的一个实施例中,提供了一种用于在受试者中调节kif18a蛋白的方法,所述方法包括向受试者施用有效剂量的式i化合物。因此,本发明的化合物可以用于治疗细胞增殖障碍,包括不受控制的细胞生长、异常的细胞周期调节、中心体异常(结构和/或数量上,片段化)。与额外中心体(》2)累积相关的其他疾病或障碍包括人乳头瘤病毒(hpv)感染,包括与hpv相关的肿瘤。所述化合物还可用于纤毛相关疾病以及消融可用作男性避孕剂的单倍体生殖细胞群。
[0218]
此外,本发明的化合物可用于但不限于预防或治疗癌症和其他kif18a介导的疾病或病症。例如,本发明的化合物可用于治疗多种实体瘤或血液源性肿瘤,例如癌,包括但不限于膀胱癌、乳腺癌、结肠癌、肾癌、肝癌、肺癌(包括鳞状细胞癌和小细胞肺癌)、食道癌、胆囊癌、卵巢癌、胰腺癌、胃癌、子宫颈癌、甲状腺癌、前列腺癌和皮肤癌(包括鳞状细胞癌);淋巴系的造血肿瘤(包括白血病、急性淋巴细胞白血病、急性成淋巴细胞白血病、b细胞淋巴瘤、t细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、毛细胞淋巴瘤和伯克特淋巴瘤);骨髓系的造血肿瘤(包括急性和慢性骨髓性白血病、骨髓增生异常综合征和早幼粒细胞白血病);间质来源的肿瘤(包括纤维肉瘤和横纹肌肉瘤以及其他肉瘤,例如软组织和骨);中枢和周围神经系统肿瘤(包括星形细胞瘤、神经母细胞瘤、神经胶质瘤和神经鞘瘤);以及其他肿瘤(包括黑素瘤、精原细胞瘤、畸胎癌、骨肉瘤、着色性干皮病、角化棘皮瘤、甲状腺滤泡癌或卡波济氏肉瘤)。
[0219]
本发明的化合物还可用于治疗癌症相关适应症,例如实体瘤、肉瘤(特别是尤因氏肉瘤和骨肉瘤)、视网膜母细胞瘤、横纹肌肉瘤、神经母细胞瘤、造血性恶性肿瘤(包括白血病和淋巴瘤)、肿瘤引起的胸膜或心包积液和恶性腹水。
[0220]
基于调节驱动蛋白影响血管生成的能力,本发明的化合物也可用于增殖性疾病的治疗和疗法。特别地,这些化合物可以用于治疗炎性疾病,尤其是治疗运动器的表现,例如多种炎性类风湿性疾病,尤其是慢性多发性关节炎,包括类风湿性关节炎、青少年关节炎或牛皮癣关节炎;肿瘤伴随综合征或肿瘤引起的炎性疾病、浑浊的积液、胶原性疾病,例如系统性红斑狼疮、多发性肌炎、皮肌炎、系统性硬皮病或混合性胶原性疾病;感染后关节炎(在身体患处或其中找不到活的病原性生物)、血清阴性的脊椎关节炎,例如强直性脊椎炎;血管炎、结节病或关节病;或其进一步的任意组合。
[0221]
本发明的化合物还可以用作针对此类病况的活性剂,如关节炎、动脉粥样硬化、牛皮癣、血管瘤、心肌血管生成、冠状动脉和脑侧突、胶体局部缺血血管生成、伤口愈合、消化性溃疡、幽门螺杆菌相关疾病、骨折、猫抓热、潮红、新生血管性青光眼和视网膜病(例如与糖尿病性视网膜病变或黄斑变性相关的视网膜病)。此外,这些化合物中的一些可以用作针对实体瘤、恶性腹水、造血癌症和过度增生性障碍(例如甲状腺增生(尤其是格雷夫斯病))和囊肿(例如卵巢基质的血管过度增生、多囊卵巢综合征的特征(stein-leventhal综合征))的活性剂,因为此类疾病需要血管细胞增殖才能生长和/或转移。
[0222]
这些化合物除了可用于人治疗外,还可用于兽医治疗伴侣动物、外来动物和农场动物,包括哺乳动物、啮齿类动物等。例如,可以用本发明提供的化合物治疗包括马、狗和猫的动物。
[0223]
组合
[0224]
尽管本发明的化合物可以作为唯一的活性药物试剂进行给药或施用,但是它们还可以与一种或更多种本发明的化合物组合使用或与其他试剂联合使用。当组合施用时,可以将治疗剂配制成分开的组合物,所述组合物同时施用或在不同时间依次施用,或者可以将治疗剂作为单一组合物给予。
[0225]
在定义本发明的化合物和另一种药物试剂的使用中,短语“共同疗法”(或“组合疗法”)旨在包括以提供有益的药物组合效果的方案以顺序方式施用每种试剂,并且还旨在包括以基本上同时的方式共同施用这些试剂,例如以具有固定比例的这些活性试剂的单个胶
囊或以每种试剂的多个单独的胶囊。
[0226]
具体地,本发明的化合物的施用可以与本领域技术人员已知的预防或治疗癌症的其他疗法联合,例如放射疗法、小分子靶向剂(例如parp抑制剂、激酶抑制剂)、具有肿瘤或细胞毒性剂的治疗性抗体(例如裸露的和与药物偶联的)免疫疗法抗体(检查点抑制剂、双特异性t细胞接合剂)。
[0227]
如果配制成固定剂量,则此类组合产品在可接受的剂量范围内采用本发明的化合物。当组合配制品不合适时,式i化合物也可以与已知的抗癌剂或细胞毒性剂依次施用。本发明不限于施用顺序;本发明的化合物可以在已知的抗癌剂或细胞毒性剂施用之前、同时或之后施用。
[0228]
存在大量的在商用上使用、在临床评估和临床前开发上可用的抗癌剂,它们可以通过组合药物化学疗法被选择用于治疗肿瘤。此类药剂分为几大类,例如抗生素类药剂、烷基化和类烷基化药剂、抗有丝分裂剂、小分子靶向剂、抗代谢药、激素剂、免疫剂、抗血管发生剂、干扰素类药剂和杂项药剂类。
[0229]
本披露还提供了用于组合疗法的方法,其中将已知可调节其他途径或相同途径的其他组分、或甚至靶标酶的重叠集合的药剂与本披露的化合物或其药学上可接受的盐组合使用。在一个方面中,这种疗法包括但不限于一种或多种本披露的化合物与化学治疗剂、治疗性抗体、小分子靶向剂和辐射治疗的组合,以提供协同或累加的治疗效果。
[0230]
许多化学治疗剂目前是本领域已知的,并且可以与本披露的化合物组合使用。在一些实施例中,化学治疗剂选自由以下组成的组:抗有丝分裂剂、烷基化剂、抗代谢药、嵌入抗生素、生长因子抑制剂、细胞周期抑制剂、酶、拓扑异构酶抑制剂、生物反应修饰剂、抗激素药、血管发生抑制剂和抗雄激素。非限制性实例是化学治疗剂、细胞毒性剂和非肽小分子,例如(甲磺酸伊马替尼)、(卡非佐米(carfilzomib))、(硼替佐米)、casodex(比卡鲁胺)、(吉非替尼)和阿霉素(adriamycin)以及多种化学治疗剂。化学治疗剂的非限制性实例包括烷基化剂,例如噻替派和环磷酰胺(cytoxantm);烷基磺酸酯,例如白消安、英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶,例如苯佐替哌(benzodopa)、卡波醌、美妥替哌(meturedopa)和乌瑞替哌(uredopa);乙烯亚胺和甲基蜜胺(methylamelamine),包括六甲蜜胺、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺(triethylenethiophosphaoramide)和三羟甲基蜜胺(trimethylolomelamine);氮芥,例如苯丁酸氮芥、萘氮芥、氯磷酰胺(cholophosphamide)、雌氮芥、异环磷酰胺、二氯甲基二乙胺、盐酸甲氧氮芥(mechlorethamine oxide hydrochloride)、美法仑、新恩比兴(novembichin)、苯芥胆甾醇(phenesterine)、泼尼莫司汀、曲磷胺、尿嘧啶氮芥;亚硝基脲,例如卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀、雷莫司汀;抗生素,例如阿克拉霉素(aclacinomysin)、放线菌素(actinomycin)、安曲霉素(authramycin)、重氮丝氨酸、博来霉素、放线菌素(cactinomycin)、卡奇霉素(calicheamicin)、卡柔比星(carabicin)、洋红霉素、嗜癌菌素(carzinophilin)、casodextm、色霉素、更生霉素、道诺霉素、地托比星、6-重氮基-5-氧代-l-正亮氨酸、多柔比星、表柔比星、依索比星、伊达比星、麻西罗霉素(marcellomycin)、丝裂霉素、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、泊非霉素(potfiromycin)、嘌呤霉素、三铁阿霉素(quelamycin)、罗多比星、链黑菌素、链脲霉素、杀结核菌素、乌苯美司、净司他丁、佐柔
比星;抗代谢药,例如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸(denopterin)、甲氨蝶呤、蝶罗呤、三甲曲沙;嘌呤类似物,例如氟达拉滨、6-巯嘌呤、硫咪嘌呤、硫鸟嘌呤;嘧啶类似物,例如安西他滨(azacitidine)、阿扎胞苷、6-氮杂尿苷、卡莫氟(carmofur)、阿糖胞苷、二脱氧尿苷、去氧氟尿苷、依诺他滨、氟尿苷,雄激素例如卡普睾酮、屈他雄酮丙酸酯(dromostanolone propionate)、环硫雄醇、美雄烷、睾内酯;抗肾上腺药,例如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,例如亚叶酸(frolinic acid);醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;安吖啶;贝曲布昔(bestrabucil);比生群;伊达曲沙(edatraxate);地磷酰胺(defofamine);秋水仙胺;地吖醌;依氟鸟氨酸(elfomithine);依利醋铵;依托格鲁;硝酸镓;羟基脲;香菇多糖;氯尼达明;米托胍腙;米托蒽醌;莫哌达醇;硝氨丙吖啶(nitracrine);喷司他汀;蛋胺氮芥(phenamet);吡柔比星;鬼臼酸(podophyllinic acid);2-乙基酰肼;丙卡巴肼;psk;丙亚胺;西佐喃;锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2',2"-三氯三乙胺;乌拉坦(urethan);长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加赛特辛(gacytosine);阿拉伯糖苷(“ara-c”);环磷酰胺;噻替派;紫杉烷,例如紫杉酚和多西他赛、白蛋白结合型紫杉酚(nab-paclitaxel);视黄酸(retinoic acid);埃斯波霉素(esperamicin);卡培他滨(capecitabine);以及上述任何一种的药学上可接受的盐、酸或衍生物。
[0231]
作为适合的化学治疗性细胞调理剂还包括用于调节或抑制激素对肿瘤的作用的抗激素剂,例如抗雌激素药,包括例如他莫昔芬(nolvadextm)、雷洛昔芬、芳香酶抑制性4(5)-咪唑、4-羟基他莫昔芬、曲沃昔芬、可莫昔芬(keoxifene)、ly 117018、奥那司酮和托瑞米芬(法乐通);和抗雄激素药,例如氟他胺、尼鲁米特、比卡鲁胺、亮丙瑞林和戈舍瑞林;苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯嘌呤;甲胺喋呤;铂类似物,例如顺铂、奥沙利铂和卡铂;依托泊苷(vp-16);异环磷酰胺;丝裂霉素c;米托蒽醌;长春碱、长春新碱;长春瑞滨;诺维本;诺安托(novantrone);替尼泊苷;道诺霉素;氨基蝶呤;希罗达(xeloda);伊班膦酸盐;拓扑替康;喜树碱-11(cpt-11);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo),
[0232]
如果需要,本披露的化合物或药物组合物可以与通常开具的抗癌药物组合使用,例如例如abraxane、abvd、阿维金(avicine)、阿巴伏单抗(abagovomab)、吖啶羧酰胺(acridine carboxamide)、阿德木单抗(adecatumumab)、17-n-烯丙基氨基-17-去甲氧基格尔德霉素、阿法雷丁(alpharadin)、阿瓦昔地(alvocidib)、3-氨基吡啶-2-甲醛氨基硫脲、氨萘非特(amonafide)、蒽二酮(anthracenedione)、抗cd22免疫毒素、抗肿瘤药、抗肿瘤发生草药(antitumorigenic herbs)、阿帕兹醌(apaziquone)、阿替莫德(atiprimod)、硫唑嘌呤(azathioprine)、贝洛替康(belotecan)、苯达莫司汀(bendamustine)、bibw 2992、比立考达(biricodar)、伯斯塔利辛(brostallicin)、苔藓抑素(bryostatin)、丁硫氨酸亚砜胺(buthionine sulfoximine)、cbv(化学疗法)、花萼海绵诱癌素(calyculin)、细胞周期非特异性抗肿瘤剂、二氯乙酸、圆皮海绵内酯(discodermolide)、依沙芦星(elsamitrucin)、依诺他滨(enocitabine)、埃博霉素(epothilone)、艾日布林(eribulin)、依维莫司(everolimus)、依沙替康(exatecan)、依昔舒林(exisulind)、铁锈醇(ferruginol)、氟罗德辛(forodesine)、磷雌酚(fosfestrol)、ice化学治疗方案、it-101、伊美克(imexon)、咪喹莫特(imiquimod)、吲哚并咔唑(indolocarbazole)、伊罗夫文(irofulven)、拉尼喹达
(laniquidar)、拉洛他赛(larotaxel)、来那度胺(lenalidomide)、硫蒽酮(lucanthone)、勒托替康(lurtotecan)、马磷酰胺(mafosfamide)、米托唑胺(mitozolomide)、萘福昔定(nafoxidine)、奈达铂(nedaplatin)、奥拉帕尼(olaparib)、他拉唑帕尼(talazoparib)、尼拉帕利(niraparib)、沃塔紫杉醇(ortataxel)、pac-1、木瓜(pawpaw)、匹杉琼(pixantrone)、蛋白酶体抑制剂、蝴蝶霉素(rebeccamycin)、瑞喹莫德(resiquimod)、鲁比特康(rubitecan)、sn-38、盐孢菌酰胺a(salinosporamide a)、沙帕他滨(sapacitabine)、斯坦福v(stanford v)、苦马豆素(swainsonine)、他拉泊芬(talaporfin)、塔利喹达(tariquidar)、优福定(tegafur-uracil)、特莫多(temodar)、替司他赛(tesetaxel)、四硝酸三铂(triplatin tetranitrate)、三(2-氯乙基)胺、曲沙他滨(troxacitabine)、乌拉莫司汀(uramustine)、瓦帝莫泽(vadimezan)、长春氟宁(vinflunine)、zd6126或唑喹达(zosuquidar)、cdk4/6抑制剂(帕博西林(palbociclib),ibrance;瑞博西林(ribociclib),kisqali;玻玛西林(abemaciclib),verzenio)。
[0233]
本披露进一步涉及使用本文所提供的化合物或药物组合物与放射疗法的组合在哺乳动物中抑制异常细胞生长或治疗过度增生障碍的方法。施用放射疗法的技术是本领域已知的,并且这些技术可以用于本文所述的组合疗法中。这种组合疗法中本披露的化合物的施用可以如本文所述来确定。
[0234]
放射疗法可以通过若干种方法之一或方法的组合来施用,包括但不限于外射束疗法、内放射疗法、植入物放射、立体定位性放射外科手术、全身放射疗法、放射疗法和永久性或临时性间质近距离放射疗法。如本文所使用,术语“近距离放射疗法”是指通过空间受限的放射性材料递送的放射疗法,该放射性材料是在肿瘤或其他增生性组织患病位点处或附近插入体内的。该术语意图不受限制地包括暴露于放射性同位素(例如,at-211、i-131、i-125、y-90、re-186、re-188、sm-153、bi-212、p-32和lu的放射性同位素)。用作本披露的细胞调理剂的适合的放射源包括固体和液体。通过非限制性实例,放射源可以是放射性核素,例如作为固体来源的i-125、i-131、yb-169、ir-192,作为固体来源的i-125,或发射光子、β粒子、γ辐射或其他治疗性射线的其他放射性核素。放射性材料还可以是从一种或多种放射性核素的任何溶液(例如,i-125或i-131的溶液)制备的流体,或者放射性流体可以使用含有固体放射性核素(例如au-198、y-90)的小颗粒的适合的流体的浆液产生。此外,可以将一种或多种放射性核素包埋于凝胶或放射性微球中。
[0235]
本披露的化合物或药物组合物可以与一定量的一种或多种选自以下的物质组合使用:抗血管发生剂、信号转导抑制剂、抗增殖剂、糖酵解抑制剂或自体吞噬抑制剂。
[0236]
抗血管发生剂可以结合本披露的化合物和本文所述的药物组合物使用,这些抗血管发生剂是例如mmp-2(基质金属蛋白酶2)抑制剂、mmp-9(基质金属蛋白酶9)抑制剂和cox-11(环氧酶11)抑制剂。抗血管发生剂包括例如雷帕霉素、替西罗莫司(temsirolimus,cci-779)、依维莫司(rad001)、索拉非尼、舒尼替尼和贝伐单抗。有用cox-ii抑制剂的实例包括阿来昔布(alecoxib)、伐地昔布和罗非昔布。有用基质金属蛋白酶抑制剂的实例描述于以下专利中:wo 96/33172、wo 96/27583、欧洲专利公开案ep 0818442、欧洲专利公开案ep 1004578、wo 98/07697、wo 98/03516、wo 98/34918、wo 98/34915、wo 98/33768、wo 98/30566、欧洲专利公开案606046、欧洲专利公开案931 788、wo 90/05719、wo 99/52910、wo 99/52889、wo 99/29667、wo 1999007675、欧洲专利公开案ep 1786785、欧洲专利公开案号
ep 1181017、美国公开案号us 20090012085、美国公开案us 5863 949、美国公开案us 5861 510和欧洲专利公开案ep 0780386,将所有这些专利通过引用以其整体并入本文。优选的mmp-2和mmp-9抑制剂是具有极小或无抑制mmp-1的活性的那些。更优选的是相对于其他基质金属蛋白酶(即,map-1、mmp-3、mmp-4、mmp-5、mmp-6、mmp-7、mmp-8、mmp-10、mmp-11、mmp-12和mmp-13)选择性抑制mmp-2和/或amp-9的那些。可用于本披露中的mmp抑制剂的一些具体实例是ag-3340、ro 32-3555和rs 13-0830。
[0237]
本发明化合物还可以用于与其他抗瘤剂的共同疗法中,这些其他抗瘤剂是例如醋孟南(acemannan)、阿柔比星、阿地白介素、阿仑单抗(alemtuzumab)、阿利维a酸(alitretinoin)、六甲蜜胺、氨磷汀、氨基乙酰丙酸、氨柔比星、安吖啶、阿那格雷、阿那曲唑、ancer、安西司亭(ancestim)、阿加来必(arglabin)、三氧化二砷、bam 002(诺夫洛斯公司(novelos))、贝沙罗汀(bexarotene)、比卡鲁胺、溴尿苷、卡培他滨、西莫白介素、西曲瑞克、克拉屈滨、克霉唑、阿糖胞苷十八烷基磷酸盐(cytarabine ocfosfate)、da 3030(dong-a)、达克珠单抗(daclizumab)、地尼白介素(denileukin diftitox)、地洛瑞林(deslorelin)、右雷佐生、地拉卓(dilazep)、多西他赛、二十二醇、度骨化醇(doxercalciferol)、去氧氟尿苷、多柔比星、溴隐亭、卡莫司汀、阿糖胞苷、氟尿嘧啶、hit双氯酚酸、干扰素-α、道诺霉素、多柔比星、维甲酸、依地福新、依决洛单抗、依氟鸟氨酸(eflornithine)、乙嘧替氟、表柔比星、红细胞生成素β、磷酸依托泊苷、依西美坦、依昔舒林(exisulind)、法倔唑、非格司亭(filgrastim)、非那雄胺、磷酸氟达拉滨、福美司坦(formestane)、福莫司汀、硝酸镓、吉西他滨、吉妥珠单抗奥唑米星(gemtuzumab zogamicin)、吉美拉西(gimeracil)/奥替拉西(oteracil)/替加氟组合、格莱克滨(glycopine)、戈舍瑞林、庚铂(heptaplatin)、人绒毛膜促性腺素、人类胎儿甲胎蛋白、伊班膦酸、伊达比星、咪喹莫特、干扰素-α、干扰素-α、天然干扰素-α-2、干扰素-α-2a、干扰素-α-2b、干扰素-α-n1、干扰素-α-n3、干扰素alfacon-1、干扰素α、天然干扰素β、干扰素β-1a、干扰素β-1b、干扰素γ、天然干扰素γ-1a、干扰素γ-1b、白介素-1β、碘苄胍、伊立替康、伊索拉定(irsogladine)、兰瑞肽(lanreotide)、lc 9018(养乐多集团(yakult))、来氟米特、来格司亭(lenograstim)、硫酸香菇多糖、来曲唑、白细胞α干扰素、亮丙瑞林、左旋咪唑 氟尿嘧啶、利阿唑(liarozole)、洛铂、氯尼达明、洛伐他汀、马索罗酚、美拉胂醇、甲氧氯普胺、米非司酮、米替福新、米立司亭、错配双链rna、米托胍腙、二溴卫矛醇、米托蒽醌、莫拉司亭(molgramostim)、那法瑞林、纳洛酮 喷他佐辛、那托司亭(nartograstim)、奈达铂、尼鲁米特(nilutamide)、那可丁、新颖红细胞生成刺激蛋白、nsc 631570奥曲肽、奥普瑞白介素(oprelvekin)、奥沙特隆、奥沙利铂(oxaliplatin)、紫杉酚、帕米膦酸(pamidronic acid)、培门冬酶、聚乙二醇干扰素-α-2b、木聚硫钠(pentosan polysulfate sodium)、喷司他丁、毕西巴尼(picibanil)、吡柔比星、兔抗胸腺细胞多克隆抗体、聚乙二醇干扰素-α-2a、卟吩姆钠、雷洛昔芬、雷替曲塞、拉斯伯门特(rasburiembodiment)、羟乙膦酸铼(re 186)、rii维甲酰酚胺(rii retinamide)、利妥昔单抗、罗莫肽、来昔决南钐(153sm)(samarium(153sm)lexidronam)、沙格司亭(sargramostim)、西佐喃、索布佐生、索纳明(sonermin)、氯化锶-89、苏拉明、他索那明(tasonermin)、他扎罗汀、替加氟、替莫泊芬(temoporfin)、替莫唑胺、替尼泊苷、四氯十氧化物、沙利度胺、胸腺法新、促甲状腺素α、托泊替康(topotecan)、托瑞米芬、托西莫单抗(tositumomab)-碘131、曲妥珠单抗、曲奥舒凡、维甲酸、曲洛司坦、三甲曲
沙、曲普瑞林、肿瘤坏死因子α、天然乌苯美司、膀胱癌疫苗、丸山(maruyama)疫苗、黑色素瘤裂解物疫苗、戊柔比星(valrubicin)、维替泊芬、长春瑞滨、维鲁利秦(virulizin)、净司他丁斯酯(zinostatin stimalamer)或唑来膦酸;阿巴瑞克(abarelix);ae 941(依特纳公司(aeterna))、氨莫司汀(ambamustine)、反义寡核苷酸、bcl-2(珍塔公司(genta))、apc 8015(丹德里昂公司(dendreon))、西妥昔单抗、地西他滨(decitabine)、德氨鲁米特(dexaminoglutethimide)、地吖醌、el 532(义隆公司(elan))、em 800(英杜里奇公司(endorecherche))、恩尿嘧啶、依他硝唑、芬维a铵(fenretinide)、非格司亭sd01(美商安进公司(amgen))、氟维司群、加洛他滨、胃泌素17免疫原、hla-b7基因疗法(伟科公司(vical))、粒细胞巨噬细胞集落刺激因子、组胺二盐酸盐、替伊莫单抗、伊洛马司他、im 862(兴创公司(cytran))、白介素-2、艾泼昔芬(iproxifene)、ldi 200(米克豪公司(milkhaus))、来立司亭(leridistim)、林妥珠单抗(lintuzumab)、ca 125mab(巴米拉公司(biomira))、癌症mab(日本制药发展公司(japan pharmaceutical development))、her-2和fc mab(梅达拉公司(medarex))、独特型105ad7 mab(crc技术公司(crc technology))、独特型cea mab(特里莱公司(trilex))、lym-1-碘131mab(特尼克隆公司(techniclone))、多态性上皮粘液素-钇90mab(安特索玛公司(antisoma))、马立马司他(marimastat)、美诺立尔、米妥莫单抗(mitumomab)、莫特沙芬钆(motexafin gadolinium)、mx 6(高德美公司(galderma))、奈拉滨(nelarabine)、诺拉曲塞(nolatrexed)、p 30蛋白、培维索孟(pegvisomant)、培美曲塞、泊非霉素(porfiromycin)、普马司他(prinomastat)、rl 0903(夏尔公司(shire))、鲁吡替康、沙铂(satraplatin)、苯乙酸钠、斯帕磷酸(sparfosic acid)、srl 172(sr制药公司(sr pharma))、su 5416(苏根公司(sugen))、ta 077(田边公司(tanabe))、四硫钼酸盐、厚果糖松草碱(thaliblastine)、血小板生成素、本紫红素乙酯锡(tin ethyl etiopurpurin)、替拉扎明、癌症疫苗(巴米拉公司)、黑色素瘤疫苗(纽约大学(new york university))、黑色素瘤疫苗(斯隆-凯特琳研究所(sloan kettering institute))、黑色素瘤肿瘤裂解物疫苗(纽约医学院(new york medical college))、病毒黑色素瘤细胞裂解物疫苗(皇家纽卡斯尔医院(royal newcastle hospital))或伐司朴达(valspodar)。
[0238]
本发明的化合物可以进一步与vegfr抑制剂一起使用。以下专利和专利申请案中所述的其他化合物可以用于组合疗法中:us 6,258,812、us 2003/0105091、wo 01/37820、us 6,235,764、wo 01/32651、us 6,630,500、us 6,515,004、us 6,713,485、us 5,521,184、us 5,770,599、us 5,747,498、wo 02/68406、wo 02/66470、wo 02/55501、wo 04/05279、wo 04/07481、wo 04/07458、wo 04/09784、wo 02/59110、wo 99/45009、wo 00/59509、wo 99/61422、us 5,990,141、wo 00/12089和wo 00/02871。
[0239]
在一些实施例中,该组合包含本发明的组合物与至少一种抗血管发生剂的组合。药剂包括但不限于在体外以合成方式制备的化学组合物、抗体、抗原结合区、放射性核素及其组合和缀合物。药剂可以是激动剂、拮抗剂、变构调节剂、毒素,或者更通常地,可以用于抑制或刺激其靶标(例如,受体或酶激活或抑制),并且由此促进细胞死亡或阻止细胞生长。
[0240]
示例性抗血管发生剂包括erbitux
tm
(imc-c225)、kdr(激酶结构域受体)抑制剂(例如,特异性结合至激酶结构域受体的抗体和抗原结合区)、抗vegf剂(例如,特异性结合vegf的抗体或抗原结合区、或可溶vegf受体或其配体结合区)(例如avastin
tm
或vegf-trap
tm
)和抗vegf受体剂(例如,与其特异性结合的抗体或抗原结合区)、egfr抑制剂(例如,与其特异
性结合的抗体或抗原结合区)(例如维克替比(vectibix)(帕尼单抗)、iressa
tm
(吉非替尼)、tarceva
tm
(厄洛替尼)、抗ang1剂和抗ang2剂(例如,与其或与其受体(例如tie2/tek)特异性结合的抗体或抗原结合区)以及抗tie2激酶抑制剂(例如,与其特异性结合的抗体或抗原结合区)。本发明的药物组合物还可以包含一种或多种特异性结合生长因子并抑制生长因子的活性的药剂(例如,抗体、抗原结合区或可溶受体),例如肝细胞生长因子(hgf,还称为散射因子)的拮抗剂、以及特异性结合其受体“c-met”的抗体或抗原结合区。
[0241]
其他抗血管发生剂包括阿仑单抗(campath)、il-8、b-fgf、tek拮抗剂(ceretti等人,美国公开案号2003/0162712;美国专利号6,413,932)、抗tweak剂(例如特异性结合抗体或抗原结合区、或可溶性tweak受体拮抗剂;参见,wiley,美国专利号6,727,225)、adam解整联蛋白结构域拮抗整联蛋白与其配体的结合(fanslow等人,美国公开案号2002/0042368)、特异性结合抗-eph受体和/或抗-ephrin抗体或抗原结合区(美国专利号5,981,245、5,728,8135,969,110;6,596,852;6,232,447;6,057,124及其专利家族成员)、抗pdgf-bb拮抗剂(例如,特异性结合抗体或抗原结合区)以及特异性结合pdgf-bb配体的抗体或抗原结合区和pdgfr激酶抑制剂(例如,与其特异性结合的抗体或抗原结合区)。
[0242]
其他抗血管发生/抗肿瘤剂包括:sd-7784(美国辉瑞公司(pfizer,usa));西仑吉肽(cilengitide)(德国默克集团(merck kgaa,germany),epo 770622);哌加他尼八钠(pegaptanib octasodium)(美国吉利德科学公司(gilead sciences,usa));阿尔法他汀(alphastatin)(英国bioacta公司(bioacta,uk));m-pga(美国新基公司(celgene,usa),us 5712291);伊洛马司他(ilomastat)(美国爱瑞发公司(arriva,usa),us 5892112);依马西尼(emaxanib)(美国辉瑞公司(pfizer,usa),us 5792783);瓦他拉尼(vatalanib)(瑞士诺华公司(novartis,switzerland));2-甲氧基雌二醇(美国恩特尔公司(entremed,usa));tlc ell-12(爱尔兰义隆公司(elan,ireland));阿奈可他乙酸酯(anecortave acetate)(美国爱尔康公司(alcon,usa));α-d148 mab(美国安进公司(amgen,usa));cep-7055(美国塞法隆公司(cephalon,usa));抗-vn mab(荷兰克鲁赛尔公司(crucell,netherlands))dac:抗血管发生剂(加拿大康古公司(conjuchem,canada));安吉西丁(angiocidin)(美国英肯制药公司(inkine pharmaceutical,usa));km-2550(日本协和发酵工业株式会社(kyowa hakko,japan));su-0879(美国辉瑞公司(pfizer,usa));cgp-79787(瑞士诺华公司(novartis,switzerland),ep 970070);argent技术(美国阿瑞雅德公司(ariad,usa));yigsr-stealth(美国强生公司(johnson&johnson,usa));纤维蛋白原e片段(英国bioacta公司(bioacta,uk));血管发生抑制剂(英国特里根公司(trigen,uk));tbc-1635(美国恩赛斯夫制药公司(encysive pharmaceuticals,usa));sc-236(美国辉瑞公司(pfizer,usa));abt-567(美国雅培公司(abbott,usa));转移抑素(美国恩特尔公司(entremed,usa));血管发生抑制剂(瑞典特里普公司(tripep,sweden));丝氨酸蛋白酶抑制剂(maspin)(日本创生公司(sosei,japan));2-甲氧基雌二醇(美国肿瘤科学公司(oncology sciences corporation,usa));er-68203-00(美国安维世公司(ivax,usa));氟草胺(美国莱恩实验室(lane labs,usa));tz-93(日本津村公司(tsumura,japan));tan-1120(日本武田公司(takeda,japan));fr-111142(日本藤泽公司(fujisawa,japan),jp 02233610);血小板因子4(美国瑞普利金公司(repligen,usa),ep 407122);血管内皮生长因子拮抗剂(丹麦波登公司(borean,denmark));贝伐单抗(pinn)(美国基因泰克公司(genentech,usa));血管发
institute of chemical technology,south korea));gw 2286(英国葛兰素史克公司(glaxosmithkline,uk));eht 0101(法国埃克森希特公司(exonhit,france));cp 868596(美国辉瑞公司(pfizer,usa));cp 564959(osi,usa);cp 547632(美国辉瑞公司(pfizer,usa));786034(英国葛兰素史克公司(glaxosmithkline,uk));krn 633(日本麒麟麦酒株式会社(kirin brewery,japan));药物递送系统内,眼内,2-甲氧基雌二醇(美国恩特尔公司(entremed,usa));吡卡酯(anginex)(荷兰马斯特里赫特大学(maastricht university,netherlands)和美国明尼苏达大学(minnesota university,usa));abt 510(美国雅培公司(abbott,usa));aal 993(瑞士诺华公司(novartis,switzerland));vegi(美国proteomtech公司(proteomtech,usa));肿瘤坏死因子-α抑制剂(美国国家老龄研究所(national institute on aging,usa));su 11248(美国辉瑞公司(pfizer,usa)和美国苏根公司(sugen,usa));abt 518(美国雅培公司(abbott,usa));yh16(中国烟台荣昌公司(yantai rongchang,china));s-3apg(美国波士顿儿童医院(boston childrens hospital,usa)和美国恩特尔公司(entremed,usa));mab,kdr(美国英克隆公司(imclone systems,usa));mab,α5β1(美国蛋白质设计(protein design,usa));kdr激酶抑制剂(英国希尔泰克公司(celltech group,uk)和美国强生公司(johnson&johnson,usa));gfb 116(美国南佛罗里达大学(south florida university,usa)和美国耶鲁大学(yale university,usa));cs 706(日本三共株式会社(sankyo,japan));康他汀a4前药(美国亚利桑那州立大学(arizona state university,usa));软骨素酶ac(ibex,加拿大(canada));bay res 2690(德国拜耳公司(bayer,germany));agm 1470(美国哈佛大学(harvard university,usa)、日本武田公司(takeda,japan)和美国tap公司(tap,usa));ag 13925(美国阿古伦公司(agouron,usa));四硫钼酸盐(tetrathiomolybdate)(美国密西根大学(university of michigan,usa));gcs 100(美国韦恩州立大学(wayne state university,usa))cv 247(英国常青藤医学团体(ivy medical,uk));ckd 732(韩国钟根堂公司(chong kun dang,south korea));mab,血管内皮生长因子(英国诺瓦公司(xenova,uk));伊索拉定(irsogladine)(inn)(日本新药株式会社(nippon shinyaku,japan));rg 13577(法国安万特公司(aventis,france));wx 360(德国威尔克斯公司(wilex,germany));角鲨胺(squalamine)(pinn)(美国金纳莱公司(genaera,usa));rpi 4610(美国锡尔纳公司(sirna,usa));癌症疗法(澳大利亚马里诺娃公司(marinova,australia));类肝素酶抑制剂(以色列insight公司(insight,israel));kl 3106(韩国科隆公司(kolon,south korea));和厚朴酚(honokiol)(美国埃默里大学(emory university,usa));zk cdk(德国先灵公司(schering ag,germany));zk angio(德国先灵公司(schering ag,germany));zk 229561(瑞士诺华公司(novartis,switzerland)和德国先灵公司(schering ag,germany));xmp 300(xoma,usa);vga 1102(日本大正公司(taisho,japan));vegf受体调节剂(pharmacopeia,usa[美国药典]);ve-钙黏着蛋白-2拮抗剂(美国英克隆公司(imclone systems,usa));血管形成抑制素(美国国立卫生研究院(national institutes of health,usa));疫苗,flk-1(美国英克隆公司(imclone systems,usa));tz 93(日本津村公司(tsumura,japan));肿瘤抑素(tumstatin)(美国贝斯以色列医院(beth israel hospital,usa));短的可溶性flt 1(血管内皮生长因子受体1)(美国默克公司(merck&co,usa));tie-2配体(美国再生元制药公司(regeneron,usa));和血小板反应蛋白1抑制剂(美
国阿勒格尼健康、教育和研究基金会(allegheny health,education and research foundation,usa))。
[0243]
自体吞噬抑制剂包括但不限于氯喹、3-甲基腺嘌呤、羟氯喹(plaquenil
tm
)、巴弗洛霉素a1(bafilomycin a1)、5-氨基-4-咪唑甲酰胺核糖核苷(aicar)、冈田酸、抑制2a型或1型蛋白磷酸酶的自体吞噬抑制性海藻毒素、camp类似物以及升高camp水平的药物例如腺苷、ly204002、n6-巯嘌呤核糖核苷和长春碱。另外,还可以使用抑制蛋白质表达的反义或sirna,这些蛋白质包括但不限于atg5(其参与自体吞噬)。
[0244]
可以用于治疗癌症并且可以与本发明的一种或多种化合物组合使用的其他药学活性化合物/药剂包括:阿法依伯汀(epoetin alfa);阿法达贝泊汀(darbepoetin alfa);帕尼单抗;培非格司亭(pegfilgrastim);帕利夫明(palifermin);非格司亭;地诺单抗(denosumab);安西司亭;amg 102;amg 386;amg 479;amg655;amg 745;amg 951;及amg 706或其药学上可接受的盐。
[0245]
在某些实施例中,将本文所提供的组合物与化学治疗剂联合施用。适合的化学治疗剂可以包括天然产物,例如长春花生物碱(例如,长春碱、长春新碱和长春瑞滨)、紫杉酚、表鬼臼毒素(epidipodophyllotoxin)(例如,依托泊苷和替尼泊苷)、抗生素(例如,更生霉素(放线菌素d)、道诺霉素、多柔比星和伊达比星)、蒽环类抗生素、米托蒽醌、博来霉素、普卡霉素(光辉霉素)、丝裂霉素、酶(例如,l-天冬酰胺酶,其系统性地代谢l-天冬酰胺并剥夺不具有合成自身天冬酰胺的能力的细胞)、抗血小板剂、抗增殖/抗有丝分裂烷基化剂(例如氮芥,例如,二氯甲基二乙胺、环磷酰胺和类似物、美法仑和苯丁酸氮芥)、乙烯亚胺和甲基蜜胺(例如,六甲基蜜胺(hexaamethylmelaamine)和噻替派)、cdk抑制剂(例如,塞利西利(seliciclib)、ucn-01、p1446a-05、pd-0332991、迪那西利(dinaciclib)、p27-00、at-7519、rgb286638和sch727965)、烷基磺酸酯(例如,白消安)、亚硝基脲(例如,卡莫司汀(bcnu)和类似物和链脲霉素)、三氮烯-达卡巴嗪(trazenes-dacarbazinine)(dtic)、抗增殖/抗有丝分裂抗代谢药例如叶酸类似物(例如,甲氨蝶呤)、嘧啶类似物(例如,氟尿嘧啶、氟尿苷和阿糖胞苷)、嘌呤类似物和相关抑制剂(例如,巯嘌呤、硫鸟嘌呤、喷司他丁和2-氯脱氧腺苷)、芳香酶抑制剂(例如,阿那曲唑、依西美坦和来曲唑)和铂配位络合物(例如,顺铂和卡铂)、丙卡巴肼、羟基脲、米托坦、氨鲁米特、组蛋白脱乙酰酶(hdac)抑制剂(例如,曲古抑菌素、丁酸钠、阿匹西坦(apicidan)、辛二酰苯胺异羟肟酸(hydroamic acid)、伏立诺他(vorinostat)、lbh 589、罗米地辛(romidepsin)、acy-1215和帕比司他(panobinostat))、mtor抑制剂(例如,替西罗莫司、依维莫司、地磷莫司(ridaforolimus)和西罗莫司)、ksp(eg5)抑制剂(例如,array 520)、dna结合剂(例如,扎利普斯(zalypsis))、pi3kδ抑制剂(例如,gs-1101和tgr-1202)、pi3kδ和γ抑制剂(例如,cal-130)、多激酶抑制剂(例如,tg02和索拉非尼)、激素(例如,雌激素)和激素激动剂例如黄体化激素释放激素(lhrh)激动剂(例如,戈舍瑞林、亮丙瑞林和曲普瑞林)、baff中和性抗体(例如,ly2127399)、ikk抑制剂、p38mapk抑制剂、抗il-6(例如,cnto328)、端粒酶抑制剂(例如,grn 163l)、极光激酶抑制剂(例如,mln8237、amg 900、azd-1152)、细胞表面单克隆抗体(例如,抗cd38(humax-cd38)、抗cs1(例如,埃罗妥珠单抗(elotuzumab))、hsp90抑制剂(例如,17aag和kos 953)、p13k/akt抑制剂(例如,哌立福辛(perifosine))、akt抑制剂(例如,gsk-2141795)、pkc抑制剂(例如,恩扎妥林)、fti(例如,zarnestra
tm
)、抗cd138(例如,bt062)、torc1/2特异性激酶抑制剂(例
如,ink128)、激酶抑制剂(例如,gs-1101)、er/upr靶向剂(例如,mkc-3946)、cfms抑制剂(例如,arry-382)、jak1/2抑制剂(例如,cyt387)、parp抑制剂(例如,奥拉帕尼、他拉唑帕尼(talazoparib)、尼拉帕利(niraparib)和维利帕尼(veliparib)(abt-888))、bcl-2拮抗剂。其他化学治疗剂可以包括二氯甲基二乙胺、喜树碱、异环磷酰胺、他莫昔芬、雷洛昔芬、吉西他滨、诺维本、索拉非尼或前述项的任何类似物或衍生物变体。
[0246]
本发明化合物亦可与放射疗法、激素疗法、手术及免疫疗法结合使用,这些疗法是本领域技术人员熟知的。
[0247]
在某些实施例中,将本文所提供的药物组合物与类固醇联合施用。适合的类固醇可以包括但不限于21-乙酰氧基孕烯醇酮、阿氯米松、阿尔孕酮、安西奈德、倍氯米松(beclomethasone)、倍他米松、布地奈德、氯泼尼松(chloroprednisone)、氯倍他索(clobetasol)、氯可托龙、氯泼尼醇、皮质酮、可的松、可的伐唑、地夫可特、地奈德、去羟米松、地塞米松、二氟拉松(diflorasone)、二氟可龙(diflucortolone)、二氟孕甾丁酯(difuprednate)、甘草次酸、氟扎可特、氟氯奈德(flucloronide)、氟米松(flumethasone)、氟尼缩松、氟轻松(fluocinolone acetonide)、醋酸氟轻松、氟考丁酯(fluocortin butyl)、氟可龙、氟米龙(fluorometholone)、醋酸甲氟龙(fluperolone acetate)、醋酸氟泼尼定(fluprednidene acetate)、氟泼尼龙(fluprednisolone)、氟氢缩松(flurandrenolide)、丙酸氟替卡松、福莫可他(formocortal)、氯氟舒松(halcinonide)、丙酸卤倍他索(halobetasol propionate)、卤米松(halometasone)、氢化可的松(hydrocortisone)、依碳酸氯替泼诺(loteprednol etabonate)、马泼尼酮、甲羟松、甲泼尼松、甲泼尼龙(methylprednisolone)、糠酸莫米松(mometasone furoate)、帕拉米松、泼尼卡酯、泼尼松龙(prednisolone)、泼尼松龙25-二乙氨基乙酸酯、泼尼松龙磷酸钠、泼尼松(prednisone)、泼尼松龙戊酸酯(prednival)、泼尼立定(prednylidene)、利美索龙、替可的松(tixocortol)、曲安西龙(triamcinolone)、曲安奈德(triamcinolone acetonide)、苯曲安奈德(triamcinolone benetonide)、己曲安奈德(triamcinolone hexacetonide)及其盐和/或衍生物。在一个特定实施例中,本发明的化合物还可以与治疗恶心的其他药学活性剂组合使用。可以用于治疗恶心的药剂的实例包括:屈大麻酚(dronabinol)、格拉司琼(granisetron)、甲氧氯普胺(metoclopramide)、昂丹司琼(ondansetron)及丙氯拉嗪(prochlorperazine)、或其药学上可接受的盐。
[0248]
本披露的化合物或药物组合物还可以与一定量的一种或多种选自以下的物质组合使用:egfr抑制剂、mek抑制剂、pi3k抑制剂、akt抑制剂、tor抑制剂和免疫疗法,包括抗pd-1、抗pdl-1、抗ctla4、抗lag1和抗ox40剂、gitr激动剂、car-t细胞和bite。
[0249]
egfr抑制剂包括但不限于小分子拮抗剂、抗体抑制剂或特定反义核苷酸或sirna。有用的egfr抗体抑制剂包括西妥昔单抗(爱必妥)、帕尼单抗(维克替比)、扎鲁木单抗(zalutumumab)、尼妥珠单抗(nimotuzumab)和马妥珠单抗(matuzumab)。egfr的小分子拮抗剂包括吉非替尼、厄洛替尼(特罗凯(tarceva))和最近的拉帕替尼(lapatinib)(泰克博(tykerb))。参见例如yan l等人,pharmacogenetics and pharmacogenomics in oncology therapeutic antibody development[肿瘤治疗抗体开发中的药物遗传学和药物基因组学],biotechniques[生物技术]2005;39(4):565-8和paez j g等人,egfr mutations in lung cancer correlation with clinical response to gefitinib therapy[肺癌中的egfr
突变与对吉非替尼疗法的临床反应的相关性],science[科学]2004;304(5676):1497-500。
[0250]
小分子egfr抑制剂的非限制性实例包括以下专利公开案中描述的任何egfr抑制剂、以及所述egfr抑制剂的所有药学上可接受的盐和溶剂化物:欧洲专利申请案ep 520722,1992年12月30日公开;欧洲专利申请案ep 566226,1993年10月20日公开;pct国际公开案wo 96/33980,1996年10月31日公开;美国专利号5,747,498,1998年5月5日授权;pct国际公开案wo 96/30347,1996年10月3日公开;欧洲专利申请案ep 787772,1997年8月6日公开;pct国际公开案wo 97/30034,1997年8月21日公开;pct国际公开案wo 97/30044,1997年8月21日公开;pct国际公开案wo 97/38994,1997年10月23日公开;pct国际公开案wo 97/49688,1997年12月31日公开;欧洲专利申请案ep 837063,1998年4月22日公开;pct国际公开案wo 98/02434,1998年1月22日公开;pct国际公开案wo 97/38983,1997年10月23日公开;pct国际公开案wo 95/19774,1995年7月27日公开;pct国际公开案wo 95/19970,1995年7月27日公开;pct国际公开案wo 97/13771,1997年4月17日公开;pct国际公开案wo 98/02437,1998年1月22日公开;pct国际公开案wo 98/02438,1998年1月22日公开;pct国际公开案wo 97/32881,1997年9月12日公开;德国申请案de 19629652,1998年1月29日公开;pct国际公开案wo 98/33798,1998年8月6日公开;pct国际公开案wo 97/32880,1997年9月12日公开;pct国际公开案wo 97/32880,1997年9月12日公开;欧洲专利申请案ep 682027,1995年11月15日公开;pct国际公开案wo 97/02266,197年1月23日公开;pct国际公开案wo 97/27199,1997年7月31日公开;pct国际公开案wo 98/07726,1998年2月26日公开;pct国际公开案wo 97/34895,1997年9月25日公开;pct国际公开案wo 96/31510
′
,1996年10月10日公开;pct国际公开案wo 98/14449,1998年4月9日公开;pct国际公开案wo 98/14450,1998年4月9日公开;pct国际公开案wo 98/14451,1998年4月9日公开;pct国际公开案wo 95/09847,1995年4月13日公开;pct国际公开案wo 97/19065,1997年5月29日公开;pct国际公开案wo 98/17662,1998年4月30日公开;美国专利号5,789,427,1998年8月4日授权;美国专利号5,650,415,1997年7月22日授权;美国专利号5,656,643,1997年8月12日授权;pct国际公开案wo 99/35146,1999年7月15日公开;pct国际公开案wo 99/35132,1999年7月15日公开;pct国际公开案wo 99/07701,1999年2月18日公开;和pct国际公开案wo 92/20642,1992年11月26日公开。小分子egfr抑制剂的其他非限制性实例包括描述于traxler,p.,1998,exp.opin.ther.patents[治疗术专利专家评述]8(12):1599-1625中的任何egfr抑制剂。
[0251]
基于抗体的egfr抑制剂包括可以部分或完全阻断egfr被其天然配体激活的任何抗egfr抗体或抗体片段。基于抗体的egfr抑制剂的非限制性实例包括以下文献中描述的那些:modjtahedi,h.等人,1993,br.j.cancer[英国癌症杂志]67:247-253;teramoto,t.等人,1996,cancer[癌症]77:639-645;goldstein等人,1995,clin.cancer res.[临床癌症研究]1:1311-1318;huang,s.m.等人,1999,cancer res.[癌症研究]15:59(8):1935-40;和yang,x.等人,1999,cancer res.[癌症研究]59:1236-1243。因此,egfr抑制剂可以是单克隆抗体mab e7.6.3(yang,1999,同上)、或mab c225(atcc登录号hb-8508)、或具有其结合特异性的抗体或抗体片段。
[0252]
mek抑制剂包括但不限于ci-1040、azd6244、pd318088、pd98059、pd334581、rdea119、arry-142886、arry-438162和pd-325901。
[0253]
pi3k抑制剂包括但不限于渥曼青霉素、wo 06/044453中描述的17-羟基渥曼青霉
素类似物、4-[2-(1h-吲唑-4-基)-6-[[4-(甲磺酰基)哌嗪-1-基]甲基]噻吩并[3,2-d]嘧啶-4-基]吗啉(还称为gdc 0941,并且描述于pct公开案号wo 09/036,082和wo 09/055,730中)、2-甲基-2-[4-[3-甲基-2-氧代-8-(喹啉-3-基)-2,3-二氢咪唑并[4,5-c]喹啉-1-基]苯基]丙腈(还称为bez 235或nvp-bez 235,并且描述于pct公开案号wo 06/122806中)、(s)-1-(4-((2-(2-氨基嘧啶-5-基)-7-甲基-4-吗啉代噻吩并[3,2-d]嘧啶-6-基)甲基)哌嗪-1-基)-2-羟基丙-1-酮(描述于pct公开案号wo 2008/070740中)、ly294002(2-(4-吗啉基)-8-苯基-4h-1-苯并吡喃-4-酮,可从艾克松医学化学公司(axon medchem)获得)、pi 103盐酸盐(3-[4-(4-吗啉基吡啶并-[3
′
,2
′
:4,5]呋喃并[3,2-d]嘧啶-2-基]苯酚盐酸盐,可从艾克松医学化学公司获得)、pik 75(n
′‑
[(1e)-(6-溴代咪唑并[1,2-a]吡啶-3-基)亚甲基]-n,2-二甲基-5-硝基苯磺酰基-酰肼盐酸盐,可从艾克松医学化学公司获得)、pik 90(n-(7,8-二甲氧基-2,3-二氢-咪唑并[1,2-c]喹唑啉-5-基)-烟酰胺,可从艾克松医学化学公司获得)、gdc-0941二甲磺酸盐(2-(1h-吲唑-4-基)-6-(4-甲烷磺酰基-哌嗪-1-基甲基)-4-吗啉-4-基-噻吩并[3,2-d]嘧啶二甲磺酸盐,可从艾克松医学化学公司获得)、as-252424(5-[1-[5-(4-氟-2-羟基-苯基)-呋喃-2-基]-甲-(z)-亚基]-噻唑烷-2,4-二酮,可从艾克松医学化学公司获得)以及tgx-221(7-甲基-2-(4-吗啉基)-9-[1-(苯基氨基)乙基]-4h-吡啶并-[1,2-a]嘧啶-4-酮,可从艾克松医学化学公司获得)、xl-765和xl-147。其他pi3k抑制剂包括去甲氧基绿胶霉素(demethoxyviridin)、哌立福辛、cal101、px-866、bez235、sf1126、ink1117、ipi-145、bkm120、xl147、xl765、帕罗米德529(palomid 529)、gsk1059615、zstk474、pwt33597、ic87114、tg100-115、cal263、pi-103、gne-477、cudc-907和aezs-136。
[0254]
akt抑制剂包括但不限于akt-1-1(抑制akt1)(barnett等人(2005)biochem.j.[生物化学杂志],385(pt.2),399-408);akt-1-1,2(抑制ak1和2)(barnett等人(2005)biochem.j.[生物化学杂志]385(pt.2),399-408);api-59cj-ome(例如,jin等人(2004)br.j.cancer[英国癌症杂志]91,1808-12);1-h-咪唑并[4,5-c]吡啶基化合物(例如,wo 05011700);吲哚-3-甲醇及其衍生物(例如,美国专利号6,656,963;sarkar和li(2004)j nutr.[营养杂志]134(12增刊),3493s-3498s);哌立福辛(perifosine)(例如,干扰akt膜定位;dasmahapatra等人,(2004)clin.cancer res.[临床癌症研究]10(15),5242-52,2004);磷脂酰肌醇醚脂质类似物(例如gills和dennis(2004)expert.opin.investig.drugs[研究药物专家评论]13,787-97);和曲西立滨(triciribine)(tcn或api-2或nci鉴定剂:nsc 154020;yang等人,(2004),cancer res.[癌症研究]64,4394-9)。
[0255]
tor抑制剂包括但不限于,抑制剂包括ap-23573、cci-779、依维莫司、rad-001、雷帕霉素、替西罗莫司、atp竞争性torc1/torc2抑制剂,包括pi-103、pp242、pp30和托林1(torin 1)。其他tor抑制剂包括fkbp12增强剂;雷帕霉素及其衍生物,包括:cci-779(替西罗莫司)、rad001(依维莫司;wo 9409010)和ap23573;雷帕霉素类似物(rapalog),例如如wo 98/02441和wo 01/14387中所披露,例如ap23573、ap23464或ap23841;40-(2-羟乙基)雷帕霉素、40-[3-羟基(羟甲基)甲基丙酸酯]-雷帕霉素(还称为cc1779)、40-表-(四唑基)-雷帕霉素(还称为abt578)、32-脱氧雷帕霉素、16-戊炔氧基-32(s)-二氢雷帕霉素和wo 05005434中披露的其他衍生物;以下专利中披露的衍生物:美国专利号5,258,389、wo 94/090101、wo 92/05179、美国专利号5,118,677、美国专利号5,118,678、美国专利号5,100,
883、美国专利号5,151,413、美国专利号5,120,842、wo 93/111130、wo 94/02136、wo 94/02485、wo 95/14023、wo 94/02136、wo 95/16691、wo 96/41807、wo 96/41807和美国专利号5,256,790;含磷雷帕霉素衍生物(例如,wo 05016252);4h-1-苯并吡喃-4-酮衍生物(例如,美国临时申请案号60/528,340)。
[0256]
免疫疗法包括但不限于抗pd-1剂、抗pdl-1剂、抗ctla-4剂、抗lag1剂和抗ox40剂。示例性抗pd-1抗体及其使用方法描述于以下文献中:goldberg等人,blood[血液]110(1):186-192(2007);thompson等人,clin.cancer res.[临床癌症研究]13(6):1757-1761(2007);和korman等人,国际申请案号pct/jp 2006/309606(公开案号wo 2006/121168 a1),将其各自通过引用明确并入本文。包括:yervoy
tm
(伊匹单抗(ipilimumab))或曲美目单抗(tremelimumab)(针对ctla-4)、加利昔单抗(galiximab)(针对b7.1)、bms-936558(针对pd-1)、mk-3475(针对pd-1)、amp224(针对b7dc)、bms-936559(针对b7-h1)、mpdl3280a(针对b7-h1)、medi-570(针对icos)、amg557(针对b7h2)、mga271(针对b7h3)、imp321(针对lag-3)、bms-663513(针对cd137)、pf-05082566(针对cd137)、cdx-1127(针对cd27)、抗ox40(普罗维登斯卫生服务(providence health services))、humabox40l(针对ox40l)、阿塞西普(atacicept)(针对taci)、cp-870893(针对cd40)、鲁卡木单抗(lucatumumab)(针对cd40)、达西珠单抗(dacetuzumab)(针对cd40)、莫罗单抗-cd3(muromonab-cd3)(针对cd3)、伊匹单抗(针对ctla-4)。免疫疗法还包括遗传工程化的t细胞(例如,car-t细胞)和双特异性抗体(例如,bite)。
[0257]
gitr激动剂包括但不限于gitr融合蛋白和抗gitr抗体(例如二价抗gitr抗体),例如美国专利号6,111,090box.c、欧洲专利号:090505b1、美国专利号8,586,023、pct公开号:wo 2010/003118和2011/090754中所述的gitr融合蛋白,或例如在以下中描述的抗gitr抗体:美国专利号7,025,962、欧洲专利号:1947183b1、美国专利号7,812,135、美国专利号8,388,967、美国专利号8,591,886、欧洲专利号:ep 1866339、pct公开号:wo 2011/028683、pct公开号:wo 2013/039954、pct公开号:wo2005/007190、pct公开号:wo 2007/133822、pct公开号:wo 2005/055808、pct公开号:wo 99/40196、pct公开号:wo 2001/03720、pct公开号:wo 99/20758、pct公开号:wo 2006/083289、pct公开号:wo 2005/115451、美国专利号7,618,632和pct公开号:wo 2011/051726。
[0258]
本文所述的化合物可以与本文所披露的药剂或其他适合的药剂组合使用,这取决于所治疗的病症。因此,在一些实施例中,本披露的一种或多种化合物将与如上所述的其他药剂共施用。在用于组合疗法中时,本文所述的化合物与第二药剂同时或分开施用。这种组合施用可以包括同时施用相同剂型中的两种药剂、同时施用单独剂型和分开施用。也就是说,本文所述的化合物和上述任何药剂可以一起配制于相同剂型中并同时施用。可替代地,本披露的化合物和上述任何药剂可以同时施用,其中两种药剂存在于单独配制品中。在另一个替代方案中,可以在施用本披露的化合物后立即施用上述任何药剂,或反之亦然。在单独施用方案的一些实施例中,本披露的化合物和上述任何药剂的施用相隔几分钟,或相隔几小时,或相隔几天。
[0259]
由于本发明的一个方面考虑了用可以分开施用的药学活性化合物的组合治疗疾病/病症,本发明进一步涉及以试剂盒形式组合单独的药物组合物。该试剂盒包含两种单独的药物组合物:本发明的化合物和第二药物化合物。试剂盒包含用于容纳单独组合物的容
器,如分开的瓶子或分开的箔袋。容器的其他实例包括注射器、盒和袋。在一些实施例中,该试剂盒包含单独组分的使用说明。在优选地以不同剂型(例如,口服和肠胃外)施用单独组分时,以不同剂量间隔施用时,或在开方的医护专业人员需要组合中个别组分的滴定时,试剂盒形式特别有利。
[0260]
实验
[0261]
缩写:在本文可以使用以下缩写:
[0262]
[0263][0264]
除非另有说明,否则所有材料皆自商业供货商获得且无需进一步纯化即使用。除非另外指明,否则所有份数皆以重量计且温度以℃表示。所有微波辅助反应均使用biotage
tm
的smith synthesizer
tm
进行。所有化合物均显示与其指定结构一致的nmr光谱。熔点是在buchi装置上确定的,并且未校正。质谱数据通过电喷雾电离技术确定。如通过高效液相色谱法确定,所有实施例均纯化至》90%的纯度。除非另有说明,否则反应在室温下进行。
[0265]
在合成本发明的化合物中,可以期望使用某些离去基团。术语“离去基团”(“lg”)
通常是指可被亲核试剂置换的基团。此类离去基团是本领域已知的。离去基团的实例包括但不限于卤化物(例如i、br、f、cl)、磺酸盐/酯例如甲磺酸盐/酯、甲苯磺酸盐/酯)、硫化物(例如sch3)、n-羟基琥珀酰亚胺、n-羟基苯并三唑等。亲核试剂的实例包括但不限于胺、硫醇、醇、格氏试剂、阴离子种类(例如醇盐、酰胺、碳负离子)等。
[0266]
下文所呈现的实例说明本发明的具体实施例。这些实例是代表性的,无意以任何方式限制权利要求书的范围。
[0267]
应注意,当关于液体使用百分比(%)时,这是相对于溶液的体积百分比。当与固体一起使用时,这是相对于固体组合物的百分比。从市场供应商获得的材料通常不经进一步纯化即可使用。涉及空气或湿气敏感试剂的反应通常在氮气或氩气气氛下进行。纯度使用高效液相色谱法(hplc)系统用在254nm和215nm处的uv检测(系统a:agilent zorbax eclipse xdb-c8 4.6x150mm,5μm,5%至100%ch3cn(在含0.1%tfa的h2o中),15min,1.5ml/min;系统b:zorbax sb-c8,4.6x5mm,10%至90%ch3cn(在含0.1%甲酸的h2o中),12min,1.0ml/min)(加利福尼亚州圣克拉拉市安捷伦科技公司(agilent technologies,santa clara,ca))来测量。硅胶色谱法通常使用预装的硅胶筒(瑞典乌普萨拉biotage(biotage,uppsala,sweden)或内布拉斯加州林肯teledyne-isco(teledyne-isco,lincoln,ne))进行。1h nmr光谱在环境温度下在bruker av-400(400mhz)光谱仪(威斯康星州麦迪逊布鲁克公司(bruker corporation,madison,wi))或varian(加利福尼亚州圣克拉拉市安捷伦科技公司(agilent technologies,santa clara,ca))400mhz光谱仪上记录。所有观察到的质子均以四甲基硅烷(tms)或其他内部参照在指定的适当溶剂中的低磁场以百万分率(ppm)报告。数据报告如下:化学位移、多重性(s=单重峰,d=双重峰,t=三重峰,q=四重峰,br=宽峰,m=多重峰)、耦合常数和质子数。低分辨质谱(ms)数据是在agilent 1100系列(加利福尼亚州圣克拉拉市安捷伦科技公司(agilent technologies,santa clara,ca))lc/ms上用在254nm和215nm处的uv检测和低共振电喷雾模式(esi)确定的。
[0268]
一般合成方案
[0269]
除非另有说明,否则用于制备这些化合物的起始物质及试剂可自商业供货商(例如奥德里奇化工公司(aldrich chemical co.,(威斯康辛州密尔沃基市(milwaukee,wis.)))、巴亨公司(bachem(托伦斯(torrance),加利福尼亚州(calif.))、或西格玛公司(sigma(圣路易斯(st louis),密苏里州(mo.)))获得,或通过本领域技术人员已知的方法遵循诸如以下参考文献中所阐述的程序来制备:fieser and fieser's reagents for organic synthesis[fieser和fieser的有机合成试剂],第1-17卷(john wiley and sons[约翰
·
威利父子公司],1991);rodd's chemistry of carbon compounds[罗德氏碳化合物化学],第1-5卷及增刊(elsevier science publishers[爱思唯尔科学出版社],1989);organic reactions[有机反应],第1-40卷(john wiley and sons[约翰
·
威利父子公司],1991),march's advanced organic chemistry[马奇高级有机化学],(john wiley and sons[约翰
·
威利父子公司],第4版)及larock's comprehensive organic transformations[larock的全面有机转化](vch publishers inc.[vch出版公司],1989)。这些方案仅说明可合成本发明化合物的一些方法,且可对这些方案进行多种修改且将向参考本披露的本领域技术人员提供建议。反应的起始物质及中间物以及终产物可使用常规技术进行分离及纯化(若期望),这些技术包括(但不限于)过滤、蒸馏、结晶、色谱法及诸如此
类。这类材料可使用常规方式(包括物理常数及光谱数据)来表征。
[0270]
除非作出相反指定,否则本文所述的反应在大气压及以下温度范围内进行:约-78℃至约150℃、更优选地约0℃至约125℃且最优选地在约室温(或周围温度)下(例如,约20℃)。
[0271]
在该一般合成部分中出于清楚目的,在本发明的发明内容中定义的式(i)化合物可以示意性地绘制以包含ar1环和ar2环,如下:
[0272][0273]
其中基团l为-nr
10-(c=o)-或-(c=o)-nr
10-,x1为n或-cr3,x2为n或-cr4,并且x3为n或-cr1;环ar1位于接头左侧,并且环ar2位于接头右侧
[0274]
通常,式(i)化合物可以通过以下三个一般步骤如下合成:
[0275]
步骤1:环ar1化合物的制备。
[0276]
步骤2:环ar2化合物的制备。
[0277]
步骤3:将环ar1化合物与环ar2化合物偶联
[0278]
下文的一般方案a-d意指向普通合成化学家提供指导,他们将容易了解,可以视需要修改溶剂、浓度、试剂、保护基团、合成步骤的顺序、时间、温度等,这些完全在普通技术人员的技术和判断范围内。
[0279]
在一个实施例中,下文的方案a-c提供了式(i)化合物的通用制备,其中l为-nr
10-(c=o);x1为-cr4;x2为n;并且x3为-cr1;具有以下式(ia):
[0280]
其中优选地,r5为h。
[0281]
式(ia)化合物的实例包括但不限于:
[0282]
其中优选地,r5为h。
[0283]
在另一个实施例中,下文的方案a-c提供了式(i)化合物的通用制备,其中l为-nr
10-(c=o);x1为-n;x2为-cr3;并且x3为-cr1;具有式(ic):
[0284][0285]
式(ic)化合物的实例包括但不限于
[0286][0287]
方案a:化合物(ia)或(ic)的制备:
[0288]
根据方案a,在一个实施例中如本文所披露的式(i)化合物可以如下合成:
[0289]
步骤1a:环ar1化合物的制备:
[0290][0291]
步骤a-1:环ar1化合物的制备:
[0292]
化合物a-1,其中w1是h,可以通过用氯磺酸处理转化为磺酰氯。在合适的碱存在下,在合适的有机溶剂如nmp、二噁烷、乙腈、四氢呋喃、dmf、二氯甲烷等中,与含r
13
基团的胺进一步反应,得到磺酰胺a-2。碱的实例包括但不限于二异丙基乙胺、碳酸钾或氢化钠。r
13
胺的实例包括但不限于叔丁胺、环丙胺、环己胺、哌啶或4,4-二氟哌啶。
[0293]
可替代地,化合物a-1,其中w1是f,可以通过两步程序转化为磺酰氯:用苄基硫醇
处理,然后用1,3-二氯-5,5-二甲基乙内酰脲进行氧化氯化。化合物a-1可商购获得或可以由本领域技术人员通过已知方法合成。
[0294]
化合物a-1的实例包括但不限于1-甲基-3-硝基苯、1-氯-4-硝基苯、1-甲氧基-4-硝基苯、1-甲氧基-3-硝基苯或3,5-二氟硝基苯。
[0295]
然后化合物a-2可以在氢气存在下与合适的还原剂如钯催化剂和氢源如pd/c反应以形成化合物a-3。
[0296]
步骤a-1-a:环ar1化合物的制备:
[0297][0298]
可替代地,化合物a-4可与r
13
胺试剂反应,随后进行金属催化胺化,其中使用合适的钯或铜催化剂和碱,以形成化合物a-3,如步骤a-1中所定义。可商购的化合物a-4的实例包括3-溴-2-氟苯磺酰氯。
[0299]
步骤a-1-b:环ar1化合物的制备:
[0300][0301]
又可替代地,硫醇化合物a-5可与r
13
试剂通过硫醇烷基化反应随后氧化反应形成化合物a-3,其中r2=so2r
13
。可以按此方式使用的r
13
试剂的实例包括但不限于亚甲基环丁烷、2,2,2-三氟乙基4-甲基苯磺酸酯或环戊-2-烯酮。
[0302]
步骤a-1-c:环ar1化合物的制备:
[0303][0304]
又可替代地,化合物a-1,其中w1是卤基(例如氟、氯或溴),可以在合适的碱存在下,在合适的有机溶剂如nmp、二噁烷、乙腈、四氢呋喃、dmf等中与合适的r2试剂反应,然后在氢气存在下与合适的还原剂如钯催化剂和氢源如pd/c反应以形成化合物a-3。
[0305]
化合物a-1可商购获得或可以由本领域技术人员通过已知方法合成。
[0306]
化合物a-1的实例包括但不限于1-氟-3-硝基苯、1,3-二氟-5-硝基苯、1-氟-3-甲基-5-硝基苯或2-溴-1-氟-4-硝基苯。
2获得的化合物a-7与活化剂(例如酰基氯(cocl)2或socl2)反应以形成酰基氯衍生物,然后可以将其与化合物a-3反应形成化合物a-8。
[0319]
可替代地,可以在偶联试剂(例如n,n
’‑
二异丙基碳二亚胺、n-(3-二甲基氨基丙基)-n
’‑
乙基碳二亚胺、苯并三唑-1-基-氧三吡咯烷基六氟磷酸鏻、o-(苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸盐、亚硫酰氯、羰基二咪唑和多膦酸酐)存在下在合适的有机溶剂(例如乙腈、四氢呋喃、dmf、二氯甲烷等)中将化合物a-3与从步骤a-2获得的化合物a-7直接偶联。
[0320]
那些普通合成化学家将容易理解,可以使用其他偶联剂。可以通过在合适的有机溶剂(例如dmso、乙腈、四氢呋喃、dmf、二氯甲烷等)中在金属催化剂和r1试剂存在下的转化反应(例如金属催化的磺酰胺化、硫化或磺酰化)进一步处理卤素基团w3来形成化合物(ia)或(ic),该r1试剂例如(1)1-甲基环丙烷-1-磺酰胺、(2)3-甲基氧杂环丁烷-3-胺、(3)叔丁基3-巯基氮杂环丁烷-1-甲酸酯、(4)2-氨磺酰基丙酸乙酯、(5)2-羟基丙烷-1-磺酰胺、(6)2-羟基乙烷-1-磺酰胺、(7)碘乙酸乙酯、(8)2-巯基丙烷-1-醇、(9)2-巯基-2-甲基丙烷-1-醇、(10)2-氨基乙-1-醇或(11)环丙烷硫醇。本领域普通技术人员将容易理解,偶联反应(例如如步骤a-3所示的)可以在多达中已知条件下进行。
[0321]
方案b:化合物(ia)或(ic)的替代制备:
[0322]
步骤b-1:环ar1化合物的制备:参见上述方案a的步骤a-1至a-1-d
[0323]
步骤b-2:环ar2化合物的制备:
[0324][0325]
方案b提供用于形成本文所披露的式(ia)或(ic)的化合物的替代性方法。在如方案a中描述的步骤a-1至a-1d中任一步之后,可以可替代地将r1基团在步骤b-2中引入到环ar2中,而不是在方案a的步骤b-3中引入。根据步骤2b,可以在碱(例如碳酸钾)存在下将化合物b-1(其中w4和w5中每一个独立地为卤素,例如氟、氯、溴或碘)与适当的羧酸保护基团(pg1试剂,例如碘甲烷)反应以形成甲酯或在合适的有机溶剂(例如nmp、乙腈、四氢呋喃、dmf、二氯甲烷等)中与其他合适的保护基团反应以形成其他酯(例如苄基酯),以形成化合物b-2,其中w4和w5中每一个如化合物b-1中定义的。在碱如叔丁醇钾的存在下,化合物b-2可以与适当的受保护的胺(pg2试剂),例如4,4-二甲基噁唑烷-2-酮反应以形成化合物b-3。其可以与r
x
试剂(例如(1)6-氮杂螺[2.5]辛烷盐酸盐、(2)4,4-二甲基哌啶盐酸盐、(3)3,4,4-三甲基哌啶盐酸盐、(4)4-甲基-6-氮杂螺[2.5]辛烷盐酸盐或(5)7-氮杂螺[3.5]壬烷盐酸盐)在合适的有机溶剂(如nmp、乙腈、四氢呋喃、dmf、二氯甲烷、dmso等)中反应形成化合物b-4,然后可将其与合适的羧酸脱保护剂进一步反应以形成化合物b-5。适当的羧酸保护基
团和脱保护剂是本领域技术人员已知的,例如如有机合成中的greene保护基团中所讨论的。
[0326]
步骤b-3:将环ar1化合物与环ar2化合物偶联并去除保护基团
[0327][0328]
步骤b-3可以在与上述步骤a-3中所述的偶联反应类似的条件下进行。
[0329]
方案c
[0330]
步骤c-1:环ar1化合物的制备:参见上述方案a的步骤a-1至a-1d
[0331]
步骤c-2:环ar2化合物的制备:化合物c-1可商购获得或可以根据本领域技术人员已知的方法来制备。
[0332]
步骤c-3:将环ar1化合物与环ar2化合物偶联并引入r
x
[0333][0334]
可以在合适的有机溶剂(例如四氢呋喃、二氯甲烷等)中将可商购的化合物c-1(例如2-氟-3-吡啶甲酸或3-氟异烟酸)与活化剂(例如酰基氯(cocl)2或socl2)反应以形成酰基氯衍生物,然后可以将其与化合物a-3反应形成化合物c-2。
[0335]
可替代地,可以在偶联试剂(例如n,n
’‑
二异丙基碳二亚胺、n-(3-二甲基氨基丙基)-n
’‑
乙基碳二亚胺、苯并三唑-1-基-氧三吡咯烷基六氟磷酸鏻、o-(苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸盐、亚硫酰氯、羰基二咪唑和多膦酸酐)存在下在合适的有机溶剂(例如乙腈、四氢呋喃、dmf、二氯甲烷等)中将化合物c-1与从步骤a-2获得的化合物a-3直
接偶联。可以在合适的有机溶剂(例如nmp、乙腈、四氢呋喃、dmf、二氯甲烷、dmso等)中将化合物c-2与r
x
试剂(例如(1)6-氮杂螺[2.5]辛烷盐酸盐、(2)4,4-二甲基哌啶盐酸盐、(3)3,4,4-三甲基哌啶盐酸盐、(4)4-甲基-6-氮杂螺[2.5]辛烷盐酸盐或(5)7-氮杂螺[3.5]壬烷盐酸盐)反应以形成化合物(ia)。
[0336]
方案d
[0337]
在另一个实施例中,式(i)化合物具有下式:
[0338]
其中l为-(c=o)-nh-;如式(ib)、(id)、和(if)化合物所示:
[0339]
以及
[0340]
如上文所定义的,可以根据方案d合成。
[0341]
步骤d-1:环ar1化合物的制备:环ar1化合物的一个实施例包括化合物d-1,具有下式:
[0342][0343]
在步骤d-1中,可以在合适的碱存在下在合适的有机溶剂例如nmp、二噁烷、乙腈、
四氢呋喃、dmf、二氯甲烷等中将化合物d-1(其中w5为卤基,例如氟或氯)与r2试剂反应以形成化合物d-2。化合物d-1的实例包括但不限于3-氟苯甲酸或3-氟-3-甲基苯甲酸。r2试剂的实例包括但不限于(1)(r)-2-甲基吗啉、(2)4,4-二氟哌啶盐酸盐、或(3)3,3-二氟氮杂环丁烷盐酸盐。碱的实例包括但不限于二异丙基乙胺、碳酸钾。
[0344]
化合物d-1可商购获得或可根据本领域技术人员已知的方法和试剂来制备。
[0345]
步骤d-2:环ar2化合物的制备:
[0346][0347]
在步骤d-2中,可以在合适的有机溶剂(例如nmp、乙腈、四氢呋喃、dmf、二氯甲烷等)中将化合物d-3(其中w6为卤基,例如氟、氯、溴或碘)与r
x
试剂(例如(1)6-氮杂螺[2.5]辛烷、(2)4,4-二甲基哌啶、(3)3,4,4-三甲基哌啶、(4)4-甲基-6-氮杂螺[2.5]辛烷或(5)7-氮杂螺[3.5]壬烷)反应以形成化合物d-4。化合物d-3的实例包括但不限于2-氟吡啶-3-胺、2-氟-6-甲基吡啶-3-胺、2-氟-5-甲基吡啶-3-胺、4-氟吡啶-3-胺、或6-溴-2-氟吡啶-3-胺。
[0348]
步骤d-3:将环ar1化合物与环ar2化合物偶联。
[0349][0350]
在步骤d-3中,化合物d-4,其中x1为n;x2为-cr4;并且x3为w6,其是卤基(例如氟、氯、溴或碘),可以与化合物d-2在活化剂如t3p或hatu或tatu的存在下,以及在dipea的存在下,在合适的有机溶剂如乙腈、四氢呋喃、dmf、二氯甲烷等中反应,以形成化合物(d-5),其中x1为n;x2为-cr4;并且x3为w6。
[0351]
然后可以通过在合适的有机溶剂(例如dmso、乙腈、四氢呋喃、dmf等)中在金属催化剂和r1试剂存在下的转化反应(例如snar、金属催化的磺酰胺化、硫化或磺酰化)进一步处理卤基基团w6来形成化合物(id),该r1试剂例如(1)氧杂环丁烷3-胺、(2)2-氨基-2-甲基丙烷-1-醇、(3)(3-氨基氧杂环丁烷-3-基)甲醇、(4)2-氨磺酰基丙酸乙酯、(5)2-羟基丙烷-1-磺酰胺、(6)2-羟基乙烷-1-磺酰胺、(7)2-巯基丙烷-1-醇、(8)2-巯基-2-甲基丙烷-1-醇、(9)2-氨基乙-1-醇或(10)环丙烷硫醇,其中x1为n;x2为-cr4;并且x3为r1。
[0352][0353]
可替代地,化合物d-4,其中x1为-cr3;x2为n;并且x3为w7,其是卤基(例如氟、氯、溴或碘),可以与化合物d-2在活化剂如t3p或hatu或tatu的存在下,以及在dipea的存在下,在合适的有机溶剂如乙腈、四氢呋喃、dmf、二氯甲烷等中反应,以形成化合物(d-5),其中x1为-cr3;x2为n;并且x3为w7。
[0354]
然后可以通过在合适的有机溶剂(例如dmso、乙腈、四氢呋喃、dmf等)中在金属催化剂和r1试剂存在下的转化反应(例如snar、金属催化的磺酰胺化、硫化或磺酰化)进一步处理卤基基团w7来形成化合物(id),该r1试剂例如(1)氧杂环丁烷3-胺、(2)2-氨基-2-甲基丙烷-1-醇、(3)(3-氨基氧杂环丁烷-3-基)甲醇、(4)2-氨磺酰基丙酸乙酯、(5)2-羟基丙烷-1-磺酰胺、(6)2-羟基乙烷-1-磺酰胺、(7)2-巯基丙烷-1-醇、(8)2-巯基-2-甲基丙烷-1-醇、(9)2-氨基乙-1-醇或(10)环丙烷硫醇,其中x1为-cr3;x2为n;并且x3为r1。
[0355][0356]
又可替代地,化合物d-4,其中x1为-cr3;x2为cr4;并且x3为n,可以与化合物d-2在活化剂如t3p或hatu或tatu的存在下,以及在dipea的存在下,在合适的有机溶剂如乙腈、四氢呋喃、dmf、二氯甲烷等中反应,以形成化合物(if),其中x1为-cr3;x2为cr4;并且x3为n。
[0357]
本领域技术人员将容易理解,偶联反应(例如如步骤d-3所示的)可以在多达中已知条件下进行。
[0358]
环ar1中间体的制备
[0359]
中间体1:3-氨基-n-(叔丁基)-5-甲基苯磺酰胺。
[0360][0361]
步骤1:在15min内向冰冷的1-甲基-3-硝基苯(2.0g,14.58mmol)中缓慢加入氯磺酸(14.57ml,219mmol)。将所得混合物在80℃下加热3h。将反应混合物用碎冰淬灭并用etoac(50ml)萃取。将有机层用饱和盐水洗涤,经无水硫酸钠干燥,过滤,并在减压下浓缩以得到呈棕色液体的3-甲基-5-硝基苯磺酰氯。将粗样品立即用于下一步。1h nmr(400mhz,氯仿-d)δ8.70(t,j=1.9hz,1h),8.52-8.39(m,1h),8.18(t,j=1.7hz,1h),和2.66(s,3h)。
[0362]
步骤2:向2-甲基丙-2-胺(1.09g,14.94mmol)和dipea(3.56ml,20.37mmol)在dcm(50ml)中的冰冷溶液中缓慢加入3-甲基-5-硝基苯-1-磺酰氯(粗制)(3.2g,13.58mmol)在二氯甲烷(50ml)中的溶液。添加后,将反应混合物缓慢升温至环境温度并在此搅拌2h。然后,加入水(100ml),搅拌10min。用二氯甲烷(2x100ml)萃取水层。将合并的有机萃取物经无水硫酸钠干燥,过滤,并且在减压下浓缩。将粗物质吸附到硅胶塞上并且通过硅胶色谱法(以在石油醚中的0%至10%etoac梯度洗脱)纯化,以提供呈淡黄色固体的n-(叔丁基)-3-甲基-5-硝基苯磺酰胺(1.9g,6.98mmol,51%产率)。1h nmr(300mhz,氯仿-d)δ8.56(d,j=
5.8hz,1h),8.27-8.16(m,1h),8.10-7.99(m,1h),4.86(s,1h),2.57(s,3h),和1.42-1.12(s,9h)。ms(esi负离子)m/z:271.2(m-1)。
[0363]
步骤3:在氢气氛围(约14.5psi-气囊压力)下搅拌n-(叔丁基)-3-甲基-5-硝基苯磺酰胺(1.9g,6.98mmol)和10%pd/c(0.6g,0.56mmol)在meoh(50ml)中的混合物持续3h,然后通过垫过滤。将垫用甲醇(150ml)冲洗。将滤液在减压下浓缩以提供白色残余物。将粗物质吸附到硅胶塞上并且通过色谱法(以在石油醚中的15%-20%etoac梯度洗脱)纯化,以提供呈灰白色固体的3-氨基-n-(叔丁基)-5-甲基苯磺酰胺(1.2g,4.95mmol,71%产率)。1h nmr(400mhz,dmso-d6)δ7.33-7.13(m,1h),6.83(dq,j=4.7,2.2hz,1h),6.76(dd,j=3.8,2.2hz,1h),6.52(q,j=3.5,2.6hz,1h),5.55-5.29(m,2h),2.27-2.05(s,3h),和1.20-0.98(s,9h)。m/z(esi):243.1(m 1)。
[0364]
表1:中间体1-1至1-3的制备类似于中间体1的步骤2-3:
[0365][0366]
中间体2:3-氨基-n-(叔丁基)-5-氟苯磺酰胺
[0367][0368]
步骤1:在0℃下向3,5-二氟硝基苯(1ml,8.80mmol)、碳酸钾(0.59ml,9.68mmol)和dmf(10ml)的混合物中加入苄硫醇(1.1ml,9.24mmol)。将反应混合物在rt下搅拌2h,并且添加水(10ml)。将所得混合物用etoac(3x100ml)萃取。将合并的有机萃取物用无水na2so4干燥并在真空中浓缩以提供粗产物,其无需进一步纯化即可使用。
[0369]
步骤2:向100-ml圆底烧瓶中加入苄基(3-氟-5-硝基苯基)硫烷(1.63g,6.19mmol)、乙腈(12ml)、水(0.3ml)、乙酸(0.45ml)。将反应混合物冷却至0℃并分批加入1,3-二氯-5,5-二甲基乙内酰脲(1.14ml,8.67mmol)。添加完成后,将反应混合物在0℃下搅拌20min,然后用饱和nahco3稀释并用etoac萃取。将有机萃取物用水洗涤,并经na2so4干燥。将溶液过滤并在真空中浓缩,得到呈白色固体的粗物质3-氟-5-硝基苯-1-磺酰氯(1.48g,6.19mmol,100%产率),并且无需进一步纯化即可使用。m/z(esi):240.2(m 1)。
[0370]
步骤3:向100-ml圆底烧瓶中加入3-氟-5-硝基苯-1-磺酰氯(1.66g,6.92mmol)、叔丁胺(0.51ml,6.92mmol)、dipea(1.81ml,10.38mmol)、和二氯甲烷(10ml)。将混合物在rt下搅拌3h,用饱和nahco3稀释,并用二氯甲烷(6ml)萃取。将有机萃取物用水洗涤,并经na2so4干燥。将溶液过滤并在真空中浓缩,得到呈白色油的粗物质。将粗物质吸附到硅胶塞上并且通过色谱法通过硅胶柱(以在庚烷中的0%至25%etoac梯度洗脱)纯化以提供呈白色固体的n-(叔丁基)-3-氟-5-硝基苯磺酰胺(1.02g,3.70mmol,53%产率)。m/z(esi):290.2(m na)。
[0371]
步骤4:向25-ml玻璃小瓶中加入铁(299mg,5.43mmol)、氯化铵(48mg,0.905mmol)、n-(叔丁基)-3-氟-5-硝基苯磺酰胺(500mg,1.81mmol)和etoh(6ml),然后加入0.5ml水。将反应混合物在80℃下搅拌1h,冷却至rt,经过滤,并在真空下除去溶剂。将反应混合物用饱和nh4cl(10ml)稀释并用etoac(10ml)萃取。将有机萃取物用水(10ml)洗涤,并经na2so4干燥。将溶液过滤并在真空中浓缩,得到呈白色油的粗物质。将粗物质吸附到硅胶塞上并且通过色谱法通过redi-sep预填充的硅胶柱(以在庚烷中的0%至40%etoac梯度洗脱)纯化以提供呈白色固体的3-氨基-n-(叔丁基)-5-氟苯磺酰胺(334mg,1.35mmol,75%产率)。1h nmr(400mhz,氯仿-d)δ6.99(t,j=1.76hz,1h),6.93(td,j=1.91,8.12hz,1h),6.51(td,j=2.35,10.17hz,1h),4.52(s,1h),1.26(s,9h)。m/z(esi):247.1(m 1)。
[0372]
中间体3:3-氨基-n-(叔丁基)-2-氟苯磺酰胺。
[0373][0374]
步骤1:在氮气氛下,向3-溴-2-氟苯磺酰氯(4.0g,14.62mmol)在二氯甲烷(40ml)中的溶液中加入三乙胺(6.12ml,43.9mmol)和叔丁胺(2.33ml,21.94mmol)。将反应混合物在室温下搅拌18h。将反应混合物用水(30ml)淬灭,并且将双相混合物用二氯甲烷(3x50ml)萃取。将合并的有机萃取物用盐水(50ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞上并且通过硅胶色谱法(以在己烷中的5%至8%etoac洗脱)纯化,以给出呈灰白色固体的3-溴-n-(叔丁基)-2-氟苯磺酰胺(3.5g,77%产率)。1h nmr(400mhz,dmso-d6):δ8.01-7.95(m,2h),7.85-7.80(m,1h),7.36-7.31(m,1h),1.13(s,9h)。m/z(esi):308.1[m-1]。
[0375]
步骤2:在氮气氛下,向3-溴-n-(叔丁基)-2-氟苯磺酰胺(3.2g,10.32mmol)在乙二醇(5ml)中的溶液中加入n1,n
2-二甲基乙烷-1,2-二胺(0.091g,1.032mmol)、碳酸钾(0.28g,2.06mmol)、氧化铜(i)(0.074g,0.516mmol)和氨水(7.5ml)。将反应容器关闭并在100℃下搅拌1h。将反应混合物冷却至室温,用水(30ml)稀释,并且用etoac(3x50ml)萃取。将合并的有机萃取物用盐水溶液(50ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞(60-120目)上并且通过硅胶色谱法(以在己烷中的25%至35%etoac洗脱)纯化,以提供呈灰白色固体的3-氨基-n-(叔丁基)-2-氟苯磺酰胺(0.90g,3.65mmol,35%产率)。1h nmr(400mhz,dmso-d6):δ7.56(s,1h),6.98-6.88(m,3h),5.50(s,2h),1.12(s,9h)。m/z(esi):247.2[m 1]。
[0376]
中间体4:3-((1-甲基环丁基)磺酰基)苯胺
[0377][0378]
步骤1:小心地向3-氨基苯硫醇(3.0g,23.96mmol)和亚甲基环丁烷(2.94g,43.1mmol)在二乙醚(30.0ml)中的混合物中加入浓h2so4(3.83ml,71.9mmol)并在室温下搅拌45min。将反应混合物通过倒入冷的饱和nahco3水溶液(200ml)中淬灭并用etoac
(3x200ml)萃取。将合并的有机萃取物用冷水(5x50ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞上并且通过快速色谱法通过redi-sep预填充的硅胶柱(以在己烷中的1%至15%etoac梯度洗脱)纯化,以提供呈无色油的3-((1-甲基环丁基)硫代)苯胺(3.2g,69%产率)。1h nmr(400mhz,dmso-d6):δ7.02-6.95(m,1h),6.63(s,1h),6.55-6.45(m,2h),2.27-2.14(m,2h),2.08-1.84(m,4h),1.45(m,3h),nh2质子不可见。m/z(esi):194.2[m 1]。
[0379]
步骤2:在室温下向3-((1-甲基环丁基)硫代)苯胺(3.0g,15.52mmol)在四氢呋喃(30ml)中的溶液中加入boc酸酐(7.21ml,31.0mmol)和三乙胺(3.24ml,23.28mmol)并搅拌18h。将反应混合物用水(100ml)淬灭并用etoac(200ml)萃取。将有机层用水(50ml)洗涤,经na2so4干燥,过滤并在减压下浓缩。将粗残余物吸附到硅胶塞(60-120目)上并且通过快速色谱法通过redi-sep预填充的硅胶柱(40g)(以在己烷中的5%至8%etoac梯度洗脱)纯化,以提供呈白色固体的叔丁基(3-((1-甲基环丁基)硫代)苯基)氨基甲酸酯(3.2g,70%产率)。1h nmr(300mhz,氯仿-d):δ7.44-7.33(m,2h),7.30-7.20(m,1h),7.10(d,j=7.6hz,1h),6.50(s,1h),2.42-2.26(m,2h),2.16-1.93(m,4h),1.57(s,9h),1.54(s,3h)。m/z(esi):294.2[m 1]。
[0380]
步骤3:向叔丁基(3-((1-甲基环丁基)硫代)苯基)氨基甲酸酯(2.0g,6.82mmol)在甲醇(40ml)和水(20ml)中的溶液中加入oxone(9.22g,15.00mmol)并在室温下搅拌5h。将反应混合物在减压下浓缩,使用10%nahco3水溶液(50ml)调节至ph 7并在etoac(3x50ml)中萃取。将合并的有机萃取物用盐水溶液(100ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞上并且通过快速色谱法通过redi-sep预填充的硅胶柱(以在己烷中的1%至40%etoac梯度洗脱)纯化,以提供呈白色固体的叔丁基(3-((1-甲基环丁基)磺酰基)苯基)氨基甲酸酯(1.8g,81%产率)。1h nmr(400mhz,dmso-d6)δ9.78(s,1h),8.05(s,1h),7.78-7.68(m,1h),7.53(d,j=8.0hz,1h),7.39(d,j=7.8hz,1h),2.72-2.64(m,2h),2.00(dt,j=10.8,7.8hz,1h),1.91-1.68(m,3h),1.49(s,9h),1.35(s,3h)。m/z(esi):326.1[m 1]。
[0381]
步骤4:在0℃下向叔丁基(3-((1-甲基环丁基)磺酰基)苯基)氨基甲酸酯(1.8g,5.53mmol)在1,4-二噁烷(20ml)中的溶液中加入hcl(4m在1,4-二噁烷中,6.91ml,27.7mmol)并在环境温度下搅拌18h。将反应混合物在减压下浓缩,使用10%nahco3水溶液调节至ph 7-8。将反应混合物用水(50ml)稀释并用etoac(3x100ml)萃取。将合并的有机萃取物用盐水(100ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将残余物用二乙醚(100ml)研磨,以得到呈灰白色固体的3-((1-甲基环丁基)磺酰基)苯胺(1.05g,84%产率)。1h nmr(400mhz,dmso-d6)δ7.34-7.21(m,1h),7.00(s,1h),6.93-6.79(m,2h),5.66(s,2h),2.73-2.59(m,2h),2.07-1.93(m,1h),1.85-1.76(m,3h),1.35(s,3h)。m/z(esi):226.1[m 1]。
[0382]
中间体5:3-((1,1,1-三氟-2-甲基丙烷-2-基)磺酰基)苯胺。
[0383][0384]
步骤1:向2,2,2-三氟乙-1-醇(5.0g,50.0mmol)在二氯甲烷(300ml)中的溶液中加入三乙胺(4.64ml,33.3mmol)和对甲苯磺酰氯(6.35g,33.3mmol)并在室温下搅拌18h。将反应混合物用水(200ml)淬灭并且在二氯甲烷(2x500ml)中萃取。将合并的有机萃取物用水洗涤,经na2so4干燥,过滤并在减压下浓缩以给出呈灰白色固体的2,2,2-三氟乙基4-甲基苯磺酸酯(5g,59%产率)。1h nmr(400mhz,氯仿-d):δ8.85(d,j=8.5hz,2h),8.43(d,j=8.5hz,2h),5.38(q,j=10.2hz,2h),3.50(s,3h)。m/z(esi):255.1[m 1]。
[0385]
步骤2:在0℃下向3-氨基苯硫醇(4.43g,35.4mmol)在thf(225ml)中的溶液中加入氢化钠(1.77g,44.3mmol)并搅拌30min。然后,加入2,2,2-三氟乙基4-甲基苯磺酸酯(9.0g,35.4mmol)并将反应混合物搅拌18h。将反应混合物用水(20ml)淬灭并且用etoac(2x50ml)萃取。将合并的有机萃取物用水洗涤,经na2so4干燥,过滤并在减压下浓缩。将粗残余物通过快速色谱法通过redi-sep预填充的硅胶柱(以在己烷中的5%至10%etoac梯度洗脱)纯化,以提供呈浅棕色油的3-((2,2,2-三氟乙基)硫代)苯胺(5g,68%产率)。1h nmr(300mhz,dmso-d6):δ6.99(d,j=7.7hz,1h),6.66-6.58(m,2h),6.47(d,j=8.0hz,1h),5.22(s,2h),3.87(q,j=10.2hz,2h)。m/z(esi):208.2[m 1]。
[0386]
步骤3:向3-((2,2,2-三氟乙基)硫代)苯胺(5.0g,24.13mmol)在四氢呋喃(50ml)中的溶液中加入三乙胺(6.73ml,48.3mmol)和boc2o(8.40ml,36.2mmol)并在室温下搅拌18h。将反应混合物用水(100ml)淬灭并用etoac(200ml)萃取。将有机层用水(100ml)洗涤,经na2so4干燥,过滤并在减压下浓缩。将粗物质吸附到硅胶塞(60-120目)上并且通过快速色谱法通过redi-sep预填充的硅胶柱(以在己烷中的5%至8%etoac梯度洗脱)纯化,以提供呈白色固体的叔丁基(3-((2,2,2-三氟乙基)硫代)苯基)氨基甲酸酯(4.2g,57%产率)。1h nmr(400mhz,dmso-d6):δ9.43(s,1h),7.62(s,1h),7.33(d,j=8.4hz,1h),7.27-7.21(m,2h),3.93(q,j=10.0hz,2h),1.48(s,9h)。m/z(esi):308.1[m 1]。
[0387]
步骤4:向叔丁基(3-((2,2,2-三氟乙基)硫代)苯基)氨基甲酸酯(4.2g,13.67mmol)在甲醇(40ml)和水(20ml)中的溶液中加入oxone(9.24g,30.1mmol)并在室温下搅拌18h。减压浓缩反应混合物。将反应混合物用10%nahco3水溶液中和并用etoac(3x200ml)萃取。将合并的有机萃取物用水(2x100ml)洗涤,经na2so4干燥,过滤并在减压下
浓缩以给出呈白色固体的叔丁基(3-((2,2,2-三氟乙基)磺酰基)苯基)氨基甲酸酯(3.2g,69%产率)。1h nmr(300mhz,dmso-d6):δ9.86(s,1h),8.22(s,1h),7.70(d,j=7.2hz,1h),7.64-7.56(m,2h),4.92(q,j=10.0hz,2h),1.49(m,9h)。m/z(esi):338.0[m-1]
[0388]
步骤5:在0℃下,向叔丁基(3-((2,2,2-三氟乙基)磺酰基)苯基)氨基甲酸酯(8.5g,25.05mmol)在无水四氢呋喃(50ml)中的溶液中加入甲基碘(15.66ml,250mmol)和hmpa(43.6ml,250mmol)。将反应混合物冷却至-78℃并在氮气氛下加入lda(2m溶液于thf中,31.3ml,62.6mmol)。将反应混合物在-78℃下搅拌30min,并使其升温至室温。将反应混合物用饱和nh4cl水溶液(100ml)稀释并用二乙醚(3x250ml)萃取。将合并的有机萃取物用盐水(250ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞上并且通过硅胶色谱法(以在己烷中的5%至7%etoac洗脱)纯化,以提供呈浅黄色固体的叔丁基(3-((1,1,1-三氟-2-甲基丙烷-2-基)磺酰基)苯基)氨基甲酸酯(1.9g,21%产率)。1h nmr(400mhz,dmso-d6)δ9.86(s,1h),8.15(s,1h),7.80(d,j=8.7hz,1h),7.62-7.58(m,1h),7.50(d,j=7.9hz,1h),1.58-1.43(m,15h)。m/z(esi):366.2[m-1]
[0389]
步骤6:在0℃下向叔丁基(3-((1,1,1-三氟-2-甲基丙烷-2-基)磺酰基)苯基)氨基甲酸酯(1.8g,4.90mmol)在1,4-二噁烷(20ml)中的溶液中加入盐酸(1,4-二噁烷中的4n溶液,12.3ml,49.0mmol)并在室温下搅拌18h。将反应混合物在减压下浓缩,并且使用10%nahco3水溶液调节至ph 7-8。将反应混合物用水(50ml)稀释并用etoac(3x100ml)萃取。将合并的有机萃取物用盐水溶液(100ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞(60-120目)上并且通过isolera-biotage(以在己烷中的17%至19%etoac洗脱)纯化,以提供呈灰白色固体的3-((1,1,1-三氟-2-甲基丙烷-2-基)磺酰基)苯胺(0.9g,69%产率)。1h nmr(400mhz,dmso-d6)δ7.30(d,j=7.9hz,1h),7.08(s,1h),7.00-6.89(m,2h),5.75(s,2h),1.49(s,6h)。m/z(esi):268.1[m 1]。
[0390]
中间体6:3-((3,3-二氟环戊基)磺酰基)苯胺。
[0391][0392]
步骤1:向3-氨基苯硫醇(10.0g,80mmol)在丙酮(160ml)中的溶液中加入boc酸酐(37.1ml,160mmol)和10%na2co3水溶液(20ml,160mmol)。将反应混合物在室温下搅拌18h,用水(250ml)淬灭并用etoac(3x250ml)萃取。将合并的有机萃取物用盐水(100ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗物质吸附到硅胶塞上并且通过快速色谱法通过
redi-sep预填充的硅胶柱(以在己烷中的1%至15%etoac梯度洗脱)纯化,以提供呈白色固体的叔丁基(3-巯基苯基)氨基甲酸酯(11g,61%产率)。1h nmr(400mhz,氯仿-d)δ13.1(s,1h),7.56(s,1h),7.42(d,j=7.2hz,1h),7.31(dd,j=7.6,7.2hz,1h),7.19(d,j=7.6hz,1h),6.54(s,1h),1.52(s,9h)。
[0393]
步骤2:将叔丁基(3-巯基苯基)氨基甲酸酯(10.0g,44.4mmol)和环戊-2-烯酮(14.58g,178mmol)的混合物在120℃下搅拌24h。将反应混合物直接吸附到硅胶塞上并且通过硅胶色谱法(以在己烷中的9%至12%etoac洗脱)纯化,以提供呈无色粘稠油的叔丁基(3-((3-氧代环戊基)硫代)苯基)氨基甲酸酯(10.0g,73%产率)。1h nmr(300mhz,氯仿-d)δ7.54(s,1h),7.28-7.17(m,2h),7.07(d,j=8.8hz,1h),6.55(s,1h),3.94(t,j=8.0hz,1h),2.71-2.58(m,1h),2.45-2.20(m,4h),2.12-1.97(m,1h),1.53(s,9h)。m/z(esi):308.6[m 1]:
[0394]
步骤3:向叔丁基(3-((3-氧代环戊基)硫代)苯基)氨基甲酸酯(5.0g,16.27mmol)在meoh(100ml)中的溶液中加入oxone(22g,35.8mmol)在水(50ml)中的溶液并在室温下搅拌18h。将反应混合物在减压下浓缩以除去甲醇,并且将所得水溶液用dcm(3x100ml)萃取。将合并的有机萃取物用盐水(50ml)洗涤,经na2so4干燥,过滤,并且在减压下浓缩,以提供呈浅黄色油的叔丁基(3-((3-氧代环戊基)磺酰基)苯基)氨基甲酸酯(4.5g,粗制),将其按原样用于下一步。1h nmr(400mhz,dmso-d6)δ9.84(s,1h),8.14(s,1h),7.71(d,j=7.92hz,1h),7.60-7.53(m,1h),7.48(d,j=7.7hz,1h),4.08(t,j=7.4hz,1h),2.45-2.16(m,6h),1.50(s,9h)。
[0395]
步骤4:在-78℃下,在氮气氛下向叔丁基(3-((3-氧代环戊基)磺酰基)苯基)氨基甲酸酯(1.65g,4.86mmol)在dcm(20ml)中的溶液中加入dast(1.606ml,12.15mmol)并在-78℃下搅拌30min。使反应混合物缓慢地升温至室温且搅拌18h。将反应混合物用1n naoh水溶液(10ml)淬灭,用水(25ml)稀释并用dcm(3x50ml)萃取。将合并的有机萃取物用盐水(80ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗物质吸附到硅胶塞上并且通过硅胶色谱法(以在己烷中的6%至8%etoac洗脱)纯化,以提供呈无色粘稠油的叔丁基(3-((3,3-二氟环戊基)磺酰基)苯基)氨基甲酸酯(0.95g,54%产率)。1h nmr(300mhz,dmso-d6):δ9.84(s,1h),8.14(s,1h),7.70(d,j=7.8hz,1h),7.61-7.43(m,2h),4.13-3.98(m,1h),2.41-1.95(m,6h),1.49(s,9h)。ms(esi,负离子)m/z:360.2[m-1]。
[0396]
步骤5:在0℃下向叔丁基(3-((3,3-二氟环戊基)磺酰基)苯基)氨基甲酸酯(1.0g,2.8mmol)在1,4-二噁烷(10ml)中的溶液中加入hcl(在二噁烷中4m溶液,10ml,40.0mmol)并在室温下搅拌24h。减压浓缩反应混合物。将粗残余物溶解在水(15ml)中并使用10%nahco3水溶液调节至ph 7,用h2o(20ml)稀释并用etoac(3x30ml)萃取。将合并的有机萃取物用盐水溶液(50ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将残余物吸附到硅胶塞上并且通过硅胶色谱法(以在己烷中的20%至25%etoac洗脱)纯化,以提供呈粘稠油的3-((3,3-二氟环戊基)磺酰基)苯胺(250mg,35%产率)。1h nmr(400mhz,meod):δ7.27(t,j=8.0hz,1h),7.15(d,j=2.0hz,1h),7.09(dd,j=8.0,2.0hz,1h),6.95(dd,j=8.0,2.0hz,1h),3.90-3.84(m,1h),2.51-2.05(m,6h),nh2质子不可见。ms(esi,阳离子)m/z:262.1[m 1]。
[0397]
中间体7:(r)-3-氟-5-(2-甲基吗啉代)苯胺。
[0398][0399]
步骤1:将1,3-二氟-5-硝基苯(3.0g,18.86mmol,阿波罗科技公司(apollo scientific))、(r)-2-甲基吗啉(2.289g,22.63mmol,阿博化学公司(arbor chemicals))和dipea(6.59ml,37.7mmol)在1,4-二噁烷(30.0ml)中的混合物在微波下在100℃下搅拌2h。将反应混合物浓缩,并且通过快速柱色谱法(以在石油醚中的0%至40%etoac的梯度洗脱)纯化,以得到呈黄色固体的(r)-4-(3-氟-5-硝基苯基)-2-甲基吗啉(1.5g,6.24mmol,33%产率)。1h nmr(400mhz,dmso-d6):δppm 7.54(d,j=2.3hz,1h),7.38(dt,j=8.4,2.1hz,1h),7.27(dt,j=12.3,2.3hz,1h),3.92(ddd,j=11.5,3.7,1.4hz,1h),3.80(dt,j=12.2,2.2hz,1h),3.68(ddt,j=12.2,3.1,1.6hz,1h),3.53-3.67(m,2h),2.79(td,j=11.9,3.6hz,1h),2.41-2.49(m,1h),1.16(d,j=6.2hz,3h)。m/z(esi):241.1(m h)
。
[0400]
步骤2:向(r)-4-(3-氟-5-硝基苯基)-2-甲基吗啉(1.8g,7.49mmol)在meoh(10ml)和thf(10ml)中的溶液中加入钯碳(0.5g,4.70mmol,印度斯坦铂公司(hindustan platinum))并在h2压力(14psi)下搅拌16h。将反应混合物通过床过滤,用meoh洗涤,并且将合并的滤液浓缩,以给出呈米色固体的(r)-3-氟-5-(2-甲基吗啉代)苯胺(1.1g,5.23mmol,70%产率)。1h nmr(400mhz,dmso-d6):δppm 5.90(d,j=12.5hz,2h),5.78(d,j=11.0hz,1h),5.19(d,j=7.9hz,2h),3.86(dd,j=11.2,3.4hz,1h),3.57(dtd,j=14.7,11.5,10.0,4.3hz,2h),3.43(d,j=11.6hz,1h),3.33(m,1h),2.58(td,j=11.7,3.3hz,1h),2.27(q,j=10.9,10.3hz,1h),1.13(dd,j=9.6,5.7hz,3h)。m/z(esi):211.2(m h)
。
[0401]
中间体8:(r)-4-氟-3-(2-甲基吗啉代)苯胺。
[0402][0403]
步骤1:将2-溴-1-氟-4-硝基苯(3.0g,13.64mmol,阿波罗科技公司)、(r)-2甲基吗啉(1.94g,19.23mmol,阿博化学公司)、pd(oac)2(0.36g,1.63mmol)、cs2co3(8.89g,27.3mmol)和xantphos(0.87g,1.50mmol)在1,4-二噁烷(15ml)中的混合物在100℃下加热16h。将反应混合物通过床过滤并用etoac洗涤。将etoac层用水洗涤,经na2so4干燥,过滤并浓缩。将残余物通过快速柱色谱法(以在己烷中的0%至20%etoac洗脱)纯化,以得到呈黄色固体的(r)-4-(2-氟-5-硝基苯基)-2-甲基吗啉(0.7g,2.91mmol,21%产率)。1h nmr(400mhz,dmso-d6):δppm 7.89(ddd,j=8.9,3.9,2.8hz,1h),7.79(dd,j=7.6,2.8hz,
1h),7.46(dd,j=12.2,8.9hz,1h),3.90(ddd,j=11.5,3.2,1.5hz,1h),3.68-3.77(m,2h),3.27-3.40(m,2h),2.85(td,j=11.6,3.2hz,1h),2.56(dd,j=11.6,10.0hz,1h),1.15(d,j=6.3hz,3h)。m/z(esi):241.1(m h)
。
[0404]
步骤2:向(r)-4-(2-氟-5-硝基苯基)-2-甲基吗啉(0.7g,2.91mmol)在meoh(10ml)和thf(10ml)中的溶液中加入钯碳(0.35g,3.29mmol,印度斯坦铂公司(hindustan platinum))并将反应混合物在h2压力(14psi)下搅拌16h。将反应混合物通过床过滤,用meoh洗涤,并且浓缩,以给出呈米色固体的(r)-4-氟-3-(2-甲基吗啉代)苯胺,将其不经纯化即直接用于下一步骤中。1h nmr(400mhz,dmso-d6):δppm 6.75(dd,j=12.9,8.5hz,1h),6.22(dd,j=7.7,2.6hz,1h),6.10(dt,j=8.6,3.1hz,1h),4.84(s,2h),3.79-3.87(m,1h),3.58-3.72(m,2h),3.07-3.20(m,2h),2.61(td,j=11.5,3.2hz,1h),2.32(t,j=10.7hz,1h),1.10(d,j=6.3hz,3h)。m/z(esi):211.2(m h)
。
[0405]
环ar2中间体的制备:
[0406]
中间体9:6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酸
[0407][0408]
将2,6-二氟烟酸(5.0g,31.5mmol)、6-氮杂螺[2.5]辛烷(3.8g,34.6mmol)和1,4-二噁烷(60ml)装入250-ml圆底烧瓶中。加入dipea(6.6ml,37.9mmol)并将浅棕色溶液在rt下搅拌18h。将混合物浓缩,并将残余物用etoac(80ml)稀释,然后依次用水(2x10ml)和盐水(10ml)洗涤。将有机相减少到约50ml,一些固体开始沉淀。将悬浮液静置18h。收集固体以提供呈黄色固体的标题化合物(2.35g)。浓缩母液并加入最少量的etoac以溶解所有残余物。将体积减少至约20ml并收集第二批产物以提供呈黄色固体的标题化合物(2.23g)。重复该程序以提供第三批标题化合物(1.10g)。将所有3个批次合并以得到6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酸(5.68g,72%产率)。1h nmr(400mhz,氯仿-d)δ10.50(s,1h),8.68(t,j=8.2hz,1h),7.00(dd,j=3.1,8.4hz,1h),3.19(t,j=5.6hz,4h),1.69(br s,4h),0.47(s,4h)。m/z(esi):251.0(m h)
。
[0409]
表1:按照类似于中间体9的制备来制备中间体9-1和9-2:
[0410][0411]
中间体10:6-((甲基磺酰基)甲基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸。
[0412][0413]
步骤1:向2-氯-6-甲基烟酸甲酯(5.0g,26.9mmol)在四氯化碳(50ml)中的搅拌溶液中加入aibn(0.442g,2.69mmol)和n-溴代琥珀酰亚胺(4.79g,26.9mmol)并在70℃下搅拌4h。将反应混合物冷却至室温,用水(50ml)淬灭,并且用二氯甲烷(2x100ml)萃取。将合并的有机萃取物用盐水(50ml)洗涤,经na2so4干燥,过滤并在减压下浓缩,以提供呈浅黄色油的甲基6-(溴甲基)-2-氯烟酸酯(5g,粗品)。将粗产物不经纯化而继续使用。ms(esi,阳离子)m/z:264[m 1]。
[0414]
步骤2:向甲基6-(溴甲基)-2-氯烟酸酯(5.9g,22.31mmol)在dmf(50ml)中的溶液中加入甲烷亚磺酸钠(2.73g,26.8mmol)并在室温下搅拌1h。将反应混合物用水(100ml)淬灭并且用etoac(3x100ml)萃取。将合并的有机萃取物用盐水溶液(50ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞(60-120目)上并且通过快速色谱法通过redi-sep预填充的硅胶柱(120g)(以在己烷中的1%至50%etoac梯度洗脱)纯化,以提供呈灰白色固体的甲基2-氯-6-((甲基磺酰基)甲基)烟酸酯(4.0g,68%产率)。1h nmr(400mhz,氯仿-d):δ8.25(d,j=7.9hz,1h),7.54(d,j=7.9hz,1h),4.45(s,2h),3.99(s,3h),3.00s,3h)。ms(esi,阳离子)m/z:264.1[m 1]。
[0415]
步骤3:在微波反应容器(20ml)中,添加甲基2-氯-6-((甲基磺酰基)甲基)烟酸酯(2.0g,7.58mmol)和6-氮杂螺[2.5]辛烷(1.012g,9.10mmol)在二甲亚砜(10ml)中的溶液并
在微波反应器(拜泰齐微波启动器(biotage microwave initiator ))中于140℃加热1h。将反应混合物吸附到硅胶塞(60-120目)上并且通过快速色谱法通过redi-sep预填充的硅胶柱(80g)(以在己烷中的1%至40%etoac梯度洗脱)纯化,以提供呈灰白色固体的甲基6-((甲基磺酰基)甲基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(1.4g,45%产率)。1h nmr(400mhz,氯仿-d):δ7.99(d,j=7.7hz,1h),6.83(d,j=7.7hz,1h),4.29(s,2h),3.91(s,3h),3.57-3.40(m,4h),3.01(s,3h),1.52-1.39(m,4h),0.38(s,4h)。ms(esi,阳离子)m/z:339.2[m 1]。
[0416]
步骤4:向甲基6-((甲基磺酰基)甲基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(1.4g,4.14mmol)在乙醇(10ml)和水(10ml)中的溶液中加入氢氧化钠(0.496g,12.41mmol)并在室温下搅拌3h。在减压下浓缩反应混合物以除去乙醇。使用1.5n hcl溶液将水层中和至ph约为7并用etoac(3x100ml)萃取。将合并的有机萃取物用盐水溶液(50ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物吸附到硅胶塞(60-120目)上并且通过快速色谱法通过redi-sep预填充的硅胶柱(40g)(以在dcm中的1%至6%meoh梯度洗脱)纯化,以提供呈灰白色固体的6-((甲基磺酰基)甲基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸(680mg,51%产率)。1h nmr(400mhz,dmso-d6)δ13.29(s,1h),7.95(d,j=7.6hz,1h),6.91(d,j=7.6hz,1h),4.53(s,2h),3.45-3.36(m,4h),1.48-1.37(m,4h),0.35(s,4h)。ms(esi,负离子)m/z:323.2[m-1]。
[0417]
中间体11:6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸。
[0418][0419]
步骤1:将2,6-二氟烟酸(10.6g,66.6mmol)和亚硫酰氯(35ml,480mmol)在氮气下合并并且加热至轻微回流持续2h。将溶液在减压下浓缩至干燥。将甲苯(100ml)添加至粗产物并且再次将其蒸发至干燥。在氮气中,将粗酰氯溶解在dcm(50ml)中并且在冰浴中冷却。将三乙胺(25ml,180mmol)和苯甲醇(7.25ml,70.1mmol)在dcm(50ml)中的混合物经10min逐滴添加,并且将混合物在rt搅拌30min。然后,添加0.1n hcl(100ml)并且将各相混合并分离。取出有机相,用硫酸镁干燥,并在减压下蒸发至干燥以提供苄基2,6-二氟烟酸酯,其不经纯化使用。m/z(esi):250.0(m h)
。
[0420]
步骤2:在氮气下,将4,4-二甲基噁唑烷-2-酮(0.80g,6.95mmol)溶解在thf(15ml)中。添加叔丁醇钾(0.75g,6.68mmol)并且将悬浮液在rt下搅拌5min。添加在n,n-二甲基乙酰胺(40ml)中的苄基2,6-二氟烟酸酯(1.60g,6.42mmol)溶液并且将混合物在rt搅拌10min。添加水(75ml)、etoac(150ml)和饱和氯化铵(25ml)并且将各相混合并分离。取出有机相,用盐水(50ml)洗涤,并且在减压下蒸发至干燥。通过硅胶色谱法(庚烷至etoac梯度)纯化给出呈白色固体的苄基6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-氟烟酸酯(1.82g,5.29mmol,82%产率)。
[0421]
步骤3:将苄基6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-氟烟酸酯(1.81g,5.23mmol)溶解在nmp(20ml)中。添加碳酸铯(2.00g,6.14mmol)和6-氮杂螺[2.5]辛烷(0.60g,5.40mmol)并且将混合物在rt搅拌18h。添加水(100ml)和etoac(150ml)并且将各相混合并分离。取出有机相,用盐水洗涤,并且在减压下蒸发至干燥。使用硅胶色谱法(在庚烷中0%至40%etoac)纯化给出呈乳白色油状物的苄基6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(1.77g,4.06mmol,78%产率)。m/z(esi):436.1(m h)
。
[0422]
步骤4:将苄基6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(1.77g,4.06mmol)溶解在etoac(30ml)并且转移到压力容器中。添加乙醇(60ml),随后添加5%钯碳(干重,50%水,0.250g,0.117mmol)。将悬浮液在40psi氢气下搅拌15min。将混合物通过垫过滤并且将固体用etoac(50ml)洗涤。将合并的滤液在减压下蒸发至干燥以给出呈白色固体的6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸(1.15g,3.33mmol,82%产率)。m/z(esi):346.0(m h)
。
[0423]
表2:按照类似于中间体11的制备来制备中间体11-1和11-2:
[0424][0425]
中间体12:2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酸
[0426][0427]
步骤1:将2,6-二氯烟酸甲酯(5.0g,24.3mmol,康比布科公司(combi-blocks))、dipea(4.7ml,26.7mmol)和6-氮杂螺[2.5]辛烷(2.70g,24.27mmol,爱斯特技术公司(astatech,inc.))在乙腈(50ml)中的混合物在rt下搅拌24h。将混合物浓缩,并且将残余物经由硅胶色谱法(在庚烷中的0%至30%etoac)纯化以给出甲基6-氯-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(4.34g,15.46mmol,64%产率)。m/z(esi):281.0(m h)
。
[0428]
步骤2:将甲基6-氯-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(4.10g,14.60mmol)、三丁基(1-乙氧基乙烯基)锡(5.80g,16.06mmol,奥德里奇公司(aldrich))和双(二叔丁基(4-二甲基氨基苯基)膦)二氯化钯(ii)(0.41g,0.58mmol,奥德里奇公司)在甲苯(30ml)中的混合物在90℃下搅拌16h。将反应混合物冷却至rt并用hcl(4m在二噁烷中,18.25ml,73.00mmol)处理并搅拌2h。然后将反应混合物通过垫过滤并用etoac洗涤。将滤液用饱和nahco3水溶液洗涤、干燥、过滤并浓缩。将残余物通过硅胶色谱法(在庚烷中的0%至30%etoac)纯化以给出甲基6-乙酰基-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(2.75g,9.54mmol,65%产率)。1h nmr(400mhz,dmso-d6)δppm 8.02(d,j=7.8hz,1h),7.28(d,j=7.6hz,1h),3.84(s,3h),3.38-3.51(m,4h),2.57(s,3h),1.33-1.53(m,4h),0.35(s,4h)。
[0429]
步骤3:在0℃下,向甲基6-乙酰基-2-(6-氮杂螺[2.5]辛-6-基)烟酸酯(2.50g,8.67mmol)在四氢呋喃(1ml)中的搅拌溶液中加入(三氟甲基)三甲基硅烷(1.54ml,10.40mmol,奥德里奇公司)。添加后,将混合物搅拌2h。滤出固体,用etoac洗涤并浓缩。通过硅胶色谱法(以在庚烷中的0%至30%etoac洗脱)纯化,以提供甲基2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酸酯(2.87g,8.01mmol,92%产率)。1h nmr(400mhz,氯仿-d)δppm 8.05(d,j=7.8hz,1h),6.85(d,j=7.8hz,1h),6.01(s,1h),3.91(s,3h),3.39-3.56(m,4h),1.69(s,3h),1.45-1.53(m,4h),0.38(s,4h)。m/z(esi):359.0(m h)
。
[0430]
步骤4:在rt下,向搅拌着的甲基2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酸酯(2.87g,8.01mmol)在meoh(20ml)中的溶液中加入naoh水溶液(8.0ml的5m溶液,40.0mmol)。添加后,将反应混合物搅拌3d。将反应混合物浓缩,用h2o稀释,用5n hcl水溶液酸化(至ph约4)。收集沉淀的固体,用h2o洗涤,并干燥得到2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酸(2.70g,98%产率)。1h nmr
(400mhz,dmso-d6)δppm 13.23(br s,1h),7.97(d,j=7.8hz,1h),7.15(d,j=7.8hz,1h),6.62(s,1h),3.36-3.43(m,4h),1.65(s,3h),1.33-1.44(m,4h),0.33(s,4h)。m/z(esi):345.0(m h)
。
[0431]
ar1和ar2中间体的偶联
[0432]
中间体13:n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。
[0433][0434]
将6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酸(2.0g,8.00mmol,中间体9)和dcm(30ml)装入250-ml圆底烧瓶中。在rt下,向反应混合物中添加草酰二氯(6.00ml,11.99mmol),随后添加两滴dmf。将混合物在rt下搅拌30min并且将溶剂在真空下除去。将残余物重新溶解在dcm(30ml)中并且用3-氨基-n-(叔丁基)苯磺酰胺(1.80g,7.90mmol)处理,随后用dipea(6.98ml,40.0mmol)处理。将反应混合物在rt搅拌1h,然后将其用水稀释并且用etoac萃取。将有机萃取物用盐水洗涤,经na2so4干燥,过滤并浓缩。将浓缩物通过快速柱色谱法(以在庚烷中的5%至50%etoac洗脱)纯化,以得到呈灰白色固体的n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-氟-2-(螺[2.5]辛-6-基)烟酰胺(3.02g,82%产率)。1h nmr(400mhz,氯仿-d)δ=11.33(s,1h),8.54(t,j=8.3hz,1h),8.27(t,j=1.9hz,1h),7.93(dd,j=1.1,8.1hz,1h),7.70-7.65(m,1h),7.55-7.47(m,1h),6.78(dd,j=3.3,8.4hz,1h),4.62(s,1h),3.32-3.25(m,4h),1.61-1.56(m,4h),1.29(s,9h),0.41(s,4h)。m/z(esi):461.1(m h)
。
[0435]
表3:按照类似于中间体13的制备来制备中间体13-1至13-5:
[0436]
[0437][0438]
中间体14:2-氟-n-(3-(哌啶-1-基磺酰基)苯基)烟酰胺
[0439][0440]
向2-氟-3-吡啶甲酸(1.0g,7.09mmol)在dcm(9ml)中的溶液中加入草酰二氯(0.80ml,9.01mmol)和催化dmf。将反应混合物在rt下搅拌1h并且将溶剂在真空下除去。将残余物重新溶解在dcm(10ml)中并用3-(哌啶-1-磺酰基)-苯胺(0.78ml,4.16mmol)处理,然后用碳酸氢钠(0.405ml,10.40mmol)处理。将反应混合物在rt搅拌16h,然后将其用水稀释并且用etoac萃取。将有机萃取物用盐水洗涤,经na2so4干燥,过滤并浓缩。将浓缩物通过快速柱色谱法(以在己烷中的0%至50%etoac洗脱)纯化,以提供呈白色固体的2-氟-n-(3-(哌啶-1-基磺酰基)苯基)烟酰胺(1.16g,77
[0441]
%产率)。1h nmr(氯仿-d)δ:8.60-8.74(m,2h),8.36-8.50(m,1h),8.04(s,1h),7.95(d,j=7.0hz,1h),7.52-7.65(m,2h),7.41-7.50(m,1h),3.02-3.10(m,4h),1.61-1.71(m,4h),1.40-1.50(m,2h)。m/z(esi):364.1(m h)
。
[0442]
表4:按照类似于中间体14的制备来制备中间体14-1至14-8:
[0443]
[0444][0445]
中间体15:3-(2-(6-氮杂螺[2.5]辛-6-基)烟酰胺基)苯磺酰氯
[0446][0447]
将n-(3-(苄硫基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(3.01g,7.01mmol,中间体14-14)、acn(28ml)、h2o水(0.7ml)和乙酸(1.4ml)装入150-ml圆底烧瓶中。将反应混合物冷却至0℃并加入1,3-二氯-5,5-二甲基咪唑烷-2,4-二酮(1.66g,8.42mmol)。将反应在0℃下搅拌3h,升温至rt并在饱和nahco3(约40ml)和etoac(40ml)之间分配。取出有机层,用水洗涤并干燥。将粗混合物通过biotage纯化(snap50,ultra,洗脱液:etoac在庚烷中5%-40%)以提供呈白色固体的3-(2-(6-氮杂螺[2.5]辛-6-基)烟酰胺基)苯磺酰氯(2.01g,71%产率)。1h nmr(400mhz,氯仿-d)δ=12.51(br s,1h),8.66(s,1h),8.59-8.47(m,2h),8.00(d,j=8.2hz,1h),7.81(d,j=7.8hz,1h),7.70-7.61(m,1h),7.29(s,1h),3.29(t,j=5.4hz,4h),1.66(br s,4h),0.45(s,4h)。ms(esi,阳离子)m/z:406.1[m 1]。
[0448]
实例
[0449]
实例100:2-(4,4-二甲基哌啶-1-基)-n-(3-(哌啶-1-基磺酰基)苯基)烟酰胺。
[0450][0451]
向2-氟-n-(3-(哌啶-1-基磺酰基)苯基)烟酰胺(44mg,0.12mmol,中间体14)在acn(1ml)中的溶液里添加4,4-二甲基哌啶盐酸盐(33mg,0.22mmol)和dipea(50μl,0.29mmol)。将反应混合物在85℃下搅拌4h,随后使其冷却至rt。将反应混合物用水(5ml)稀释并用etoac(2x5ml)萃取。将合并的有机萃取物在真空中浓缩并吸附到硅胶塞上并通过硅胶柱进行色谱分离(用在庚烷中的0%-60%etoac洗脱),以提供2-(4,4-二甲基哌啶-1-基)-n-(3-(哌啶-1-基磺酰基)苯基)烟酰胺(35mg,0.08mmol,33%产率)。1h nmr(氯仿-d)δ:12.27(br s,1h),8.42-8.61(m,2h),8.14(d,j=7.0hz,1h),7.91-8.04(m,1h),7.63(d,j=5.9hz,1h),7.48-7.57(m,2h),3.20(br s,4h),3.06(br s,4h),1.65(br s,8h),1.26(br s,2h),1.08(br s,6h)。m/z(esi):457.2(m h)
。
[0452]
表5:按照类似于实例100的制备来制备实例100-1至100-24:
[0453]
[0454]
[0455]
[0456]
[0457][0458]
实例101:n-(3-(n-环丙基氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。
[0459][0460]
将3-(2-(6-氮杂螺[2.5]辛-6-基)烟酰胺基)苯-1-磺酰氯(0.049g,0.12mmol,中间体15)、环丙胺(0.01g,0.19mmol)和dcm(1ml)装入玻璃小瓶中。向反应混合物中加入dipea(0.065ml,0.37mmol)并将混合物在rt下搅拌2h。将混合物浓缩,并将粗产物通过硅胶色谱法(etoac在庚烷中10%-70%)纯化,以得到呈白色固体的n-(3-(n-环丙基氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(43mg,84%产率)。1h nmr(400mhz,氯仿-d)δ=
12.15(br s,1h),8.50(d,j=6.3hz,2h),8.39(s,1h),7.94(d,j=8.0hz,1h),7.69(d,j=7.8hz,1h),7.61-7.53(m,1h),7.24(t,j=6.0hz,1h),5.00(s,1h),3.28(t,j=5.3hz,4h),2.32(d,j=4.1hz,1h),1.63(s,4h),0.75-0.59(m,4h),0.43(s,4h)。ms(esi,阳离子)m/z:427.1[m 1]。
[0461]
表6:按照类似于实例101的制备来制备实例101-1至101-10:
[0462]
[0463][0464]
实例102:(r)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(3-羟基吡咯烷-1-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0465][0466]
将n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
(0.080g,0.17mmol,中间体13)、dmso(2ml)、(r)-3-吡咯烷醇(0.028g,0.33mmol)和dipea(0.091ml,0.52mmol)装入玻璃小瓶中。将混合物在110℃下搅拌5h并冷却至rt。将反应混合物用水(15ml)淬灭并且用etoac(2x15ml)萃取。将合并的有机萃取物用盐水(15ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物经硅胶色谱法纯化(用于庚烷中的30%-100%etoac梯度),以提供呈白色固体的(r)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(3-羟基吡咯烷-1-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(71mg,77%产率)。1h nmr(400mhz,dmso-d6)δ11.14(s,1h),8.32(s,1h),7.81-7.88(m,2h),7.46-7.57(m,3h),6.16(d,j=8.61hz,1h),4.97(d,j=3.33hz,1h),4.39(br s,1h),3.45-3.59(m,3h),3.39(br d,j=8.61hz,1h),3.15-3.24(m,4h),1.97-2.10(m,1h),1.85-1.95(m,1h),1.42-1.50(m,4h),1.12(s,9h),0.30(s,4h)。ms(esi,阳离子)m/z:582.2[m 1]。
[0467]
表7:按照类似于实例102的制备来制备实例102-1至102-31:
[0468]
[0469]
[0470]
[0471]
[0472]
[0473]
[0474]
[0475][0476]
实例103:n-(3-(环戊基磺酰基)苯基)-6-((2-羟基-2-甲基丙基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0477][0478]
将n-(3-(环戊基磺酰基)苯基)-6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(95mg,0.21mmol,中间体13-1)、1-氨基-2-甲基-丙-2-醇(0.037ml,0.41mmol)、dipea(0.036ml,0.21mmol)和dmso(3ml)装入玻璃小瓶中。将混合物在85℃下搅拌24h并冷却至rt。将反应混合物用水(15ml)淬灭并且用etoac(2x15ml)萃取。将合并的有机萃取物用盐水(15ml)洗涤,经na2so4干燥,过滤并且在减压下浓缩。将粗残余物经硅胶色谱法纯化(用于庚烷中的0%-100%etoac:etoh(3:1)梯度),以提供n-(3-(环戊基磺酰基)苯基)-6-((2-羟基-2-甲基丙基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(84mg,77%产率)。1h nmr(dmso-d6)δ:11.25(s,1h),8.39(s,1h),7.96(d,j=8.0hz,1h),7.75(d,j=8.4hz,1h),7.58-7.68(m,1h),7.53(d,j=7.8hz,1h),6.98(br s,1h),6.31(d,j=8.4hz,1h),4.57(s,1h),3.73(t,j=7.7hz,1h),3.32(s,2h),3.16(d,j=4.7hz,4h),1.74-1.98(m,4h),1.51-1.72(m,4h),1.46(br s,4h),1.13(s,6h),0.31(s,4h)。ms(esi,阳离子)m/z:527.2[m 1]。
[0479]
表8:按照类似于实例103的制备来制备实例103-1至103-28:
[0480]
[0481]
[0482]
[0483]
[0484]
[0485]
[0486][0487]
实例104:n-(3-(环戊基磺酰基)苯基)-6-(氧杂环丁烷-3-基氧基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0488][0489]
将n-(3-(环戊基磺酰基)苯基)-6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(100mg,0.22mmol,中间体13-1)、dipea(387μl,2.19mmol)和3-羟基氧杂环丁烷(64.8μl,0.87mmol)的混合物在100℃下加热24h。加入h2o,收集固体,干燥并通过硅胶柱色谱法(0-50%etoac/庚烷)纯化,得到n-(3-(环戊基磺酰基)苯基)-6-(氧杂环丁烷-3-基氧基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(33mg,0.065mmol,30%产率)。1h nmr(dmso-d6)δ:10.65(s,1h),8.35(br s,1h),7.99(d,j=7.8hz,1h),7.82(d,j=8.0hz,1h),7.61-7.68(m,1h),7.52-7.60(m,1h),6.37(d,j=8.2hz,1h),5.52-5.62(m,1h),4.90(t,j=6.7hz,2h),4.61(t,j=6.3hz,2h),3.73(dt,j=15.2,7.6hz,1h),3.33(s,4h),1.85(d,j=5.3hz,4h),1.50-1.70(m,4h),1.36(br s,4h),0.29(s,4h)。ms(esi,阳离子)m/z:512.2[m 1]。
[0490]
表9:按照类似于实例104的制备来制备实例104-1:
[0491][0492]
实例105:n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-((1-羟基-2-甲基丙-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。
[0493][0494]
步骤1:向100-ml圆底烧瓶中装入6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸(549mg,1.59mmol,中间体11)和dcm(8ml)。在rt下,向反应混合物中添加草酰二氯(1.43ml,2.86mmol,在dcm中2m),随后添加两滴dmf。将混合物在rt搅拌1h并且将溶剂在真空下除去。将残余物重新溶解在dcm(10ml)中并且用3-氨基-n-(叔丁基)苯磺酰胺(0.38ml,1.67mmol)和dipea(1.39ml,7.95mmol)处理。将反应混合物在rt搅拌18h,然后将其用水稀释并且用etoac萃取。将有机萃取物用盐水洗涤,经na2so4干燥,过滤并浓缩。将浓缩物通过快速柱色谱法(以在庚烷中的0%至60%etoac洗脱)纯化为呈浅黄色固体的n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(703mg,1.26mmol,80%产率)。ms(esi,阳离子)m/z:556.1[m 1]。
[0495]
步骤2:向玻璃小瓶中装入n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(703mg,1.26mmol)、meoh(2ml)和氢氧化钠(1.26ml,6.33mmol,5n)。在70℃搅拌1h,冷却至rt,并且将溶剂在减压下除去。将残余物在半饱和的nh4cl(10ml)和etoac(10ml)之间分配。将水相用etoac(2x10ml)萃取。将合并的有机萃取物用水(20ml)洗涤并且经na2so4干燥。将粗物质吸附到硅胶塞上并且通过色谱法通过redi-sep预填充的硅胶柱(以在庚烷中的0%至60%etoac的梯度洗脱)纯化以提供呈白色固体的n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-((1-羟基-2-甲基丙-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(485mg,0.92mmol,72%产率)。1h nmr(400mhz,dmso-d6)δppm11.21(s,1h),8.32(t,j=1.45hz,1h),7.84(dt,j=7.88,1.45hz,1h),7.71(d,j=8.71hz,1h),7.50-7.57(m,2h),7.49(dt,j=7.88,1.45hz,1h),6.60(s,1h),6.28(d,j=8.50hz,1h),4.81(t,j=5.70hz,1h),3.59(d,j=5.81hz,2h),3.11-3.17(m,4h),1.44-1.51(m,4h),1.36(s,6h),1.12(s,9h),0.31(s,4h)。ms(esi,阳离子)m/z:530.2[m 1]。
[0496]
表10:按照类似于实例105的制备来制备实例105-1至105-32:
[0497]
[0498]
[0499]
[0500]
[0501]
[0502]
[0503][0504]
实例106:n-(3-(环戊基磺酰基)苯基)-6-((1,3-二羟基丙烷-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0505][0506]
将n-(3-(环戊基磺酰基)苯基)-6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(100mg,0.219mmol,中间体13-1)、dipea(141mg,1.09mmol)和2-氨基-1,3-丙二醇盐酸盐(56mg,0.44mmol)在dmso(1ml)中的混合物在85℃下加热16h。使反应混合物冷却至rt,加入h2o,并且通过过滤收集沉淀的固体。将粗固体通过硅胶色谱法(在庚烷中的0-50%etoac:etoh(3:
1))纯化,得到n-(3-(环戊基磺酰基)苯基)-6-((1,3-二羟基丙烷-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(48mg,0.09mmol,41%产率)。1h nmr(dmso-d6)δ:11.23(s,1h),8.38(s,1h),7.92-7.99(m,1h),7.73(d,j=8.6hz,1h),7.59-7.68(m,1h),7.52(d,j=8.2hz,1h),6.78(br s,1h),6.26(d,j=8.6hz,1h),4.63(t,j=5.5hz,2h),3.92-4.07(m,1h),3.66-3.80(m,1h),3.47-3.63(m,4h),3.07-3.23(m,4h),1.77-1.95(m,4h),1.52-1.69(m,4h),1.38-1.50(m,4h),0.31(s,4h)。ms(esi,阳离子)m/z:529.1[m 1]。
[0507]
表11:以下实例按照与实例106所述类似的程序来制备:
[0508]
[0509][0510]
实例107-1和107-2:(r)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酰胺和(s)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酰胺
[0511][0512]
将2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酸(0.87g,2.52mmol,中间体12)和dcm(8ml)装入100-ml圆底烧瓶中。在rt下,向反应混合物中添加草酰二氯(2.52ml,5.05mmol,在dcm中2m),随后添加两滴dmf。将混合物在rt搅拌1h并且将溶剂在真空下除去。将残余物重新溶解在dcm(10ml)中并且用3-氨基-n-(叔丁基)苯磺酰胺(0.576g,2.52mmol)和dipea(2.20ml,12.62mmol)处理。将反应混合物在rt搅拌18h,然后将其用水稀释并且用etoac萃取。将有机萃取物用盐水洗涤,经na2so4干燥,过滤并浓缩。将浓缩物通过快速柱色谱法(以在庚烷中的10%至60%etoac洗脱)纯化,以得到外消旋n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酰胺。1h nmr(400mhz,氯仿-d)δ11.19(s,1h),8.52(d,j=8.02hz,1h),8.26(s,1h),7.94(dd,j=1.17,8.22hz,1h),7.68(d,j=7.82hz,1h),7.47-7.54(m,1h),7.37(d,j=8.02hz,1h),5.85(s,1h),4.79(br s,1h),3.29-3.38(m,4h),1.76(s,3h),1.57-1.65(m,4h),1.28(s,9h),0.42(s,4h)。ms(esi,阳离子)m/z:555.2[m 1]。通过制备型sfc使用adh柱(250x21mm,5mic)用75ml/min流速的80%液态co2和20%meoh的流动相分离该物质,以得到:
[0513]
实例107-1:(r)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酰胺。第一洗脱峰;ee》99.5%。1h nmr(400mhz,氯仿-d)δ11.21(s,1h),8.53(d,j=8.02hz,1h),8.27(t,j=1.66hz,1h),7.94(dd,j=1.17,8.22hz,1h),7.68(d,j=8.02hz,1h),7.48-7.55(m,1h),7.37(d,j=8.02hz,1h),5.85(s,1h),4.69(s,1h),3.30-3.38(m,4h),1.77(s,3h),1.61(br d,j=5.28hz,4h),1.28(s,9h),0.43(s,4h)。ms(esi,阳离子)m/z:555.2[m 1]。
[0514]
实例107-2:(s)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)-6-(1,1,1-三氟-2-羟基丙烷-2-基)烟酰胺。第二洗脱峰;ee》99.5%。1h nmr(400mhz,氯仿-d)δ11.23(s,1h),8.54(d,j=8.02hz,1h),8.28(t,j=1.76hz,1h),7.93(dd,j=1.17,8.22hz,1h),7.69(d,j=7.82hz,1h),7.49-7.56(m,1h),7.38(d,j=7.83hz,1h),5.85(s,1h),4.61(s,1h),3.31-3.39(m,4h),1.77(s,3h),1.60-1.66(m,4h),1.29(s,9h),0.43(s,4h)。ms(esi,阳离子)m/z:555.2[m 1]。
[0515]
立体化学是任意确定的。
[0516]
表12:以下实例按照与实例107-1和107-2所述类似的程序来制备:
[0517][0518]
实例109-1和109-2:(s)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(1,2-二羟基丙烷-2-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺和(r)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(1,2-二羟基丙烷-2-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。
[0519][0520]
步骤1:将n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-氯-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(1.00g,2.09mmol,中间体13-2)、amphos(0.151g,0.21mmol)、三丁基(1-乙氧基乙烯基)锡烷(0.85ml,2.51mmol)和甲苯(10ml)装入100-ml圆底烧瓶中。将反应混合物在90℃下搅拌30min。将混合物冷却至rt,用hcl/二噁烷(2ml,4m)处理,并在rt下搅拌30min。将反应混合物在饱和碳酸氢钠水溶液(40ml)与etoac(40ml)之间分配。用etoac(40ml)萃取水相。
将合并的有机相通过使用etoac(2x10ml)洗脱的chem elut萃取柱进行干燥。将有机相浓缩,并且将粗产物通过biotage纯化(snap25,ultra,洗脱液:etoac在庚烷中0%-50%)以提供6-乙酰基-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(0.85g,84%产率)。1h nmr(400mhz,dmso-d6)δ=10.79(s,1h),8.31(s,1h),7.95(d,j=7.4hz,1h),7.87(d,j=2.9hz,1h),7.60-7.52(m,3h),7.42(d,j=7.4hz,1h),3.49-3.40(m,4h),2.61(s,3h),1.43-1.35(m,4h),1.11(s,9h),0.29(s,4h)。
[0521]
步骤2:将三甲基碘化亚砜(0.201g,0.914mmol)和dmso(1.5ml)装入20ml闪烁小瓶中。向该混合物中加入叔丁醇钾(0.093g,0.83mmol)并将混合物在rt下搅拌30min。然后,添加在1.0ml的dmso中的6-乙酰基-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(0.399g,0.82mmol),并将黄色溶液在rt下搅拌3h。将反应混合物在水(15ml)和etoac(10ml)之间分配。将水相用etoac(2x10ml)萃取。将合并的有机萃取取用盐水(30ml)洗涤,并通过使用etoac(2x5ml)洗脱的chem elut萃取柱干燥。浓缩有机相,并继续使用粗产物。ms(esi,阳离子)m/z:499.2[m 1]。
[0522]
步骤3:向150-ml圆底烧瓶中装入n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(2-甲基环氧乙烷-2-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(2.19g,3.95mmol)、二噁烷(12ml)和水(12ml)。然后,添加盐酸(2.0ml,8.00mmol),并将反应混合物在rt下搅拌3h。将混合物用水(50ml)稀释并用etoac萃取(2x30ml)。将合并的有机相用水洗涤并通过使用etoac(2x10ml)洗脱的chem elut萃取柱进行干燥。将合并的有机萃取物浓缩并且通过biotage纯化(snap100,ultra,洗脱液:etoac在庚烷中40%-100%)以提供n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(1,2-二羟基丙烷-2-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(1.14g,56%产率)。1h nmr(400mhz,氯仿-d)δ11.52(s,1h),8.50(d,j=8.02hz,1h),8.27(t,j=1.66hz,1h),7.94(dd,j=1.08,8.12hz,1h),7.67(d,j=8.02hz,1h),7.49-7.54(m,1h),7.33(d,j=7.82hz,1h),4.68(s,1h),4.61(s,1h),3.81-3.90(m,1h),3.72-3.80(m,1h),3.26-3.34(m,4h),2.46(br s,1h),1.60-1.66(m,4h),1.53(s,3h),1.29(s,9h),0.43(s,4h)。ms(esi,阳离子)m/z:517.2[m 1]。通过制备型sfc使用ox-h柱(250x21mm,5mic)用50ml/min流速的40%液态co2和60%meoh(20mm nh3)的流动相分离该物质,以得到:
[0523]
实例109-1:(s)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(1,2-二羟基丙烷-2-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。第一洗脱峰;ee》99.5%。1h nmr(400mhz,氯仿-d)δ=11.49(s,1h),8.46(d,j=8.0hz,1h),8.25(s,1h),7.95(dd,j=1.1,8.1hz,1h),7.67(d,j=7.8hz,1h),7.55-7.47(m,1h),7.33(d,j=8.0hz,1h),4.78(s,1h),3.89-3.83(m,1h),3.79-3.72(m,1h),3.29(t,j=5.4hz,4h),1.63-1.56(m,4h),1.53(s,3h),1.28(s,9h),0.41(s,4h)。ms(esi,阳离子)m/z:517.2[m 1]。
[0524]
实例109-2:(r)-n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(1,2-二羟基丙烷-2-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。第二洗脱峰;ee》99.5%。1h nmr(400mhz,氯仿-d)δ=11.50(s,1h),8.46(d,j=7.8hz,1h),8.25(s,1h),7.95(dd,j=1.1,8.1hz,1h),7.67(d,j=7.8hz,1h),7.54-7.47(m,1h),7.33(d,j=8.0hz,1h),4.81(s,1h),4.69(dt,j=2.0,4.1hz,1h),3.89-3.81(m,1h),3.79-3.72(m,1h),3.32-3.24(m,4h),2.80-2.36(m,1h),1.62-1.56(m,4h),1.53(s,3h),1.28(s,9h),0.41(s,4h)。ms(esi,阳离子)m/z:517.2[m 1]。
[0525]
立体化学是任意确定的。
[0526]
实例110:n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(甲基磺酰胺基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺。
[0527][0528]
向玻璃小瓶中装入6-溴-n-(3-(n-(叔丁基)氨磺酰基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(96mg,0.185mmol,中间体13-3)、甲磺酰胺(21mg,0.23mmol)、cui(14mg,0.07mmol)和磷酸钾(129mg,0.61mmol)。将小瓶抽真空并用n2回填。将该过程再重复四次,加入dmf(1ml),然后加入(1r,2r)-(-)-n,n
″‑
二甲基环己烷-1,2-二胺(0.017ml,0.11mmol)。将小瓶密封且将反应混合物在100℃下搅拌4h。将混合物用etoac(4ml)稀释并通过垫过滤。将滤液用水(2x5ml)洗涤并浓缩。将粗产物通过biotage纯化(snap10,ultra,洗脱液:etoac在庚烷中40%-90%)以提供呈白色固体的n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-(甲基磺酰胺基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(41mg,42%产率)。1h nmr(400mhz,氯仿-d)δ=11.23(s,1h),8.40(d,j=8.3hz,1h),8.27(s,1h),7.91(br d,j=8.1hz,1h),7.66(d,j=7.7hz,1h),7.55-7.47(m,1h),6.86(d,j=8.3hz,1h),4.66(s,1h),3.38(s,3h),3.32-3.22(m,4h),1.60(br d,j=4.6hz,4h),1.29(s,9h),0.41(s,4h)。ms(esi,阳离子)m/z:536.2[m 1]。
[0529]
实例111:6-((1-羟基-2-甲基丙烷-2-基)氨基)-n-(4-甲基-3-(噁唑-2-基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0530][0531]
步骤1:将n-(3-溴-4-甲基苯基)-6-氟-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(0.5g,1.195mmol,中间体13-5)、2-氨基-2-甲基-1-丙醇(0.23ml,2.39mmol)和dipea(0.62ml,3.59mmol)在dmso(6ml)中的混合物在140℃下加热24h。将反应混合物冷却至rt,并且在etoac和水之间分配。将分离的有机层用盐水洗涤,经na2so4干燥,并过滤。将滤液浓缩并且
通过硅胶色谱法(0-70%etoac/庚烷)进行纯化,以得到n-(3-溴-4-甲基苯基)-6-((1-羟基-2-甲基丙烷-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(0.26g,0.53mmol,45%产率)。ms(esi,阳离子)m/z:487.1/489.1[m 1]。
[0532]
步骤2:将n-(3-溴-4-甲基苯基)-6-((1-羟基-2-甲基丙烷-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(0.050g,0.10mmol)、四钯(0.024g,0.021mmol)和2-(三正丁基甲锡烷基)噁唑(0.028ml,0.13mmol)装入压力小瓶中。将小瓶用n2吹扫几分钟,然后加入1,4-二噁烷(1ml)。将小瓶密封并在120℃下加热24h。将反应混合物浓缩,然后通过制备型hplc纯化,得到呈灰白色固体的6-((1-羟基-2-甲基丙烷-2-基)氨基)-n-(4-甲基-3-(噁唑-2-基)苯基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(15mg,0.032mmol,31%产率)。1h nmr(400mhz,氯仿-d)δppm 0.42(s,4h)1.45(s,6h)1.65(br s,4h)2.69(s,3h)3.22(t,j=5.38hz,4h)3.75(s,2h)4.72(br s,1h)5.19(br s,1h)6.27(d,j=8.61hz,1h)7.27-7.34(m,2h)7.67(dd,j=8.31,2.25hz,1h)7.74(s,1h)8.24(d,j=8.41hz,1h)8.44(d,j=2.15hz,1h)11.76(s,1h)。ms(esi,阳离子)m/z:476.1[m 1]。
[0533]
表13:以下实例111-1至111-13按照如关于实例111所述的类似程序来制备:
[0534]
[0535]
[0536][0537]
实例112:n-(3-(n-(叔丁基)氨磺酰基)-5-(呋喃-2-基)苯基)-6-((1-羟基-2-甲基丙烷-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0538][0539]
步骤1:向5ml微波反应管中加入n-(3-溴-5-(n-(叔丁基)氨磺酰基)苯基)-6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(0.084g,0.13mmol,中间体13-4)、呋喃-2-基硼酸(0.034g,0.31mmol)、pd(pph3)4(10mg,8.22μmol)、碳酸钠(0.20ml,0.40mmol,2m)在二噁烷(2ml)中的溶液。通过将ar鼓泡通过反应混合物5min使混合物脱气。将管在120℃下进行以下微波照射30min。将混合物冷却至rt,并且在水(5ml)和etoac(5ml)之间分配。将水相用etoac(2x5ml)萃取。将合并的有机相用水(15ml)以及饱和氯化钠水溶液(15ml)洗涤。将有机相通过使用etoac(2x5ml)洗脱的chem elut萃取柱进行干燥。将有机物浓缩并且通过biotage纯化(ultra,洗脱液:丙酮在庚烷中20%-70%)以提供n-(3-(n-(叔丁基)氨磺酰基)-5-(呋喃-2-基)苯基)-6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(34mg,41%产率)。1h nmr(400mhz,氯仿-d)δ11.95(s,1h),8.52(d,j=8.61hz,1h),8.40(s,1h),8.04(s,1h),7.94(s,1h),7.90(d,j=8.61hz,1h),7.53(d,j=1.37hz,1h),6.83(d,j=3.33hz,1h),6.54(dd,j=1.76,3.33hz,1h),4.54(s,1h),4.15(s,2h),3.24(t,j=5.38hz,4h),1.79(s,6h),1.67(br s,4h),1.31(s,9h),0.45(s,4h)。ms(esi,阳离子)m/z:622.0[m 1]。
[0540]
步骤2:向玻璃小瓶中装入n-(3-(n-(叔丁基)氨磺酰基)-5-(呋喃-2-基)苯基)-6-(4,4-二甲基-2-氧代噁唑烷-3-基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(34mg,0.054mmol)、meoh(2ml)和naoh(0.1ml,0.5mmol,5m)。将反应混合物在70℃下搅拌1h。使混合物冷却至rt并浓缩。将残余物在半饱和的nh4cl(3ml)和etoac(3ml)之间分配。用etoac(3ml)萃取水相。将合并的有机相浓缩,并且将粗品通过biotage纯化(snap10,ultra,洗脱液:etoac在庚烷中30%-100%)以提供呈白色固体的n-(3-(n-(叔丁基)氨磺酰基)-5-(呋喃-2-基)苯基)-6-((1-羟基-2-甲基丙烷-2-基)氨基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺(27mg,84%产率)。1h nmr(400mhz,dmso-d6)δ11.24(s,1h),8.32(s,1h),8.08(s,1h),7.84(d,j=1.17hz,1h),7.80(s,1h),7.70(d,j=8.61hz,1h),7.62(s,1h),6.96(d,j=3.33hz,1h),6.66(dd,j=1.76,3.33hz,1h),6.61(s,1h),6.27(d,j=8.61hz,1h),4.83(t,j=5.58hz,1h),3.59(br d,j=5.48hz,2h),3.12-3.19(m,4h),1.47(br s,4h),1.36(s,6h),1.14(s,9h),0.30(s,4h)。ms(esi,阳离子)m/z:596.3[m 1]。
[0541]
表14:按照类似于实例112的制备来制备实例112-1至112-3:
[0542][0543][0544]
实例113:n-(3-(n-(叔丁基)氨磺酰基)苯基)-6-((甲基磺酰基)甲基)-2-(6-氮杂螺[2.5]辛-6-基)烟酰胺
[0545][0546]
在0℃下,向6-((甲基磺酰基)甲基)-2-(6-氮杂螺[2.5]辛-6-基)烟酸(0.1g,0.308mmol,中间体10)在dmf(2ml)中的溶液中添加hatu(0.176g,0.462mmol)和二异丙基乙胺(0.135ml,0.771mmol)并且搅拌10min。将3-氨基-n-(叔丁基)苯磺酰胺(0.070g,0.308mmol)添加到反应混合物中并在室温下搅拌24h。将反应混合物用水(15ml)淬灭并且用etoac(2x15ml)萃取。将有机层用盐水溶液(15ml)洗涤,经na2so4干燥,过滤并在减压下浓缩。将粗残余物通过硅胶色谱法(使用在己烷中的50%etoac梯度)纯化,以给出呈浅黄色固
体的标题化合物(68mg,28%产率)。1h nmr(400mhz,dmso-d6):δ10.76(s,1h),8.32(s,1h),7.93-7.81(m,2h),7.62-7.51(m,3h),7.02(d,j=7.7hz,1h),4.57(s,2h),3.36(t,j=7.6hz,4h),3.13(s,3h),1.36(t,j=7.6hz,4h),1.11(s,9h),0.28(s,4h)。ms(esi,阳离子)m/z:535.2[m 1]。
[0547]
实例114:n-(3-(n-(叔丁基)氨磺酰基)苯基)-3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺
[0548][0549]
向n-(3-(n-(叔丁基)氨磺酰基)苯基)-3-氟异烟酰胺(1.43g,4.07mmol,中间体14-16)在dmso(1ml)中的溶液中添加6-氮杂螺[2.5]辛烷(0.68g,6.10mmol)和cs2co3(4.64g,14.24mmol)。将反应混合物在100℃下搅拌18h,随后使其冷却至rt。将反应混合物用水(5ml)稀释并用etoac(2x5ml)萃取。将合并的有机萃取物在真空中浓缩并吸附到硅胶塞上并通过硅胶柱进行色谱分离(用在庚烷中的0%-60%etoac洗脱),以提供n-(3-(n-(叔丁基)氨磺酰基)苯基)-3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺(0.28g,0.64mmol,16%产率)。1h nmr(400mhz,dmso-d6)δ:11.14(s,1h),8.54(s,1h),8.37(d,j=4.9hz,1h),8.32(s,1h),7.86-7.93(m,1h),7.55-7.64(m,3h),7.53(d,j=4.9hz,1h),3.08-3.14(m,4h),1.41(br t,j=4.9hz,4h),1.11(s,9h),0.28(s,4h)。m/z(esi):443.5(m h)
。
[0550]
表15:按照类似于实例114的制备来制备实例114-1至114-2:
[0551][0552]
实例115:n-(3-(3,3-二氟哌啶-1-羰基)-4-甲基苯基)-3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺
[0553][0554]
步骤1:向甲基5-(3-氟异烟酰胺基)-2-甲基苯甲酸酯(0.82g,2.84mmol,中间体14-8)在二噁烷-ch3cn(2:1,5ml)中的溶液中添加6-氮杂螺[2.5]辛烷(0.38g,3.41mmol)和dipea(0.55g,4.27mmol)。在微波下,将反应混合物在170℃下搅拌1h。将混合物吸附到硅胶塞上并通过硅胶柱进行色谱法(用在庚烷中的25-45%etoac洗脱),以提供呈灰白色固体的甲基5-(3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺基)-2-甲基苯甲酸酯(0.80g,2.11mmol,74%产率)。m/z(esi):380.1(m h)
。
[0555]
步骤2:将甲基5-(3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺基)-2-甲基苯甲酸酯(0.80g,2.11mmol)、氢氧化锂水合物(0.22g,5.27mmol)在thf(3ml)、h2o(3ml)和meoh(1ml)中的混合物在50℃下加热3h。将反应混合物冷却至rt并在真空下浓缩。将残余物用1n hcl(10ml)处理,滤出黄色沉淀,用水洗涤,并且干燥。获得呈黄色固体的5-(3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺基)-2-甲基苯甲酸二盐酸盐(0.72g,1.64mmol,78%产率)。1h nmr(400mhz,dmso-d6)δ10.99(br s,1h),8.59(s,1h),8.42(d,j=5.28hz,1h),8.27(d,j=2.35hz,1h),7.66-7.82(m,2h),7.28-7.38(m,1h),3.69-5.21(m,3h),3.11-3.26(m,4h),2.5(s,3h),1.31-1.49(m,4h),0.32(s,4h)。m/z(esi):366.0(m h)
。
[0556]
步骤3:将5-(3-(6-氮杂螺[2.5]辛-6-基)异烟酰胺基)-2-甲基苯甲酸二盐酸盐(50mg,0.11mmol)、三乙胺(80μl,0.6mmol)和3,3-二氟哌啶盐酸盐(27mg,0.17mmol)在0.5ml的dmf中的混合物用t3p(50%wt在etoac中)(0.27ml,0.46mmol)处理,并将混合物在45℃下搅拌2h。将其用etoac稀释,依次用1n naoh和盐水洗涤。将有机层浓缩并在反相hplc上纯化残余物(10-90%[0.1%tfa]在ch3cn中的0.1%tfa水溶液),得到呈黄色蓬松粉末的标题化合物(45mg,0.06mmol,57%产率)。1h nmr(400mhz,dmso-d6)δ10.97(br s,1h),8.58(s,1h),8.41(d,j=4.89hz,1h),7.53-7.74(m,3h),7.32(d,j=8.41hz,1h),4.25(br s,3h),3.71(br s,1h),3.50(br s,1h),3.22(t,j=4.89hz,1h),3.16(t,j=4.99hz,4h),2.19(s,3h),2.03-2.15(m,2h),1.73(m,1h),1.62(br s,1h),1.24-1.42(br s,4h),0.32(s,4h)。m/z(esi):469.2(m h)
。
[0557]
表16:按照类似于实例115的制备来制备实例115-1至115-5:
[0558][0559][0560]
附加实例
[0561]
下面的实例116-128可以根据与上述实例类似的程序使用可商购的原料制备,或者可以根据本领域技术人员熟悉的程序制备。
[0562]
[0563]
[0564][0565]
生物学实例
[0566]
以下测定法用于测试本发明的示例性化合物。根据下述程序测试的那些实例的数据示于下表a中。
[0567]
kif18a酶测定:使用微管刺激的atp酶活性测定测量用化合物处理后的kif18a酶活性。在22个浓度点范围内,将化合物在dmso(西格玛公司(sigma inc))中连续稀释2倍。使用杆状病毒系统表达重组人kif18a(1-467his-标记的)蛋白,并通过安进公司(amgen inc.)的亲和色谱法进行纯化。使用adp-glo
tm
激酶/atp酶测定试剂盒(普罗米加公司(promega inc))对反应中的kif18a蛋白、微管(mt)和atp的浓度进行优化以进行标准化的同质酶测定。该测定测量由atp酶反应形成的adp。制备反应缓冲液[(15mm tris,ph7.5(泰克诺瓦公司(teknova inc)),10mm mgcl2(jt贝克公司(jt baker inc)),0.01%pluronic f-68(生命技术公司(life technologies inc)),1μm紫杉醇(cytoskeleton公司(cytoskeleton inc))和30μg/ml猪微管(cytoskeleton公司(cytoskeleton inc))]。向制备的反应缓冲液中添加化合物和kif18a蛋白(30nm)并在室温下孵育15min,接下来向反应混合物中添加atp(km,75μm),在室温下再孵育15min。将5μl的adp-glo
tm
试剂和2.5μl的反应混合物混合并在室温下孵育40min。添加10μl adp-glo
tm
检测试剂,并在室温下孵育40min。使用带有超发光模块(珀金埃尔默公司(perkin elmer inc))的envision酶标仪(microplate reader)读取发光。使用带有四参数逻辑回归拟合模型的基因数据筛选(genedata screener)软件(版本15.0.1,基因数据公司(genedata inc))进行浓度-应答曲线拟合和ic
50
确定。
[0568]
表a提供了本技术及其优先权文件中示例的化合物的数据,作为本发明的代表性化合物,如下:化学名称(由acd软件或chemdraw(professional 15.0)命名)和生物学数据(ic
50
,以μm计)。ex.#是指实例编号
[0569]
表a:生物学数据
[0570]
[0571]
[0572]
[0573]
[0574]
[0575]
[0576]
[0577]
[0578]
[0579]
[0580]
[0581]
[0582]
[0583]
[0584][0585]
出于清楚和理解的目的,已经通过说明和实例的方式详细地描述了前述发明。本领域技术人员理解,可以在所附权利要求书的范围内进行改变和修改。因此,应理解,以上描述旨在是说明性的而非限制性的。因此,本发明的范围不应参考上文的描述来确定,而应参考以下所附权利要求书以及此权利要求书所赋予的等同方案的全部范围来确定。
[0586]
出于所有目的,本文引用的所有专利、专利申请和出版物在此通过引用整体并入本文,其程度就好像每个单独的专利、专利申请或出版物被如此单独地表示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。