nup98基因作为胶质瘤干细胞特异性分子标志物和胶质母细胞瘤治疗及预后靶点的应用
技术领域
1.本发明属于技术领域,具体涉及nup98基因作为诊断胶质瘤干细胞的分子标志物和治疗及预后靶点的应用。
背景技术:
2.胶质母细胞瘤(glioblastoma,gbm)是星形细胞肿瘤中恶性程度最高的胶质瘤。肿瘤位于皮质下,多数生长于幕上大脑半球各处。呈浸润性生长,常侵犯几个脑叶,并侵犯深部结构,还可经胼胝体波及对侧大脑半球。发生部位以额叶最多见。胶质母细胞瘤生长速度快,70%~80%患者病程在3~6个月,病程超过1年者仅10%。病程较长者可能由恶性程度低的星形细胞瘤演变而来。由于肿瘤生长迅速,脑水肿广泛,颅内压增高症状明显,所有患者都有头痛、呕吐症状。视盘水肿有头痛、精神改变、肢体无力、呕吐、意识障碍与言语障碍。肿瘤浸润性破坏脑组织,造成一系列的局灶症状,患者有不同程度的偏瘫、偏身感觉障碍、失语和偏盲等。神经系统检查可发现偏瘫、脑神经损害、偏身感觉障碍与偏盲。癫痫的发生率较星形细胞瘤和少枝胶质细胞瘤少见,部分患者有癫痫发作。部分患者表现为淡漠、痴呆、智力减退等精神症状。
3.胶质瘤干细胞(glioma stem cells,gsc)被认为是gbm治疗耐受及肿瘤复发的关键,但是单独或联合靶向gsc的临床治疗方案未取得有效进展。因此,寻找到胶质母细胞瘤(glioblastoma,gbm)的治疗靶点,及诊断、预后的分子标志物是有待解决的技术难题。
技术实现要素:
4.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
5.本发明提供一种nup98基因的应用,其中,所述nup98基因作为胶质瘤干细胞特异性分子标志物。
6.作为本发明所述的nup98基因的应用的一种优选方案:所述nup98基因作为胶质母细胞瘤治疗及预后靶点。
7.作为本发明所述的nup98基因的应用的一种优选方案:通过检测nup98基因的mrna表达水平诊断胶质母细胞瘤。
8.作为本发明所述的nup98基因的应用的一种优选方案:nup98基因与转录因子p65结合,并调控p65的转录活性来调控胶质瘤干细胞的dna损伤修复。
9.作为本发明所述的nup98基因的应用的一种优选方案:nup98基因的表达水平与胶质母细胞瘤患者生存率相关。
10.作为本发明所述的nup98基因的应用的一种优选方案:nup98基因检测引物为,上游引物:5
’‑
ctccaccactaattcaggcttt-3’;下游引物:5
’‑
gaggctggtagtctgctgatt-3’。
11.本发明的有益效果:nup98基因通过调控gsc的dna损伤修复在gsc的自我更新,增殖及胶质瘤的恶性进展中发挥着重要作用。通过病人数据库和细胞水平的分析我们发现nup98在gsc中特异性高表达。在敲低nup98以后我们发现可以抑制gsc的自我更新、增殖并抑制体内肿瘤的进展。进一步通过转录组测序和生物信息学分析,我们发现nup98通过调节dna损伤修复在gsc的自我更新,增殖并抑制体内肿瘤的进展中发挥作用。最后通过蛋白质谱检测,我们发现,nup98调控dna损伤修复是与转录因子p65的结合,并调控p65的转录活性来实现,nup98过表达与脑肿瘤患者低生存率相关。nup89表达水平作为胶质母细胞瘤的标志物,nup89作为胶质母细胞瘤标志物的诊断准确性为93%,诊断特异性为100%,敏感性为85.4%。
附图说明
12.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
13.图1为gscs和gbm中nup98的特异性上调。
14.图2为nup98调节gscs生长和自我更新。
15.图3为nup98维持gscs干细胞标志物、存活率和胶质母细胞瘤生长。
16.图4为nup98调节gscs中的dna修复通路。
17.图5为nup98与p65相互作用调节gscs的dna修复通路。
18.图6为nup98和p65共同调节gscs中的dna修复通路。
19.图7为nup98过表达与脑肿瘤患者低生存率相关。
20.图8为核孔复合体家族成员基因的相关性分析。
21.图9为p65与nup98相互作用。
22.图10为p65调节gscs的dna修复通路。
具体实施方式
23.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
24.实施例1:
25.胶质母细胞瘤干细胞获取及培养:本发明实验中使用的胶质母细胞瘤组织从杜克大学患者的多余手术切除样本中获得,根据机构审查委员会批准的协议(090401),经过神经病理学审查并获得知情同意书,所有患者研究均按照赫尔辛基宣言进行。gsc387和gsc4121通过杜克大学的材料转让协议进行转让。所有gscs细胞用添加了了不含有维生素a的b27(invitrogen)的neurobasal培养基(invitrogen)中培养,并添加egf和bfgf(各20ng/ml;r&d systems)、丙酮酸钠和glutamax。
26.体内肿瘤发生模型构建:所有小鼠体内肿瘤发生实验都是根据加州大学圣地亚哥分校动物护理和使用机构委员会批准的动物实验方案进行的。对活的gscs细胞进行量化并颅内注射到nsg小鼠中。nup98 shrna实验是通过将10,000个人源gscs细胞植入nsg小鼠的
右大脑皮层形成颅内异种移植物,直到观察到小鼠的明显神经学体征,然后将小鼠处死以进行进一步分析。获取小鼠脑组织,将小鼠脑组织在4%甲醛中固定,在30%蔗糖中冷冻保存,冷冻切片,he染色进行组织学分析。
27.质粒和慢病毒转导:从sigma-aldrich公司获得人基因组中表达靶向人核孔蛋白nup98(nucleoporin 98kda)基因(trcn0000046913和trcn0000046914)、p65(trcn0000014683和trcn0000014686)的两种非重叠shrna的慢病毒,及非靶向对照组shrna(trcn00409),用qrcr分析shrna的敲低效率,用于后续实验。人nup98全长基因、人nup98的各种缺失突变体以及p65全长基因,是通过使用in-fusion hd cloning kit(clontech,638920)试剂盒将基因的开放阅读框(orf)克隆到pcdhmcs-t2a-puro-mscv载体(system biosciences)中,用293ft细胞制备慢病毒,使用标准磷酸钙转染方法通过共转染包装载体pcmv-dr8.2 dvpr and pci-vsvg实现慢病毒转染。
28.增殖和神经球形成分析:在96孔板中以1000个细胞/孔的密度铺板,重复6次,进行细胞增殖实验。用celltiter-glo(promega,madison,wi,usa)试剂盒测量细胞增殖,通过体外极限稀释方法测量神经球的形成,参考(flavahan et al.,2013)。
29.rt-pcr定量:使用trizol试剂(sigma aldrich)提取细胞总rna,qscript cdna synthesis kit(takara)用于将rna反转录成cdna。使用applied biosystems 7900ht循环仪、sybr-green pcr master mix(vazyme)进行实时定量pcr。本发明用于qpcr分析的引物对分别是:
30.人nup98基因上游引物:5
’‑
ctccaccactaattcaggcttt-3’;下游引物:5
’‑
gaggctggtagtctgctgatt-3’;
31.人p65基因上游引物:5
’‑
atgtggagatcattgagcagc-3’;下游引物:5
’‑
cctggtcctgtgagccatt-3’;
32.sox2基因上游引物:5
’‑
agggctgggagaaagaagag-3’;下游引物:5
’‑
ggagaatagttggggggaag-3’;
33.myc基因上游引物:5
’‑
tgaggagacaccgcccac-3’;下游引物:5
’‑
caacatcgatttcttcctcatcttc-3’;
34.olig2基因上游引物:5
’‑
caagaagcaaatgacagagccgga-3’;下游引物:5
’‑
tggtgagcatgaggatgt agttgc-3’;
35.brca1基因上游引物:forward 5
’‑
gaaaccgtgccaaaagacttc-3’;下游引物:5
’‑
ccaaggttagagagttggacac-3’;
36.brca2基因上游引物:5
’‑
acaagcaacccaagtgtcaat-3’;下游引物:5
’‑
tgaagctacctccaaaactgtg-3’;
37.eme1基因上游引物:5
’‑
tctgaggagttgccaacatttg-3’;下游引物:5
’‑
ggcttcacaatctgagatgtcaa-3’;
38.rad54b基因上游引物:5
’‑
gccaaacactgatgatttgtgg-3’;下游引物:5
’‑
cctgagaagaatgcgagatagc-3’;
39.blm基因上游引物:5
’‑
cagactccgaaggaagttgtatg-3’;下游引物:5
’‑
tttggggtggtgtaacaaatgat-3’;
40.xrcc2基因上游引物:5
’‑
tgctttatcacctaacagcacg-3’;下游引物:5
’‑
tgctcaagaattgtaactagccg-3’;
41.brip1基因上游引物:5
’‑
cttacccgtcacagcttgcta-3’;下游引物:5
’‑
cactaagagattgttgccatgct-3’;
42.rad54l基因上游引物:5
’‑
aggcaggtcctgtgatgatga-3’;下游引物:5
’‑
tcaaaggtttccgaaaaggagac-3’;
43.brcc3基因上游引物:5
’‑
gagtctgacgctttcctcgtt-3’;下游引物:5
’‑
tgtatcatcgttcaactcccct-3’;
44.mre11基因上游引物:5
’‑
atgcagtcagaggaaatgatacg-3’;下游引物:5
’‑
caggccgatcacccatacaat-3’;
45.rad51基因上游引物:5
’‑
caacccatttcacggttagagc-3’;下游引物:5
’‑
ttctttggcgcataggcaaca-3’.
46.蛋白免疫印迹:收集样品并在ripa缓冲液(50mm tris-hcl,ph 7.5,150mm nacl,0.5%脱氧胆酸钠,0.1%sds,100mm naf,1mm na3vo4,1mm edta,10%(v/v)甘油,含有pmsf and cocktail抑制剂)中裂解样品,在冰上孵育30分钟,bio-rad试剂盒用于确定蛋白质浓度,使用nupage bis-tris凝胶(life technologies)进行电泳,然后转移到pvdf膜(millipore)上。tbst添加5%脱脂奶粉用于封闭。一抗在4℃下过夜。使用的抗体如下:anti-nup98(c39a3)、anti-p65(d14e12)、anti-ha(6e2)、anti-ha(c29f4)、anti-caspase-3(9662),anti-cleaved caspase-3(5a1e),抗体购自cell signaling technology。anti-γ-h2ax(ab2893)购自abcam。anti-β-tubulin(am031a)抗体购自abgent。anti-parp1(13371-1-ap)购自proteintech。anti-brca1(a0212)、anti-brca2(a2435)、anti-rad51(a2829)、anti-rad54l(a20181)抗体购自abclonal。
47.免疫共沉淀:使用含有pmsf和cocktail抑制剂的ip缓冲液(20mm tris-hcl、150mm nacl、1%triton x-100、0.5%脱氧胆酸钠、1mm dtt)在4℃下裂解细胞2小时。在4℃下离心10分钟14000rpm后,用20μg/ml dna酶i进一步处理上清液30分钟,并将指示抗体和igg作为阴性对照添加到上清液中,并在4℃下培养过夜。然后,上清液在4℃下与protein-a g琼脂珠孵育2小时进行免疫沉淀,对于flag标签蛋白的免疫共沉淀,上清液与m2珠(millipore sigma)在4℃下孵育过夜,
48.免疫荧光染色和成像:对于免疫荧光显微镜成像,将细胞涂覆在涂有基质凝胶的盖玻片上24小时后,细胞在室温下用4%多聚甲醛固定两次30分钟,并用pbs清洗,然后用0.45%的triton x-100渗透10分钟,并在室温下用3%的bsa封闭2小时。将细胞与一抗在4℃下孵育过夜,用pbs洗涤三次后,在37℃下用与alexa fluor 488或alexa fluor 594(invitrogen)结合的二抗染色2小时,洗涤pbs后,用dapi染色细胞核,加入抗荧光猝灭剂后,通过共焦成像(尼康ti-e-air)或尼康80i 10-1500x显微镜观察细胞,使用imagej软件进行处理。
49.患者数据库生物信息学:为了确定nup98在胶质母细胞瘤患者中的临床相关性,我们查询癌症基因组图谱(tcga)胶质母细胞瘤数据集,表达水平被分为两组,以中值为分界点。使用kaplan-meier统计检验和对数秩检验分析两组患者的生存时间和状态。
50.染色质免疫沉淀(chip)分析:每种条件下收集4
×
106个细胞,使用simplechip enzymatic chromatin ip kit(cst,#9003)试剂盒进行芯片检测,细胞在含有1%甲醛的培
养基中在室温下固定10分钟以将蛋白质与dna交联,收集细胞、洗涤、裂解,然后加入微球菌核酸酶消化dna,对细胞进行超声处理,然后在4℃下用抗nup98抗体(c39a3)、抗p65(d14e12)或正常兔igg免疫沉淀裂解物过夜,洗涤拉下的染色质,并通过在65℃下加热6h,然后用蛋白酶k消化,使用以下引物组对纯化的dna进行定量pcr:
51.brca1上游引物:5
’‑
atggattggagtgttgttatgtt-3’;下游引物:5
’‑
tttctccgagtgttcgccaag-3’;
52.brca2上游引物:5
’‑
ggactcttaagggtcagcgag-3’;下游引物:5
’‑
cgcagcagtgccacagc-3’;
53.eme1上游引物:5
’‑
ggctccacccaggatgtg-3’;下游引物:5
’‑
cagtagtcagagcggggtg-3’;
54.rad51上游引物:5
’‑
gctagctccatttcccactt-3’;下游引物:5
’‑
cttttcaacccgccacagcc-3’;
55.blm上游引物:5
’‑
cttttcaacccgccacagcc-3’;下游引物:5
’‑
ggagggacgcgtatctccaa-3’;
56.xrcc2上游引物:5
’‑
cagacaagaaaagcaccagctg-3’;下游引物:5
’‑
cgcagactctacggccagt-3’;
57.rad54l上游引物:5
’‑
aggttcgattgacccggtct-3’;下游引物:5
’‑
aggtggaaaccaggatcagact-3’.
58.rna测序与数据分析:使用trizol试剂(sigma-aldrich)从细胞颗粒中分离总细胞rna,纯化rna并进行测序分析。
59.实施例2:
60.实验结果:
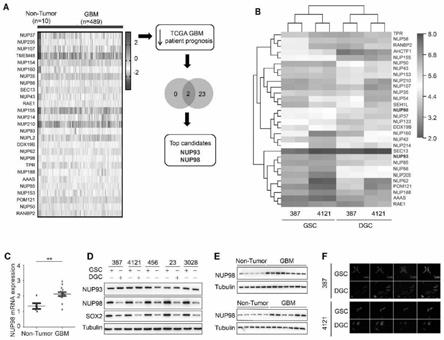
61.图1分析揭示了gscs和gbm中nup98的特异性上调。图1a.tcga gbm数据库中npc基因的mrna表达谱。b.gsc和dgc的npc基因rna序列的配对分析。c.胶质母细胞瘤和正常脑组织中nup98 mrna水平的qrt-pcr定量测定。d.通过免疫印迹法对患者来源的胶质母细胞瘤模型(t387、t4121、t456、gsc23和t3028)的五对gscs和dgcs细胞进行nup98蛋白水平测定,tubulin蛋白作为内参对照。e.通过免疫印迹法评估胶质母细胞瘤和正常脑组织中nup98的蛋白水平,tubulin蛋白作为内参对照。f.人胶质母细胞瘤样本t387和4121的gscs或dgcs中nup98的免疫荧光染色。
62.图2为nup98调节gscs生长和自我更新。图2a.定量rt-pcr检测表达非靶向对照shrna(shcont)、shnup98-1或shnup98-2的387和4121gscs中的nup98 mrna。数据以六个独立实验的平均值
±
sem表示,**p《0.01。b.用对照非靶向shrna序列(shcont)、shnup98-1或shnup98-2转导gscs后的nup98水平的免疫印迹。c.用非靶向对照shrna(shcont)或两个靶向nup98的独立、非重叠shrna(shnup98-1或shnup98-2)中的一个转导两种gscs(387和4121),通过直接细胞计数评估细胞效应。数据以六个独立实验的平均值
±
sem表示,**p《0.01。d.用非靶向对照shrna(shcont)或两个靶向nup98的独立、非重叠shrna(shnup98-1或shnup98-2)中的一个转导两种gsc培养物(387和4121)。通过celltiter-glo细胞活力测定评估细胞效应,数据以六个独立实验的平均值
±
sem表示,**p《0.01。e.用非靶向对照shrna(shcont)或两个靶向nup98的独立、非重叠shrna(shnup98-1或shnup98-2)中的一个转导两
种gscs(387和4121)。通过球体形成的体外极限稀释试验(elda)评估对自我更新的影响。f.对(e)中elda分析的gscs形成的球体数量(每1000个细胞)的定量分析。数据以六个独立实验的平均值
±
sem表示,**p《0.01。g.来源于t387(左)和t4121(右)的表达shcont、shnup98-1或shnup98-2的gscs的神经球的代表性图像。比例尺,100μm。每个图像代表至少5个重复实验。
63.图3为nup98维持gscs干细胞标志物、存活率和胶质母细胞瘤生长。a.b.用对照非靶向shrna序列(shcont)、shnup98-1或shnup98-2转导gscs后,免疫印迹显示caspase 3(a)和parp(b)水平。c.d.对表达shcont、shnup98-1或shnup98-2的387和4121gscs的gbm肿瘤中cleaved caspase-3(cleaved casp-3,绿色)进行免疫荧光染色并对cleaved caspase-3阳性细胞进行定量。比例尺:25μm。数据表示为平均值
±
s.e.m.*p《0.01,t检验。e.在387和4121gscs中用两个非重叠shrnas抑制nup98的表达。使用不针对已知哺乳动物基因(shcont)的对照序列shrna作为阴性对照。对干细胞标志物进行定量rt-pcr,包括sox2、olig2和myc。数据以三个独立实验的平均值
±
sem表示,**p《0.01。f.用对照非靶向shrna序列(shcont)、shnup98-1或shnup98-2转导gscs后,免疫印迹显示干细胞标志物(sox2、olig2和myc)水平。g.表达shcont、shnup98-1或shnup98-2的387或4121gscs的颅内免疫受损小鼠的kaplan-meier生存曲线。(n=每组5只动物)。h.表达shcont、shnup98-1或shnup98-2的387或4121gscs后第18天收集的小鼠大脑组织,苏木精和伊红染色切片。比例尺,2毫米。
64.图4为nup98调节gscs中的dna修复通路。图4a.tcga数据库中与nup98表达相关的go通路的基因富集分析。b.在tcga胶质母细胞瘤样本中,nup98表达与dna修复的转录特征显著相关。使用分子特征数据库和dna修复基因的nup98表达特征计算tcga rna序列数据的单样本gsea分数。阴影表示95%置信区间。c.nup98沉默的387和4121gscs(shnup98)与对照387和4121gscs(shcont)之间差异表达基因的热图分析。差异表达基因有2倍或更大的表达差异。在差异表达基因中,160个上调,185个下调。d.通过比较nup98沉默的387(shnup98)和387gscs(shcont)、4121gscs(shnup98)和对照4121gscs(shcont)之间的差异表达基因,进行rna测序(rna seq)分析。基于每个gsc沉默的相似结果一致性,进行优先排序。图片表示rna序列分析鉴定的shnup98特异基因之间的重叠。e.387和4121gscs中敲低nup98后下调的基因的gsea。用标准化富集分数绘制富集基因特征图。f.对387和4121gscs中的nup98敲低进行生物重复序列rna-seq分析,并对dna修复途径基因进行选择性分析,根据每个样本的log2转化fpkm值计算z分数。g.在387和4121gscs中,使用两个非重叠shrna抑制nup98的表达。使用不针对已知哺乳动物基因(shcont)的对照序列shrna作为阴性对照。对dna修复酶进行定量rt-pcr,包括eme1、rad54b、rad51、blm、brca1、brca2、xrcc2、brip1和rad54l。数据以三个独立实验的平均值
±
sem表示。**p《0.01。h.对照非靶向shrna序列(shcont)、shnup98-1或shnup98-2转导gscs后,免疫印迹实验反映dna修复标记gama-h2ax水平。i.表达shcont、shnup98-1或shnup98-2的387和4121gscs的gbm肿瘤中gama-h2ax(gama-h2ax,绿色)的免疫荧光染色和gama-h2ax阳性细胞的定量。比例尺:25μm。数据表示为平均值
±
s.e.m.*p《0.01,t检验。
65.图5为nup98与p65相互作用调节gscs的dna修复通路。a.387gsc细胞裂解物中的非特异性对照igg或抗nup98抗体进行质谱后,进行免疫沉淀(ip)。b-e.在4121和387gscs中用抗nup98抗体或抗p65抗体对免疫沉淀(ip)产物进行蛋白免疫印迹。f.来源于387和
4121gscs的gbm肿瘤中nup98和p65的免疫荧光染色。h.免疫印迹显示用对照非靶向shrna序列(shcont)、shp65-1或shp65-2转导gscs后的dna修复标记gama-h2ax水平。i.表达shcont、shp65-1或sh65-2的387和4121gscs的gbm肿瘤中gama-h2ax(gama-h2ax,绿色)的免疫荧光染色和gama-h2ax阳性细胞定量。比例尺:25 μm。数据表示为平均值
±
s.e.m.*p《0.01,t检验。
66.图6为nup98和p65共同调节gscs中的dna修复通路。a.nup98沉默的387(shnup98)和对照387gscs(shcont)之间差异表达基因的热图分析。差异表达基因有2倍或更大的表达差异。在差异表达基因中,160个上调,185个下调。b.387和4121gscs中p65敲低后下调基因的gsea。用标准化富集分数绘制富集基因特征图。c.387和4121gscs中的p65敲低后进行rna seq分析,并对dna修复途径基因进行选择性分析,根据每个样本的log2转化fpkm值计算z分数。d.通过比较nup98沉默、p65沉默和jaspar数据库中差异表达的dna修复基因,进行rna测序(rna seq)分析。e.单独使用shnup98、shp65或shnup98和shp65组合后,对dna修复酶进行定量rt-pcr,包括brac1、brac2、rad51、blm、rad54l、xrcc2、eme1和blm。数据以三个独立实验的平均值
±
sem表示。**p《0.01。f.单独使用shnup98、shp65或shnup98和shp65组合后对dna修复酶进行免疫印迹,包括brac1、brac2、rad51、blm、rad54l、xrcc2、eme1和blm。nup98和p65直接与387和4121gscs的dna修复通路中酶的启动子区域结合。t检验,*p《0.05,**p《0.01;n=每组3个独立实验。数据以中位数
±
s.e.m表示。
67.图7为nup98过表达与脑肿瘤患者低生存率相关。(a)来自tcga胶质母细胞瘤数据库的正常大脑(n=10)和胶质母细胞瘤组织(n=528)中nup98的mrna表达。(b至e)通过四种不同胶质瘤数据库对nup98进行kaplan-meier生存分析;(b)tcga胶质母细胞瘤和tcga胶质母细胞瘤lgg rna序列;(c)cgga gbm和cgga胶质母细胞瘤lgg rna序列;(d)rembrandt(e)lee y gbm。(f)nup89表达水平作为胶质母细胞瘤的标志物的roc曲线分析。nup89作为胶质母细胞瘤标志物的诊断准确性为93%,诊断特异性为100%,敏感性为85.4%。
68.图8为核孔复合体家族成员基因的相关性分析。图8显示了tcga胶质母细胞瘤患者基因表达的相关性。图9为p65与nup98相互作用,其表达与tcga胶质母细胞瘤样本中dna修复的转录特征显著相关。
69.图10为p65调节gscs的dna修复通路。在387和4121gscs中使用两个非重叠的shrna敲低p65表达。用不针对已知哺乳动物基因(shcont)的对照序列shrna作为阴性对照。对dna修复酶进行定量rt-pcr,包括rad51、blm、brca2、eme1、brca1、brip1、xrcc2、brcc3、rad54l和mre11。数据以三个独立实验的平均值
±
sem表示。**p《0.01。
70.综上,胶质母细胞瘤(glioblastoma,gbm)是中枢神经系统恶性程度最高的原发性肿瘤,胶质瘤干细胞(glioma stem cells,gsc)被认为是gbm治疗耐受及肿瘤复发的关键,但是单独或联合靶向gsc的临床治疗方案未取得有效进展。本发明中我们发现nup98基因通过调控gsc的dna损伤修复在gsc的自我更新,增殖及胶质瘤的恶性进展中发挥着重要作用。通过病人数据库和细胞水平的分析我们发现nup98在gsc中特异性高表达。在敲低nup98以后我们发现可以抑制gsc的自我更新、增殖并抑制体内肿瘤的进展。进一步通过转录组测序和生物信息学分析,我们发现nup98通过调节dna损伤修复在gsc的自我更新,增殖并抑制体内肿瘤的进展中发挥作用。最后通过蛋白质谱检测,我们发现,nup98调控dna损伤修复是与转录因子p65的结合,并调控p65的转录活性来实现,nup98过表达与脑肿瘤患者低生存率相
关。nup89表达水平作为胶质母细胞瘤的标志物,nup89作为胶质母细胞瘤标志物的诊断准确性为93%,诊断特异性为100%,敏感性为85.4%。
71.应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。