1.本发明涉及抗真菌类药物制剂,尤其涉及伏立康唑外用制剂及其制备方法。
背景技术:
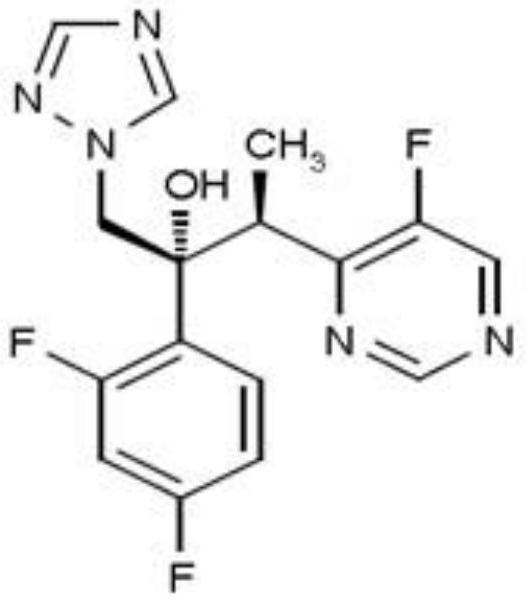
2.伏立康唑化学名为:(2r,3s)-2-(2,4-difluorophenyl)-3-(5-fluoro-4-pyrimidinyl)-1-(1h-1,2,4triazol-1-yl)-2-butanol,分子式为:c
16h14
f3n5o分子量为:349.3。
[0003][0004]
伏立康唑为第二代三唑类抗真菌药物,它克服了第一代抗真菌药,如氟康唑、伊曲康唑抗菌谱不够广、生物利用度低及耐药性问题。用于治疗成人及2周岁以上儿童的侵袭性曲霉病、非中性粒细胞减少症和其他深层组织念珠菌感染中的念珠菌血症、食管念珠菌病,以及由尖端赛多孢子菌和镰刀菌属(包括腐皮镰刀菌)引起的严重真菌感染。
[0005]
皮肤真菌感染临床上根据其感染部位可分为浅表真菌病(感染部位限于角质层、毛发、指甲)、皮下真菌病(真皮及皮下组织的感染)及系统性真菌病(又称为侵袭性真菌病)。浅表真菌病以外用制剂为主,常用药物包括:酮康唑、环吡酮和特比萘芬等外用制剂,其中以酮康唑为代表的咪唑类药物占比最大。由于酮康唑肝毒性较大,其口服给药剂型在欧洲、澳大利亚和中国相继停止使用。2017年中国将酮康唑相关非处方药如洗剂、软膏调出非处方药目录实施处方监测管理。
[0006]
伏立康唑已上市剂型包括用于静脉给药的冻干粉针、口服给药的片剂和干混悬剂,商品名为:vefend。伏立康唑为氟康唑衍生物,其抗菌谱更广,对曲霉属具有杀菌作用;对念珠菌属、赛多孢霉属和镰刀菌属有抗菌活性;对隐球菌属、双相真菌等也有很好的抗菌活性。carrillo-munoz et.al.的研究表明:伏立康唑念珠菌、白色念珠菌、假丝酵母等引起灰指甲的真菌体外抑菌活性好于特比奈芬、伊曲康唑。bueno j g et.al测定了伏立康唑对引起甲真菌病的皮肤真菌(如红毛滴虫、趾间滴虫等)的抑菌活性,其mic几何平均值为0.037-0.107g/ml,抑菌活性较好。其研究也表明:伏立康唑对其他相关的皮肤真菌也有较高的抗真菌活性。muangkaew w et.al.对临床常见皮肤病的真菌(包括:毛癣菌、红毛癣菌、孢子菌等),分别用不同抗真菌药对其进行体外抑菌试验。结果表明:伏立康唑对念珠菌的抑菌效果优于氟康唑、伊曲康唑和特比奈芬。
[0007]
伏立康唑口服和注射剂在临床上应用时间较长,安全性优于以酮康唑代表的咪唑
类抗真菌药。体外抑菌活性试验表明:其对引皮肤感染的真菌具有较好的抑菌活性,可能是治疗顽固性感染(如甲癣)或免疫缺陷患者皮肤真菌感染的安全、有效手段。对于浅表性真菌感染口服或注射剂伏立康唑不容易直接针对患处,如果伏立康唑制备成外用制剂则可直接针对患处,能更有效进行治疗。
[0008]
但是,伏立康唑稳定性较差,尤其是在水溶液状态下,伏立康唑易于水解,经过逆醇醛反应产物重组,生成非活性的异构体杂质。因此,伏立康唑很难制备成有长期稳定的含水的软膏、注射液、滴眼液。此外,伏立康唑logd为1.8,为半极性化合物,其溶解性较差,在水溶液中的溶解度仅为0.65mg/ml,而且无法通过常规增溶方法,如油、表面活性剂或与水混溶的共溶剂进行增溶。
技术实现要素:
[0009]
本发明的目的在于提供一种伏立康唑外用制剂,能直接针对患处,用于治疗浅表性真菌感染,且解决了伏立康唑溶解性差,在水中不稳定的问题,提供一种稳定性好,溶解性好,皮内分布高的伏立康唑外用制剂。
[0010]
本发明的另一目的在于提供一种伏立康唑外用制剂的制备方法。
[0011]
为了解决背景技术中存在的问题,本发明采用如下技术方案:
[0012]
伏立康唑外用制剂,至少包括伏立康唑、基质材料和增溶剂,其中所述的增溶剂是异丙酯类或烃类溶剂。
[0013]
优选的,本发明的伏立康唑外用制剂由伏立康唑、基质材料和增溶剂组成,其中所述的增溶剂是异丙酯类或烃类溶剂。
[0014]
作为优选,所述的异丙酯类是已二酸二异丙酯。
[0015]
作为优选,所述的烃类溶剂是十六烷。
[0016]
作为优选所述的基质材料是十四醇、十六醇、十八醇及其混合物、乳化蜡、微晶蜡、石蜡或液体石蜡、凡士林、矿物油、蜂蜡、羊毛脂、羊毛醇中的一种或多种混合。
[0017]
本发明伏立康唑外用制剂,按重量百分比计包括伏立康唑0.3%~3%、基质材料67%~94%、增溶剂5%~30%。
[0018]
进一步优选的,本发明提供的伏立康唑外用制剂,按重量百分比计包括伏立康唑0.3%~3%、基质材料67%~94%、增溶剂10%~20%。
[0019]
在具体的实施方案中,本发明提供的伏立康唑外用制剂,按重量百分比计包括伏立康唑1%、基质材料79%、增溶剂20%。
[0020]
本发明还公开伏立康唑外用制剂的制备方法,包括如下步骤:
[0021]
(1)增溶剂中加入伏立康唑原料,搅拌溶解;
[0022]
(2)基质材料融化备用;
[0023]
(3)混合搅拌即得。
[0024]
本发明伏立康唑外用制剂,提供了伏立康唑外用抗真菌的剂型,能更有效针对患处,而且解决了伏立康唑外用制剂制备过程中伏立康唑稳定性差,尤其在有水状态下,伏立康唑易水解经过逆醇醛反应产物重组,生成非活性的异构体杂质。本发明在研究中发现伏立康唑在酯类和烷烃类辅料中具有良好的溶解度与稳定性,尤其在加入异丙酯类和烃类溶剂后,效果明显。
附图说明
[0025]
图1为实施例7体外释放的测定实验中伏立康唑软膏在ph7.2磷酸盐缓冲液的释药曲线。
[0026]
图2为迷你猪皮内渗透性实验给药部位示意图。
[0027]
图3为实施例3相容性实验中介质为水对应的液相色谱。
[0028]
图4为实施例3相容性实验中介质为丙二醇时对应的液相色谱。
[0029]
图5为实施例3相容性实验中介质为油酸时对应的液相色谱。
[0030]
图6为实施例3相容性实验中介质为已二酸二异丙酯时对应的液相色谱。
具体实施方式
[0031]
下面结合实施例对本发明做进一步的说明。
[0032]
实施例1:制备伏立康唑软膏剂
[0033]
处方:
[0034][0035][0036]
制备工艺:
[0037]
(1)于烧杯中称取处方量的增溶剂,60℃水浴加热,将处方量的伏立康唑加入搅拌使其尽可能全部溶解,保温备用;
[0038]
(2)60℃水浴加热,熔融基质,至完全融化,保温备用;
[0039]
(3)混合:将步骤(1)获得的药物溶液,在搅拌状态下缓慢倒入融化的基质中,搅拌均匀。于室温下冷却,即得。
[0040]
实施例2:伏立康唑在不同溶剂中溶解度实验;
[0041]
伏立康唑在不同溶剂中溶解度:
[0042][0043]
由上表可知,伏立康唑在已二酸二异丙酯中的溶解度最大。
[0044]
实验例3:相容性
[0045]
将伏立康唑溶解于下列溶剂中,配成近似饱和的含药溶液。含药溶液放置于加速条件下(40℃/75%rh),7天后取出,参照以下液相色谱条件,进行有关物质检测。
[0046][0047][0048][0049]
结论:伏立康唑在不同的溶剂中在加速7天后,检测显示,伏立康唑在乙二酸二异丙酯和十六烷中具备较好的相容性和稳定性,不易降解,伏立康唑在水、丙二醇和油酸中均出现显著的降解。关于杂质计算,是以1/1000浓度的自身对照,杂质计算时,用杂质峰面积as/对照峰面积ar*校正因子。对于杂质a和杂质c,校正因子是0.7。
[0050]
介质为水对应的液相色谱见图3,该谱图对应的数据如下:
[0051] rtarea%areaheightusp plate countresolutions/n11.85667612810.2602043977797 6364.222.1634002346.07411613994753.603616.234.95419090.0292801402520.918.747.379551157583.63741774475639.4113007.1
[0052]
介质为丙二醇时对应的液相色谱见图4,该谱图对应的数据如下:
[0053] rtarea%areaheightusp plate countresolutions/n11.839739220.564129752509 653.022.139455860.348738629522.01371.837.2491298860399.088602708286214.8630335.3
[0054]
介质为油酸时对应的液相色谱见图5,该谱图对应的数据如下:
[0055] rtarea%areaheightusp plate countresolutions/n11.8351027161.043182792564 1036.122.135633420.6431033429822.04585.737.268968331398.314452799293115.1025664.6
[0056]
介质为己二酸二异丙酯时对应的液相色谱见图6,该谱图对应的数据如下:
[0057] rtarea%areaheightusp plate countresolutions/n11.83516220.0192962614 19.522.13513720.01623834402.0915.637.234872741899.966416956303615.4127468.7
[0058]
实施例4:稳定性实验:
[0059]
将实施例1处方1、处方2、处方3获得的伏立康唑软膏于加速条件下放置7天,后进行外观和有关物质检测。
[0060][0061]
结论:实施例1中所得的伏立康唑软膏在加速7天后,总杂增长不明显,显示具有较好的相容性。
[0062]
实施例5:采用体外皮肤渗透性试验,评价不同配方的体外经皮渗透性。
[0063]
实验过程:
[0064]
(1)取出冷冻的猪皮,室温条件下于0.9%的生理盐水中解冻;解冻后,采用电推子剃除猪皮表的猪皮,用手术剪除皮下脂肪组织,备用;
[0065]
(2)将实验用皮铺于franz立式扩散池的接收室,采用手术剪,修剪边缘,边缘余量不少于5mm;修剪完成后,用夹具夹紧。并精密称定整套扩散池的重量。
[0066]
(3)采用1ml注射器,用美工刀切除注射器前部,使前端开口,以便吸取及挤出样品,并减小挤压应力对待待测试样品性能的影响;用该装置吸收约0.2-0.3ml的样品,均匀涂布于皮肤表面(样品加入量约300mg);称取加样后扩散池的重量,扣减加样前的重量后,即得到样品重量;加样结束后,采用封口膜封口,避免样品在实验过程中变干。
[0067]
(4)以ph7.2的磷酸盐缓冲液为接收介质,试验温度32℃
±
1℃;
[0068]
(5)6小时后,分别提取角质层及表皮。采用提取介质,提取并测定其中的药物浓度。
[0069][0070]
实施例6:具有不同处方伏立康唑软膏的制备
[0071]
以凡士林为基质,已二酸二异丙酯为增溶剂和促渗剂,分别制备处方1、4-6.
[0072][0073]
实验步骤:
[0074]
(1)于烧杯中称取约处方量的已二酸二异丙酯,60℃水浴加热,将处方量的伏立康唑加入搅拌使其尽可能全部溶解,保温备用;
[0075]
(2)60℃水浴加热,熔融凡士林基质,至完全融化,保温备用;
[0076]
(3)混合:已二酸二异丙酯药物溶液,在搅拌状态下缓慢倒入融化的凡士林中,搅拌均匀。于室温下冷却,即得。
[0077]
实施例7:体外释放的测定
[0078]
采用franz扩散池,以ph7.2的磷酸盐缓冲液为提取介质,试验温度为32℃
±
0.5℃,扩散膜采用0.45μm聚砜膜(美国pall),进行体外渗透性试验。试验步骤如下:
[0079]
(1)将提取介质加入250ml左右的锥形瓶,于32℃水浴条件下预热。其间,采用温度计确定介质的温度,当介质温度为32℃
±
0.5℃后,备用。
[0080]
(2)将磁力转子加到扩散室,之后将试验用聚砜膜夹持于扩散室和样品室中间。
[0081]
(3)确认介质温度达到32℃
±
0.5℃后,开始加样。将夹持有聚砜膜的扩散池于天平上称重、清零;将不少于300mg的样品缓慢挤到聚砜膜上,用注射器未端抹平,均匀平摊到整个表面。
[0082]
(4)抽取预热好的介质,小心加入扩散池的扩散室中。加液时避免混入气泡。
[0083]
(5)设置转速为600rpm,启动搅拌。确定扩散池内的磁力搅拌转动正常,无跳动、抖动。
[0084]
(6)取样分别于1小时、2小时、4小时、6小时、8小时和24小时,采用取样针,于franz扩散池接收室的中间位置取样。每次取样1ml,同时补充1ml的介质,以保持接收介质液面始终接触到皮面。计算不同时间点提取介质中药物含量,用于计算单位面积药物释放量m;m与时间t的平方根符合以下公式:
[0085][0086]
其中,
[0087]
m为单位面积药物释放量(μg/cm2);
[0088]
t为取样时间;
[0089]
k代表药物的释放速率。
[0090]
实验结果如下:
[0091]
药物释放速率与处方中的已二酸二异丙酯相关,随着已二酸二异丙酯用量的增加,伏立康唑的药物释放速率加快。
[0092][0093]
实施例8:迷你猪皮内渗透性在体动物试验
[0094]
选用3~5月龄、体重15-20kg的迷你猪,首次给药前适应至少一周。动物给药前背部去毛,背部中心线两侧各选取4个区域,共8个区域,每块面积8cm
×
4cm,左右两侧区域间隔5cm,同侧区域间隔4cm。分别于处死前4小时、8小时、12小时和24小时给药,给药后进行包扎。样本采集前用温水清洗每块给药部位。具体见图2。
[0095]
最后一个时间点涂抹给药4小时后用温水清洗给药部位后取样,给药部位皮肤整块取下后分离去除皮下脂肪。调节植皮刀厚度0.1mm,在给药部位取一次,为表皮层;调节植皮刀厚度0.75mm,在相同部位向下依次取两次,两次取下的组织作为真皮层。分离后各组织取约4cm2用于伏立康唑及伏立康唑氮氧化物的检测。
[0096]
[0097][0098]
伏立康唑氮氧化物为伏立康唑在体内的主要代谢物。文献资料表明(p morli
è
re,a m s silva,r s g r seixas,f bosc
á
,j-c mazi
è
re,j ferreira,r santus,p filipe.photosensitisation by voriconazole-n-oxide results from a sequence of solvent and ph-dependent photochemical and thermal reactions.j photochem photobiol b.2018,187:1-9):伏立康唑氮氧化物体外摩尔消光系数mec》1000,可能与伏立康唑的光毒性有关。真皮内过多的伏立康唑氮氧化物,在受光照射后,可能产生光毒性反应。
[0099][0100]
伏立康唑在表皮内的分布,与软膏的释放速率相关,释放越快,释放药量越多,表皮内的伏立康唑含量越高;处方6和处方1在真皮内的药物分布类似,大于处方5,但小于处方1;处方5、处方6和处方1在真皮内的伏立康唑氮氧化物分布类似,远低于处方4。
[0101]
结果表明:处方5释药最慢,其在表皮和真皮内的药物分布最少;处方4释药最快,其在表皮内伏立康唑分布较高,在真皮内伏立康唑和伏立康唑氮氧化物分布远高于其它处方。考虑伏立康唑氮氧化物潜在光毒性,处方4的光毒性可能大于处方1、5和6;处方1具有更高的表皮药物分布,真皮内的伏立康唑和伏立康唑氮氧化物与处方5和处方6类似,可能具有最佳的疗效及最小的毒副作用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。