一种多能干细胞体外形成3d球的培养方法
技术领域
1.本发明属于生物技术领域,具体涉及一种多能干细胞体外形成3d球的培养方法。
背景技术:
2.多能干细胞(pluripotent stem cells,psc)包括胚胎干细胞(escs)和诱导性多能干细胞(ipsc)。胚胎干细胞是指从囊胚期的内细胞团中分离出来的,能在体外培养,具有发育多能性的干细胞。诱导性多能干细胞,是将oct3/4、sox2、c-myc、klf4四种转录因子转入成体细胞中,诱导出与胚胎干细胞性质相似的干细胞。多能干细胞具有无限扩增和体外定向分化能力,给基因功能研究、细胞基因治疗和药物筛选等领域带来了深远的影响。近年来,干细胞医疗行业成果斐然,吸引了社会各界的关注。然而,如何将多能干细胞规模化培养以增加实用性仍然是制约其发展的主要问题之一。
3.就目前而言,细胞培养技术主要分为两种,一种是2d细胞培养技术,另一种则是3d细胞培养技术。2d细胞培养是将细胞黏附在培养板上,在充满营养物质和细胞因子的培养基中贴壁培养。3d细胞培养则是通过特定方法让细胞形成3d球形结构,使细胞在体外进行立体式生长、分化和迁移,并形成具有一定组织特异性的三维复合结构。
4.传统的2d细胞培养体系虽然有很多优点,但这些模型缺乏维持原位细胞特性,无法反映细胞与细胞,细胞与基质之间的相互作用。通过纯化分离所得的原代细胞在体外2d培养之后也往往会失去其原有的功能和特性,3d细胞培养的出现很好的解决了这些问题。
5.多能干细胞3d培养的第一步是将多能干细胞体外形成3d球。目前让多能干细胞形成3d球的方法大概分为以下四种:第一种,将贴壁细胞消化成单细胞悬液,放入低粘附的培养皿中,让细胞自然成球;第二种,将细胞消化成单细胞悬液,加入微载体,细胞依附在微载体上,借助微载体的结构形成3d球;第三种,将细胞消化成单细胞悬液,加入细胞外基质,细胞通过细胞外基质的粘附作用形成3d球;第四种,将细胞消化成单细胞悬液,加入低粘附u底或v底96孔板中,借助离心力,让细胞聚集在底部成球。以上这四种方法存在成球效率低、操作复杂、成本高等缺点,因此寻找一种成球效率高、操作简便、成本低的3d培养方法是必要的。
技术实现要素:
6.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种多能干细胞体外形成3d球的培养方法,能够简化操作,极大提高成球率,无需借助载体,降低培养成本。
7.本发明提出了一种多能干细胞体外形成3d球的培养方法:
8.步骤1,将多能干细胞置于培养器皿中,加入干细胞培养基进行培养;
9.步骤2,细胞生长后,加入消化液,进行消化;
10.步骤3,消化结束后,移除消化液,加入成球培养基,使细胞从培养器皿的表面脱落,但仍然保持细胞团块状态,此时形成细胞悬液;
11.步骤4,将细胞悬液转移至培养皿中继续培养;
12.其中,所述成球培养基成分组成为:干细胞培养基;人神经调节蛋白-1,5ng/ml~10ng/ml;青霉素-链霉素,50u/ml~100u/ml。
13.具体的,步骤2中所述细胞生长后,先将培养基移除,加洗涤液,洗涤后再加入消化液,进行消化。
14.具体的,所述的干细胞培养基包括重组人碱性成纤维细胞生长因子和重组人转化生长因子β。
15.具体的,所述干细胞培养基还包括氨基酸、维生素、碳水化合物、无机盐。
16.优选的,步骤2中所述消化,具体时间为3.5min~4min。
17.进一步优选的,所述消化时间为3.5min~3.75min。
18.优选的,步骤3中所述的使细胞从培养皿表面脱落,具体为用电动助吸器或手动助吸器中的任一种吹打细胞,吹打力度为2ml/s~5ml/s。
19.进一步优选的,所述的吹打力度为2ml/s~2.5ml/s。
20.优选的,步骤2中所述的细胞生长,密度达到60%~90%后进行消化。
21.进一步优选的,所述的细胞生长,密度达到70%~80%后进行消化。
22.优选的,所述洗涤液为磷酸盐缓冲盐溶液或杜氏磷酸盐缓冲盐溶液中的任一种。
23.优选的,步骤2中所述消化液为蛋白水解酶-胶原酶复合液、乙二胺四乙酸或中性蛋白酶中的至少一种。
24.进一步优选的,所述消化液为蛋白水解酶-胶原酶复合液。
25.根据本发明的一种优选的实施方式,至少具有以下有益效果:
26.本发明提出的多能干细胞体外形成3d球的培养方法,操作简单,极大地提高了成球效率,所形成的3d球的数量多,不需要借助外加的载体,降低了在体外对多能干细胞进行3d培养的成本。
附图说明
27.下面结合附图和实施例对本发明做进一步的说明,其中:
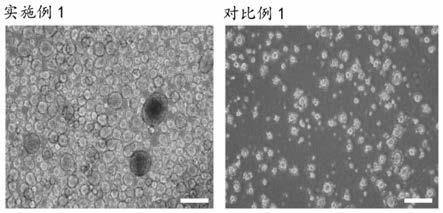
28.图1为本发明实施例1和对比例1中3d培养的人多能干细胞的显微成像图,比例尺为200μm;
29.图2为本发明实施例1、对比例2、对比例3、对比例4和对比例5中3d培养的人多能干细胞的显微成像图,比例尺为200μm;
30.图3为本发明实施例1、对比例2、对比例6和对比例7中3d培养的人多能干细胞的显微成像图,比例尺为200μm。
具体实施方式
31.下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
32.本发明的描述中,除非另有明确的限定,吹打、培养等词语应做广义理解,所属技术领域技术人员可以结合技术方案的具体内容合理确定上述词语在本发明中的具体含义。
33.本发明的描述中,参考术语“一种实施例”等的描述意指结合该实施例描述的具体
方法、材料等包含于本发明的至少一个实施例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例。而且,描述的具体方法、材料可以在任何的一个或多个实施例中以合适的方式结合。
34.实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
35.本发明实施例中用到的耗材和设备如表1所示。
36.表1
37.耗材和设备名称供应商货号t25培养瓶corning4306395ml移液管jet biofilgsp01000510ml移液管jet biofilgsp0100106cm培养皿jet biofiltcd000060二氧化碳培养箱thermo150i电动助吸器gilsonpipetman
38.本发明实施例中用到的主要试剂如表2所示。
39.表2
[0040][0041]
实施例1
[0042]
本实施例使用的培养基为成球培养基1,具体成分及配制如表3所示。
[0043]
表3
[0044]
成分配制量mtesr
tm
1培养基9.9mlheregulinβ-15ng/ml青霉素-链霉素0.1ml
[0045]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化
3.5min;消化结束后将accutase消化液移除,加入成球培养基1进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0046]
实施例2
[0047]
本实施例使用的培养基为成球培养基1,具体成分及配制如表3所示。
[0048]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml乙二胺四乙酸,于二氧化碳培养箱中37℃消化3.5min;消化结束后将乙二胺四乙酸移除,加入成球培养基1进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0049]
实施例3
[0050]
本实施例使用的培养基为成球培养基1,具体成分及配制如表3所示。
[0051]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml中性蛋白酶,于二氧化碳培养箱中37℃消化3.5min;消化结束后将中性蛋白酶移除,加入成球培养基1进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0052]
对比例1
[0053]
本对比例使用的培养基为成球培养基1,具体成分及配制如表3所示,与实施例1的区别在于加入mtesr
tm
1培养基来终止消化。
[0054]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化3.5min;消化结束后加入1ml mtesr
tm
1培养基,以终止消化;将细胞悬液转移到15ml离心管中,800r/min~1000r/min离心5min,弃上清;加入成球培养基1进行吹打,控制力度为2.5ml/s,将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0055]
对比例2
[0056]
本对比例使用的培养基为成球培养基2,具体成分及配制如表4所示,与实施例1的区别在于未加入heregulinβ-1。
[0057]
表4
[0058]
成分配制量mtesr
tm
1培养基9.9ml青霉素-链霉素0.1ml
[0059]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化3.5min;消化结束后将accutase消化液移除,加入成球培养基2进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0060]
对比例3
[0061]
本对比例使用的培养基为成球培养基3,具体成分及配制如表5所示,与实施例1的区别在于加入heregulinβ-1的浓度为2ng/ml。
[0062]
表5
[0063]
成分配制量mtesr
tm
1培养基9.9mlheregulinβ-12ng/ml青霉素-链霉素0.1ml
[0064]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化3.5min;消化结束后将accutase消化液移除,加入成球培养基3进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0065]
对比例4
[0066]
本对比例使用的培养基为成球培养基4,具体成分及配制如表6所示,与实施例1的区别在于加入heregulinβ-1的浓度为10ng/ml。
[0067]
表6
[0068]
成分配制量mtesr
tm
1培养基9.9mlheregulinβ-110ng/ml青霉素-链霉素0.1ml
[0069]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化3.5min;消化结束后将accutase消化液移除,加入成球培养基4进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0070]
对比例5
[0071]
本对比例使用的培养基为成球培养基5,具体成分及配制如表7所示,与实施例1的区别在于加入heregulinβ-1的浓度为20ng/ml。
[0072]
表7
[0073]
成分配制量mtesr
tm
1培养基9.9mlheregulinβ-120ng/ml青霉素-链霉素0.1ml
[0074]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化3.5min;消化结束后将accutase消化液移除,加入成球培养基5进行吹打,控制力度为2.5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0075]
对比例6
[0076]
本对比例使用的培养基为成球培养基2,具体成分及配制如表4所示,与实施例1的区别在于消化时间为4min,吹打力度为5ml/s,未加入heregulinβ-1。
[0077]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化4min;消化结束后将accutase消化液移除,加入成球培养基2进行吹打,控制力度为5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0078]
对比例7
[0079]
本对比例使用的培养基为成球培养基1,具体成分及配制如表3所示,与实施例1的区别在于消化时间为4min,吹打力度为5ml/s。
[0080]
培养方法:培养人多能干细胞,当细胞生长密度达到70%~80%时,从培养瓶中移除培养基,加入4ml pbs清洗1次,加入1ml accutase消化液,于二氧化碳培养箱中37℃消化4min;消化结束后将accutase消化液移除,加入成球培养基1进行吹打,控制力度为5ml/s;将吹打后的细胞悬液转移到3个6cm培养皿中,每个培养皿加入5ml细胞悬液;培养1天后于倒置显微镜下观察成球情况,并选取3个不同的视野拍照。
[0081]
实施例和对比例中人多能干细胞的成球情况如附图所示,其中:
[0082]
实施例1和对比例1中细胞的成球情况如图1所示,采用本发明即实施例1培养形成的3d球,数量非常多;而对比例1基本都为单颗细胞的状态,这是因为加入培养基终止消化,需要将细胞离心和重悬后才能进行接种,在这一过程中已将细胞分散成单细胞状态,导致很难成球。
[0083]
实施例1、对比例2、对比例3、对比例4和对比例5中细胞的成球情况如图2所示,采用本发明即实施例1(heregulinβ-1的浓度为5ng/ml)培养形成的3d球,数量非常多,球体表面相对光滑,有明显的边界区分,且高倍镜下观察到球体比较紧密;对比例2未加入heregulinβ-1,有少量球体形成,球体很小,表面不光滑,没有明显的边界,且高倍镜下观察到球体很松散;对比例3加入heregulinβ-1的浓度为2ng/ml,有球体形成,球体直径整体大于对比例2,小于实施例1,且高倍镜下观察到球体相对松散;对比例4加入heregulinβ-1的浓度为10ng/ml,有较多球体形成,数量上少于实施例1,但球体直径整体要大于实施例1;对比例5加入heregulinβ-1的浓度为20ng/ml,形成球体的数量少于对比例4,球体直径整体大于对比例4。由此可以看出,heregulinβ-1蛋白浓度为0ng/ml、2ng/ml时球体比较松散,直径比较小;浓度为5ng/ml~20ng/ml时,随着蛋白浓度的增加球体数目呈递减趋势,球体直径呈递增趋势,但球体如果大于300μm,内部中心的细胞可能会因营养成分难以到达和缺氧等原因而死亡,实施例1和对比例1~4球体直径小于300μm,对比例5中比较多的球体直径大于300μm。因此heregulinβ-1的蛋白浓度为5ng/ml~10ng/ml是一个适合的浓度范围。
[0084]
实施例1、对比例2、对比例6和对比例7中细胞的成球情况如图3所示,采用本发明即实施例1(heregulinβ-1的浓度为5ng/ml,消化时间3.5min,吹打力度2.5ml/s)培养形成的3d球,数量非常多,球体表面相对光滑,有明显的边界区分;对比例2未加入heregulinβ-1,消化时间3.5min,吹打力度2.5ml/s,有球体形成,表面不光滑,没有明显的边界;对比例6未加入heregulinβ-1,消化时间4min,吹打力度5ml/s,很少有细胞形成3d球,大部分为不规
则细胞团;对比例7加入heregulinβ-1的浓度为5ng/ml,消化时间4min,吹打力度5ml/s,有少量球体出现,球体表面不够光滑。由此可以得出,本发明对人多能干细胞的体外3d培养减少了消化的时间,控制了吹打细胞的力度,使得细胞消化结束后仍然能保持团块状态,增加了成球效率;而且本发明中加入了heregulinβ-1蛋白,它是一种结构相关的糖蛋白,包含一个免疫球蛋白结构域和一个表皮生长样因子结构域,表皮生长样因子结构域是直接与受体酪氨酸激酶erb3和erb4结合所必需的,该蛋白的加入更加提高了成球的效率。
[0085]
另外,与本发明的实施例1相比,实施例2和实施例3分别加入了不同的消化液,结果显示实施例2和实施例3培养形成的3d球,数量多,球体表面相对光滑,有明显的边界区分,与实施例1的成球效果相似。表明乙二胺四乙酸、中性蛋白酶等较温和的消化液也适用于对人多能干细胞进行体外3d成球培养。
[0086]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。