1.本发明属于生物医学技术领域,具体地说,涉及一种去势抵抗性前列腺癌核酸适配体及其筛选方法和应用。
背景技术:
2.前列腺癌是严重威胁我国男性健康的泌尿生殖系恶性肿瘤。在早期,多数前列腺癌患者对雄激素剥夺治疗有效,但在历经3-5年的缓解期后,约20%的患者会由激素依赖性前列腺癌(androgen dependent prostate cancer,adpc)发展为去势抵抗性前列腺癌(castration resistant prostate cancer,crpc)。crpc患者极易发生骨转移,5年生存率较低。当前,国际上公认的crpc临床诊断标准为:去势后血清睾酮水平《50ng/dl并且合并1)生化进展:1周内连续3次psa升高并且psa》2ng/ml;或者2)影像学进展:出现新的转移灶;或者3)患者症状进展恶化。由此可见,国内外对crpc的诊断还处于临床表观水平,无法从微观水平早期发现前列腺癌的去势抵抗状态。在前列腺癌发展为crpc早期,如能在细胞分子水平及早发现并给予有效治疗方案,可延缓肿瘤进展速度,延长患者生存期,提高终末期生活质量。
3.适配体是一段由短链rna或单链dna(single-stranded dna,ssdna)折叠形成的具有特定二维或三维结构的寡聚核苷酸。与抗体类似,适配体能以高亲和力、高特异性结合相应靶标,此外,适配体还具有分子量小、低免疫原性、高组织渗透性、高稳定性等独特优势。基于此,核酸适配体对于肿瘤早期诊断及靶向治疗具有广阔的应用前景。当前,尚未有特异性靶向前列腺癌去势抵抗状态的核酸适配体见诸报道。
技术实现要素:
4.有鉴于此,本发明针对现有技术存在的问题,提供了一种去势抵抗性前列腺癌核酸适配体及其筛选方法和应用,为在细胞分子水平早期筛查去势抵抗性前列腺癌提供新思路和实验基础。
5.为了解决上述技术问题,本发明公开了一种去势抵抗性前列腺癌核酸适配体,该适配体的核苷酸序列组成包含序列1或序列2中任意一条所示的dna片段。
6.优选地,该核酸适配体的dna序列能选择性连接荧光物质、放射性同位素标记物、磁性纳米微粒、化学药物或生物素-链霉亲和素。
7.优选地,核酸适配体的dna序列的某一位置进行甲基化、巯基化、氨基化或磷酸化。
8.优选地,该核酸适配体对去势抵抗性前列腺癌细胞具有良好的靶向亲和性和特异性。
9.优选地,该核酸适配体能特异性结合去势抵抗性前列腺癌细胞。
10.优选地,该核酸适配体能特异性识别并结合去势抵抗性前列腺癌组织。
11.本发明还公开了一种去势抵抗性前列腺癌核酸适配体的筛选方法,包括以下步骤:
12.步骤1,设计并合成随机单链dna文库及上、下游引物,其序列分别为:
13.随机dna文库:
[0014]5’‑
tgcggcagttgaagcaaggc(n40)acggcagcaccagagaacca;
[0015]
上游引物:5
’‑
tgcggcagttgaagcaaggc-3’;
[0016]
下游引物:5
’‑
tggttctctggtgctgccgt-3’;
[0017]
上游引物的5’端用fam标记,下游引物的5’端用生物素标记;
[0018]
dna文库和引物采用固相亚磷酸酰胺合成法,经hplc纯化;
[0019]
步骤2,模板dna提取
[0020]
取2od随机单链dna文库,用1.2ml灭菌双蒸水和0.3ml结合缓冲液binding buffer充分溶解,在95℃变性5min,冰浴10min;
[0021]
分别制备激素依赖性前列腺癌细胞系lncap和去势抵抗性前列腺癌细胞系c4-2的细胞悬液,置于超声破碎仪作用60min,将上述预处理的细胞悬液分别与随机dna文库溶液在37℃振荡孵育2h,经灭菌pbs洗涤后加入等体积酚-氯仿-异戊醇溶剂混匀,离心;移取上方的无机液体再次加入等体积酚-氯仿-异戊醇溶剂混匀,重复此过程2-3次;
[0022]
向所得产物中加入1/10体积的乙酸钠和等体积的异丙醇混匀,置于-20℃冷冻3h,离心,加入-20℃预冷的75%酒精,离心后加入灭菌双蒸水重悬沉淀,充分混匀;
[0023]
步骤3,目的dna提取
[0024]
以步骤2中提取的dna为模板行pcr扩增,向pcr产物中加入1/10体积乙酸钠和等体积的异丙醇混匀,置于-20℃冷冻3h,离心,用-20℃预冷的75%酒精重悬沉淀,离心,用buffer i缓冲液重悬沉淀,置于水浴锅中煮沸10min,然后迅速转移到冰上冰浴30min;
[0025]
移取50μl链霉亲和素磁珠悬液,在磁性分离器上静置1min,弃上清,加入buffer i缓冲液充分振荡重悬,磁性分离,然后与上述经冰浴30min的dna溶液充分振荡重悬、磁性分离,移取上清液加入1/10体积的乙酸钠和等体积的异丙醇混匀,置于-20℃冷冻3h,离心,再次加入-20℃预冷的75%酒精重悬,离心,则白色沉淀即为此一轮筛选得到的单链dna;
[0026]
步骤4,核酸适配体的筛选
[0027]
以步骤3得到的单链dna作为下一轮筛选的文库和dna模板,重复步骤3的操作,每重复一次为一轮筛选,共进行14轮筛选,最后一轮所得的白色沉淀即为目的dna,即核酸适配体。
[0028]
优选地,结合缓冲液binding buffer的配置方法:分别称取23.83g hepes,43.87g nacl,1.87g kcl,0.83g无水cacl2,1.02g mgcl2·
6h2o,分别用灭菌双蒸水溶解后混合,再用盐酸调ph至7.4,最后灭菌双蒸水定容至1000ml,即得。
[0029]
优选地,buffer i缓冲液的配置方法:将tris-hcl、edta溶液及nacl混合,使组分浓度分别达到10mmol/l tris-hcl,1mmol/l edta,1mol/l nacl,最后加入1ml tween-20充分混匀,调整ph至7.4。
[0030]
在本发明的第三个方面,一种去势抵抗性前列腺癌核酸适配体在检测去势抵抗性前列腺癌组织细胞中的应用。
[0031]
与现有技术相比,本发明可以获得包括以下技术效果:
[0032]
本发明公开的一种去势抵抗性前列腺癌核酸适配体,较传统的抗体相比具有分子量小、低免疫原性、高亲和性等优势;此外,本发明核酸适配体采用的筛选技术成本低,可在
体外大批量生产,可重复性好,易于运输保存。
[0033]
本发明核酸适配体能以高亲和性高特异性结合去势抵抗性前列腺癌组织细胞。利用本发明核酸适配体能从细胞分子水平早期检测前列腺癌的去势抵抗状态,对于及时调整前列腺癌用药、改善预后具有重要意义。
附图说明
[0034]
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
[0035]
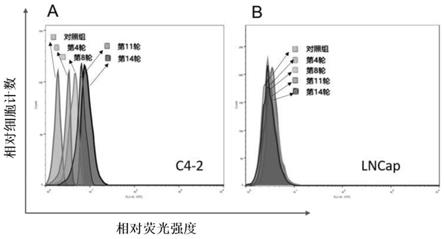
图1为本发明实施例中核酸适配体的筛选流程,峰形代表第4轮、第8轮、第11轮、第14轮筛选产物与靶细胞结合情况,其中a为crpc-1,b为crpc-2;
[0036]
图2为本发明实施例中核酸适配体crpc-1的二级结构示意图;
[0037]
图3为本发明实施例中核酸适配体crpc-2的二级结构示意图;
[0038]
图4为本发明实施例中核酸适配体crpc-1和crpc-2的解离常数曲线,其中a为crpc-1,b为crpc-2;
[0039]
图5为本发明实施例中利用流式细胞术检测核酸适配体crpc-1、crpc-2对去势抵抗性前列腺癌细胞的靶向亲和性,其中a为crpc-1,b为crpc-2;
[0040]
图6为本发明实施例中利用细胞免疫荧光染色检测核酸适配体crpc-1、crpc-2对去势抵抗性前列腺癌细胞的靶向亲和性;
[0041]
图7为本发明实施例中利用组织免疫荧光染色检测核酸适配体crpc-1对去势抵抗性前列腺癌组织的靶向特异性;
[0042]
图8为本发明实施例中分子探针aptamer
crpc-1-goldmag对去势抵抗性前列腺癌细胞的mr成像检测。
具体实施方式
[0043]
以下将配合实施例来详细说明本发明的实施方式,藉此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
[0044]
本发明公开了一种去势抵抗性前列腺癌特异性核酸适配体,有助于解决目前前列腺癌去势抵抗状态发现不及时、治疗延后的难题,且较传统抗体制备简便、稳定性好、易于保存运输。
[0045]
本发明采用流式细胞术对核酸适配体筛选过程进行监测,以去势抵抗性前列腺癌细胞c4-2为靶细胞,以激素依赖性前列腺癌细胞lncap为负筛选细胞。结果显示,随着筛选轮次的增加,核酸适配体与靶细胞结合的荧光强度逐渐增强,说明本发明筛选出的核酸适配体能与靶细胞特异性结合,且结合能力随筛选次数的增加而逐渐增强,至第14轮筛选时,核酸适配体与靶细胞的结合趋于饱和。
[0046]
本发明公开了一种去势抵抗性前列腺癌核酸适配体,该适配体的核苷酸序列组成包含序列1或序列2中任意一条所示的dna片段。
[0047]
序列1:
[0048]5’‑
ggatgacgctcggatgccactacgagagcggttgtatttcgagtgtaaaagtgtcaccagcacgtggcaaaccgtctggg-3’;
[0049]
序列2:
[0050]5’‑
aggcagacgccaacgaggaggttggagtctcgtctggtttccggattgaatagttcaggcaaacgccagcatccatgagc-3’。
[0051]
该核酸适配体的dna序列能选择性连接荧光物质、放射性同位素标记物、磁性纳米微粒、化学药物或生物素-链霉亲和素。
[0052]
核酸适配体的dna序列的某一位置进行甲基化、巯基化、氨基化或磷酸化。
[0053]
以上无论是经过哪种修饰的核酸适配体序列,均具有与初始核酸适配体类似的分子构象、理化性质及靶向能力,均可用于去势抵抗性前列腺癌组织细胞的检测。
[0054]
实施例1:去势抵抗性前列腺癌特异性核酸适配体筛选
[0055]
(1)设计合成随机单链dna文库及上、下游引物
[0056]
设计合成两端含有20个核苷酸、中间含有40个核苷酸的随机单链dna文库,其序列为:
[0057]
tgcggcagttgaagcaaggc(n40)acggcagcaccagagaacca;
[0058]
上游引物:5
’‑
tgcggcagttgaagcaaggc-3’;
[0059]
下游引物:5
’‑
tggttctctggtgctgccgt-3’;
[0060]
上游引物的5’端用fam标记,下游引物的5’端用生物素标记;
[0061]
dna文库和引物采用固相亚磷酸酰胺合成法,经hplc纯化。
[0062]
(2)模板dna提取
[0063]
取2od随机单链dna文库,用1.2ml灭菌双蒸水和0.3ml 5
×
binding buffer(23.83g hepes,43.87g nacl,1.87g kcl,0.83g无水cacl2,1.02g mgcl2·
6h2o,盐酸调ph至7.4,灭菌双蒸水定容至1000ml)充分溶解,在95℃变性5min,冰浴10min;分别制备激素依赖性前列腺癌细胞系lncap和去势抵抗性前列腺癌细胞系c4-2的细胞悬液,置于超声破碎仪作用60min,将上述预处理的细胞悬液分别与随机dna文库溶液在37℃振荡孵育2h,经灭菌pbs洗涤后加入等体积酚-氯仿-异戊醇(酚、氯仿、异戊醇的体积比为125:24:1)溶剂混匀,离心。离心后的液体分为三层:上方清亮的无机液体层,中间白色的蛋白层和下方油状的有机层。移取上方的无机液体再次加入等体积酚-氯仿-异戊醇(酚、氯仿、异戊醇的体积比为125:24:1)溶剂混匀,重复此过程2-3次。向所得产物中加入1/10体积的乙酸钠(3mol/l)和等体积的异丙醇混匀,置于-20℃冷冻3h,离心,加入适量-20℃预冷的75%酒精,离心后加入灭菌双蒸水重悬沉淀,充分混匀。
[0064]
(3)目的dna提取
[0065]
以步骤(2)中提取的dna为模板行pcr扩增(c4-2细胞基因组作为正筛选的pcr模板,lncap细胞基因组作为负筛选的pcr模板),向pcr产物中加入1/10体积乙酸钠(3mol/l)和等体积的异丙醇混匀,置于-20℃冷冻3h,离心,用-20℃预冷的75%酒精重悬沉淀,离心,用buffer i缓冲液(buffer i缓冲液的配置方法:将tris-hcl、edta溶液及nacl混合,使组分浓度分别达到10mmol/l tris-hcl,1mmol/l edta,1mol/l nacl,最后加入1ml tween-20充分混匀,调整ph至7.4。)重悬沉淀,置于水浴锅中煮沸10min,然后迅速转移到冰上冰浴30min。移取50μl链霉亲和素磁珠悬液,在磁性分离器上静置1min(此操作以后均简称“磁性分离”),弃上清,加入适量buffer i缓冲液充分振荡重悬,磁性分离,然后与上述经冰浴30min的dna溶液充分振荡重悬、磁性分离,移取上清液加入1/10体积的乙酸钠(3mol/l)和
等体积的异丙醇混匀,置于-20℃冷冻3h,离心,再次加入适量-20℃预冷的75%酒精重悬,离心,则白色沉淀即为此一轮筛选得到的单链dna,以此作为下一轮筛选的文库和dna模板,重复上述“目的dna提取”步骤,每重复一次为一轮筛选,共进行14轮筛选,最后一轮所得的白色沉淀即为目的dna,即核酸适配体。利用流式细胞术监测核酸适配体筛选进程,如图1所示。
[0066]
(4)核酸适配体鉴定
[0067]
将最后一轮次筛选所得的dna产物行pcr扩增纯化,pcr产物与ptopo载体连接,转化至大肠杆菌感受态dh5
ɑ
中进行扩增。随机挑取60个单克隆,分别置于lb培养基中培养12h,然后行菌液pcr,pcr产物用核酸凝胶电泳鉴定。将出现明显目的条带的菌液样品进行dna测序。经过对测序结果对比分析,最终得到如下两条单链dna序列,即为上述本实施例可用于检测去势抵抗性前列腺癌组织细胞的核酸适配体。
[0068]
序列1(命名为crpc-1):
[0069]5’‑
ggatgacgctcggatgccactacgagagcggttgtatttcgagtgtaaaagtgtcaccagcacgtggcaaaccgtctggg-3’;
[0070]
序列2(命名为crpc-2):
[0071]5’‑
aggcagacgccaacgaggaggttggagtctcgtctggtttccggattgaatagttcaggcaaacgccagcatccatgagc-3’。
[0072]
用rna structure(http://rna.urmc.rochester.edu/rnastructureweb/)预测核酸适配体的二级结构,如图2和3所示。
[0073]
在核酸适配体5’端标记fam荧光基团,采用单点吸附测定法获得适配体的平衡解离常数kd。以流式细胞术荧光几何平均值为纵坐标,以适配体浓度为横坐标,根据公式y=bmax
×
x/(kd x)方程模拟曲线,计算核酸适配体的平衡解离常数。结果表明,核酸适配体的平衡解离常数均在纳摩尔范围内,且crpc-1较crpc-2的平衡解离常数更小,如图4所示。
[0074]
实施例2:检测去势抵抗性前列腺癌特异性核酸适配体的特异性
[0075]
(1)流式细胞术检测核酸适配体的细胞特异性
[0076]
常规培养人前列腺癌细胞系lncap和c4-2。取对数生长期的前列腺癌细胞,用0.25%胰酶消化,800rpm离心5min,弃上清,加入流式洗液重悬细胞,1000rpm离心5min,用胎牛血清37℃封闭30min,加入200pmol fam标记的核酸适配体crpc-1/crpc-2溶液充分重悬细胞,置于冰上孵育30min,用流式细胞仪检测各细胞系分别与两条核酸适配体特异性结合的情况,结果如图5所示。
[0077]
结果显示:crpc-1和crpc-2均可以与去势抵抗性前列腺癌细胞系c4-2特异性结合,结合荧光强度较高,而不能结合激素依赖性前列腺癌细胞系lncap;结果说明,筛选出的两条适配体对crpc细胞具有良好的靶向亲和性和特异性。
[0078]
(2)细胞免疫荧光染色检测核酸适配体的细胞特异性
[0079]
同样取对数生长期的前列腺癌细胞lncap和c4-2,分别接种于20mm激光共聚焦培养皿中,置于细胞培养箱中培养,待细胞完全伸展并长到培养皿底面积约75%时,吸弃上清液,pbs洗涤,向培养皿中加入4%多聚甲醛固定15min,5%bsa室温封闭1h,用pbs洗涤后加入200pmol fam标记的核酸适配体crpc-1/crpc-2溶液,置于4℃避光孵育6-8h,加入dapi(dapi与pbs溶液按照体积比为1:1000)孵育5min衬染细胞核,封片后置于激光共聚焦荧光
显微镜下观察各细胞的荧光显示比例,结果如图6所示。
[0080]
结果显示:c4-2细胞表面可见明显的荧光标记,而lncap细胞表面未见特异性荧光显示,结果说明筛选出的核酸适配体能特异性结合去势抵抗性前列腺癌细胞。
[0081]
(3)组织免疫荧光染色检测核酸适配体的组织特异性
[0082]
分别收集临床良性前列腺增生组织、早期前列腺癌组织及去势抵抗性前列腺癌组织,浸泡于4%多聚甲醛固定;常规脱水、透明、浸蜡、包埋,制成石蜡组织块,按4μm厚度切成组织切片;经抗原修复后,向组织切片上滴加适量5%bsa,使其完全覆盖组织,室温封闭1h,然后将标记fam荧光基团的核酸适配体溶液滴加到组织切片上,4℃避光孵育过夜;加入适量dapi(1:1000)室温孵育5min衬染细胞核,封片后置于激光共聚焦荧光显微镜下观察三种前列腺病理组织的荧光显示比例,结果如图7所示。
[0083]
结果显示:核酸适配体能使去势抵抗性前列腺癌组织特异性染色,而对良性前列腺增生组织及早期前列腺癌组织染色不明显,结果说明筛选出的核酸适配体能特异性识别并结合去势抵抗性前列腺癌组织。
[0084]
实施例3:核酸适配体与金磁纳米微粒共偶联构建的分子探针在去势抵抗性前列腺癌细胞的mr成像检测
[0085]
(1)核酸适配体crpc-1与金磁纳米微粒共偶联构建分子探针aptamer
crpc-1-goldmag
[0086]
充分振摇goldmagtm-cs金磁纳米微粒悬液,取200μl加入500μl偶联缓冲液振荡混匀,于室温旋转混合30min,磁性分离5min。巯基修饰的核酸适配体crpc-1和随机dna文库各取50μl,分别加入500μl偶联缓冲液充分混匀后加入金磁纳米微粒中,37℃、220rpm孵育30min,磁性分离。加入500μl pbst缓冲液洗涤、重悬偶联产物,磁性分离,弃上清。pbs洗涤后加入600μl封闭缓冲液充分重悬偶联产物,在37℃、220rpm振摇封闭1h,用pbs重复洗涤、磁性分离。用同样方法制备对照分子探针ssdna-goldmag(ssdna为随机单链dna)。
[0087]
(2)体外探究分子探针对去势抵抗性前列腺癌细胞的mr成像
[0088]
取前列腺癌细胞系lncap、c4-2以及人正常前列腺基质细胞系wpmy-1分别接种于6孔板中,在孵箱培养过夜,用pbs洗涤细胞3次,向6孔板中分别加入10μl分子探针,置于孵箱中孵育30min;用细胞刮刀刮下6孔板中的贴壁细胞,分别收集到ep管中,向各ep管加入1ml温热的琼脂糖凝胶溶液充分混匀,置于室温冷却至凝固;将ep管置于mri扫描仪上进行扫描,采用t2wi横轴位方向扫描,扫描参数为:tr 3500ms,te 90ms,fov 109mm,层厚2.0mm,层数8,平均采集次数8次。扫描完成后,将mr图像传到后处理工作站进行处理,分别测量比较图像中各组样品的信号强度,结果如图8所示。
[0089]
结果显示:分子探针aptamer
crpc-1-goldmag可以使去势抵抗性前列腺癌细胞c4-2的t2wi信号强度减低,作为细胞对照组的激素依赖性前列腺癌细胞lncap以及人正常前列腺基质细胞wpmy-1的t2wi信号强度未见明显减低;此外,对照组分子探针ssdna-goldmag均不能使如上细胞t2wi信号强度减低。结果说明aptamer
crpc-1-goldmag对去势抵抗性前列腺癌细胞具有一定亲和性,且能通过mr成像检测。
[0090]
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行
改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。