1.本发明涉及蛋白质加工技术领域,具体涉及一种乳清蛋白组合物及其制备方法和应用。
背景技术:
2.乳清蛋白(whey protein)被称为蛋白之王,是从牛奶中提取的一种蛋白质,具有营养价值高、易消化吸收、含有多种活性成分等特点,是公认的人体优质蛋白质补充剂之一。
3.在各种蛋白质中,乳清蛋白的营养价值是最高的。乳清蛋白属于优质的完全蛋白质,也是动物性蛋白。它含有人体必需的8种氨基酸,且配比合理,接近人体的需求比例,是人体生长、发育、抗衰老等生命活动不可缺少的精华物质。同时,乳清蛋白较易被消化吸收,并且许多实验研究都证明,服用乳清蛋白浓缩物能促进体液免疫和细胞免疫,刺激人体免疫系统,阻止化学诱发性癌症的发生。此外,乳清蛋白中脂肪、乳糖含量低,但它含有β-乳球蛋白、α-乳白蛋白、免疫球蛋白,还有其他多种活性成分。正是这些活性成分使乳清蛋白具备了有益于人体的诸多保健功能,因此它被认为是人体所需的优质蛋白质来源之一。
4.从营养学的角度来看,经动物性蛋白质来源的食物中含有对人体有害的过量饱和脂肪、胆固醇等有害物质,过量食用易导致人体脂肪和胆固醇升高,从而导致心血管疾病的发生。通过服用蛋白粉可以在补充蛋白的同时避免这些问题。再加上它服用方便,吸引利用率高,能减少肠胃负担,所以服用蛋白粉是补充蛋白质的最佳选择,而乳清蛋白则是人们选择蛋白粉的首要考虑。
5.对于乳清蛋白质,由于从经口摄取到消化吸收的速度快,并包含大量支链氨基酸,如撷氨酸、亮氨酸、异亮氨酸等,因此一般认为可以防止肌肉疲劳,并且可以高效地增强肌肉。然而,如果可以将这种释放特性放缓,将能够更好地促进肌肉正向合成而可以广泛应用于预防老年人肌肉萎缩、运动人群运动后肌肉修复和瘦身需求以及儿童生长发育等诸多领域。
6.缓释乳清的当前状态取决于“胶束乳清”的发展和未公开的聚合工艺,由glanbia销售的原料wheyxr(wxr)是宣称具有缓释特性的聚合型乳清。其认为所形成的较大的乳清聚集体,能够限制胃蛋白酶到达蛋白质并减慢在胃中的消化。所有证据似乎都基于乳清蛋白对胃液中存在的胃蛋白酶的相对耐受性。然而,由于乳清蛋白倾向于快速通过胃部并进入小肠,因此难以证明对胃蛋白酶耐受的相关性。
技术实现要素:
7.有鉴于此,本发明的目的在于提供一种乳清蛋白组合物,使其在经过胃肠消化道时具备更缓慢的消化特性;
8.本发明的另外一个目的在于提供一种能够缓慢释放亮氨酸的乳清蛋白组合物;
9.本发明的另外一个目的在于提供一种能够显著提高在胃中粘度的乳清蛋白组合
物,使其能够延缓进入肠道的时间;
10.本发明的另外一个目的在于提供一种能够降低β-乳球蛋白消化速率的乳清蛋白组合物;
11.本发明的另外一个目的在于提供上述乳清蛋白组合物在制备营养补充剂、肌肉合成促进剂和乳制品中的应用以及其制备方法。
12.为了实现上述目的,本发明提供如下技术方案:
13.一种乳清蛋白组合物,包括乳清蛋白和β-酪蛋白,其中β-酪蛋白与乳清蛋白的质量比不低于4.5:95.5。本发明在具体实施方式中所使用的乳清蛋白和β-酪蛋白主要来自于牛乳,但这并不排除其可以选择来自其他来源的原料乳。本发明乳清蛋白组合物可以是直接通过对原料乳进行工艺处理制备出的符合要求的混合物;也可以是将β-酪蛋白和乳清蛋白按比例复配添加的混合物。
14.作为优选,所述β-酪蛋白与乳清蛋白的质量比为(4.5:95.5)-(50:50);进一步优选地,所述β-酪蛋白与乳清蛋白的质量比为(9:91)-(20:80),更优选地,所述β-酪蛋白与乳清蛋白的质量比为(9:90)-(17:83);在本发明具体实施方式中,所述β-酪蛋白与乳清蛋白的质量比可选择为4.6:95.4、5:95、9.4:90.6、10:90、15:85、16.6:83.4或17:83。
15.除直接使用β-酪蛋白和乳清蛋白复配外,本发明也能使用特定的处理(包括在低温下保持一定时间)将β-酪蛋白从酪蛋白胶束中溶出后进入到乳清中,利用其独特的分子伴侣作用,与乳清蛋白中的α-乳白蛋白和β-乳球蛋白形成独特的结合体,从而保护乳清蛋白不会迅速消化。与标准乳清浓缩蛋白以及wheyxr(wxr)相比,本发明组合物无论是通过对原料乳进行工艺处理制备得到还是按比例复配添加得到,都具有降低亮氨酸释放速率的特性。
16.同时,在不同β-酪蛋白和乳清蛋白比例的组合物中,对β-乳球蛋白残余量分析,结果显示,在4:96的以上比例的组合物中才能够表现出相比较标准乳清浓缩蛋白更慢的β-乳球蛋白消化速率。
17.在前述乳清蛋白基础上,本发明发现微粒化过程会进一步强化β-酪蛋白与乳清蛋白的充分组合,从而进一步达到缓慢释放亮氨酸的效果,以及增加体外消化模型消化中胃液的粘度,这可能会阻止蛋白质释放到肠内,延迟了消化过程。与ph6.5的微粒化过程相比,ph7.5的微粒化过程在这些方面的效果更加明显;而且,本发明组合物无论是通过对原料乳进行工艺处理制备得到还是按比例复配添加得到都可以通过微粒化达到上述效果。同时微粒化过程也会改善混合物的其他物理属性包括粒径分布、溶解性、稳定性、黏度等。比较意外的是,本发明发现如果不复配β-酪蛋白而单独对标准乳清浓缩蛋白进行微粒化过程,会加剧乳清蛋白的消化速率,这说明了β-酪蛋白的添加能够改变这种过快的消化速率现象并可进一步延缓消化过程。正是基于上述的实验结论,本发明的乳清蛋白组合物优选为微粒化后的乳清蛋白组合物。
18.作为优选,所述微粒化在ph值6.5-9.0下高温高速剪切;所述高温为80-100℃,所述高速剪切为6000-20000rpm,处理时间为3-10min。更优选为高温为91-99℃,所述高速剪切为8000-15000rpm,处理时间为4-8min。其中,优选微粒化工艺参数为:ph7.5,温度95℃,时间5min,剪切速率9600rpm。微粒化结束后迅速冷却至15℃。
19.作为更进一步地方案优化,本发明还在前述基础上添加多糖;多糖因其天然的粘
稠度优势及多羟基基团的存在而具有较多的结合位点,从而与富含β-酪蛋白的乳清蛋白具备了进一步结合的条件,它可能会进一步增强混合物的黏度特性或延缓亮氨酸的释放速率。海藻酸盐和κ-卡拉胶在体外消化模型胃液中的粘度高于其他测试的多糖,其中κ-卡拉胶是其他多糖的30-50倍。同时,在ph7.5的微粒化下附加多糖的效果要优于在ph6.5的微粒化下附加多糖的效果。
20.在对亮氨酸释放的分析实验中,海藻酸钾能降低微粒化富含β-酪蛋白的乳清蛋白在体外消化过程中亮氨酸的释放速率;虽然添加κ-卡拉胶不能显著降低微粒化富含β-酪蛋白的乳清蛋白在肠道阶段亮氨酸释放速率,但考虑到κ-卡拉胶会引起胃液粘度的强烈增加,因此可以预见补充κ-卡拉胶后,乳清蛋白进入肠道的速度会更慢,将有助于延迟在体内小肠中释放出游离亮氨酸。
21.在消化实验中,相对于标准乳清浓缩蛋白以及市售产品wxr及其添加多糖的对照品,本发明的经过微粒化并且附加相同多糖的乳清蛋白组合物的水解度低于各对照品的水解度,这表明了本发明乳清蛋白组合物具备更好的缓释效果;同样地,ph7.5微粒化的实验组的效果一如既往的表现出优于ph6.5微粒化的实验组的效果。
22.作为优选,本发明所述多糖选自卡拉胶、海藻酸盐、壳聚糖、羧甲基纤维素和黄蓍胶中的一种或两种以上,多糖添加量为0.1-0.3%;根据前述实验结果,在具体实施方式中,可添加κ-卡拉胶和/或海藻酸钾,以期实现在不同消化道中的优异效果。
23.同时,本发明还提供了通过对原料乳进行工艺处理制备乳清蛋白组合物的方法,将脱脂原料乳在0-10℃下低温处理(静置10-120h,优选10-24h),然后用不小于20-200nm的膜过滤,透过液通过超滤浓缩除去乳糖,获得含有乳清蛋白和β-酪蛋白的乳清蛋白组合物。
24.在较低温度下β-酪蛋白从酪蛋白胶束中释放出来富集到脱脂乳的上清中。发生原因是疏水作用的强度随着温度的降低而降低,从而使β-酪蛋白从胶束中自由溶出并进入上清。β-酪蛋白可以形成自己的胶束,但直径不大于20-30nm。因此,使用20-200nm(优选50nm)的陶瓷膜或聚合膜足以截留酪蛋白胶束,同时允许乳清蛋白和β-酪蛋白穿过进入透过液。然后使用超滤(10kda)来浓缩透过液并除去乳糖,剩下的上清蛋白含有的β-酪蛋白与乳清蛋白的比例为(4.5:95.5)-(20:80)。
25.sds-page凝胶电泳结果显示,在10℃、4℃和2℃处理牛奶后得到的β-酪蛋白与乳清蛋白的比例,使用化学发光成像仪进行估算,10℃为4.6∶95.4;4℃为9.4∶90.6;2℃为16.6:83.4。因此,本发明的制备方法可以轻松达到含有5-20%的β-酪蛋白的乳清蛋白。如果要达到更高β-酪蛋白比例的乳清蛋白组合物,可以通过复配的方式进行。
26.根据前述关于微粒化过程所能够带来的有益效果的描述,本发明制备方法可进一步增加微粒化的操作过程,所述微粒化为在ph值6.5-9.0下高温高速剪切,然后迅速冷却防止蛋白长时间高温变性。作为优选,所述高温为80-100℃,所述高速剪切为6000-20000rpm,处理时间为3-10min。更优选为高温为91-99℃,所述高速剪切为8000-15000rpm,处理时间为4-8min。其中,优选微粒化工艺参数为:ph7.5,温度95℃,时间5min,剪切速率9600rpm。微粒化结束后迅速冷却至15℃。
27.作为优选,所述微粒化过程为通过浓缩处理(蛋白质浓度不低于4%)得到浓缩液,随后进行微粒化处理,进一步浓缩至总固形物含量不低于20%,并根据需要喷干成粉、不喷成干粉或成为其他形式的组合物。
28.在本发明具体实施方式中,所述微粒化过程为将超滤后的截留液在55℃下浓缩,直至达到5%-10%的蛋白质浓度。通过添加hcl或naoh将浓缩液的ph调至ph7.5,并在95℃下处理5min,同时进行9600rpm高速剪切。在该步骤之后,将微粒化的蛋白体系迅速冷却至15℃。然后进一步浓缩至总固体含量为20-25%,最后进行喷雾干燥(进口温度200℃,出口温度保持在90-100℃之间)。
29.微粒化之后还可以添加多糖进行混合,所述选自卡拉胶、海藻酸盐、壳聚糖、羧甲基纤维素和黄蓍胶中的一种或两种以上,添加量为0.1-0.3%。
30.根据上述提供的制备方法,本发明同样提出了由所述制备方法制备获得的乳清蛋白组合物。由于本发明提供的乳清蛋白组合物具备多种缓慢消化的技术效果,并且相比市售同类产品wheyxr具备更加优秀的缓慢消化效果,因此本发明还提供了乳清蛋白组合物在制备具有缓慢消化和/或缓慢释放氨基酸的乳清蛋白类产品中的应用,这些产品可以是营养补充剂、肌肉合成促进剂或一些乳制品。
31.因此,本发明同样提供了所述乳清蛋白组合物在制备营养补充剂、肌肉合成促进剂或乳制品中的应用,所述乳清蛋白组合物既可以是通过对原料乳进行工艺处理制备出的符合要求的混合物,如上述提到的制备工艺;同时也可以是将β-酪蛋白和乳清蛋白按比例复配添加的混合物,或进一步微粒化和/或添加多糖的混合物。
32.依据上述应用,本发明提供了一种营养补充剂、肌肉合成促进剂或乳制品,产品的名称根据应用领域不同而具体确定,但作为一个共同的特征都是包含了本发明所述的乳清蛋白组合物,其他组分可以根据产品的需求添加食品上可添加的辅料和/或营养物质,营养物质包括但不限于维生素和矿物质等。
33.在本发明具体实施方式中,本发明提供了一种营养补充剂,其以营养棒状形式呈现,除了包含本发明所述乳清蛋白组合物,还添加有葡萄糖浆、甘油、麦芽糊精、椰子油和卵磷脂。
34.同时本发明还具体提供了一种乳制品,其以粉末状形式呈现,包含本发明所述乳清蛋白组合物,以及乳糖、果糖、葡萄糖、奶油、维生素、矿物质和卵磷脂。其中维生素包括但不限于维生素a、c、d、e,矿物质包括但不限于钙盐、铁盐、锌盐、镁盐,例如它们的磷酸盐或硫酸盐。
35.在对具体配方产品的消化实验中,本发明得出了不同食品配方对氨基酸释放速率有较强的影响的结果,其中粉状配方的亮氨酸消化速率慢于固体棒类配方;在同种食品配方下,添加本发明乳清蛋白组合物与市售wxr对照样品的亮氨酸释放效果接近。
36.由以上技术方案可知,本发明提供的乳清蛋白组合物主要由一种新颖的乳蛋白成分组成,其比市场上其他乳清蛋白具有较慢的消化特性。它是一种富含β-酪蛋白的可附加微粒化以及复合天然多糖的乳清蛋白浓缩物,能够起到延迟消化促进肌肉合成和提供充足营养的作用。
附图说明
37.图1所示为本发明乳清蛋白组合物的示例性制备流程图;
38.图2所示为不同温度处理条件下获得本发明乳清蛋白组合物的蛋白电泳图;
39.图3所示为富含β酪蛋白的乳清蛋白组合物与对照组经人工模拟消化液后亮氨酸
释放量曲线图;
40.图4所示为本发明乳清蛋白组合物与对照组经人工模拟消化液后亮氨酸释放量曲线图
41.图5所示为本发明乳清蛋白组合物配制成5%蛋白浓度溶液开展微粒化工艺时的粘度曲线图;
42.图6所示为未经微粒化处理的乳清蛋白组合物与对照样品经人工模拟消化液后的粘度曲线图;
43.图7所示为本发明乳清蛋白组合物与对照样品经人工模拟消化液后的粘度曲线图;
44.图8所示为本发明乳清蛋白组合物分别复合海藻酸盐和卡拉胶后经人工模拟消化液后的粘度曲线图;
45.图9所示为本发明乳清蛋白组合物复合海藻酸钾后经人工模拟消化液后的亮氨酸释放曲线图;
46.图10所示为本发明乳清蛋白组合物复合卡拉胶后经人工模拟消化液后的亮氨酸释放曲线图;
47.图11所示为不同温度处理条件下获得本发明乳清蛋白组合物经人工模拟消化液后的乳清蛋白残留量曲线图;
48.图12所示为本发明乳清蛋白组合物分别经人工胃液和肠液消化后的相对蛋白水解度柱状图;
49.图13所示为本发明乳清蛋白组合物经人工消化液消化前后的蛋白水解度柱状图;
50.图14所示为本发明乳清蛋白组合物在配方中应用后经人工模拟消化液后的亮氨酸释放量曲线图;
51.图15所示为本发明乳清蛋白组合物的非还原性(nr)和还原性(r)凝胶电泳图;
52.图16所示为不同复合多糖影响乳清蛋白在人工模拟消化液中的粘度曲线图;
53.图17所示为复合不同浓度卡拉胶影响乳清蛋白在人工模拟消化液中的粘度曲线图。
具体实施方式
54.本发明公开了一种乳清蛋白组合物及其制备方法和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述乳清蛋白组合物及其制备方法和应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的乳清蛋白组合物及其制备方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
55.本发明乳清蛋白组合物对标普通乳清蛋白浓缩物以及市售产品wxr,关键内容是三项改进或它们的任意结合,即:1)通过低温(0-10℃)膜滤工艺富集了β-酪蛋白;2)通过微粒化处理改善粒径分布、溶解性、稳定性、粘度、亮氨酸释放等特性;3)特定的多糖(κ-卡拉胶和/或海藻酸钾)不引起胶凝现象,但进一步提高其粘度和延缓亮氨酸释放。
56.在本发明中进行的对比实验中,如未特别说明,除去各组应有的区别外,其他实验
条件保持一致。
57.以下就本发明所提供的一种乳清蛋白组合物及其制备方法和应用做进一步说明。
58.实施例1:通过脱脂原料乳制备所述乳清蛋白组合物
59.1、富含β-酪蛋白的乳清蛋白原料的生产
60.牛原奶脱脂巴杀后在较低温度下,例如4℃静置处理24h,β-酪蛋白从酪蛋白胶束中释放出来富集到脱脂乳的上清中。使用50nm的陶瓷膜或聚合膜截留酪蛋白胶束,同时允许乳清蛋白和β-酪蛋白穿过进入透过液。然后使用10kda超滤来浓缩透过液并除去乳糖,剩下的上清蛋白为富含β-酪蛋白的乳清蛋白原料;示例性的流程图参见图1。
61.2、微粒化
62.将步骤1中的截留液在55℃下浓缩,直至达到5%的蛋白质浓度。通过添加1m hcl或40%naoh将浓缩物的ph调至ph7.5,并在95℃下处理5min,同时进行高速9600rpm剪切。在该步骤之后,将微粒化的蛋白体系迅速冷却至15℃。然后进一步浓缩至总固体含量为20-25%,最后进行喷雾干燥(进口温度200℃,出口温度保持在90-100℃之间)。
63.3、添加多糖
64.通过实验确定了提高上述原料在胃消化阶段粘度的最佳多糖种类和添加比例。0.3%的κ-卡拉胶在胃部具有最大的粘度,而0.3%的海藻酸盐也能增加粘度并在整个肠道的消化过程中得以保持。最终发现ph7.5下微粒化的复合了多糖的乳清蛋白展现出与乳清浓缩蛋白不同的优异缓释效果。
65.实施例2:不同温度下获得的富含β-酪蛋白的乳清蛋白原料
66.按照实施例1步骤1的方式,调整温度为10℃、4℃和2℃处理牛奶后获得富含β-酪蛋白的乳清蛋白原料。使用化学发光成像仪进行估算β-酪蛋白和乳清蛋白的比例,结果见图2;
67.由图2可以明显看出,10℃为4.6∶95.4;4℃为9.4∶91.6;2℃为16.6:83.4。因此,本发明在2-10℃低温下可以轻松达到4.5:94.5-17:83范围内的乳清蛋白组合物,同时可以预期在0-10℃可以获得4.5:94.5-20:80范围内的乳清蛋白组合物。
68.实施例3:富含β-酪蛋白乳清蛋白的体外消化
69.实验目的:研究β-酪蛋白蛋白和乳清蛋白消化前后的变化,选出亮氨酸释放速率低的蛋白原料。
70.实验方法:用相关的消化酶按照标准静态体外消化法将目标蛋白酶解,使用岛津lcms 2010ev系统检测消化后消化液中亮氨酸的含量。
71.实验分组:
72.对照组:wpc-乳清浓缩蛋白(wpc392,恒天然);wxr-wheyxr,市售商品;
73.实验组1:bcnwp6.5-膜滤生产的含β-酪蛋白调节ph6.5时的乳清样品(按实施例1步骤1方法制备);
74.实验组2:bcnwp7.5-膜滤生产的含β-酪蛋白调节ph7.5时的乳清样品(按实施例1步骤1方法制备);
75.实验组3:combcnwp7.5-β-酪蛋白和乳清蛋白wpc392混合(10:90)调节ph7.5后生产的乳清样品;
76.结果见图3,3个实验组在肠液消化阶段酶解后释放出的亮氨酸速率都比对照组样
品要低,表示其消化速率低于对照组。
77.实施例4:富含β-酪蛋白乳清蛋白的体外消化
78.实验目的:比较β-酪蛋白蛋白对微粒化与未微粒化乳清蛋白消化速率的影响。
79.实验方法:用相关的消化酶按照标准静态体外消化法将目标蛋白酶解,使用岛津lcms 2010ev系统检测消化后消化液中亮氨酸的含量。
80.实验分组:
81.对照组:wpc:乳清浓缩蛋白(wpc392,恒天然);
82.实验组1:mwp6.5:在ph6.5下微粒化的乳清浓缩蛋白;
83.实验组2:mwp7.5:在ph7.5下微粒化的乳清浓缩蛋白;
84.实验组3:mbcnwp6.5:在ph6.5时微粒化的富含β-酪蛋白的乳清原料(按实施例1步骤1-2方法制备);
85.实验组4:mbcnwp7.5:在ph7.5时微粒化的富含β-酪蛋白的乳清原料(按实施例1步骤1-2方法制备);
86.实验组5:combcnwp7.5-β-酪蛋白和乳清蛋白wpc392混合后(10:90)在ph7.5时微粒化的富含β-酪蛋白的乳清样品;
87.结果见图4,实验组1和2比对照组的亮氨酸释放速率快,说明微粒化能加速乳清蛋白的消化;实验组3和4比实验组1和2的消化速率要慢,表明β-酪蛋白能降低微粒化乳清蛋白的消化速率;实验组5与实验组3和4的氨基酸释放速率接近,表明将β-酪蛋白与乳清蛋白按实验组3和4中的比例混合后,也能达到缓慢释放亮氨酸的效果。
88.实施例5:不同酪蛋白含量的乳清蛋白样品粘度实验
89.实验目的:在胃液中“变稠”的食物往往会延迟胃排空,可能导致消化明显延迟。比较样品与对照组的粘度,从而得出延缓消化的样品种类。
90.实验方法:配制5%总蛋白含量的溶液,使用mcr301流变仪和锥板检测蛋白总浓度为5%时相同条件下180秒内的粘度,随后开展2h的模拟人工胃液消化实验。
91.实验分组:
92.对照组:wpi6.5/7.5(乳清分离蛋白,恒天然wpi895,该实验内为同种wpi):表示在ph6.5/7.5时微粒化的乳清分离蛋白。
93.实验组1:15/6.5和15/7.5表示脱脂乳在15℃保持24h后制得的样品溶液分别在ph6.5/7.5时微粒化的乳清蛋白样品,其中β-酪蛋白与乳清蛋白比例约4:96。
94.实验组2:10/6.5和10/7.5表示脱脂乳在10℃保持24h后制得的样品溶液分别在ph6.5/7.5时微粒化的乳清蛋白样品,其中β-酪蛋白与乳清蛋白比例约5:95。
95.实验组3:4/6.5和4/7.5表示脱脂乳在4℃保持24h后制得的样品溶液分别在ph6.5/7.5时微粒化的乳清蛋白样品,其中β-酪蛋白与乳清蛋白比例约10:90。
96.实验结果见图5,相对于对照样品wpi,实验组样品均具有较高的粘度。脱脂乳保存的温度越低,在配制成5%的蛋白溶液中的粘度相对越高。调节的两个ph水平下,ph7.5的蛋白溶液的粘度更高。
97.实施例6:富含β-酪蛋白的乳清蛋白样品粘度实验
98.实验目的:明确微粒化对粘度的影响。
99.实验方法:使用mcr301流变仪和锥板检测在人工模拟胃液和肠液的粘度。
100.实验分组:
101.对照组1:wpc(乳清浓缩蛋白,恒天然wpc392);wxr,wheyrx,一种竞品;
102.对照组2:mw,胶束乳清;
103.对照组3:mwp6.5、mwp7.5分别在ph6.5或7.5下微粒化的乳清蛋白wpc392;
104.实验组1:bcnwp6.5和bcnwp7.5分别表示膜滤生产的含β-酪蛋白调节ph6.5和ph7.5时的乳清样品(按实施例1步骤1方法);
105.实验组2:mbcnwp6.5、mbcnwp7.5表示分别在ph6.5或7.5下微粒化的富含β-酪蛋白的乳清蛋白(按实施例1步骤1-2方法制备);
106.实验结果见图6和图7,微粒化的实验组2在胃液中的粘度显著高于未微粒化的实验组1的粘度。实验组2中ph7.5的微粒化原料在胃液中的粘度明显高于ph6.5的微粒化原料。
107.实施例7:添加多糖原料体外消化实验
--
粘度测试
108.实验目的:明确多糖对粘度提升的作用。
109.实验方法:按0.3%w/w的比例添加多糖混合均匀后,使用mcr301流变仪和锥板检测在人工模拟胃液和肠液的粘度。
110.实验分组:
111.对照组1:wxr alg:商品wxr 海藻酸钾;
112.对照组2:wxr kcg:商品wxr κ-卡拉胶;
113.实验组1:mbcnwp6.5 alg:ph6.5微粒化富含β-酪蛋白的乳清 海藻酸钾(按实施例1步骤1-3方法制备);
114.实验组2:mbcnwp7.5 alg:ph7.5微粒化富含β-酪蛋白的乳清 海藻酸钾(按实施例1步骤1-3方法制备);
115.实验组3:mbcnwp6.5 kcg:ph6.5微粒化富含β-酪蛋白的乳清 κ-卡拉胶(按实施例1步骤1-3方法制备);
116.实验组4:mbcnwp7.5 kcg:ph7.5微粒化富含β-酪蛋白的乳清 κ-卡拉胶(按实施例1步骤1-3方法制备);
117.实验结果将图8,实验组2和实验组4ph7.5时与多糖形成复合物,比ph6.5复合多糖已经对照组的粘度高。
118.实施例8:添加多糖原料体外消化实验
--
氨基酸释放
119.实验目的:明确筛选出的两种对亮氨酸释放速率的作用。
120.实验方法:按0.3%w/w的比例添加多糖混合均匀后,用相关的消化酶按照标准静态体外消化法将目标蛋白酶解,使用岛津lcms 2010ev系统检测消化后消化液中亮氨酸的含量。
121.实验分组:
122.对照组1:wpc(乳清浓缩蛋白,恒天然wpc392);
123.实验组1:mbcnwp6.5:ph6.5微粒化富含β-酪蛋白的乳清(按实施例1步骤1-2方法制备);
124.实验组2:mbcnwp7.5:ph7.5微粒化富含β-酪蛋白的乳清(按实施例1步骤1-2方法制备);
125.实验组3:mbcnwp6.5 alg:ph6.5微粒化富含β-酪蛋白的乳清 海藻酸钾(按实施例1步骤1-3方法制备);
126.实验组4:mbcnwp7.5 alg:ph7.5微粒化富含β-酪蛋白的乳清 海藻酸钾(按实施例1步骤1-3方法制备);
127.实验组5:mbcnwp6.5 kcg:ph6.5微粒化富含β-酪蛋白的乳清 κ-卡拉胶(按实施例1步骤1-3方法制备);
128.实验组6:mbcnwp7.5 kcg:ph7.5微粒化富含β-酪蛋白的乳清 κ-卡拉胶(按实施例1步骤1-3方法制备);
129.实验结果显示,海藻酸钾能降低微粒化富含β-酪蛋白的乳清蛋白在体外消化过程中氨基酸的释放速率(图9)。
130.虽然添加κ-卡拉胶不能显著降低富含β-酪蛋白的微粒乳清蛋白在肠道阶段亮氨酸释放速率(图10),但考虑到κ-卡拉胶会引起胃液粘度的强烈增加,因此可以预见补充κ-卡拉胶后,乳清蛋白进入肠道的速度会更慢,将有助于延迟在体内小肠中释放出游离亮氨酸。
131.实施例9:消化实验
--
乳清蛋白中β-乳球蛋白残余量分析
132.实验目的:比较消化程度,鉴别缓慢消化的快慢能力。
133.实验方法:配制10%总蛋白含量的溶液,然后进行体外消化。使用体积排阻(sce-hplc)和反相高效液相色谱法(rp-hplc)测定消化前、胃液消化后和肠液消化后的β-乳球蛋白残留量。
134.实验分组:
135.对照组:wpi6.5/7.5(乳清分离蛋白,恒天然wpi895,该试验内为同种wpi):表示在ph6.5/7.5时微粒化的乳清分离蛋白。
136.实验组1:15/6.5和15/7.5表示脱脂乳在15℃保持至少10h后制得的样品溶液分别在ph6.5/7.5时微粒化的乳清蛋白样品,其中β-酪蛋白与乳清蛋白比例约4:96(按实施例1步骤1-2方法制备,温度、低温处理时间和ph参数对应改变)。
137.实验组2:10/6.5和10/7.5表示脱脂乳在10℃保持至少10h后制得的样品溶液分别在ph6.5/7.5时微粒化的乳清蛋白样品,其中β-酪蛋白与乳清蛋白比例约5:95(按实施例1步骤1-2方法制备,温度、低温处理时间和ph参数对应改变)。
138.实验组3:4/6.5和4/7.5表示脱脂乳在4℃保持至少10h后制得的样品溶液分别在ph6.5/7.5时微粒化的乳清蛋白样品,其中β-酪蛋白与乳清蛋白比例约10:90(按实施例1步骤1-2方法制备,温度、低温处理时间和ph参数对应改变)。
139.实验结果见图11,随着温度的降低,β-酪蛋白:乳清蛋白的比例变高,经体外消化后乳清蛋白中未消化的β-乳球蛋白的比例逐渐升高。这说明较高的β-酪蛋白比例的实验组可比与标准乳清蛋白对照组表现出更慢的消化速度。
140.比照标准乳清蛋白对照组(wpi/6.5和wpi/7.5)中的剩余量,β-酪蛋白与乳清蛋白比例约5:95(严格来说为4.6:95.4)的乳清蛋白组合物或β-酪蛋白吧比例更高的组合物会在消化终点比对照组剩余较多的β-乳球蛋白,因此在本发明乳清蛋白组合物中β-酪蛋白与乳清蛋白的质量比不低于4.6:95.4的情况下,可以表现出更慢的消化速度。
141.实施例10:消化实验
--
水解度分析1
142.实验目的:比较水解度,鉴别缓慢消化的快慢能力。
143.实验方法:对分别用胃液和肠液消化后的蛋白按照j.adler-nissen(1979)方法进行水解度检测。
144.实验分组:
145.对照组1:wxr alg-g/i:商业wxr 0.3%海藻酸钾分别经人工模拟胃液/肠液消化。
146.对照组2:wxr kcg-g/i:商业wxr 0.3%κ-卡拉胶分别经人工模拟胃液/肠液消化。
147.实验组1:mbcnwp6.5 alg-g/i:ph6.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%海藻酸钾(按实施例1步骤1-3方法制备),经人工模拟胃液和肠液消化。
148.实验组2:mbcnwp7.5 alg-g/i:ph7.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%海藻酸钾(按实施例1步骤1-3方法制备),经人工模拟胃液和肠液消化。
149.实验组3:mbcnwp6.5 kcg-g/i:ph6.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%κ-卡拉胶(按实施例1步骤1-3方法制备),经人工模拟胃液和肠液消化。
150.实验组4:mbcnwp7.5 kcg-g/i:ph7.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%κ-卡拉胶(按实施例1步骤1-3方法制备),经人工模拟胃液和肠液消化。
151.实验结果见图12,实验组1、2、3、4样品的水解度显著低于对照组,表明实验组1、2、3、4的缓释效果更好;实验组1、2、3、4中ph7.5时微粒化的样品的水解度低于ph6.5时的水解度,表明ph7.5微粒化样品缓释效果更好。
[0152][0153]
实施例11:消化实验
--
水解度分析2
[0154]
实验目的:比较水解度,鉴别缓慢消化的快慢能力。
[0155]
实验方法:对依次经胃液和肠液消化后的蛋白按照j.adler-nissen(1979)介绍的三硝基苯磺酸(tnbs)方法进行水解度检测。
[0156]
实验分组:
[0157]
对照组1:wpc(乳清浓缩蛋白,恒天然wpc392);
[0158]
对照组2:wxr(wheyrx,一种竞品);
[0159]
实验组1:mbcnwp6.5 alg:ph6.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%海藻酸钾(按实施例1步骤1-3方法制备),经人工模拟消化液消化。
[0160]
实验组2:mbcnwp7.5 alg:ph7.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%海藻酸钾(按实施例1步骤1-3方法制备),经人工模拟消化液消化。
[0161]
实验组3:mbcnwp6.5 kcg:ph6.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%κ-卡拉胶(按实施例1步骤1-3方法制备),经人工模拟消化液消化。
[0162]
实验组4:mbcnwp7.5 kcg:ph7.5时微粒化富含β-酪蛋白的乳清蛋白添加0.3%κ-卡拉胶(按实施例1步骤1-3方法制备),经人工模拟消化液消化。
[0163]
实验结果见图13,实验组1、2、3、4样品的水解度显著低于对照组,表明实验组1、2、3、4的缓释效果更好;实验组1、2、3、4中ph7.5时微粒化的样品的水解度低于ph6.5时的水解度,表明ph7.5微粒化样品缓释效果更好。
[0164]
实施例12:样品添加到配方后的消化实验
--
氨基酸释放
[0165]
实验目的:明确不同配方形式对消化速率的影响。
[0166]
实验方法:按如下表1配方配制出终产品,用相关的消化酶按照标准静态体外消化
法将目标蛋白酶解,使用岛津lcms 2010ev系统检测消化后消化液中亮氨酸的含量。
[0167]
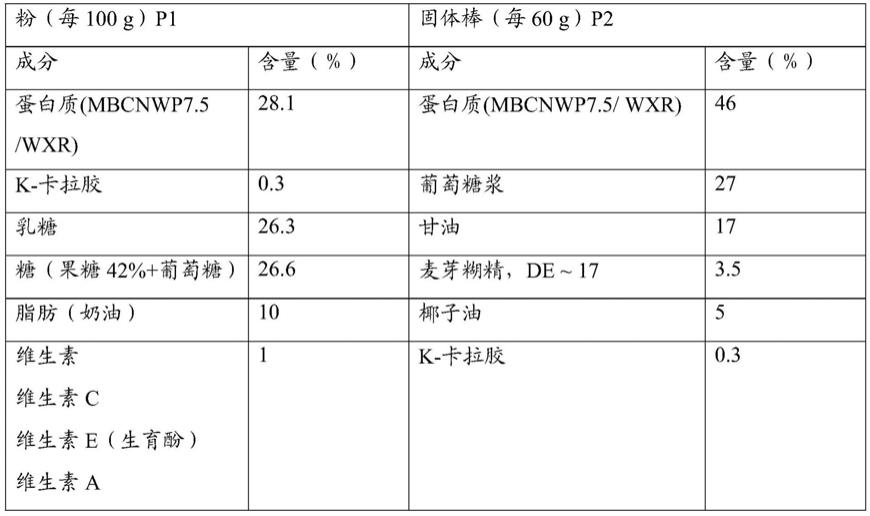
表1
[0168][0169][0170]
实验分组:
[0171]
对照组1:p1 wxr:粉状配方p1添加商品wxr缓慢释放乳清原料;
[0172]
对照组2:p2 wxr:固体棒类配方p2添加商品wxr缓慢释放乳清原料;
[0173]
实验组1:p1 mbcnwp7.5:粉状配方p1添加ph7.5微粒化富含β-酪蛋白乳清原料添加0.3%κ-卡拉胶(按实施例1步骤1-3方法制备);
[0174]
实验组2:p2 mbcnwp7.5:固体棒类配方 ph7.5微粒化富含β-酪蛋白乳清原料添加0.3%κ-卡拉胶(按实施例1步骤1-3方法制备)。
[0175]
实验结果见图14,不同食品配方对氨基酸释放速率有较强的影响,粉状配方的消化速率慢于固体棒类配方;同种食品配方下,添加本发明乳清蛋白组合物与wxr对照样品的亮氨酸释放效果接近。
[0176]
实施例13:不同蛋白样品的非还原(nr)和还原(r)sds-page凝胶电泳实验
[0177]
实验分组:
[0178]
1、牛奶;
[0179]
2、由1组牛奶分离的乳清蛋白;
[0180]
3、由2组乳清蛋白制备的富含β-酪蛋白的乳清蛋白(超滤/渗滤后截留液,总固形物浓度为0.2%);
[0181]
4、ph6.5微粒化乳清蛋白(同2组乳清蛋白);
[0182]
5、ph7.5微粒化乳清蛋白(同2组乳清蛋白);
[0183]
6、ph6.5微粒化富含β-酪蛋白的乳清蛋白(同3组乳清蛋白,总固形物浓度为10%);
[0184]
7、ph7.5微粒化富含β-酪蛋白乳清蛋白(同3组乳清蛋白,浓度为10%总固形物);
[0185]
8、ph6.5微粒化富含β-酪蛋白乳清蛋白(同6组,粉末);
[0186]
9、ph7.5微粒化富含β-酪蛋白乳清蛋白(同7组,粉末)。
[0187]
结果见图15,非还原性(nr)凝胶电泳仅显示没有与其他蛋白聚集的蛋白,而还原性(r)凝胶电泳由于蛋白间聚合反应被破坏了从而其条带能够显示所有蛋白。泳道4、6、8是在ph6.5时微粒化的,在非还原性凝胶中底部条带(代表α-乳白蛋白)几乎与未微粒化的对照样品的泳道3相同。而底部起第二个条带(代表β-乳球蛋白)几乎消失,表明β-乳球蛋白在微粒化处理后几乎完全聚集。
[0188]
泳道5、7、9是在ph7.5时微粒化的(底部条带变得模糊不清,第二条带的程度相比泳道4、6、8的稍强,表明更多α-乳白蛋白、更少β-乳球蛋白被聚集。因此该图能观察使用两种ph进行乳清蛋白微粒化的不同机制。
[0189]
实施例14:乳清蛋白添加不同多糖后在人工模拟消化液中的粘度试验
[0190]
在人工胃液(无酶)中,检测蛋白浓度为8%并添加0.2%或0.3%重量百分比选定多糖的wpc392(wp)蛋白溶液的粘度。其中,alg-海藻酸钾;cmc-羧甲基纤维素;tgh-黄蓍胶;xth-黄原胶,temp-温度,gj-人工胃液,结果见图16。
[0191]
同时,在人工胃液(无酶)中,检测蛋白浓度为8%并添加0.1-0.3%重量百分比卡拉胶的wpc392蛋白溶液的粘度,pure表示0.1%重量百分比的卡拉胶,结果见17。
[0192]
综合图16和图17可以明显看出,κ-卡拉胶在体外消化模型胃液中的粘度明显高于其他测试的多糖,大约是其他多糖的30-50倍。而海藻酸钾在体外消化模型胃液中的粘度也明显高于其他测试的多糖。
[0193]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。