1.本发明属于生物检测技术领域,特别是涉及一种基于数字微流控的集成化外泌体来源核酸提取系统及方法。
背景技术:
2.传统的外泌体分离富集技术包括超高速离心、超滤、尺寸排阻色谱(sec)、高分子聚合物共沉淀、免疫等几类方法,其中,基于超高速离心的外泌体分离手段是目前领域内公认的金标准。然而,传统分离方法需要集中较大量的样本,耗时较长,或需要大型设备,因此并不能较好地适应微量处理与快速检测的需求。在此背景下,基于微流控手段的外泌体分离富集得到了广泛的关注,相关方法被广泛研究,其中包括基于传统注射泵驱动的免疫、微过滤柱、磁珠、声表面波等方法,此类方法往往需要多路泵同时或交替注入样本或反应液,某些情况下还需要同时调控芯片上的微阀以及流道之外的物理场,在一定程度上限制了系统的可操作性。然而,数字微流控平台藉由其高度灵活与自动的特点,可以在一定程度上克服上述传统微流控领域中的共性问题,从而称为微量外泌体样本快速预处理的高效平台。
3.目前的数字微流控技术主要由介电润湿(ewod)技术实现,其基本原理是液滴在强电场作用下,其在固体表面的接触角会发生降低,因此当疏水表面的局部加高电压时,液滴在表面张力作用下倾向于向高电压位置移动,由此实现对液滴的驱动与控制。目前基于介电润湿的数字微流控技术已有较成熟的技术积累,可以利用标准的微机电系统(mems)工艺制备大规模的数字微流控芯片,且相关应用研究也已经覆盖生物、化学领域研究,包括片上免疫组织化学、多聚酶链式反应(pcr)、单细胞培养与分离、焦磷酸测序,以及多种片上样本纯化与制备过程。然而,目前关于数字微流控技术在外泌体样本制备与预处理方面的研究仍鲜有报道。
技术实现要素:
4.鉴于以上所述现有技术的缺点,本发明的目的在于提供基于数字微流控的集成化外泌体来源核酸提取系统及方法,将外泌体样本中的外泌体富集、核酸释放过程集成于数字微流控芯片上,使处理后的样本可直接用于后续核酸扩增与检测,实现了外泌体来源核酸样本的预处理集成化与自动化。
5.为实现上述目的及其他相关目的,本发明提供一种基于数字微流控的集成化外泌体来源核酸提取系统,所述核酸提取系统包括:
6.微流控芯片,所述微流控芯片包括间隔设置的上极板和下极板,所述上极板开设有进样口,所述上极板与下极板的两侧分别设置有间隔板,并与所述间隔板之间形成内部反应腔,外泌体样本自所述进样口加入所述内部反应腔中进行核酸提取;
7.磁铁控制单元,所述磁铁控制单元设置于所述微流控芯片的上方,所述磁铁控制单元包括电磁铁和夹持于所述电磁铁顶端的永磁铁,所述电磁铁在垂直于所述微流控芯片的方向上推动与收缩,带动所述永磁铁靠近或远离所述微流控芯片;
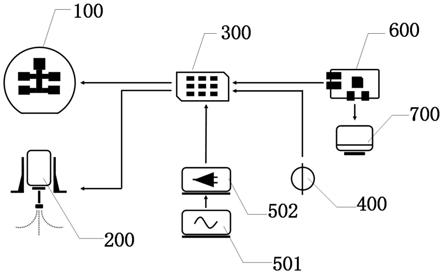
8.驱动电源,所述驱动电源包括芯片驱动电源、磁铁驱动电源和开关电路,所述开关电路的电压输入端分别与所述芯片驱动电源、所述磁铁驱动电源连接,所述开关电路的电压输出端分别与所述微流控芯片、所述磁铁控制单元连接,所述芯片驱动电源通过所述开关电路为所述微流控芯片提供驱动电压,所述磁铁驱动电源通过所述开关电路控制所述电磁铁的推动与收缩;
9.控制单元,所述控制单元包括控制界面和mcu,所述控制界面与所述mcu连接,所述mcu与所述开关电路的信号输入端连接,所述控制界面通过所述mcu实现对所述开关电路的控制。
10.优选地,所述内部反应腔包括通过各通道依次连通的样本腔、孵育腔、释放剂腔、废液腔和备用腔;所述废液腔的输入端连接有第一通道,所述样本腔通过第二通道与所述第一管道连通,所述孵育腔通过第三通道与所述第一通道连通,所述释放剂腔通过第四通道与所述第一通道连通,所述备用腔通过备用通道与所述第一通道连通。
11.优选地,所述上极板的下方设置有导电镀层,所述导电镀层的下方和所述进样口的两侧均涂覆有上部疏水层,所述下极板的上方设置有介电层,所述介电层的上方涂覆有下部疏水层,且所述介电层内部嵌设有多个驱动电极,多个所述驱动电极分别对应设置于所述内部反应腔的下方,用于驱动液滴的移动。
12.优选地,所述微流控芯片设置于所述夹具探针台上,所述夹具探针台上设置有多路探针,多路探针分别与多个所述驱动电极相应连接。
13.优选地,所述开关电路包括继电器阵列,所述继电器阵列包括多个继电器,每个所述继电器连接一路所述探针,所述继电器通过所述探针相应的控制所述驱动电极的通断。
14.优选地,所述导电镀层为氧化铟锡导电镀层;
15.所述下极板为图形化电极,所述图像化电极采用标准mems工艺制造而成;
16.所述间隔板的厚度为80~120μm。
17.优选地,所述芯片驱动电源包括信号发生器和电压放大器,所述信号发生器产生的信号经所述电压放大器放大后接入开关电路。
18.优选地,所述控制界面包括控制程序和图形界面,所述控制程序通过所述mcu实现对所述开关电路的控制,所述图形界面包括手动模式和自动模式,所述手动模式用于用户手动控制所述驱动电极,所述自动模式用于编辑所需执行的动作流程进而自动执行。
19.一种基于数字微流控的集成化外泌体来源核酸提取方法,所述核酸提取方法包括以下步骤:
20.s1、提供如权利要求1~8中任一所述的基于数字微流控的集成化外泌体来源核酸提取系统;
21.s2、配制外泌体样本溶液、磁珠悬浮液和释放剂溶液;
22.s3、开启mcu、芯片驱动电源和磁铁驱动电源,并打开控制界面;
23.s4、在控制界面选择手动模式,开启内部反应腔的驱动电极,将步骤s2中配制的所述外泌体样本溶液、磁珠悬浮液和释放剂溶液分别从进样口注入内部反应腔;
24.s5、控制界面调为自动模式,在自动模式下设置执行流程,自动完成外泌体样本的预处理和核酸提取,得到核酸释放液;
25.s6、断开开关电路,并取下微流控芯片,收集得到的核酸释放液。
26.优选地,步骤s5中自动完成外泌体样本的预处理和核酸提取,具体包括以下步骤:
27.s51、推动电磁铁使永磁体靠近孵育腔,将磁珠与液体分离,磁珠聚集在电磁铁周围并滞留于孵育腔内部,同时操控驱动电极将孵育腔中的液体转移至废液腔中;
28.s52、收缩电磁铁使永磁铁远离孵育腔,将样本腔中的外泌体样本溶液转移至孵育腔中,外泌体样本溶液与磁珠均匀混合,孵育30~60min,得到磁珠-外泌体混合液;
29.s53、再次推动电磁铁使永磁体靠近孵育腔,将孵育腔中的磁珠-外泌体混合产物与剩余的样本溶液分离,磁珠-外泌体混合产物聚集在电磁铁周围并滞留于孵育腔内部,同时操控驱动电极将剩余的样本溶液转移至废液腔中;
30.s54、再次收缩电磁铁使永磁体远离孵育腔,将释放剂溶液转移至步骤s53的孵育腔中,释放剂溶液与孵育腔中的磁珠-外泌体混合产物均匀混合,孵育10min,得到核酸释放液。
31.如上所述,本发明的基于数字微流控的集成化外泌体来源核酸提取系统及其方法,具有以下有益效果:
32.本发明中将外泌体样本中的外泌体富集与核酸释放过程集成与微流控芯片上,实现了高效一体化外泌体富集以及核酸释放,实现了外泌体来源核酸样本预处理集成化与自动化,为后续的核酸扩增、检测与分析提供快速预处理手段。
33.本发明相比于传统的外泌体富集与处理方式,本发明中的微流控芯片用于外泌体样本预处理具有高自动化程度、反应充分的优势,利用该提取系统可以在90分钟内自动完成微量外泌体样本的预处理,并使外泌体富集的效率显著高于管内手动操作的富集效率,同时该核酸提取系统具有高灵活性,不仅可以用于外泌体来源的核酸提取,还可以用于其他的用途。
附图说明
34.图1显示为本发明具体实施例中核酸提取系统的结构示意图。
35.图2显示为本发明具体实施例中控制程序模块图。
36.图3显示为本发明具体实施例中图形界面模块图。
37.图4显示为本发明具体实施例中微流控芯片的结构示意图。
38.图5显示为本发明具体实施例中微流控芯片的内部反应腔的结构布局示意图。
39.图6显示为本发明实施例2中采用粒径追踪分析法分别对实施例2中孵育后剩余样本溶液a、外泌体样本溶液b、管内剩余样本溶液c的表征图。
40.图7显示为本发明实施例2中采用粒径追踪分析法测得的实施例2中孵育后剩余样本溶液a、外泌体样本溶液b、管内剩余样本溶液c的浓度结果图。
41.图8显示为本发明实施例3中采用荧光定量pcr(qpcr)分析分别对管内混合孵育组收集的管内释放液d、实施例3中收集的片上释放液e和空白样f的测试结果。
42.图9显示为本发明实施例3中采用数字pcr分析对管内混合孵育组收集的管内释放液d的测试结果。
43.图10显示为本发明实施例3中采用数字pcr分析对本实施例3中收集的片上释放液e的测试结果。
44.元件标号说明
45.100
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微流控芯片
46.101
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
上极板
47.102
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
进样口
48.103
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
导电镀层
49.104
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
上部疏水层
50.105
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
间隔板
51.106
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
内部反应腔
52.1061
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
样本腔
53.1062
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
孵育腔
54.1063
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
释放剂腔
55.1064
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
废液腔
56.1065
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
备用腔
57.107
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
下极板
58.108
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
下部疏水层
59.109
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
介电层
60.1091
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
驱动电极
61.200
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
磁铁控制单元
62.300
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
开关电路
63.400
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
磁铁驱动电源
64.501
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
信号发生器
65.502
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
电压放大器
66.600
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
mcu
67.700
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
控制界面
68.701
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
控制程序
69.702
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
图形界面
具体实施方式
70.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
71.请参阅图10。需要说明的是,本实施例中所提供的图示仅以示意方式说明本发明的基本构想,遂图式中仅显示与本发明中有关的组件而非按照实际实施时的组件数目、形状及尺寸绘制,其实际实施时各组件的型态、数量及比例可为一种随意的改变,且其组件布局型态也可能更为复杂。
72.本发明中将外泌体样本中的外泌体富集与核酸释放过程集成与微流控芯片上,实现了高效一体化外泌体富集以及核酸释放,实现了外泌体来源核酸样本预处理集成化与自动化,为后续的核酸扩增、检测与分析提供快速预处理手段;本发明相比于传统的外泌体富集与处理方式,本发明中的微流控芯片用于外泌体样本预处理具有高自动化程度、反应充
分的优势,利用该提取系统可以在90分钟内自动完成微量外泌体样本的预处理,并使外泌体富集的效率显著高于管内手动操作的富集效率,同时该核酸提取系统具有高灵活性,不仅可以用于外泌体来源的核酸提取,还可以用于其他的用途。
73.实施例1
74.本发明具体实施例提供一种基于数字微流控的集成化外泌体来源核酸提取系统,该提取系统包括:微流控芯片100、磁铁控制单元200、驱动电源和控制单元;其中,微流控芯片100包括间隔设置的上极板101和下极板107,上极板101开设有进样口102,上极板101与下极板107的两侧分别设置有间隔板105,并与间隔板105之间形成内部反应腔106,外泌体样本自进样口102加入内部反应腔106中进行核酸提取;磁铁控制单元200设置于微流控芯片100的上方,磁铁控制单元200包括电磁铁和夹持于电磁铁顶端的永磁铁,电磁铁在垂直于微流控芯片100的方向上推动与收缩,带动永磁铁靠近或远离微流控芯片100;驱动电源包括芯片驱动电源、磁铁驱动电源400和开关电路300,开关电路300的电压输入端分别与芯片驱动电源、磁铁驱动电源400连接,开关电路300的电压输出端分别与微流控芯片100、磁铁控制单元200连接,芯片驱动电源通过开关电路300为微流控芯片100提供驱动电压,磁铁驱动电源400通过开关电路300控制电磁铁的推动与收缩;控制单元包括控制界面700和mcu600,控制界面700与所述mcu600连接,mcu600与开关电路300的信号输入端连接,控制界面700通过mcu600实现对开关电路300的控制。
75.具体的,磁铁控制单元200中的电磁铁为双向锁定的推拉式电磁铁,由开关电路300的继电器控制电磁铁在z轴(垂直于微流控芯片100)方向上的推动与收缩,从而使其顶端的永磁铁靠近或远离微流控芯片100,实现对微流控芯片100中磁珠的集中与释放。其中,单向锁定电磁铁,其原理在普通推拉电磁铁的产品一端增加一个永磁块设计,其工作原理是通电推出(或拉住)马上就可以断电,它还是会保持在终端,就像普通推拉式电磁铁长时间通电一样,保持通电实现推住状态,只是单向锁定电磁铁通电后马上就能断电,主要是靠内部永磁块产生的保持力保持在终端,这时行程和力量都能保持,复位需反向通电;双向锁定电磁铁,和单向锁定电磁铁原理相同,只是在于内部是双线圈设计,使其在两端够能够产生保持力,并且两端行程以及保持力量是相同的。
76.具体的,mcu600(微型计算机)为采用raspberrypi 4b,其相应的控制程序701及其图形界面702基于qt 5.12开发,并在基于linux的raspberry pi os系统下运行,参阅图2、图3所示。作为示例,内部反应腔106包括通过各通道依次连通的样本腔1061、孵育腔1062、释放剂腔1063、废液腔1064和备用腔1065;废液腔1064的输入端连接有第一通道,样本腔1061通过第二通道与第一管道连通,孵育腔1062通过第三通道与第一通道连通,释放剂腔1063通过第四通道与第一通道连通,备用腔1065通过备用通道与第一通道连通。
77.作为示例,上极板101的下方设置有导电镀层103,导电镀层103的下方和进样口102的两侧均涂覆有上部疏水层104,下极板107的上方设置有介电层109,介电层109的上方涂覆有下部疏水层108,且介电层109内部嵌设有多个驱动电极1091,多个驱动电极1091分别对应设置于内部反应腔106的下方,用于驱动液滴的移动。
78.具体的,上部疏水层104和下部疏水层108均采用teflonaf 2400材料制作,当然,在其他实施例中也可以采用其他材质,在此不做过分限制。参阅图5所示,多个驱动电机均嵌设于介电层109,其中三个驱动电极1091相对应设置于孵育腔1062的下方,三个驱动电极
1091轮流加压可以使孵育腔1062中的磁珠与转移进入孵育腔1062中的溶液混合均匀并较好的孵育;另外,在第一通道、第二通道、第三通道、第四通道与备用通道对应的下方依次排布有多个驱动电极1091,在驱动电极1091的驱动下可以实现内部反应腔106中不同腔室之间液滴的转移。具体关于驱动电极1091的数量,在此不做过分限制。
79.作为示例,微流控芯片100设置于夹具探针台上,夹具探针台上设置有多路探针,多路探针分别与多个驱动电极1091相应连接。
80.具体的,多个驱动电极1091分别引出有电极引脚,电极引脚与探针接触,即探针通过电极引脚来控制驱动电极1091的通断,通过接通不同的驱动电极1091实现对内部反应腔106中液滴的移动。
81.作为示例,开关电路300包括继电器阵列,继电器阵列包括多个继电器,每个继电器连接一路探针,继电器通过探针相应的控制驱动电极1091的通断。
82.具体的,开关电路300中的各个继电器分别对应连接一路探针,一路探针通过电极引脚连接一个驱动电极1091,相应的控制微流控芯片100上驱动电极1091的通断,从而控制微流控芯片100中液滴的移动;但具体关于继电器的数量以及探针的具体数量,在此不做过分限制,满足两者一一对应关系即可。
83.作为示例,导电镀层103为氧化铟锡(ito)导电镀层103;下极板107为图形化电极,图像化电极采用标准mems工艺制造而成;间隔板105的厚度为80~120μm。
84.具体的,间隔板105的厚度可以为80μm、90μm、100μm、110μm、120μm等。
85.作为示例,芯片驱动电源包括信号发生器501和电压放大器502,信号发生器501产生的信号经电压放大器502放大后接入开关电路300。
86.具体的,信号发生器501是一种能提供各种频率、波形和输出电平电信号的设备,本实施例中,优选地,信号发生器501产生频率为1khz正弦波,产生的信号经电压放大器502放大至200~250vrms,放大后的电压作为微流控芯片100的驱动电压。
87.作为示例,控制界面700包括控制程序701和图形界面702,控制程序701通过mcu600实现对开关电路300的控制,图形界面702包括手动模式和自动模式,手动模式用于用户手动控制驱动电极1091,自动模式用于编辑所需执行的动作流程进而自动执行。
88.具体的,控制程序701通过直接调用mcu600的通用输入输出接口(gpio)实现对继电器的控制,并允许用户通过图形界面702对单个电极进行手动控制,或现场编辑所需要执行的动作流程从而进行自动执行;在自动执行模式下,程序允许用户保存或读取动作流程,并且通过多线程实时显示当前各驱动电极1091的状况以及流程的执行进度;另外,在控制程序701中,用户可以自由选用并定义raspberrypi硬件上即将在实验中使用的gpio引脚,使流程设计更具有灵活性。
89.为了更好的理解本发明具体实施例中的基于数字微流控的集成化外泌体来源核酸提取系统,本发明具体实施例中还提供一种基于数字微流控的集成化外泌体来源核酸提取方法,该提取方法包括以下步骤:
90.s1、提供如权利要求1~8中任一所述的基于数字微流控的集成化外泌体来源核酸提取系统;
91.s2、配制外泌体样本溶液、磁珠悬浮液和释放剂溶液;
92.具体的,将外泌体样本溶液、磁珠悬浮液和释放剂溶液均稀释处理,然后分别加入
0.01%的吐温-20;
93.s3、开启mcu600、芯片驱动电源和磁铁驱动电源400,并打开控制界面700;
94.s4、在控制界面700选择手动模式,开启内部反应腔106的驱动电极1091,将步骤s2中配制的外泌体样本溶液、磁珠悬浮液和释放剂溶液分别从进样口102注入内部反应腔106;
95.具体的,为了适应标准的25μl荧光定量pcr反应体系,系统单次处理的样本总量为10μl,在本实施例中,磁珠悬浮液、核酸释放剂的加入量均为10~20μl;磁珠悬浮液中的磁珠为微米级磁珠,磁珠为基于免疫法捕获的磁珠、静电力吸附法捕获的磁珠、脂质分子亲和法捕获的磁珠中的一种或组合。
96.s5、控制界面700调为自动模式,在自动模式下设置执行流程,自动完成外泌体样本的预处理和核酸提取,得到核酸释放液;
97.s6、断开开关电路300,并取下微流控芯片100,收集得到的核酸释放液。
98.其中,步骤s5中自动完成外泌体样本的预处理和核酸提取,具体包括以下步骤:
99.s51、推动电磁铁使永磁体靠近孵育腔1062,将磁珠与液体分离,磁珠聚集在电磁铁周围并滞留于孵育腔1062内部,同时操控驱动电极1091将孵育腔1062中的液体转移至废液腔1064中;
100.s52、收缩电磁铁使永磁铁远离孵育腔1062,将样本腔1061中的外泌体样本溶液转移至孵育腔1062中,外泌体样本溶液与磁珠均匀混合,孵育30~60min,得到磁珠-外泌体混合液;具体的,孵育腔1062的下方对应设置有三个驱动电极1091,三个驱动电极1091轮流加电压,使外泌体样本溶液在保持运动的过程中与磁珠进行孵育;
101.s53、再次推动电磁铁使永磁体靠近孵育腔1062,将孵育腔1062中的磁珠-外泌体混合产物与剩余的样本溶液分离,磁珠-外泌体混合产物聚集在电磁铁周围并滞留于孵育腔1062内部,同时操控驱动电极1091将剩余的样本溶液转移至废液腔1064中;
102.s54、再次收缩电磁铁使永磁体远离孵育腔1062,将释放剂溶液转移至步骤s53的孵育腔1062中,释放剂溶液与孵育腔1062中的磁珠-外泌体混合产物均匀混合,孵育10min,得到核酸释放液。
103.实施例2
104.本实施例提供一种基于数字微流控的集成化外泌体的富集,其富集方法包括以下步骤:
105.s1、提供实施例1中的基于数字微流控的集成化外泌体来源核酸提取系统;
106.s2、配制外泌体样本溶液和磁珠悬浮液;其中,本实施例中所采用的外泌体样本为经过无血清培养的h1975细胞系上清液经过梯度离心、过滤、超高速离心后,其中的外泌体被分离并浓缩形成;经过粒径追踪分析(nta)测试浓度后,外泌体样本的浓度为1.5
×
108/ml(每毫升的颗粒数为1.5
×
108个),加入吐温-20将其配制为浓度为0.01%(v/v)的外泌体样本溶液(即,将外泌体样本加入吐温-20中,吐温-20的体积占总体积的比例为0.01%);磁珠悬浮液采用商用化人cd9抗体修饰的磁珠(life technologies corporation生产),将其浓度稀释一倍后,然后加入吐温-20,得到浓度为0.01%(v/v)的磁珠悬浮液(稀释一倍后的人cd9抗体修饰的磁珠加入吐温-20后,吐温-20的体积占总体积的比例为0.01%);
107.s3、开启mcu600、芯片驱动电源和磁铁驱动电源400,并打开控制界面700;
108.s4、在控制界面700选择手动模式,开启内部反应腔106的驱动电极1091,将步骤s2中配制的外泌体样本溶液10μl和磁珠悬浮液20μl分别从进样口102注入样本腔1061和孵育腔1062中;
109.s5、控制界面700调为自动模式,在自动模式下设置执行流程,自动完成外泌体样本的预处理;
110.其中,步骤s5中自动完成外泌体样本的预处理具体包括以下步骤:
111.s51、推动电磁铁使永磁体靠近孵育腔1062,将磁珠与液体分离,磁珠聚集在电磁铁周围并滞留于孵育腔1062内部,同时操控驱动电极1091将孵育腔1062中的液体转移至废液腔1064中;
112.s52、收缩电磁铁使永磁铁远离孵育腔1062,将样本腔1061中的外泌体样本溶液转移至孵育腔1062中,外泌体样本溶液与磁珠均匀混合,孵育30min,得到磁珠-外泌体混合液;
113.s53、再次推动电磁铁使永磁体靠近孵育腔1062,将孵育腔1062中的磁珠-外泌体混合产物与剩余的样本溶液分离,磁珠-外泌体混合产物聚集在电磁铁周围并滞留于孵育腔1062内部,同时操控驱动电极1091将剩余的样本溶液转移至备用腔1065中;
114.s6、断开开关电路300,并取下微流控芯片100,并用移液器收集孵育后剩余的样本溶液。
115.性能测试
116.采用nta分别对本实施例中所收集的孵育后剩余样本溶液a、步骤s2中所配制的外泌体样本溶液b以及管内混合孵育组得到的管内剩余样本溶液c进行测试。
117.其中,管内混合孵育组具体为,按照磁珠试剂盒将样本溶液与磁珠一同放在离心管中,在常温下静置或保持摇晃,最后收集剩余的样本溶液。
118.参阅图6、图7所示,测试结果显示,剩余样本溶液a的浓度为所配制的外泌体样本溶液b的浓度的29.4%,推算得出,本实施例中的外泌体样本富集的效率为70.6%,而管内混合孵育的孵育效率为35.4%。
119.实施例3
120.本实施例提供一种基于数字微流控的集成化外泌体来源核酸提取方法,其提取方法与实施例2中的不同在于:
121.步骤s2中配制的外泌体样本溶液和磁珠悬浮液同实施例1中的相同,另外还需配制稀释剂溶液,本实施例中所采用的稀释剂溶液为圣湘生物样本释放剂s1014稀释至原浓度的5%,然后加入吐温-20将其配制为浓度为0.01%(v/v)的稀释剂溶液;
122.步骤s4中将10μl释放剂溶液也注入内部反应腔106;
123.步骤s5中在自动模式自动完成外泌体样本的预处理和核酸提取,得到核酸释放液;其中步骤s5中自动完成外泌体样本的预处理和核酸提取,具体包括以下步骤:步骤s53中将剩余的样本溶液转移至废液腔1064中;步骤s54、再次收缩电磁铁使永磁体远离孵育腔1062,将释放剂溶液转移至步骤s53的孵育腔1062中,释放剂溶液与孵育腔1062中的磁珠-外泌体混合产物均匀混合,孵育10min,得到核酸释放液;其他的步骤与实施例2中自动完成外泌体样本的预处理的步骤相同,在此不再赘述;
124.步骤s6中,取下微流控芯片100,用移液器收集核酸释放液。
125.其他步骤与方法同实施例2中的相同,在此不再赘述。
126.性能测试
127.将步骤s6中收集到的核酸释放液分成两份;采用荧光定量pcr(qpcr)分析分别对管内混合孵育组收集的管内释放液d、本实施例3中收集的片上释放液e和空白样f进行测试;采用数字pcr分析分别对管内混合孵育组收集的管内释放液d和本实施例3中收集的片上释放液e进行测试。本实施例中的被检测基因为甘油醛-3-磷酸脱氢酶(gapdh)基因,该酶基因为管家基因,被广泛应用为核酸检测中的内参;数字pcr反应采用一步法逆转录-扩增试剂盒,因此不对外泌体样本中的rna与可能存在的少量dna进行细分;荧光定量pcr反应采用荧光探针法,其前后引物与探针均为自行设计;每个反应体系均为25μl,其中包含预混液、逆转录与dna聚合酶、引物与探针、rna酶抑制剂与5μl样本,其余体积用depc水补足,其中,depc水是用depc(diethyl pyrocarbonate,焦碳酸二乙酯)处理过并经高温高压灭菌的超纯水(一级水),无色液体。
128.检测结果参阅图8~10,qpcr分析显示,基于数字微流控的集成化外泌体来源核酸提取系统进行预处理后的核酸释放液的ct值为35.7,管内对照组的ct值为34.3;
129.数字pcr分析结果与qpcr分析结果基本吻合,显示二者被检测到的片段浓度分别为19.5与25.7copies/μl,表明rna存在一定损失,但总量不存在数量级差异。
130.综上所述,本发明中将外泌体样本中的外泌体富集与核酸释放过程集成与微流控芯片上,实现了高效一体化外泌体富集以及核酸释放,实现了外泌体来源核酸样本预处理集成化与自动化,为后续的核酸扩增、检测与分析提供快速预处理手段;本发明相比于传统的外泌体富集与处理方式,本发明中的微流控芯片用于外泌体样本预处理具有高自动化程度、反应充分的优势,利用该提取系统可以在90分钟内自动完成微量外泌体样本的预处理,并使外泌体富集的效率显著高于管内手动操作的富集效率;本发明中的提取方法具有高灵活性,根据可以根据所加入的试剂不同,获得差异化的预处理结果。所以,本发明有效克服了现有技术中的种种缺点而具高度产业利用价值。
131.上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。