1.本发明属于生物医药技术领域,具体涉及一种克拉屈滨在制备用于预防或治疗银屑病药物中的用途,更具体地涉及一种克拉屈滨在制备用于预防或治疗银屑病药物中的用途、克拉屈滨单剂型制剂和药物联合。
背景技术:
2.银屑病是免疫介导的慢性复发性炎症性皮肤病,其典型临床表现为鳞屑性红斑或斑块。据流行病学调查结果显示,银屑病的患病率呈不断上升趋势。银屑病通常治疗困难,不能彻底治愈,易复发。
3.因此,迫切需要探索开发一种预防或治疗银屑病的药物。
技术实现要素:
4.本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。为此,本发明提供了一种克拉屈滨在制备用于预防或治疗银屑病药物中的用途、克拉屈滨单剂型制剂和药物联合,本发明的克拉屈滨可有效治疗银屑病,为人类或动物银屑病治疗或辅助治疗药物提供理论依据和应用价值。
5.本发明是基于发明人的下列发现而完成的:
6.克拉屈滨,化学名为2-氯化脱氧腺苷(2-chlorodeoxyadenosine,2-cda),是一种脱氧核苷类似物,其早期被用于治疗毛细胞白血病,是毛细胞白血病的一线标准治疗方法。此外,临床实验研究表明,克拉屈滨单独使用或与其他细胞毒性药物联合使用,在治疗慢性淋巴细胞白血病、巨球蛋白血症、惰性淋巴恶性肿瘤以及急性髓性白血病等血液系统恶性肿瘤方面显示出良好的疗效和耐受性。同时,克拉屈滨也可以治疗多发性硬化症和其他自身免疫性疾病,包括自身免疫性溶血性贫血、类风湿关节炎、系统性红斑狼疮和无viii因子抑制物a型血友病。
7.银屑病的病因涉及遗传、免疫和环境等因素,研究表明在银屑病患者中以t淋巴细胞介导为主、多种免疫细胞共同参与的免疫反应,可引起角质形成细胞过度增殖或关节滑膜细胞与软骨细胞发生炎症。随着人们对tnfα、il-12/23、il-17a等细胞炎症因子在银屑病发病中的深入认识,采用某些针对细胞炎症因子的单抗类生物制剂类药物治疗银屑病,如tnfα拮抗剂(依那西普、英夫利昔、阿达木单抗)、il-12/23拮抗剂(乌司奴单抗)和il-17a拮抗剂(司库奇尤单抗),结果发现,一些中重度银屑病患者对上述药物反应不佳,严重影响生活质量,且伴有明显关节症状。然而,在少数严重难治性的中重度银屑病患者中,随着时间的推移,银屑病皮损会对这些治疗方法产生耐药性,同时可能会产生严重的副反应。
8.为了解决上述问题,发明人经过大量实验惊喜的发现,克拉屈滨可有效治疗银屑病。此外,发明人利用流式细胞技术对银屑病相关的细胞进行检测,进一步评估克拉屈滨治疗银屑病的有效性,结果表明,克拉屈滨可显著缓解银屑病导致的th1、th17细胞增多和th2、treg细胞降低的现象。
9.在本发明的一个方面,本发明提出了一种克拉屈滨在制备药物中的用途,所述药物用于预防或治疗银屑病。发明人经过实验发现,克拉屈滨可有效治疗银屑病。
10.根据本发明的实施例,上述用途还可以进一步包含如下附加技术特征的至少之一:
11.根据本发明的实施例,所述银屑病为中重度银屑病。发明人经过实验发现,本发明的药物对中重度银屑病具有较好的治疗效果。
12.根据本发明的实施例,所述药物用于减少th1细胞的含量。
13.根据本发明的实施例,所述药物用于增加th2细胞的含量。
14.根据本发明的实施例,所述药物用于减少th17细胞的含量。
15.根据本发明的实施例,所述药物用于增加treg细胞的含量。
16.在本发明的另一方面,本发明提出了一种体外调整免疫细胞群的方法。根据本发明的实施例,所述方法包括:将待处理离体免疫细胞群与克拉屈滨进行接触,所述离体免疫细胞群包括th1细胞、th2细胞、th17细胞和treg细胞中的至少之一。由此,采用克拉屈滨可对离体免疫细胞群进行调整,以改变离体免疫细胞群中不同细胞的比例,将离体免疫细胞群采用克拉屈滨进行处理后,离体免疫细胞群中的th1细胞或th17细胞数量降低,或th2细胞或treg细胞数量升高。根据本发明实施例的体外调整免疫细胞群的方法,在实验中,可针对性的对离体免疫细胞群特定免疫细胞的数量进行调控,为后续进一步研究奠定的了基础,如所获得的改变了相应免疫细胞数量的免疫细胞群,发明人可进一步探究免疫细胞群中免疫细胞之间的沟通变化、细胞因子的分泌变化等,为免疫细胞群体的研究奠定了模型基础。
17.根据本发明的实施例,所述克拉屈滨的工作浓度为0.01~1mg/ml。发明人经过大量实验得到上述较优浓度,由此,对免疫细胞群中对应免疫细胞数量的调整效果更好。
18.在本发明的又一方面,本发明提出了一种免疫细胞群。根据本发明的实施例,所述免疫细胞群是通过前述方法获得的。根据上述体外调整免疫细胞群的方法,相比于调整前的离体免疫细胞群,可得到th1细胞或th17细胞含量降低的免疫细胞群,或者得到th2细胞或treg细胞含量增加的免疫细胞群。
19.在本发明的又一方面,本发明提出了一种克拉屈滨单剂型制剂。根据本发明的实施例,所述单剂型制剂包括600~2400mg/ml的克拉屈滨作为活性成分。由此,采用上述制剂可有效治疗银屑病。
20.根据本发明的实施例,所述单剂型制剂包括1000~2000mg/ml的克拉屈滨作为活性成分,优选为1500~1800mg/ml。由此,对银屑病的治疗效果较佳。
21.在本发明的又一方面,本发明提出了一种药物联合。根据本发明的实施例,所述药物联合用于预防或治疗银屑病,所述药物联合包括克拉屈滨作为第一活性剂;以及其他预防或治疗银屑病的药物作为第二活性剂。由此,采用上述药物联合可有效治疗银屑病。
22.根据本发明的实施例,所述其他预防或治疗银屑病的药物包括依那西普、英夫利昔、阿达木单抗、乌司奴单抗、司库奇尤单抗、环孢素、阿维a和甲氨蝶呤中的至少之一。
23.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
24.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
25.图1是根据本发明实施例1中银屑病小鼠模型图;
26.图2是根据本发明实施例2中不同组的银屑病皮损严重程度评分;
27.图3是根据本发明实施例3中正常对照组的th1细胞检测检测结果;
28.图4是根据本发明实施例3中银屑病模型组的th1细胞检测检测结果;
29.图5是根据本发明实施例3中克拉屈滨低剂量组的th1细胞检测检测结果;
30.图6是根据本发明实施例3中克拉屈滨高剂量组的th1细胞检测检测结果;
31.图7是根据本发明实施例3中阳性药甲氨蝶呤组的th1细胞检测检测结果;
32.图8是根据本发明实施例3中不同组的th1细胞含量;
33.图9是根据本发明实施例3中正常对照组的th2细胞检测检测结果;
34.图10是根据本发明实施例3中银屑病模型组的th2细胞检测检测结果;
35.图11是根据本发明实施例3中克拉屈滨低剂量组的th2细胞检测检测结果;
36.图12是根据本发明实施例3中克拉屈滨高剂量组的th2细胞检测检测结果;
37.图13是根据本发明实施例3中阳性药甲氨蝶呤组的th2细胞检测检测结果;
38.图14是根据本发明实施例3中不同组的th2细胞含量;
39.图15是根据本发明实施例3中不同组的th1/th2的比值结果;
40.图16是根据本发明实施例3中正常对照组的th17细胞检测检测结果;
41.图17是根据本发明实施例3中银屑病模型组的th17细胞检测检测结果;
42.图18是根据本发明实施例3中克拉屈滨低剂量组的th17细胞检测检测结果;
43.图19是根据本发明实施例3中克拉屈滨高剂量组的th17细胞检测检测结果;
44.图20是根据本发明实施例3中阳性药甲氨蝶呤组的th17细胞检测检测结果;
45.图21是根据本发明实施例3中不同组的th17细胞含量;
46.图22是根据本发明实施例3中正常对照组的treg细胞检测检测结果;
47.图23是根据本发明实施例3中银屑病模型组的treg细胞检测检测结果;
48.图24是根据本发明实施例3中克拉屈滨低剂量组的treg细胞检测检测结果;
49.图25是根据本发明实施例3中克拉屈滨高剂量组的treg细胞检测检测结果;
50.图26是根据本发明实施例3中阳性药甲氨蝶呤组的treg细胞检测检测结果;
51.图27是根据本发明实施例3中不同组的treg细胞含量;
52.图28是根据本发明实施例3中不同组的th17/treg细胞含量。
具体实施方式
53.下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
54.需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
55.术语
56.本文中,术语“治疗”用于指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防疾病或其症状而言可以是预防性的,和/或就部分或完全治愈疾病和/或疾病导致的不良作用而言可以是治疗性的。本文使用的“治疗”涵盖哺乳动物、特别是人的疾病,包括:(a)在容易患病但是尚未确诊得病的个体中预防疾病(例如银屑病)或病症发生;(b)抑制疾病,例如阻滞疾病发展;或(c)缓解疾病,例如减轻与疾病相关的症状。本文使用的“治疗”涵盖将药物或化合物给予个体以治疗、治愈、缓解、改善、减轻或抑制个体的疾病的任何用药,包括但不限于将含本文所述克拉屈滨的药物给予有需要的个体。
57.本文中,术语“预防”用于指在疾病或病症发生前试图中止其出现。
58.本文中,术语“单剂量”是指受试者单次服用的剂量。本文使用的“单剂量制剂”是指将受试者所需的药品,按受试者每次可服用的剂量独立制成的制剂。
59.本文中,术语“药物联合”是指两种或多种药物以单独或混合的形式存在,该药物联合可同时地施用给受试者,也可分别作为单独实体同时地或顺序地施用给患者,且无特定的时间限制。其中,这种施用可在体内提供两种或多种有效组分。
60.本发明提出了一种克拉屈滨在制备用于预防和/或治疗银屑病药物中的用途,下面将分别对其进行详细描述。
61.用途
62.本发明提出了一种克拉屈滨在制备药物中的用途,所述药物用于预防或治疗银屑病。发明人经过实验发现,克拉屈滨可有效治疗银屑病。
63.根据本发明的实施例,所述药物用于预防或治疗中重度银屑病。
64.目前发现,在少数严重难治性银屑病患者中,随着时间的推移,银屑病会对这些传统的治疗药物(例如依那西普、英夫利昔、阿达木单抗、乌司奴单抗、司库奇尤单抗等)产生耐药性,同时可能出现严重的副反应。而采用本技术的药物,可有效的治疗严重难治的中重度银屑病。
65.需要说明的是,“中重度银屑病”是指银屑病皮损面积和严重程度指数(pasi)大于20分,具体参见文献“augustin m,et al.j eur acad dermatol venereol 2012;26 suppl 4:1-16;13;2.ema,guideline on clinical investigation of medicinal products indicated for the treatment of psoriasis(chmp-ewp-2454-02)”。
66.在一些实施方案中,所述药物用于减少th1细胞的含量。
67.在一些实施方案中,所述药物用于增加th2细胞的含量。
68.在一些实施方案中,所述药物用于减少th17细胞的含量。
69.在一些实施方案中,所述药物用于增加treg细胞的含量。
70.在一些实施方案中,所述药物包含一种或多种药学上可接受的辅料,例如:可以为稳定剂或增稠剂,具体类型不受限制。该药物的剂型选自注射剂,进而实现大剂量的给药需求,并且,避免胃肠循环对药物有效成分的影响。
71.本发明还提出了一种克拉屈滨在预防或治疗银屑病中的用途。发明人将克拉屈滨施用于患有银屑病的小鼠模型,发现其可有效治疗小鼠的银屑病皮损。此外,发明人利用流式细胞技术对银屑病相关的细胞因子进行检测,进一步评估克拉屈滨治疗银屑病的有效性,结果发现克拉屈滨可显著缓解银屑病导致的th1、th17细胞增多和th2、treg细胞降低的
现象。
72.在一些实施方案中,所述克拉屈滨的给药量为10~40mg/kg/d。由此,以便起到预防和治疗银屑病的目的,尤其是治疗中重度银屑病。
73.在一些实施方案中,所述克拉屈滨的给药量为25~35mg/kg/d。由此,对银屑病的治疗效果较佳,尤其是治疗中重度银屑病。
74.需要说明的是,mg/kg/d是指根据受试者的体重每日施用的用量,例如30mg/kg/d可为60kg受试者每日施用约1.8g的药量,可以单次或每天分次施用。
75.治疗方法
76.本发明还提出了一种预防或治疗银屑病的方法,该方法包括:向受试者施用克拉屈滨。发明人将克拉屈滨施用于患有银屑病的小鼠模型,发现其可有效治疗小鼠的银屑病皮损。此外,发明人利用流式细胞技术对银屑病相关的细胞因子进行检测,进一步评估克拉屈滨治疗银屑病的有效性,结果发现克拉屈滨可显著缓解银屑病导致的th1、th17细胞增多和th2、treg细胞降低的现象。
77.在一些实施方案中,所述克拉屈滨的给药量为10~40mg/kg/d。由此,以便起到预防和治疗银屑病的目的,尤其是治疗中重度银屑病。
78.在一些实施方案中,所述克拉屈滨的给药量为25~35mg/kg/d。由此,对银屑病的治疗效果较佳,尤其是治疗中重度银屑病。
79.需要说明的是,mg/kg/d是指根据受试者的体重每日施用的用量,例如30mg/kg/d可为60kg受试者每日施用约1.8g的药量,可以单次或每天分次施用。
80.体外调整免疫细胞群的方法
81.本发明还提出了一种体外调整免疫细胞群的方法。根据本发明的实施例,该方法包括:将待处理离体免疫细胞群与克拉屈滨进行接触,所述离体免疫细胞群包括th1细胞、th2细胞、th17细胞和treg细胞中的至少之一。由此,采用克拉屈滨可对离体免疫细胞群进行调整,以改变离体免疫细胞群中不同细胞的比例。
82.在一些实施方案中,所述克拉屈滨的工作浓度为0.01~1mg/ml(例如0.01mg/ml、0.02mg/ml、0.05mg/ml、0.1mg/ml、0.15mg/ml、0.2mg/ml、0.25mg/ml、0.3mg/ml、0.35mg/ml、0.4mg/ml、0.55mg/ml、0.6mg/ml、0.65mg/ml、0.7mg/ml、0.75mg/ml、0.8mg/ml、0.85mg/ml、0.9mg/ml、0.95mg/ml、1mg/ml)。发明人经过大量实验得到上述较优浓度,由此,对免疫细胞群的调整效果较好。
83.在一些实施方案中,所述免疫细胞群的调整包括减少th1细胞、减少th17细胞、增加th2细胞和增加treg细胞中的至少之一。
84.本发明还提出了一种免疫细胞群。根据本发明的实施例,该免疫细胞群是通过前述体外调整免疫细胞群的方法获得的。根据上述体外调整免疫细胞群的方法,可得到th1细胞或th17细胞含量降低的免疫细胞群,或者得到th2细胞或treg细胞含量增加的免疫细胞群。
85.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
86.实施例1:银屑病小鼠模型的建立
87.(1)将小鼠通过腹腔注射戊巴比妥钠(80mg/kg)进行麻醉,用儿童剃发器刮除背部毛发,形成约2cm
×
3cm大小暴露区域,用脱毛膏处理剔除毛发区域;
88.(2)单笼饲养1天后,涂抹62.5mg/天咪喹莫特乳膏(质量分数为5%),持续14天;
89.(3)根据相对对照组的pasi评分来判定模型成功与否,结果发现银屑病小鼠模型的pasi评分存在显著性差异(p《0.05),因此,银屑病小鼠模型构建成功,构建的小鼠模型照片如图1所示。
90.实施例2:小鼠模型的体外实验
91.(1)随机将实施例1构建成功的银屑病小鼠模型随机分为模型组、克拉屈滨高剂量组(简称高剂量组)、克拉屈滨低剂量组(简称低剂量组)、阳性药物甲氨蝶呤组,每组10只小鼠,以及选择10只正常小鼠作为正常对照组,做好标记于独立通气笼具中单笼饲养;
92.(2)对小鼠进行分组治疗,该治疗的时机为实施例1的银屑病小鼠模型构建成功后的第一天,其中,克拉屈滨高剂量组用克拉屈滨以30mg/kg/d的注射量对小鼠进行静脉注射,克拉屈滨低剂量组用克拉屈滨以20mg/kg/d的注射量对小鼠进行静脉注射,阳性药物甲氨蝶呤组用甲氨蝶呤以1mg/kg/d的注射量对小鼠进行静脉注射,模型组用生理盐水以0.2ml/只的注射量对小鼠进行静脉注射。
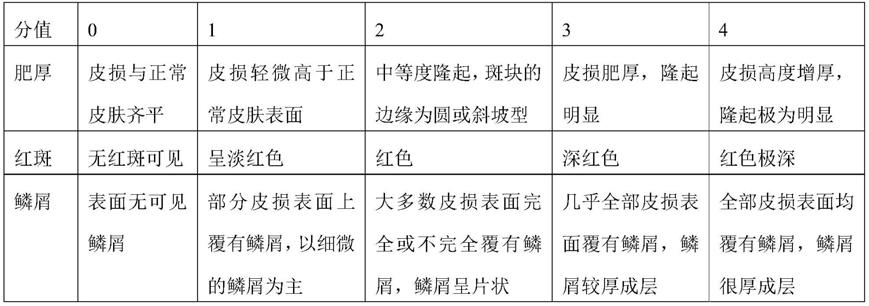
93.(3)第25天对小鼠背部区域进行银屑病皮损严重程度评分(pasi)并提取小鼠血清,用流式细胞术检测th1、th2、th17、treg细胞因子,其中,银屑病皮损严重程度评分(pasi)标准参见表1,药物处理后小鼠银屑病的严重程度结果如图2所示。
94.表1:银屑病皮损严重程度评分
[0095][0096]
图2中,*表示与正常对照组相比存在显著性差异(p《0.05),**表示与正常对照组相比存在极显著性差异(p《0.01);#表示与银屑病模型组相比存在显著性差异(p《0.05),##表示与银屑病模型组相比存在极显著性差异(p《0.01)。
[0097]
结果表明,银屑病模型组与正常对照组相比,银屑病皮损严重程度显著升高,当使用克拉屈滨(低剂量组/高剂量组)和阳性药甲氨蝶呤处理后银屑病皮损严重程度显著降低,并且克拉屈滨的治疗效果与阳性药甲氨蝶呤间无显著性差异。因此,该实验表明,克拉屈滨对银屑病具有显著的治疗作用,其治疗效果与阳性药甲氨蝶呤效果近似。
[0098]
实施例3:流式细胞术检测
[0099]
采用流式细胞术检测实施例2中于25天提取的小鼠血清中的th1、th2、th17、treg细胞因子,具体参见图3-28。其中,图8、14-15、21、27-28中,*表示与正常对照组相比存在显
著性差异(p《0.05),**表示与正常对照组相比存在极显著性差异(p《0.01),#表示与银屑病模型组相比存在显著性差异(p《0.05),##表示与银屑病模型组相比存在极显著性差异(p《0.01)。
[0100]
th1细胞的检测结果参见图3-8。结果表明,与正常对照组相比,银屑病模型中的th1细胞比例明显升高,当使用克拉屈滨(低剂量组/高剂量组)和阳性药甲氨蝶呤后,th1细胞所占比例降低。因此,克拉屈滨可显著缓解银屑病导致的th1细胞增多的现象。
[0101]
th2细胞的检测结果参见图9-14。结果表明,与正常对照组相比,银屑病模型组th2细胞比例显著降低,当使用克拉屈滨(低剂量组/高剂量组)和阳性药甲氨蝶呤后th2细胞比例升高。因此,该实验表明,克拉屈滨可改善银屑病导致的th2细胞比例降低的现象。
[0102]
th1/th2的检测结果参见图15。结果表明,与正常对照组相比,银屑病模型组中的th1/th2比例显著升高,当使用克拉屈滨(低剂量组/高剂量组)和阳性药甲氨蝶呤治疗后,th1/th2比例降低,克拉屈滨治疗组与阳性药甲氨蝶呤组间无显著性差异。因此,该实验表明,克拉屈滨可显著改善银屑病导致的th1/th2比例升高的现象,其治疗效果与阳性药甲氨蝶呤近似。
[0103]
th17细胞的检测结果参见图16-21。结果表明,与正常对照组相比,银屑病模型组中的th17比例显著升高,当使用克拉屈滨(低剂量组/高剂量组)和阳性药甲氨蝶呤治疗后,th17比例降低。因此,该实验表明,克拉屈滨可显著降低银屑病导致的th17升高的现象。
[0104]
treg细胞的检测结果参见图22-27。结果表明,与正常对照组相比,银屑病模型组中treg细胞的比例显著降低,当使用克拉屈滨高剂量组和阳性药甲氨蝶呤治疗后,treg的比例上升,克拉屈滨高剂量与阳性药间无显著性差异。因此,该实验表明,克拉屈滨可有效缓解银屑病导致的treg细胞比例降低的现象。
[0105]
th17/treg的检测结果参见图28。结果表明,与正常对照组相比,银屑病模型组中th17/treg比例显著升高,当使用克拉屈滨(低剂量组/高剂量组)和阳性药甲氨蝶呤处理后显著降低th17/treg比例,克拉屈滨高剂量与阳性药甲氨蝶呤无显著性差异。因此,该实验表明,克拉屈滨可显著改善由银屑病导致的th17/treg比例升高的现象,克拉屈滨高剂量的效果与阳性药治疗效果近似。
[0106]
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
[0107]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。