1.本发明涉及微流控芯片技术领域,特别涉及一种用于建立体外血管生理学模型的微流控芯片平台。
背景技术:
2.微流控芯片,即微流控芯片实验室。微流控芯片内构建由合适尺寸的单元,可同时容纳分子、细胞、甚至是仿生的组织抑或是器官。而芯片所具有的特殊且便捷的操控体系,使芯片能同时对实验的物理、化学和生物参数以及环境进行调控。因此,二十一世纪以来,微流控芯片已经成为体外对哺乳动物细胞进行仿生并对其微环境进行精准操控的最佳平台。
3.微流控技术具有微型化、集成化、低消耗的特点外,能够精确地控制多个系统参数,如化学浓度梯度、流体剪切力、以及构建细胞图形化培养、组织-组织界面与器官-器官相互作用等,从而模拟人体器官的复杂结构、微环境和生理学功能,解决传统的二维细胞培养模式和动物实验的诸多不足,可能成为一种仿生、高效、节能的生理学研究、疾病模型及药物开发工具。建立体外生理学模型需要考虑外界环境参数的真实性。将微流控技术与微加工、细胞生物学相结合而产生的器官芯片技术在对外界环境参数的控制中具有其他技术难以比拟的能力,通过产生流体剪切力、机械应力、生化浓度梯度等理化刺激,细胞能够响应这些刺激而发生自组装,展现更加真实的生理学功能,因而在体外生理学模型建立中具有特殊的优势。
4.血管病变,尤其是糖尿病足是导致糖尿病患者致残、致死的严重慢性并发症之一。传统治疗手段包括药物、血管搭桥和介入手术等,但临床效果不佳,至少有30%~40%糖尿病足患者因下肢微循环差、小血管完全闭塞,无法进行外科血管重建手术而不得不接受截肢手术。然而由于糖尿病足患者多因年老体弱,心肺功能差且基础疾病多,导致他们大多数都不能接受手术治疗。因而,开辟新的治疗途径是必然趋势。糖尿病外周动脉病变的病理基础为动脉粥样硬化,严重的病变出现溃疡、出血并诱发血栓形成,导致管腔闭塞,这是导致糖尿病足的最主要原因之一。
5.然而现有基于微流控芯片平台的血管模型均为模拟血管,模拟血管难以作为研究血管病变的生理学模型进行使用。
技术实现要素:
6.为了克服上述现有技术的缺陷,本发明所要解决的技术问题是:提供一种可构建真血管模型的微流控芯片平台。
7.为了解决上述技术问题,本发明提供一种用于建立体外血管生理学模型的微流控芯片平台,包括灌注液罐、微流控微流控蠕动泵、基片和废液管,它们依次通过软管彼此连接以形成闭合管路;
8.所述基片包括至少一个用于容纳体外血管的容纳空间,以及设置在所述基片上并
均与所述容纳空间相连通的至少一对的进液口和出液口,所述进液口和出液口内均设置有连接头,所述连接头的一端用于插入所述体外血管的端部以撑直所述体外血管,另一端与所述软管相连。
9.本发明的有益效果在于:本发明所提供的用于建立体外血管生理学模型的微流控芯片平台可构建真血管模型并通过微流控微流控蠕动泵模拟动脉血流,可作为血管病变的基础研究模型。通过将全血微灌注到微流控芯片平台中可动态观察动脉病变的发生和发展的全过程,可为探讨血管病变机制以及为后期用药检测等提供基础。
附图说明
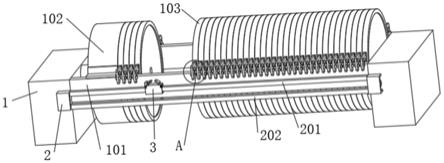
10.图1所示为本发明在具体实施方式中微流控芯片平台的结构示意图;
11.图2所示为本发明在具体实施方式中基片的结构示意图;
12.图3所示为本发明在具体实施方式中微流控芯片平台的局部照片;
13.图4所示为本发明在具体实施方式中对照组血管he染色的100倍放大照片;
14.图5所示为本发明在具体实施方式中对照组血管he染色的400倍放大照片;
15.图6所示为本发明在具体实施方式中实验组血管96h培养下he染色的200倍放大照片;
16.图7所示为本发明在具体实施方式中实验组血管96h培养下he染色的800倍放大照片;
17.图8所示为本发明在具体实施方式中对照组血管以免疫组化sp法处理的200倍放大照片;
18.图9所示为本发明在具体实施方式中对照组血管以免疫组化sp法处理的400倍放大照片;
19.图10所示为本发明在具体实施方式中实验组血管96h培养下以免疫组化sp法处理的200倍放大照片;
20.图11所示为本发明在具体实施方式中实验组血管96h培养下以免疫组化sp法处理的800倍放大照片;
21.图12所示为本发明在具体实施方式中阳性对照血管样本以tunel法处理的800倍放大照片;
22.图13所示为本发明在具体实施方式中对照组血管以tunel法处理的200倍放大照片;
23.图14所示为本发明在具体实施方式中实验组血管96h培养下以tunel法处理的200倍放大照片;
24.图15所示为本发明在具体实施方式中实验组血管96h培养下以tunel法处理的400倍放大照片。
25.标号说明:1、灌注液罐;2、微流控蠕动泵;3、基片;31、基底层;32、盖板层;4、废液罐;5、软管;6、连接头;7、容纳空间;8、培养箱;9、体外血管;10、进液口;11、出液口。
具体实施方式
26.为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附
图予以说明。
27.本发明中血管病变尤指动脉粥样硬化、止血和血栓形成、炎症性血管疾病及肿瘤经血管转移等,这些血管病变均与血管壁与血流之间产生的剪切力直接相关。因此,在体外构建真血管的病理学研究模型具有重要的意义。并且,构建真血管的病理学研究模型相较于传统具有模拟血管的病理学研究模型而言,具有动态观察血管病变发生以及发展全过程的独有优势,同时也可为后期用药以及药用价值评估提供生理学基础。
28.因此,参见图1至图3,本发明提供一种用于建立体外血管9生理学模型的微流控芯片平台,包括灌注液罐1、微流控微流控蠕动泵2、基片3和废液管,它们依次通过软管5彼此连接以形成闭合管路;所述基片3包括至少一个用于容纳体外血管9的容纳空间7,以及设置在所述基片3上并均与所述容纳空间7相连通的至少一对的进液口10和出液口11,所述进液口10和出液口11内均设置有连接头6,所述连接头6的一端用于插入所述体外血管9的端部以撑直所述体外血管9,另一端与所述软管5相连。
29.其中,微流控蠕动泵2作为模拟血管流体力学的基础,通过其滑轮挤压软管5以模拟血液在血管内的流动,再现动脉血流。同时,可通过对微流控蠕动泵2的滑轮转速进行调节,以实时改变灌注量、灌注时间、灌注压以及对血管剪切力等相关血管病变影响因素进行调节,从而允许对多种血管病变的形成和发展进行研究。通过将微流控蠕动泵2与基片3组合成体外血管9生理学模型的微流控芯片平台,由于流体(灌注液)只与微流控蠕动泵2的内部软管5以及外部软管5相接触,不接触微流控蠕动泵2的其他结构,可有效避免流体污染,同时还具有重复精度和稳定性精度高,以及自吸能力良好,可空转或避免流体回流等优点。
30.所述基片3具有至少一个用于容纳体外血管9的容纳空间7。所述容纳空间7可以只有一个或多个,当采用多个容纳空间7的技术方案时,多个容纳空间7的排列方式可以为单列式或阵列式。所述容纳空间7可以为完全形成在基片3内部,或形成在基片3的表面。
31.每个容纳空间7内应具有至少一对的进液口10和出液口11,以允许灌注液通过微流控蠕动泵2从灌注液罐1泵入位于容纳空间7中的血管中,并通过出液口11泵入废液罐4中。同时,每个容纳空间7中也允许多对进液口10和出液口11,多对进液口10和出液口11之间存在不同间距,以允许将血管通过连接头6连接不同的进液口10和出液口11实现对不同长度血管的适用。
32.在实际操作过程中,为了保持体外血管9的端部与连接头6的密封性,可采用无菌线进行结扎,或采用具有球形端部的连接头6,通过体外血管9与球形端部的胀紧作用实现密封。
33.需要说明的是,为了避免各组件材质在实验过程中毒害体外血管9,各组件都应采用医用级别材料或无菌无毒材料,如采用医用级蠕动泵硅胶管、经过严格高压灭菌消毒的标准连接头6等。其中,医用级蠕动泵硅胶管应具有高透明性,以便于观察灌注液在软管5内流动。
34.所述灌注液罐1用于存储灌注液,所述灌注液可以为全血,或经过特定处理的血液制品,如添加有特定药物或特定组分(脂质、糖分等),或减少某些特定组分(脂质、糖分等)的血液制品、或特定的细胞培养基,如deme培养基,以模拟在特定血液条件下血管的病变形成和发展。
35.在一种实施方式中,所述基片3还设置有培养窗,所述培养窗与所述容纳空间7相
连通。所述培养窗设置在基片3上,并与所述容纳空间7相连通,以在基片3的表面形成用于容纳体外血管9的凹槽。所述培养窗不仅便于实验员观察体外血管9,同时也便于实验员将体外血管9嵌入基片3中、以及便于实验员将体外血管9的端部插入连接头6的一端上并结扎。
36.所述基片3具有至少一个与所述容纳空间7相连通的出气孔。所述出气孔不仅用于平衡容纳空间7与基片3外侧的气压,同时促进容纳空间7内部空气的流通。
37.优选的,所述基片3的材质为聚二甲基硅氧烷。
38.需要说明的是,所述基片3不仅可以选用聚二甲基硅氧烷注塑成型,同时也可以使用水凝胶注塑成型。
39.在一种实施方式中,参见图2所示,所述基片3包括层叠设置的基底层31和盖板层32,所述基底层31和盖板层32层叠设置,所述观察窗布置在盖板层32表面,所述基底层31和盖板层32通过等离子氧化法相连。具体而言,所述基片3通过光刻浇筑成型基底层31和盖板层32,然后以空心管切割法和按压打孔器分别对基底层31和盖板层32进行切割,以形成至少一对的进液口10和出液口11,和至少一个出气孔,然后将基底层31和盖板层32复合后经等离子照射数秒并迅速压合热固,以形成基片3。通过等离子氧化法将基底层31和盖板层32相连,可有效提高二者之间的连接性,从而提高基片3的整体机械强度。在使用前,所述基片3应当进行严格的高压高温消毒,具体为先用异丙醇清洁基片3中的容纳空间7、进液口10、出液口11和出气孔,然后经超声波清洗后使用高压灭菌锅进行彻底灭菌。
40.进一步的,所述微流控芯片平台还包括培养箱8,所述基片3位于所述培养箱8中,以保持所述基片3处于37℃,5%二氧化碳浓度的工作环境中。通过培养箱8严格控制体外血管9的培养条件,以避免培养环境条件的改变对微流控芯片平台的实验精度造成下降。
41.实施例1
42.参见图1至图3,用于建立体外血管9生理学模型的微流控芯片平台,包括灌注液罐1、微流控微流控蠕动泵2、基片3和废液管,它们依次通过软管5彼此连接以形成闭合管路;
43.所述基片3包括至少一个用于容纳体外血管9的容纳空间7,以及设置在所述基片3上并均与所述容纳空间7相连通的一对的进液口10和出液口11,所述进液口10和出液口11内均设置有连接头6,所述连接头6的一端用于插入所述体外血管9的端部以撑直所述体外血管9,另一端与所述软管5相连;
44.所述基片3还设置有培养窗,所述培养窗与所述容纳空间7相连通;
45.所述基片3具有一个与所述容纳空间7相连通的出气孔;
46.所述基片3的材质为聚二甲基硅氧烷;
47.所述基片3包括层叠设置的基底层31和盖板层32,所述基底层31和盖板层32通过等离子氧化法相连;
48.所述微流控芯片平台还包括培养箱8,所述基片3位于所述培养箱8中,以保持所述基片3处于37℃,5%二氧化碳浓度的工作环境中。
49.检测例1
50.采用新西兰大白兔和泰国小香猪作为样本获取动脉,取动物下肢动脉和颈动脉处管径约为1mm的血管,并将血管的两端进行修整和去除坏死组织和凝血块后立即植入低温且含有抗生素的全细胞营养液中冲洗3遍,以去除坏死部分。将样品血管分成1~1.5cm长节
段,植入37℃、5%二氧化碳浓度的培养箱中备用,作为实验用血管(实验组)和对照组(无处理)。
51.参见图3所示,将实验用血管置于微流控芯片中,采用高压灭菌过的手术钳和镊子将血管的端部套入连接头上,采用无菌线对血管的两端进行结扎以保证灌注液流通顺畅且不漏液。
52.在实验中,实验组的灌注液采用dmem培养基,内含10%胎牛血清,1%青霉素和链霉素,以及5%的对应组别血清,所述灌注液在使用前经过0.22μm滤头过滤处理。
53.每12h对微流控芯片进行观察和清洁,分别取24h、48h、72h和96h灌注液-80℃冷冻保存,每48h进行灌注液换液,每96h取血管于甲醛固定液中固定并切片,并分别对血管进行he染色、以sp法进行免疫组化实验以及tunel检测,实验照片分别为图4至图15。
54.图4显示对照组血管在he染色下的100倍放大照片。图中血管由3层结构组成,内膜、中层(肌层)和外膜(滋养层)以内弹力板和外弹力板为界,组织结构清晰完整。图5显示对照组血管在he染色下400倍放大照片。图中血管内皮清晰可见且完整,内弹力板呈波折状,中层多层平滑肌细胞环形围绕管腔,其间可见少许弹力纤维。
55.图6显示实验组血管在微流控芯片平台培养96h下he染色的200倍放大照片。图中三层组织结构完整、清晰,各层细胞排列完好,细胞结构无明显异常。图7显示实验组血管在微流控芯片平台培养96h下he染色的800倍放大照片。图中血管内皮细胞清晰可见,内弹力板呈波浪状,中层平滑肌细胞结构正常。
56.图8显示对照组血管以免疫组化sp法处理的200倍放大照片。图中对血管平滑肌α-actin抗体染色,可见血管中层平滑肌细胞呈阳性反应。图9显示对照组血管以免疫组化sp法处理的400倍放大照片。图中对血管平滑肌α-actin抗体染色,可见血管中层平滑肌细胞呈阳性反应,血管内皮及外膜间质呈阴性反应。
57.图10显示实验组血管在微流控芯片平台培养96h下以免疫组化sp法处理的200倍照片。图中对血管中层平滑肌α-actin抗体染色,可见中层平滑肌呈阳性反应。图11显示实验组血管在微流控芯片平台培养96h下以免疫组化sp法处理的800倍照片。图中对血管中层平滑肌α-actin抗体染色,可见中层平滑肌呈阳性反应,血管内皮细胞清晰可见且呈阴性反应。
58.图12显示阳性对照血管样本以tunel法处理的800倍放大照片。以dnase1处理阳性对照血管样本,可见血管中层平滑肌细胞经tunel法染色大多呈阳性反应。图13显示对照组血管以tunel法处理的200倍放大照片。图中可见血管内皮细胞、中层平滑肌细胞经tunel法染色大多呈阴性反应。
59.图14显示实验组血管在微流控芯片平台培养96h下以tunel法处理的200倍照片。图中可见血管内皮细胞、中层平滑肌细胞及外膜间质经tunel法染色大多呈阴性反应。图15显示实验组血管在微流控芯片平台培养96h下以tunel法处理的400倍照片。图中可见血管内皮细胞、中层平滑肌细胞tunel法染色大多呈阴性反应。
60.可见,经微流控芯片平台培养的实验组血管在不同时间其血管的活性(搏动)、组织结构、细胞形态与对照组血管比较无明显差别;免疫组化染色显示,不同时期的实验组血管均显示出平滑肌细胞α-actin阳性反应;各动脉中层平滑肌细胞均具有一定程度的增殖能力(少部分细胞增殖细胞核抗原染色阳性);血管壁细胞显示出无明显凋亡特征(tunel法
染色阴性)。
61.基于上述实验表明,从形态和机能上,实验组血管与对照组血管并无明显区别,即本发明所提供的用于建立体外血管生理学模型的微流控芯片平台可有效作为血管病变的生理学模型,对研究血管病变具有重要的意义。
62.综上,本发明所提供的用于建立体外血管生理学模型的微流控芯片平台可构建真血管模型并通过微流控微流控蠕动泵模拟动脉血流,可作为血管病变的基础研究模型。通过将全血微灌注到微流控芯片平台中可动态观察动脉病变的发生和发展的全过程,可为探讨血管病变机制以及为后期用药检测等提供基础。
63.以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。